89的制作方法
89
zr标记人骨髓间充质干细胞的方法
技术领域
1.本发明涉及核医学技术领域,具体涉及一种
89
zr标记人骨髓间充质干细胞(hmscs)的方法,特别是使用8-羟基喹啉螯合的
89
zr标记hmscs的方法。
背景技术:
2.有研究表明,人骨髓间充质干细胞(hmscs)来源于中胚层,在一定条件下可以分化成中胚层细胞,如软硬骨细胞、脂肪细胞和肌肉细胞,还可以跨胚层界限分化为外胚层神经元、神经胶质细胞以及内胚层的心肌细胞和肝脏细胞等。其免疫原性低、组织来源广泛、无伦理问题、成瘤风险低,是目前备受关注的一类具有自我复制及多向分化潜能的组织干细胞。众所周知,干细胞治疗需要将干细胞移植到患者体内,因此,确认干细胞在宿主体内的迁移路径对判断干细胞移植的治疗效果至关重要。
89
zr作为常用的pet核素,半衰期为78.4h,可以连续追踪细胞至少7d,非常适合用来标记细胞。但由于使用
89
zr-oxine标记间充质干细胞存在较多技术难题,例如(1)干细胞相对于一般细胞较脆弱,在传代及标记的过程中会造成细胞死亡;(2)间充质干细胞增殖较慢,细胞融合后就会开始老化,继而自发分化,且标记及给药需要的细胞量较大,故标记前的细胞准备工作非常困难;(3)标记时需控制放射性剂量和细胞数量的比例,放射性剂量过高会引起细胞死亡;(4)dmso作为
89
zr-oxine复合物的溶剂,其本身具有一定细胞毒性,需控制dmso占反应总体积的比例等,故迄今为止,还未有使用
89
zr-oxine标记间充质干细胞的报道。提供一种用放射性同位素
89
zr标记hmscs的方法,以借助pet实现hmscs的体内示踪,应有益于帮助分析hmscs在生物体内的分布和迁移情况。
技术实现要素:
3.为克服现有技术中缺乏使用
89
zr-oxine标记hmscs的方法的缺陷,本发明提供了一种
89
zr标记hmscs的方法,通过预先用8-羟基喹啉螯合
89
zr
4+
,然后将8-羟基喹啉螯合的
89
zr-oxine摄入hmscs内,完成标记。通过用放射性同位素
89
zr标记hmscs,可以借助pet实现hmscs的体内示踪,帮助分析hmscs在生物体内的分布和迁移情况。
4.本发明主要通过以下技术方案解决上述技术问题:
5.本发明提供的技术方案之一为:一种用放射性同位素
89
zr标记人骨髓间充质干细胞(hmscs)的方法,所述方法包括:将待标记的hmscs与前体
89
zr-oxine混合、孵育,得到
89
zr-hmscs细胞。
6.在一些优选的实施方案中,所述孵育为室温震荡孵育。
7.较佳地,所述震荡孵育的转速为300-600rpm。
8.较佳地,所述震荡孵育的时间为30-120min,优选60min。
9.作为一种优选的方案,所述前体
89
zr-oxine的制备包括以下步骤:
10.(1)将ph 7.0-8.0的
89
zr-oxalate溶液与溶于氯仿的8-羟基喹啉混匀;
11.(2)室温震荡;
12.(3)分离出下层氯仿相,蒸发氯仿;
13.(4)用dmso复溶,待完全溶解后加入dpbs稀释,使dmso的体积小于或等于反应总体积的2%,得到所述前体
89
zr-oxine。
14.在本发明一更优选实施方案中,步骤(1)中所述
89
zr-oxalate的放射性为0.5-10mci,优选3mci。
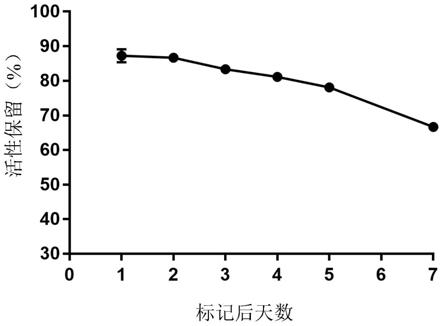
15.在一些优选的实施方案中,步骤(1)中所述
89
zr-oxalate溶液的ph值为7.4。
16.在一些优选的实施方案中,步骤(1)中所述8-羟基喹啉的浓度为1mg/ml。
17.作为一种优选的方案,所述混匀为室温震荡混匀;
18.所述震荡混匀的转速优选为300rpm。
19.作为一种优选的方案,在步骤(1)中,加入的氯仿与8-羟基喹啉等体积。
20.作为一种优选的方案,在步骤(3)中,使用真空离心浓缩仪来蒸发氯仿。
21.本发明的积极进步效果在于:
22.1.标记后hmscs存活率较标记前仅下降约2.9%,说明
89
zr-oxine标记对hmscs存活率无明显影响;
23.2. 89
zr-oxine进入hmscs后7d内的流出率在10%~35%之间,可以满足一定时间内的活体成像要求;
24.3. 89
zr-oxine标记不会影响hmscs细胞的成脂及成骨分化功能;
25.4. 89
zr-oxine标记后细胞凋亡水平略微升高,但是与未标记细胞相比,无显著性差异;
26.5. 89
zr-oxine标记组和未标记组hmscs均显示出间充质干细胞的预期表面标志表达(+ve针对cd73、cd90和cd105;-ve针对cd14、cd19、hla-dr、cd34和cd45)。
附图说明
27.图1:
89
zr-oxine合成的示意图。
28.图2:
89
zr-oxine标记的hmscs连续7d的流出率变化。
29.图3a:未标记的hmscs(100
×
)。
30.图3b:
89
zr-oxine标记的hmscs(100
×
)。
31.图4:
89
zr-oxine标记与未标记的hmscs的细胞成脂及成骨分化检测结果图。
32.图5:
89
zr-oxine标记与未标记的hmscs的细胞凋亡检测结果图。
33.图6a:
89
zr-oxine标记前hmscs的细胞表面标志表达检测结果图。
34.图6b:
89
zr-oxine标记后hmscs的细胞表面标志表达检测结果图。
具体实施方式
35.1. 89
zr-oxine合成
36.取100-200μl 89
zr-oxalate,用na2co3调节ph至7.4左右,然后加入500μl 8-羟基喹啉(1mg/ml,溶于氯仿),室温震荡1h以上。将下层的氯仿相萃取出来,得到
89
zr-oxine,用真空离心浓缩仪蒸发氯仿,再用60μl dmso复溶,待完全溶解后加入dpbs稀释至200μl。
89
zr-oxine合成示意图见图1。
37.2. 89
zr-oxine标记hmscs
38.收集5
×
106个hmscs,用5ml dpbs重悬,加入上述200μl 89
zr-oxine,室温震荡孵育30min。离心去除上清,然后用dpbs清洗标记细胞3次,得到
89
zr标记的hmscs细胞。
39.实施例一:
40.使用不同放射性剂量梯度标记hmscs,观察不同放射性剂量对hmscs的标记率以及活力的影响。
41.试验步骤:取3个50ml离心管,按照表1顺序加入试剂,在室温下低速(300rpm)震荡孵育30min,孵育结束后1200rpm,离心5min。分离上清和沉淀细胞,测定放射性,直至上清放射性/沉淀放射性≤10%,分别计算3组hmscs的标记率。3组沉淀hmscs分别用1ml生理盐水重悬,得到3组不同放射性的
89
zr标记的hmscs悬液,用台盼蓝染色进行细胞计数,计算细胞活力。
42.表1:各实验组活hmscs个数及放射性剂量
43.组别活hmscs数(个)总放射性(μci)11.0
×
10615021.0
×
10610031.0
×
10660
44.细胞标记率计算公式:沉淀细胞放射性/总放射性
×
100%。
45.标记后3组细胞的标记率和细胞活力如表2所示。
46.表2:不同放射性的
89
zr标记后对hmscs标记率及活力的影响
[0047][0048]
结论:3组不同放射性剂量标记结果相比,每106个hmscs使用60μci 89
zr-oxine标记率和细胞活力最高,标记效果最好,故选用60μci 89
zr-oxine进行后续实验。
[0049]
实施例二:
[0050]
每106个hmscs用60μci 89
zr-oxine的比例标记hmscs,放大细胞数,增大震荡频率,观察细胞的标记率和细胞活力情况。
[0051]
试验步骤:取1个50ml离心管,按照表3顺序加入试剂,在室温下低速(600rpm)震荡孵育30min,孵育结束后1200rpm,离心5min。分离上清和沉淀细胞,测定放射性,直至上清放射性/沉淀放射性≤10%,计算细胞的标记率。沉淀细胞用5ml生理盐水重悬,得到
89
zr标记的hmscs悬液,用台盼蓝染色进行细胞计数,计算细胞活力。结果见表4。
[0052]
表3:活hmscs个数及放射性剂量
[0053]
组别活细胞数(个)总放射性(μci)11.2
×
107720
[0054]
表4:60μci 89
zr-oxine对hmscs的标记率及活力的影响
[0055]
组别沉淀细胞放射性(μci)标记率(%)细胞活力(%)150069.497.5
[0056]
结论:每106个细胞用60μci 89
zr-oxine的比例标记hmscs用于正式试验,可获得较高的标记率和细胞活力。
[0057]
实施例三:
[0058]
对
89
zr-oxine标记的hmscs的流出率、细胞形态、细胞成脂及成骨分化、细胞凋亡、细胞表面标志等进行检测,观察
89
zr-oxine标记对细胞生物学特性的影响。
[0059]
1. 89
zr-oxine标记的hmscs的流出率检测
[0060]
89
zr-oxine标记的hmscs以1
×
105个/孔接种于24孔板中,于接种后24h、48h、72h、96h、120h、168h每个时间点各选择三个孔,分别用伽马计数仪检测3个复孔上清液、上清清洗液、细胞消化液和细胞清洗液的放射性,流出率按上清放射性占总放射性的百分比计算。
89
zr-oxine标记的hmscs连续7d的流出率的检测,结果如表5和图2所示。
[0061]
表5:
89
zr-oxine标记的hmscs连续7d的流出率
[0062]
时间(天)123457流出率(%)12.713.316.718.921.933.3
[0063]
2. 89
zr-oxine标记的hmscs的细胞形态检测
[0064]
未标记和标记的hmscs分别以2
×
105个/孔接种于6孔板中,将6孔板放入二氧化碳培养箱中孵育(37℃,5%co2),每2天更换一次新鲜的hmscs完全培养基,直至细胞融合度达到80%-90%时,弃去培养基,每孔加2ml dpbs清洗,然后将6孔板置于倒置显微镜下观察细胞形态。
[0065]
89
zr-oxine标记与未标记的hmscs的细胞形态如图3a和图3b所示。
[0066]
3. 89
zr-oxine标记的hmscs的细胞成脂及成骨分化检测
[0067]
未标记和标记hmscs分别以2
×
105个/孔接种于6孔板中,将6孔板放入二氧化碳培养箱中孵育(37℃,5%co2),待细胞长到60%-70%满时,小心地将孔内完全培养基吸走,分别加入2ml间充质干细胞成脂/成骨诱导分化培养基,对照孔用完全培养基作非诱导对照。每隔3天分别更换新鲜培养基。诱导分化2-4周,视细胞的形态变化及生长情况,成脂分化细胞和成骨分化细胞分别用油红o染液和茜素红染液进行染色。将6孔板置于倒置显微镜下观察成脂及成骨分化效果。
[0068]
89
zr-oxine标记与未标记的hmscs的细胞成脂及成骨分化结果如图4所示。
[0069]
4. 89
zr-oxine标记的hmscs的细胞凋亡检测
[0070]
在流式检测管中加入1
×
106个标记的hmscs待测细胞,离心,弃上清;将细胞重悬于1
×
结合缓冲液中(浓度为1
×
106个/ml);设置空白对照组、fitc单染组、pi单染组和样本组。空白对照组:1ml标记的hmscs悬液加入到流式管中,不加annexin-v-fitc和pi。fitc单染组:1ml标记的hmscs悬液加入到流式管中,加入10μl fitc;混匀,室温,避光孵育10min。pi单染组:1ml标记的hmscs悬液加入到流式管中,加入20μl pi;混匀,室温,避光孵育10min。样本组:1ml标记的hmscs悬液中,加入10μl fitc和20μl pi溶液;混匀,室温,避光孵育10min。孵育结束后用流式细胞仪检测分析。
[0071]
89
zr-oxine标记与未标记的hmscs的细胞凋亡检测结果如图5所示。
[0072]
5. 89
zr-oxine标记的hmscs的细胞表面标志检测
[0073]
将标记的hmscs待测细胞(约1.2
×
107个)离心后用1.2ml的dpbs重悬,取12支流式检测管,分别加入100μl标记的hmscs悬液,然后分别标记样本管共8支,同型对照管共4支。然后于样本管中加入荧光素标记的抗体为试验管,于同型对照管中加入荧光素标记同型抗体作为阴性对照,各2μl,混匀;4℃,避光孵育30min。孵育结束后1200rpm离心5min,弃上清,加2ml的dpbs混匀,1200rpm离心5min,反复清洗2次(洗去未标记抗体)。弃去上清液,控干,加入500μl dpbs重悬,上机检测。
[0074]
89
zr-oxine标记与未标记的hmscs的细胞的表面标志表达检测结果如图6a和图6b所示。
[0075]
结论:检测结果表明
89
zr-oxine标记hmscs后不会影响细胞形态、细胞成脂及成骨分化能力和细胞表面标志表达等细胞生物学特性,也几乎不会增加细胞的凋亡水平。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1