基因串联表达盒、多位点基因编辑系统及应用的制作方法
本发明涉及酵母基因编辑领域,具体而言,涉及一种基因串联表达盒、多位点基因编辑系统及应用。
背景技术:
1、酿酒酵母作为最经典的真核单细胞模式生物,在科学研究和生产应用中被大量使用。对酿酒酵母进行变异和工程改造是科学研究和生产应用中最常见的手段,提高这种手段的精准性或者实现对酿酒酵母精准的变异和工程改造,能大大提高科学研究的效率和降低生产应用的成本。目前,对酿酒酵母的基因组进行精准工程改造的主流技术有:酵母转化介导同源重组技术、emage基因编辑技术、以crispr/cas为基础的一系列精准基因编辑技术以及合成基因组学技术。
2、酵母转化介导同源重组技术通过向酵母转化一个含有目的遗传改造序列的dna片段(含突变的片段、基因敲除片段或基因插入的片段)来实现目标位点的精准工程改造。该dna片段在目的遗传改造序列的两端加上了一定长度的(通常大于40bp)目标位点上下游同源序列,且一般为了方便筛选,会包含一个筛选标记基因在目的遗传改造序列内。通过将该序列转化至酵母菌株内,诱导酵母将遗传改造片段与目标位点序列发生同源重组,使目标位点获得设计的遗传改造变异,然后在对应的筛选培养基(营养缺陷型或抗生素筛选)上筛选,实现目标位点的精准工程改造。虽然该技术能实现精准的工程改造,然而由于该技术效率较低,1μgdna转化效率小于0.1%,若不使用筛选标记基因进行筛选难以获得目标菌株。而若使用筛选标记基因进行筛选,则会在目标位点处留下不想要的筛选标记基因且需要考虑筛选基因对目标位点附近的基因或基因表达元件的干扰,因此后续多会涉及筛选基因的敲除,无法进行大规模或高通量的基因敲除。另外,该方法虽然可以进行多位点编辑,但位点之间距离不可太远。
3、emage基因编辑技术通过向酵母转化一段100nt长度左右的单链寡核苷酸来实现精准的基因编辑。该寡核苷酸序列需根据目标序列与最近的自我复制起始序列(ars)的位置关系来确定,需保证其序列与目标序列发生复制时的后随链(lagging strand)序列相似。该寡核苷酸产生的变异通常是比目标序列多插入、删除、突变一个或多个核苷酸,无法进行长度较长的变异(如基因插入)。该技术需要通过电刺激转化,将单链寡核苷酸转化至酵母菌株内,诱使酵母在dna复制过程中,错误使用该单链寡核苷酸作为目标序列复制时后随链上的“冈崎片段”,使得寡核苷酸上的变异被引入到子细胞当中,实现基因精准编辑。虽然该技术可与自动化设备偶联,具有一定高通量或大规模工程改造菌株的潜力,然而,该技术效率随目标序列与ars序列距离增加而减小,且缺乏快速有效的筛选方法。因此该技术受到目标序列位置的影响,可用范围受限,并且该方法需通过成本较高过程较为繁琐的测序验证方法来筛选目标改造菌株,使其下游应用难以展开。
4、以crispr/cas为基础的一系列精准基因编辑技术通过设计靶向目标位点的sgrna,引导cas蛋白对目标位点进行切割,引起双链断裂,诱发细胞进行dna双链断裂修复。并在修复过程中,引入同源重组模板序列,诱使细胞发生同源重组修复。通过在模板序列中引入设计的变异,实现目标位点的精准基因编辑。该技术效率较高,常能达到90%以上。然而,多位点基因编辑技术只能对多个位点进行简单的、不可控的突变编辑(一个或几个核苷酸的敲除、替换或插入),精准基因编辑技术只能同时对单个位点进行精准编辑。尚未有能在实现对多个位点基因编辑的同时进行精准编辑的技术,使得对菌株的系统工程改造需要较长的时间
5、合成基因组技术通过人工设计与dna合成,能大规模的对菌株进行大量的工程改造,是新兴的工程改造手段,理论上能实现任何人为设计的改造,改造程度比其他技术更大。然而合成基因组技术成本较高,不适用于目标位点数量较多但较分散的菌株工程改造。
技术实现思路
1、本发明的主要目的在于提供一种基因串联表达盒、多位点基因编辑系统及应用,以解决现有技术中难以同时对多个位点进行精确基因编辑的问题。
2、为了实现上述目的,根据本发明的第一个方面,提供了一种基因串联表达盒,该基因串联表达盒包括多个串联的基因编辑元件组,且相邻两个基因编辑元件组之间由同源臂间隔开来,多个基因编辑元件组分别靶向多个目标编辑位点;同源臂之间不相同,同源臂和基因串联表达盒上其他部分不同。
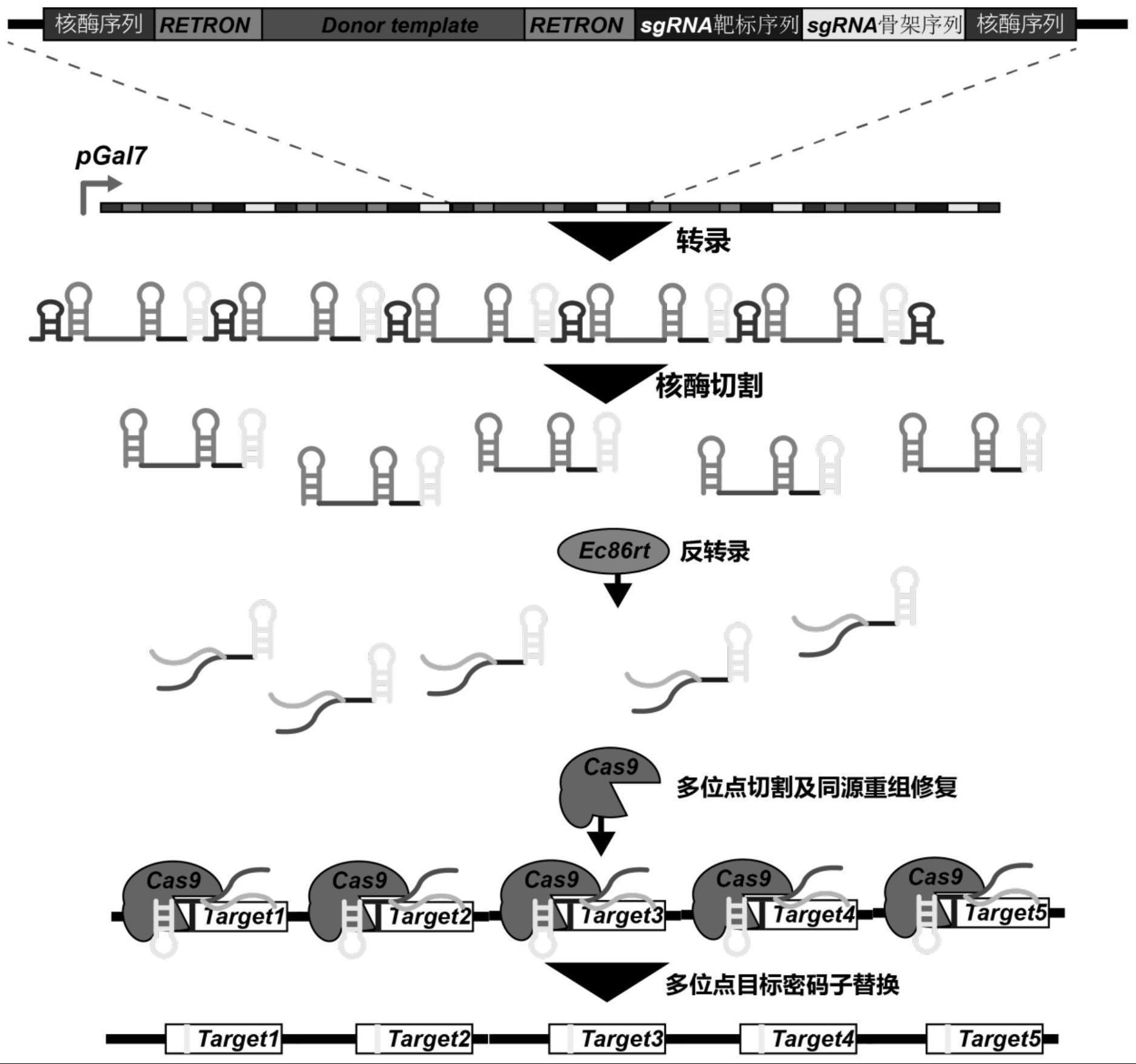
3、进一步地,每个基因编辑元件组包括沿5’到3’方向依次连接的反转录子、向导rna的dna序列以及位于反转录子5’端的第一核酶序列和位于向导rna的dna序列3’端的第二核酶序列,第一核酶序列和第二核酶序列具有自剪切活性,其中,反转录子包括沿5’到3’方向依次连接的反转录子5’序列、同源重组修复模板序列及反转录子3’序列;优选地,同源重组修复模板序列包括沿5’到3’方向依次连接的目标编辑位点的上游序列、设计变异序列和目标编辑位点的下游序列;优选地,设计变异序列包括0~3000个碱基;优选地,目标位点上游序列包括30~100个碱基,更优选为40-60bp,进一步优选为50bp;优选地,目标位点下游序列包括30~100个碱基,更优选为40-60bp,进一步优选为50bp;优选地,向导rna序列包括依次连接的靶标rna靶标序列和靶标rna骨架序列,靶标rna靶标序列与反转录子3’序列的3’端连接,靶标rna骨架序列的3’端与第二核酶序列的5’端连接;优选地,第一核酶序列与第二核酶序列不同;优选地,第一核酶序列与第二核酶序列各自独立地编码如下任意一种核酶:锤头核酶、肝炎δ病毒核酶或发卡核酶;优选地,靶标rna骨架序列为cas9蛋白的靶标rna骨架序列,更优选为seq id no:1:gtttcagagctatgctggaaacagcatagcaagttgaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgcttttt;优选地,多个同源臂各自独立地选自如下任意一种序列:seq id no:2:gcattaaaacaacaacatttgatacgtaaccccttaaatg、seq idno:3:ttaaataaacaagcaatcagacttaacatttagcggcata、seq id no:4:gtcccggtccgattgtgtacacgcttaatgaagtattcct、seq id no:5:cttggacacaatagctttaactgttagcgcgcgaaaatgt;优选地,设计变异序列选自如下任意一种:1)无;2)目标编辑位点的替代序列;3)含有多于目标编辑位点的插入序列;优选地,多个目标编辑位点包括多个不同位置的目标编辑位点,更优选为2~5个,进一步优选为3个;优选地,多个目标编辑位点包括多个不同位置的cgg位点,更优选为2~5个,进一步优选为3个;优选地,多个目标编辑位点包括5个不同位置的cgg位点,多个基因编辑元件组中,每个基因编辑元件组所携带的同源重组修复模板序列中的设计变异序列分别为:cgt、cgc、cgc、aga及agg;优选地,反转录子5’序列包括:seq id no:6:atgcgcacccttagcgagaggtttatcattaaggtcaacctctggatgttgtttcggcatcctgcattgaatctgagttactgtctgttttcct;优选地,反转录子3’序列包括:seq id no:7:aggaaacccgtttcttctgacgtaagggtgcgca。
4、进一步地,基因串联表达盒还包括启动子,多个基因编辑元件组由同一启动子驱动表达;优选地,启动子为第一诱导型启动子;优选地,第一诱导型启动子包括pgal系列启动子;优选地,pgal系列启动子选自如下任意一种:pgal1、pgal4、pgal7或pgal10。
5、根据本发明的第二个方面,提供了一种质粒,该质粒包括上述基因串联表达盒。
6、进一步地,质粒还包括酵母人工染色体着丝粒元件;优选地,质粒进一步包括筛选标记基因;优选地,筛选标记基因包括营养缺陷型标记基因和/或抗生素抗性基因;优选地,营养缺陷型标记基因包括ura3、his3或leu2;优选地,抗生素抗性基因包括氨苄青霉素抗性基因、bleor基因、neo基因或kanmx基因;进一步优选地,抗生素抗性基因包括氨苄青霉素抗性基因;优选地,质粒进一步包括大肠杆菌复制起始位点元件;优选地,大肠杆菌复制起始位点元件包括:如下质粒中的复制起点ori:cole1、pmb1、pbr322或puc;优选地,质粒进一步包括穿梭质粒复制起始位点元件;优选地,穿梭质粒复制起始位点元件包括:f1 ori、orit或oriv。
7、根据本发明的第三个方面,提供了一种多位点基因编辑系统,该多位点基因编辑系统包括cas基因、ec86rt基因以及向导rna的dna序列,其中,向导rna的dna序列以上述基因串联表达盒或质粒的形式存在;优选地,多位点基因编辑系统为酿酒酵母的多位点基因编辑系统;优选地,cas基因包括cas9基因;优选地,cas9基因和ec86rt基因均位于质粒上或均整合到酿酒酵母的基因组上;优选地,位于质粒上时,cas9基因和ec86rt基因位于同一质粒上构成cas9/ec86rt质粒,或者,位于不同质粒上构成cas9/ec86rt质粒组;优选地,cas9/ec86rt质粒或cas9/ec86rt质粒组上还包括驱动cas9基因的启动子和/或驱动ec86rt基因的第二诱导型启动子;优选地,第二诱导型启动子包括pgal系列启动子;优选地,pgal系列启动子包括pgal1、pgal4、pgal7或pgal10;优选地,cas9基因的第二诱导型启动子和ec86rt基因的第二诱导型启动子不相同;优选地,cas9/ec86rt质粒或cas9/ec86rt质粒组包括酵母人工染色体着丝粒元件;优选地,cas9/ec86rt质粒或cas9/ec86rt质粒组包括筛选标记基因;优选地,cas9/ec86rt质粒组中不同质粒的筛选标记基因不同;优选地,筛选标记基因包括营养缺陷型标记基因和/或抗生素抗性基因;优选地,营养缺陷型标记基因包括ura3、his3或leu2;优选地,抗生素抗性基因包括氨苄青霉素抗性基因、bleor基因、neo基因或kanmx基因;优选地,cas9/ec86rt质粒或cas9/ec86rt质粒组包括整合位点上游同源序列和整合位点下游同源序列;优选地,整合位点上游同源序列和整合位点下游同源序列包括40~100个碱基。
8、根据本发明的第四个方面,提供了一种宿主细胞,该宿主细胞包含如下至少一种:a)上述多位点基因编辑系统中的cas9/ec86rt质粒或cas9/ec86rt质粒组;b)上述质粒;c)上述多位点基因编辑系统;优选地,宿主细胞为整合有cas9基因和ec86rt基因的酿酒酵母细胞;优选地,酿酒酵母细胞包括营养缺陷型酿酒酵母细胞;优选地,宿主细胞为模式生物的细胞,模式生物包括酿酒酵母或大肠杆菌;优选地,宿主细胞包括酿酒酵母ytl026、大肠杆菌dh5α、大肠杆菌top10或大肠杆菌dh10β。
9、根据本发明的第五个方面,提供了一种多位点基因编辑方法,该多位点基因编辑方法包括:诱导细胞中的多位点基因编辑系统进行表达,从而启动细胞中多个目标编辑位点的基因编辑,多位点基因编辑系统为上述多位点基因编辑系统;优选地,多位点基因编辑方法用于模式生物的基因编辑;优选地,模式生物包括酿酒酵母,多位点基因编辑方法为酿酒酵母多位点基因编辑方法。
10、进一步地,在诱导酿酒酵母细胞中的多位点基因编辑系统进行表达之前,酿酒酵母多位点基因编辑方法还包括:将上述质粒转化入上述宿主细胞;或者将上述质粒以及上述多位点基因编辑系统中的cas9/ec86rt质粒或cas9/ec86rt质粒组共同转化入酿酒酵母细胞;优选地,酿酒酵母细胞包括营养缺陷型酿酒酵母细胞,更优选为酿酒酵母ytl026、by4741或by4742;优选地,质粒的转化方法包括酵母醋酸锂-单链dna转化法、热激法或电转化法。
11、进一步地,在转化之后,以及诱导酿酒酵母细胞中的多位点基因编辑系统进行表达之前,酿酒酵母多位点基因编辑方法还包括:利用筛选培养基和/或菌落pcr筛选转化后的阳性克隆,得到携带基因串联表达盒、cas9基因和ec86rt基因的酿酒酵母细胞;优选地,诱导酿酒酵母细胞中的多位点基因编辑系统进行表达包括:诱导酿酒酵母细胞表达cas9蛋白和ec86rt逆转录酶,并诱导酿酒酵母细胞中的多个基因编辑元件组转录,从而启动酿酒酵母细胞中多个目标编辑位点的基因编辑;优选地,采用预诱导剂和诱导剂依次诱导酿酒酵母细胞中的多位点基因编辑系统进行表达;优选地,预诱导剂为棉子糖,诱导剂为半乳糖;优选地,诱导酿酒酵母细胞表达cas9蛋白和ec86rt逆转录酶的诱导剂与诱导多个基因编辑元件组转录的诱导剂不同;优选地,在启动酿酒酵母细胞中多个目标编辑位点的基因编辑之后,酿酒酵母多位点基因编辑方法还包括:利用测序筛选突变成功的酿酒酵母细胞;优选地,多个目标编辑位点包括多个不同位置的目标编辑位点,更优选为2~5个,进一步优选为3个;优选地,多个目标编辑位点包括多个不同位置的cgg位点,更优选为2~5个,进一步优选为3个;优选地,多个目标编辑位点包括5个不同位置的cgg位点,多个基因编辑元件组中,每个基因编辑元件组所携带的同源重组修复模板序列中的设计变异序列分别为:cgt、cgc、cgc、aga及agg。
12、根据本发明的第六个方面,提供了一种试剂盒,该试剂盒包括上述质粒,或者上述多位点基因编辑系统,或者上述宿主细胞。
13、根据本发明的第七个方面,提供了一种上述基因串联表达盒,或者上述质粒,或者上述多位点基因编辑系统,或者上述宿主细胞,或上述酿酒酵母多位点基因编辑方法,或上述试剂盒在多位点基因编辑中的应用;优选地,应用为在酿酒酵母的多位点基因编辑中的应用。
14、应用本发明的技术方案,利用基因串联表达盒实现多个元件组的同时表达,在cas9蛋白和ec86rt逆转录酶共同作用下,同时实现酿酒酵母中多个位点的精确基因编辑,提高酿酒酵母基因编辑效率。
- 还没有人留言评论。精彩留言会获得点赞!