一种解钾促生吡咯伯克霍尔德菌及其菌剂和应用
1.本发明属于微生物技术领域,具体地说,涉及一种解钾促生吡咯伯克霍尔德菌及其菌剂和应用。
背景技术:
2.烟草(nicotiana tabacum)属茄科一年生草本植物,是重要的经济作物之一。我国烟草产量占世界总产量的1/3,在许多地区都具有广泛的种植面积。烟草既是我国国民经济的重要组成部分,也是一项高税收的特殊产业,目前已成为我国河南、云南、四川等地区地方财政的重要支柱重要途径。烟草生长过程中对钾素的需求量很高。钾做为烤烟的品质元素之一,与烟草的燃烧完全性、燃烧均匀性、吃味、香气、化学成分及烟叶安全性密切相关,对改善烟叶的可燃性和阴燃持火性具有显著作用。自然界中,供烟草生长吸收利用的钾元素主要来自土壤。我国土壤全钾量为0.5%-2%,以钾长石、云母等硅铝酸钾为主的难溶性钾占总量的95%,能供作物直接吸收利用的钾素资源极其有限。为改善烟叶品质,提高烟草含钾量,烟草种植中常使用大量化学钾肥,而施用的钾肥在土壤中极易被固定,成为无效态或缓效态钾,对一年生烟草的生长几乎没有效用。大量施用钾肥不仅增加烟草栽培成本,还严重影响种植区的生态环境,如病虫害抗药性增加,土壤板结,重金属含量超标,水体污染等,导致环境污染及资源浪费。因此,寻找新型方法提高作物对土壤中钾元素吸收已成为迫切需要解决问题。解钾菌又称硅酸盐菌,是能够分解土壤中的硅酸盐等矿物,并将难溶性的钾、磷等元素转变为可溶性状态,供植物吸收利用的一类微生物。解钾菌通过酸解等途径使土壤中无效钾缓慢转换成有效态的钾,供作物缓慢吸收,提高作物中钾素含量。从而提高作物抗倒伏、抗干旱、抗病虫害等能力,同时增加作物产量,提高经济效益。本研究从四川泸州植烟区烟草根际土壤分离得到一株具有优良解钾能力的吡咯伯克霍尔德菌dy211,通过室内实验检测菌株不同时期的解钾能力,并通过田间试验进一步考察菌株对烟草产量和品质的影响,且吡咯伯克霍尔德菌dy211具有较好的促生作用,能够提高顶部和中部烟叶的钾含量。
技术实现要素:
3.1、要解决的问题
4.本发明第一个目的在于提供一种从四川泸州烟草根际土壤中分离的解钾菌-吡咯伯克霍尔德菌(burkholderia pyrrocinia)dy211,丰富了解钾促生菌的菌种资源,为研究开发促生菌菌剂奠定基础。
5.本发明第二个目的在于提供上述吡咯伯克霍尔德菌dy211对解钾和促进植物生长的应用。
6.本发明第三个目的在于提供一种利用上述菌株dy211生产的微生物菌剂。
7.本发明第四个目的在于提供上述微生物菌剂的制备方法。
8.本发明第五个目的在于提供上述微生物菌剂对解钾和促进植物生长的应用。
9.本发明第六个目的在于提供上述菌株dy211的筛选、鉴定方法。
10.2、技术方案
11.为解决上述问题,本发明采用如下的技术方案。
12.一种解钾促生吡咯伯克霍尔德菌,所述的吡咯伯克霍尔德菌的拉丁学名为burkholderiapyrrocinia,其编号为dy211,2021年11月17日保存于中国典型培养物保藏中心,保藏号为 cctcc m20211436。
13.一种菌剂,包括如上述所述的吡咯伯克霍尔德菌。
14.上述所述的菌剂中,所述的菌剂的活性成分为吡咯伯克霍尔德菌的菌液及其代谢上清液。
15.一种如上述所述的菌剂的制备方法,包括以下步骤:
16.(1)固体解钾培养基制备;
17.(2)液体解钾培养基制备;
18.(3)活化菌株的制备:挑取在固体解钾培养基平板的吡咯伯克霍尔德菌单菌落,制备种子液,然后接种于液体解钾培养基中,在温度28℃、转速160r/min的摇瓶中培养,待菌株生长至对数生长期时,使用无菌水稀释菌液,获得菌剂。
19.上述所述的菌剂的制备方法中,
20.步骤(1)中所述的固体解钾培养基,包括以下组分及含量:葡萄糖10g/l、酵母膏0.4g/l、硫酸镁0.2g/l、磷酸氢二钾0.5g/l、氯化钠0.2g/l,碳酸钙1g/l和琼脂20g/l。
21.上述所述的菌剂的制备方法中,
22.步骤(1)中所述的液体解钾培养基,包括以下组分及含量:淀粉5g/l、酵母膏1g/l、硫酸镁0.5g/l、磷酸氢二钠2g/l、碳酸钙1g/l和三氯化铁5mg/l。
23.一种如上述所述的解钾促生吡咯伯克霍尔德菌在促进烟草生长中的应用。
24.上述所述的解钾促生吡咯伯克霍尔德菌在促进烟草生长中的应用中,
25.所述的促进烟草生长的应用包括提高成熟期烟草植株的生物量和烟叶钾含量。
26.上述所述的菌剂在促进烟草生长中的应用中,
27.所述的吡咯伯克霍尔德菌的剂型是药学上可接受的剂型。
28.3、有益效果
29.相比于现有技术,本发明的有益效果为:
30.本发明所述的菌株从四川泸州植烟区烟草根际土壤中经过筛选获得,编号为dy211,能够溶解难溶性钾、促进植物生长和提高叶片钾含量。其形态特征为:呈革兰氏阴性,菌落呈圆形,透明略带白色,表面湿润有光泽,边缘规整,水滴状隆起。综合各项生理生化试验结果和分子生物学分析,该菌鉴定为吡咯伯克霍尔德菌。现有技术中并未公开吡咯伯克霍尔德菌应用于解钾和促进植物生长,该菌吡咯伯克霍尔德菌dy211不同于公开的伯克霍尔德菌。通过功能性鉴定试验可以看出,伯克霍尔德菌dy211能够溶解难溶性钾(钾长石粉);同时,吡咯伯克霍尔德菌dy211在解钾试验中,其菌液、菌体具有较高的解钾能力。施用吡咯伯克霍尔德菌dy211菌剂能够提高成熟期烟草植株的生物量和烟叶钾含量。使烟草植株茎高增加 12.0%,叶片数增加12.9%,茎直径增加16.9%,中部叶长增加28.8%,中部叶宽增加18.5%,并可显著提高顶部和中部烟叶中的钾含量。
附图说明
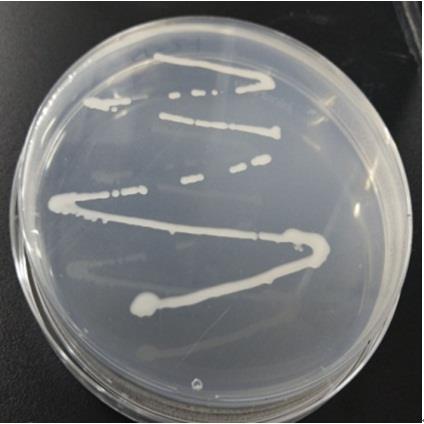
31.图1为本发明提供的伯克霍尔德菌dy211的宏观形态图;
32.图2为已知伯克霍尔德菌a12的宏观形态图;
33.图3为本发明提供的伯克霍尔德菌dy211的固体培养时的解钾性能鉴定图;
34.图4为已知伯克霍尔德菌a12的固体培养时的解钾性能鉴定图;
35.图5为本发明提供的伯克霍尔德菌dy211和已知伯克霍尔德菌a12液体培养时的可溶性钾的动态变化图;
36.图6为本发明提供的伯克霍尔德菌dy211的16srdna基因序列扩增示意图;
37.图7为本发明提供的伯克霍尔德菌dy211的基于16srdna基因序列构建的系统发育树。
具体实施方式
38.下面结合具体实施例对本发明进一步进行描述。
39.下面将结合本发明实施例中的内容,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
40.除非另有定义,本说明书所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。
41.本发明中,吡咯伯克霍尔德菌(burkholderia pyrrocinia)菌株dy211或被简称为菌株d y211。本发明所提供的吡咯伯克霍尔德菌可作为液体菌剂使用。
42.本发明中,吡咯伯克霍尔德氏菌a12选自山东农业大学植保学院,株菌a12与genban k中已有的burkholderia pyrrocinia菌株dq360828亲缘关系最近,16s rdna序列相似度达到99.85%。
43.实施例1菌株dy211的分离筛选
44.从四川泸州植烟区烟草根际土壤采集土样,从中分离出不同的微生物,采用梯度稀释法处理土壤样品,吸取适宜梯度的稀释液200μl到平板上进行涂布,于28℃倒置培养。逐日观察菌落形态特征,选取有透明解钾圈或者菌斑的菌株,通过平板划线法进行纯化,并将纯化菌株保存于固体解钾培养基上,待用。
45.将上述待用菌株进行摇瓶培养,活化扩繁,配制解钾固体培养基,准备好灭好菌的平板,培养基灭好菌之后倒板,待凝固之后,吸取菌液1μl点到平板上,封好板放置于28℃培养,待有透明解钾圈或者菌斑时,观察实验结果。结合图1和图2,选取解钾能力最强菌株dy2 11进一步研究,并与已知解钾菌a12解钾能力进行比较,实验操作与dy211一致,菌株d y211和a12解钾能力如表1所示,菌株dy211直径比达到4.37,强于菌株a12。如图3和图4所示,本实施例的菌株dy211能够溶难溶性钾,且解钾圈直径、菌斑直径较大。硅酸盐固体培养基成分如下:
46.硅酸盐固体培养基:高磷酸钙2.0g,硫酸镁0.005g,三氯化铁0.1g,碳酸钙2.0g,蔗糖 5.0g,酵母膏0.5g,钾长石粉2.0g,琼脂粉15.0g,去离子水1.0l,ph 7.2-7.5。解钾评估标准:直径比=解钾圈直径/菌斑直径*100%;
47.表1 dy211和已知解钾菌a12解钾能力评估
[0048][0049]
实施例2菌株dy211的解钾能力测定
[0050]
按照种子液培养基配方制备培养基,分装于250ml三角瓶,每瓶100ml,瓶口用过滤孔径0.22μm的封口膜包扎,121℃灭菌20min,冷却备用。在无菌条件下,将活化好的菌种用接种环接种至种子液培养基中,每瓶接种一环,重复三次,瓶口无菌封口膜包扎,28℃摇床培养,每24h无菌操作取样,对发酵液中细菌数量进行计数,待活菌数增至108cfu/ml左右时,即可做种子液使用。对其中一瓶种子液灭菌,121℃,20min,制成灭活的种子液,备用。
[0051]
按照发酵培养基配方制备培养基,分装于250ml三角瓶,每瓶100ml,瓶口用过滤孔径0.22μm的封口膜包扎,121℃灭菌20min,冷却备用。在无菌条件下,为发酵培养基接种,每瓶加1ml种子液。实验组(分别为dy211组和a12组)加正常种子液,对照组(ck组)加灭活的种子液,实验组与ck组均重复6次,瓶口用无菌封口膜包扎,28℃摇床培养,分别于3 、7、14、21、28d时,取样10ml于无菌离心管中保存,采用滤纸初步过滤杂质,对滤液进行85 00rpm/min离心10min处理,取上清,根据gb5009.91-2017测定有效钾含量。
[0052]
种子液培养基:磷酸氢二钠2.0g,硫酸镁0.5g,碳酸钙0.1g,三氯化铁5.0mg,酵母膏0.5g,可溶性淀粉5.0g,去离子水1.0l,ph 7.0-7.2。
[0053]
发酵培养基:硫酸铵0.2g,硫酸镁0.5g,碳酸钙0.1g,氯化钠0.1g,三氯化铁5.0mg,蔗糖10.0g,钾长石粉5.0g,去离子水1.0l,ph 7.0-7.2。
[0054]
如图5所示,相对于ck组与a12组,dy211组的解钾能力显著性较高。
[0055]
实施例3菌株dy211的鉴定
[0056]
1.形态学鉴定
[0057]
如图1所示,革兰氏染色结果显示菌株dy211为革兰氏阴性,球状。菌落呈圆形,透明略带白色,表面湿润有光泽,边缘规整,水滴状隆起。
[0058]
2.生理生化鉴定
[0059]
参考《常见细菌系统鉴定手册》,通过生理生化试验对解钾促生菌菌株进行初步鉴定,鉴定结果显示:革兰氏阴性,吲哚反应阴性,v-p实验反应阴性,甲基红反应阳性,产硫化氢阴性,氧化酶实验阴性,吲哚实验阴性,鼠李糖、葡萄糖、蔗糖利用实验为阳性。
[0060]
根据上述鉴定结果,该解钾促生菌菌株dy211初步鉴定为伯克霍尔德菌。
[0061]
3.分子生物学鉴定
[0062]
如图4所示,将菌株dy211提取dna并作为模板,16s rdna通用上游引物为27f:5
′ꢀ‑
agagtttgatcctggctcag-3
′
下游引物为1492r:5
′‑
tacggttaccttgttacgactt
‑ꢀ3′
,对16srdna核苷酸片段进行扩增,将扩增片段直接进行序列测定。16srdnapcr体系反应条件见表2和表3。
[0063]
表2 16s rdna pcr反应体系
[0064]
组分反应体系(μl)2
×
taq master mix2627f引物11492r引物1基因组dna1ddh2o21总体积50
[0065]
表3 16s rdna pcr反应程序
[0066][0067]
将测序的结果输入ncbi网站上的blast程序进行比对,结果显示该菌株16srdna核苷酸序列与genbank基因库中的burkholderia pyrrocinia的16srdna序列同源度最高,同源率达到99.58%,如图6和图7所示;通过dnaman6.0对genbank中已有的伯克霍尔德菌属的16srdna序列进行遗传进化分析,结果显示,解钾促生菌菌株dy211 16s rdna与burkholderia pyrrocinia同源性最高,因此可以初步判定该菌株dy211为吡咯伯克霍尔德菌。
[0068]
通过形态、生理生化特征和16s rdna序列分析可知,该菌株为吡咯伯克霍尔德菌,命名为吡咯伯克霍尔德菌dy211,该菌株于2021年11月17日保藏于中国典型培养物保藏中心,保藏登记号:cctcc m20211436。
[0069]
实施例4菌株dy211对烟草种子出苗的影响
[0070]
菌株dy211促进烟草植株生长的应用,包括以下步骤:
[0071]
(1)种子处理:将未经处理过的烟草种子取适量放入培养皿中进行消毒灭菌,将挑选好的种子置于通风橱进行氯气消毒,在烧杯中放入50ml次氯酸钠和10ml氯化氢,关闭橱窗,消毒2h,消毒后放入超净工作台,通风,待用
[0072]
(2)将营养土(钾源主要为难溶性钾)经过121℃,20min灭菌后冷却,装入穴盘中,置于无菌水水中,待充分吸收无菌水后,每穴放入消毒后的烟草种子两颗
[0073]
(3)促生菌菌液制备:将活化好菌株进行发酵,28℃培养,定期取样检测菌株浓度,对于过高浓度菌株使用无菌水稀释,对于浓度未达标菌株继续发酵,保证在育苗时施用菌液的有效浓度是108cfu/ml,
[0074]
(4)为探究不同用量和不同时期施用dy211菌液对烟草种子出苗的影响,设计以下实验处理:a1:播种时施加1ml菌液/穴,a2:播种时施加2ml/穴,a3:播种时施加5ml/穴,a4:
播种+出苗期各施加1ml/穴,a5:播种+出苗期各施加2ml/穴,a6:播种+出苗期各施加5ml/穴, a7:出苗期时施加1ml/穴,a8:出苗期时施加2ml/穴,a9:出苗期时施加5ml/穴,以施加相应用量的无菌水作为空白对照组(无菌液),每个处理4列,每列8个重复定期对出苗情况进行统计,共统计三次,第一次为处理25d,第二次处理50d,第三次为80d,
[0075]
(5)为比较菌株dy211与现有菌株a12对烟草出苗效果的强弱,将现有菌株a12与菌株dy211相同处理,实验处理编号依次为b1、b2、b3、b4、b5、b6、b7、b8、b9,定期对出苗情况进行统计,共统计三次,第一次为处理25d,第二次处理50d,第三次为80d。
[0076]
表4菌株dy211在穴盘实验烟草种子出苗的影响
[0077][0078]
表5菌株a12在穴盘实验烟草种子出苗的影响
[0079][0080]
[0081]
如表4和表5所示,菌株dy211与现有菌株a12在出苗实验中相比,具有明显优势,尤其是a7与a9两组出苗率最高。根据菌株dy211对烟草种子出苗的影响情况,选择处理组 a1、a4、a7、a9进行后续田间实验,为保持同等条件,现有菌株也选择同等处理b1、b4、 b7、b9进行后续田间实验。
[0082]
实施例5菌株dy211对烟草植株生物量的影响
[0083]
移栽期将烟草幼苗移植至大田中,待烟草生长至成熟期,分别测定烟草植株茎高增,叶片数,茎直径,中部叶长和中部叶宽。每株十个重复,通过originlab originpro 8.5软件分析,发现利用dy211制备的菌液能够提高土壤中可溶性钾含量,增加烟草生物量,如表6所示,处理组a1使成熟期烟草植株茎高增加8.4%,叶片数增加12.5%,茎直径增加15.3%,中部叶长增加23.3%,中部叶宽增加12.1%。且其他处理组与ck相比也普遍有显著提高;如表6和表7所示,菌株dy211相对于现有菌株a12,在茎高、茎直径、中部叶长、中部叶宽上具有明显优势,菌株a12对烟草幼苗促进主要体现在烟草茎直径。同时,可以明显看出, a7与a9两组,烟草生物量各项指标(茎高、叶片数、茎直径、中部叶长及中部叶宽)相对较高,例如,处理组a9使成熟期烟草植株茎高增加12.0%,叶片数增加12.9%,茎直径增加 16.9%,中部叶长增加28.8%,中部叶宽增加18.5%。
[0084]
表6菌株dy211对烟草生物量的影响
[0085][0086]
注:*表示显著/**表示极显著
[0087]
表7菌株a12对烟草生物量的影响
[0088][0089][0090]
注:*表示显著/**表示极显著
[0091]
实施例6菌株dy211对烟叶钾含量的影响
[0092]
取成熟烟草植株的中部和顶部叶片,每种叶片十个重复,烘干后采用火焰原子吸收光谱法(gb5009.91-2017)测定叶片中的钾含量。通过originlab originpro 8.5软件对
数据分析,发现顶部和中部叶片中的钾含量和对照相比均有显著提高。如表8,处理组a7中部叶和顶部叶钾含量的提升最明显,钾含量增长率分别达到22.22%和72.48%,且对烟草种子出苗的影响较小,如表8和表9,菌株dy211相对菌株a12对烟叶含量具有显著影响,菌株a12 对烟草植株顶部烟叶有一定促进作用,但增长率不大。具体来说,a9组各项指标占显著性差异,例如中部叶增长率为20.98%,又例如顶部叶增长率为59.63%。
[0093]
表8菌株dy211对烟草中部和顶部叶片钾含量的影响
[0094][0095]
注:*表示显著/**表示极显著
[0096]
表9菌株a12对烟草中部和顶部叶片钾含量的影响
[0097][0098]
注:*表示显著/**表示极显著
[0099]
本发明从四川泸州植烟区烟草根际土壤中筛选到解钾菌菌株dy211,对该菌株的形态特征、生理生化特性和16s rdna序列进行测定,确定该菌株为吡咯伯克霍尔德菌dy211(burkholderia pyrrocinia)。采用火焰原子吸收光谱法(gb5009.91-2017)测定菌株dy211代谢上清液中可溶性钾的含量,进而在田间试验中对烟草的促生作用进行测试,结果表明,该菌株在固体和液体培养条件下均可利用难溶性钾,液体培养14d时代谢上清液中速效钾含量为5.48mg/l,解钾率达到292.86%,因此具有优良的解钾能力。同时,利用吡咯伯克霍尔德菌dy211制备的菌液能够烟草植株的生物量和烟叶钾含量。使烟草植株茎高增加12.0%,叶片数增加12.9%,茎直径增加16.9%,中部叶长增加28.8%,中部叶宽增加18.5%,并能显著提高顶部和中部烟叶中的钾含量。从而促进烟草生长,提高烟叶品质,减少化学肥料的使用,该解钾促生菌株及其菌液具有广泛的应用前景。
[0100]
以上内容是结合具体实施方式对本发明作进一步详细说明,不能认定本发明具体实施只局限于这些说明,对于本发明所属技术领域的普通技术人员来说,在不脱离本发明
的构思的前提下,还可以做出若干简单的推演或替换,都应当视为属于本发明所提交的权利要求书确定的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1