腺相关病毒载体在逆向标记外周组织或器官一级神经网络中的应用
1.本发明属于生物技术领域,具体涉及腺相关病毒载体在逆向标记外周组织或器官一级神经网络中的应用。
背景技术:
2.近些年,脑肠轴已经成为大家关注的焦点,被称为第二大脑的肠道与中枢神经系统之间存在着互相投射而形成千丝万缕的联系。事实上,除了肠道之外,肾脏、心脏、肝脏、脾等外周组织、器官均与中枢神经系统存在密切的解剖学连接,接受中枢神经系统的调控以执行不同的功能。然而,缺乏有效的工具病毒载体使得人们对这些协调过程知之甚少。
3.工具病毒作为高效载体在神经环路研究中扮演着重要的角色。它不仅可以靶向特定类型的神经细胞,而且可携带目的基因在靶细胞内高效表达。目前,常用顺向跨多级突触的单纯疱疹病毒(herpes simplex virus,hsv)和逆向跨多级突触的伪狂犬病病毒(pseudorabies virus,prv)探究中枢-外周神经环路,但针对外周单级神经网络的解析还缺乏高效的载体。虽然利用aav2-retro在周围神经系统中实现了单级网络的解析,但受限于效率较低而无法推广。鉴于脑肠轴等系列中枢与外周神经系统协同作用的研究需求,亟需发展一套可用于解析外周一级神经网络的工具病毒载体。
技术实现要素:
4.基于目前现有技术中存在的缺陷,本发明提供了一种腺相关病毒载体aav9-retro的新用途,即利用携带目的基因的aav9-retro载体感染外周组织或器官,从而实现对外周组织或器官的逆向一级神经网络进行标记或操控的方法。该方法为研究外周器官或组织的神经生理学功能研究提供了新手段,且在周围神经系统性疾病模型的建立和基因治疗领域等具有广泛的应用价值和市场前景。
5.本发明一个方面提供了腺相关病毒载体在标记支配外周组织或器官的一级神经网络的应用,或者在制备标记支配外周组织或器官的一级神经网络的试剂中的应用;所述腺相关病毒载体为aav9-retro,所述腺相关病毒载体中还包含编码标记蛋白的基因和启动子。
6.进一步地,所述外周组织选自外周神经组织、肌肉、上皮组织、结缔组织等;更优选为外周神经节、骨骼肌、平滑肌、心肌、表皮、腺体、真皮、脂肪、骨、软骨、韧带等。
7.进一步地,所述器官选自膀胱、眼、耳、鼻、口腔、舌、咽、喉、犁鼻器、唾液腺、肝、肾、脾、心、肠道、胃、胰腺、肺、气管、血管、淋巴管、淋巴结、四肢、垂体、甲状腺、甲状旁腺、胰岛、肾上腺、生殖器等。
8.进一步地,所述标记蛋白选自荧光蛋白、酶反应显色蛋白等,更优选为bfp、cfp、gfp、yfp、rfp、irfp、cerulean、venus、egfp、ecfp、eyfp、ebfp、dsred、dtomato、tdtomato、mcherry、mkate、mapple、mbanana、mcitrine、morange、mplum、tagrfp、tagbfp、hrp等。
9.进一步地,所述启动子选自cag、cmv、ef1α、nef、hsyn、camkiiα、vgat、thy1、tre、uas、gfap、gfaabc1d等。
10.进一步地,一级神经网络为支配外周组织或器官的神经元、神经胶质细胞。
11.本发明另一个方面提供了支配外周组织或器官的一级神经网络的标记方法,所述标记方法包括以下步骤:
12.s1)将腺相关病毒载体注射至待标记的外周组织或器官中,
13.s2)观察脑组织和其他组织或器官中标记蛋白的分布情况;
14.其中,所述腺相关病毒载体为aav9-retro,所述腺相关病毒载体中还包含编码标记蛋白的基因和启动子。
15.进一步地,所述外周组织选自外周神经组织、肌肉、上皮组织、结缔组织等;更优选为外周神经节、骨骼肌、平滑肌、心肌、表皮、腺体、真皮、脂肪、骨、软骨、韧带等。
16.进一步地,所述器官选自膀胱、眼、耳、鼻、口腔、舌、咽、喉、犁鼻器、唾液腺、肝、肾、脾、心、肠道、胃、胰腺、肺、气管、血管、淋巴管、淋巴结、四肢、垂体、甲状腺、甲状旁腺、胰岛、肾上腺、生殖器等。
17.进一步地,所述标记蛋白选自荧光蛋白、酶反应显色蛋白等,更优选为bfp、cfp、gfp、yfp、rfp、irfp、cerulean、venus、egfp、ecfp、eyfp、ebfp、dsred、dtomato、tdtomato、mcherry、mkate、mapple、mbanana、mcitrine、morange、mplum、tagrfp、tagbfp、hrp等。
18.进一步地,所述启动子选自cag、cmv、ef1α、nef、hsyn、camkiiα、vgat、thy1、tre、uas、gfap、gfaabc1d等。
19.进一步地,一级神经网络为支配外周组织或器官的神经元、神经胶质细胞。
20.进一步地,所述标记方法为非诊断或治疗目的的。
21.本发明再一个方面提供了腺相关病毒载体的在支配外周组织或器官的神经元中表达目的蛋白或功能性rna的应用,或者在制备在支配外周组织或器官的神经元中表达目的蛋白或功能性rna的试剂中的应用;所述腺相关病毒载体为aav9-retro,所述腺相关病毒载体中还包含编码目的蛋白或功能性rna的基因和启动子。
22.进一步地,所述外周组织选自外周神经组织、肌肉、上皮组织、结缔组织等;更优选为外周神经节、骨骼肌、平滑肌、心肌、表皮、腺体、真皮、脂肪、骨、软骨、韧带等。
23.进一步地,所述器官选自膀胱、眼、耳、鼻、口腔、舌、咽、喉、犁鼻器、唾液腺、肝、肾、脾、心、肠道、胃、胰腺、肺、气管、血管、淋巴管、淋巴结、四肢、垂体、甲状腺、甲状旁腺、胰岛、肾上腺、生殖器等。
24.进一步地,所述目的蛋白选自标记蛋白或活性蛋白,所述活性蛋白选自激活神经元蛋白、抑制神经元蛋白、钙离子信号探针蛋白、小分子信号探针蛋白、介导凋亡蛋白、疾病相关突变蛋白、生理条件下的正常蛋白、细胞因子、抗病毒因子、病毒感染辅助受体、重组酶、基因编辑工具蛋白,所述功能性rna选自小rna、小干扰rna、小发卡rna、小向导rna、细胞器定位rna、用于rna测序或原位杂交分析的barcode rna等。
25.本发明再一个方面提供了在支配外周组织或器官的神经元中表达目的蛋白或功能性rna的方法,所述方法包括将腺相关病毒载体注射至待标记的外周组织或器官中,
26.其中,所述腺相关病毒载体为aav9-retro,所述腺相关病毒载体中还包含编码目的蛋白或功能性rna的基因和启动子。
27.进一步地,所述外周组织选自外周神经组织、肌肉、上皮组织、结缔组织等;更优选为外周神经节、骨骼肌、平滑肌、心肌、表皮、腺体、真皮、脂肪、骨、软骨、韧带等。
28.进一步地,所述器官选自膀胱、眼、耳、鼻、口腔、舌、咽、喉、犁鼻器、唾液腺、肝、肾、脾、心、肠道、胃、胰腺、肺、气管、血管、淋巴管、淋巴结、四肢、垂体、甲状腺、甲状旁腺、胰岛、肾上腺、生殖器等。
29.进一步地,所述目的蛋白选自标记蛋白或活性蛋白,所述活性蛋白选自激活神经元蛋白、抑制神经元蛋白、钙离子信号探针蛋白、小分子信号探针蛋白、介导凋亡蛋白、疾病相关突变蛋白、生理条件下的正常蛋白、细胞因子、抗病毒因子、病毒感染辅助受体、重组酶、基因编辑工具蛋白,所述功能性rna选自小rna、小干扰rna、小发卡rna、小向导rna、细胞器定位rna、用于rna测序或原位杂交分析的barcode rna等。
30.进一步地,所述标记方法为非诊断或治疗目的的。
31.本发明再一个方面提供了腺相关病毒载体在制备支配治疗外周组织或器官的神经元异常导致的疾病的药物中的应用;
32.所述腺相关病毒载体为aav9-retro,所述腺相关病毒载体中还包含编码治疗用蛋白或功能性rna的基因和启动子。
33.进一步地,所述目的蛋白选自标记蛋白或活性蛋白,所述活性蛋白选自激活神经元蛋白、抑制神经元蛋白、生理条件下的正常蛋白、细胞因子、抗病毒因子、基因编辑工具蛋白,所述功能性rna选自小rna、小干扰rna、小发卡rna、小向导rna等。
34.与现有技术相比,本发明具有以下优点及有益效果:
35.本发明发现了腺相关病毒aav9-retro载体的新用途,aav9-retro载体能够将目的基因表达在支配外周组织或器官的神经元中,基于此aav9-retro载体可以携带目的基因用于标记、操控周围神经系统,也可以作为基因治疗的载体。
36.相比于aav2-retro载体,aav9-retro载体在周围神经系统中具有更高的逆向标记效率。
附图说明
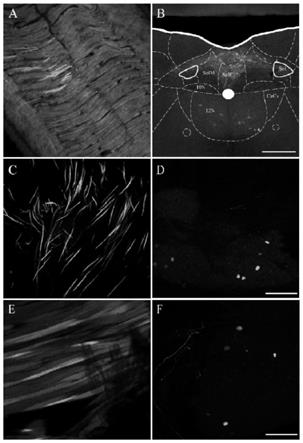
37.图1分别为将aav9-retro-cag-egfp注射到舌、膀胱壁以及腿部肌肉的标记结果。其中a图为舌注射位点,b图为被aav9-retro-cag-egfp标记地支配舌肌的运动神经元,胞体主要集中在12n脑区;c图为膀胱壁注射位点,d图为在神经节中观察到被绿色荧光蛋白标记的神经元胞体;e图为腿部肌肉注射位点,f图为神经节中观察到被绿色荧光蛋白标记的神经元胞体。这些结果表明aav9-retro可以通过逆向吸收的方式标记支配外周组织或器官的神经元,并且对于不同的外周组织或器官具有普适性。scale bars:250μm。
具体实施方式
38.为了使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明,但不能理解为对本发明的可实施范围的限定。
39.在本发明中,提供了利用aav9-retro载体开发了一种解析支配外周组织或器官一级神经网络的方法。而利用aav9-retro载体将目的基因表达于外周神经系统也属于本发明的保护范围。
40.aav9-retro载体能够标记支配外周组织或器官的一级神经网络。在本发明的具体实施案例中,将aav9-retro-cag-egfp注射至c57bl/6j品系小鼠的舌组织、膀胱壁以及腿部肌肉,在延髓以及外周神经节中观察到被绿色荧光蛋白标记的神经元胞体,结果表明aav9-retro可以通过轴突末端吸收的方式标记支配外周组织或器官的神经元。
41.在本发明中,腺相关病毒载体aav9-retro为在腺相关病毒载体aav9蛋白序列第588位谷氨酰胺和第589位丙氨酸之间插入序列ladqdytkta获得。参见aav9 retro mediates efficient transduction with axon terminal absorption and blood
–
brain barrier transportation,lin et al.mol brain(2020)13:138,https://doi.org/10.1186/s13041-020-00679-1。
42.实施例1逆向示踪腺相关病毒病毒制备
43.采用已知方法获得腺相关病毒aav9-retro,具体参见aav9-retro mediates efficient transduction with axon terminal absorption and blood
–
brain barrier transportation,lin et al.mol brain(2020)13:138,https://doi.org/10.1186/s13041-020-00679-1,采用杆状病毒表达系统包装腺相关病毒方法,对aav9-retro载体进行病毒包装,并用碘克沙醇梯度离心法进行浓缩和纯化,最后用sybr green qpcr法检测重组腺相关病毒滴度,然后将aav9-retro稀释至5
×
10
12
vg/ml浓度
44.实施例2逆向示踪腺相关病毒病毒标记支配控制组织或器官的神经元试验
45.2个月龄左右的c57bl/6j小鼠(购自湖南斯莱克景达实验动物有限公司)通过腹腔注射1%戊巴比妥钠麻醉,将3μl带有荧光蛋白基因的逆向示踪腺相关病毒病毒9aav9-retro-cag-egfp分别注射至不同小鼠的舌、膀胱壁以及腿部肌肉,病毒经过4周的表达,用1%的戊巴比妥钠对小鼠进行麻醉,并用磷酸缓冲溶液(phosphate buffer saline,pbs)与4%的多聚甲醛溶液(paraformaldehyde solution,pfa)心脏灌流,并剥离脑组织、脊髓、舌组织、膀胱壁、腿部肌肉等。所有组织经4%的pfa溶液固定4小时后,再用30%的蔗糖-pbs溶液脱水,将脱水后的组织用组织包埋剂包埋,脑组织被冰冻切片机切成40μm厚的脑片,其余组织均被切为80μm。对脑片与组织样品进行dapi染色,制作成切片并使用激光扫描共聚焦显微镜对其进行成像,激发光波长为488nm。
46.活体检测结果如图1所示,其中a图为舌注射位点,b图为被aav9-retro-cag-egfp标记地支配舌肌的运动神经元,胞体主要集中在12n脑区;c图为膀胱壁注射位点,d图为在神经节中观察到被绿色荧光蛋白标记的神经元胞体;e图为腿部肌肉注射位点,f图为神经节中观察到被绿色荧光蛋白标记的神经元胞体。这些结果表明aav9-retro可以通过逆向吸收并在上游神经元中表达荧光蛋白的方式标记支配外周组织或器官的神经元。多种不同组织和器官的结果也证明了本发明的方法对于不同的外周组织或器官具有普适性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1