用于单细胞识别的细菌耐药性快速检测微流控芯片、制备及应用
1.本发明涉及微流控技术、微生物技术、医学检验方法等领域。尤其涉及一种用于单细胞识别的细菌耐药性快速检测微流控芯片及其制备,以及其在生物医学中的应用。
背景技术:
2.细菌耐药特性又称细菌抗药性,指细菌对药物的耐受性,细菌一旦产生抗药性,药物即不再是治疗该细菌的特效药。
3.近年来随着广谱和超广谱抗生素在临床上的普遍使用,耐药菌株的检出率逐年增加,并开始出现多重耐药、全耐药菌株。病原菌的药敏试验结果可以为临床医生的用药提供很好的依据,从而针对性的使用抗菌药物,有效的杜绝抗生素的滥用,减少耐药菌株的产生,维持微生物菌群的稳定。
4.传统的细菌耐药分析方法有kirby-bauer纸片法(k-b法)、琼脂稀释法和肉汤稀释法、e-test纸条法,自动化检测系统有梅里埃vitek 2 全自动细菌鉴定及药敏分析系统、thermo全自动药敏分析系统、bd phoenix automated microbiology系统等,其中梅里埃vitek 2全自动细菌鉴定及药敏分析系统是目前医院最常用的检测方法,它是将菌落种进孔板检测卡中,孵育到较高浓度,通过培养液的浑浊度进行检测。
5.病原菌药敏检测需要经标本的采集、培养、药敏试验,该过程通常需数天,耗时较长,增加了医疗负担,同时病人无法在第一时间得到最佳治疗方案,有延误病情的风险。
6.所以,寻求一种快速、高效、可行性强的新型细菌耐药性检测平台,是临床敏感性药物筛查的迫切需求。
技术实现要素:
7.针对上述问题,本发明提供一种用于单细胞识别的细菌耐药性快速检测微流控芯片,利用所述微流控芯片可实现高通量、高精度、低成本、低消耗等的细菌耐药性的快速检测,不仅可以克服现有技术中存在的比浊法耗时较长的问题,还可解决目前临床耐药检测自动化程度低、劳动强度大、易受人为因素干扰等问题。
8.本发明采用的具体方案如下:本发明的目的一是提供一种用于单细胞识别的细菌耐药性快速检测微流控芯片,所述微流控芯片上的微结构包括注菌区、注药区和反应区;所述反应区包含相互独立且成一列排布的若干个微米尺度的反应孔,每个反应孔两侧分别连接注菌通道和注药通道;所述注药区包含若干个与所述反应孔一一对应的注药孔,所述注药孔的个数与反应孔的个数相同,所述注药孔之间相互独立且成一列排布,所述注药孔与反应孔通过所述注药通道连通;所述注菌区包含一个注菌孔,所述注菌孔中的菌液通过注菌通道多级分流一次性分别注入所有反应孔中。
9.作为对上述微流控芯片的进一步优化,所述反应孔和注药孔的个数均为16个;所述注菌孔中的菌液通过注菌通道经四级分流一次性分别注入到16个所述反应孔中。
10.更进一步地,所述注菌通道包含多级分流弯道,所述分流弯道采用平滑弧直角弯道,减少迪安流和乱流,确保流路畅通性和可控性。
11.作为对上述微流控芯片的进一步优化,所述微流控芯片的基材选用聚二甲基硅氧烷和玻璃的杂化材料,采用等离子键合法制得。所述微流控芯片的制备,包括以下步骤:(1)用su-8光刻法刻蚀出含微流控芯片微结构的母板;(2)配制聚二甲基硅氧烷混合溶液:将聚二甲基硅氧烷与固化剂以10:1的质量比例混合,通过搅拌使其充分混合,置于真空干燥箱中通过抽真空除去混合溶液中的气泡;(3)将聚二甲基硅氧烷混合溶液倒在准备好的母板上,再次置于真空干燥箱中抽出气泡后放入60 ℃干燥箱中至少4 h使其完全固化,固化后取出后打孔,形成pdms微结构层,备用;(4)芯片键合,将固化后的准备好的pdms微结构层与玻璃片分别置于等离子清洗仪中,起辉后处理20 s,处理后1分钟内将pdms微结构层与玻璃片迅速贴合,并置于60 ℃干燥箱中加热10分钟,使键合更充分。
12.作为对上述微流控芯片的进一步优化,所述微流控芯片的基材选用pc,采用真空热压法健合封片制得。所述微流控芯片的制备,包括以下步骤:(1)选用满足耐药性检测芯片的实验需求的耐低温、高温的无色透明pc;(2)用精雕机加工微流控芯片微结构,用0.2 mm超细微粒钨钢铣刀雕刻而成。
13.作为对上述微流控芯片的进一步优化,所述微流控芯片中药物预置,即将药物采用冻干预置的方法植入反应区,具体操作为:将药物分别通过注药孔注入后进入反应区并冻干粘附于反应孔底部,冻干温度在-40~-60 ℃。
14.本发明的目的二在于提供利用所述微流控芯片进行细菌耐药性检测的方法,包括以下步骤:步骤一、根据细菌的耐药检测需求,使用显微注射微泵将配置好的药物通过注药孔注入微流控芯片,准确控制注入量,使药物完全进入反应区;使用冷冻干燥器冻干微流控芯片,使药物预置在反应区内,真空包装备用;步骤二、稀释待测细菌使其浓度为1
×
104个/ml,使用微量移液器将其注入微流控芯片中,并进入反应区与药物接触;步骤三、将微流控芯片置于显微镜下,每隔5-10min采集反应区内的细菌生长状态图片并计数细菌个数,根据菌种需求在适宜环境培养并追踪采集30 min-2 h;以时间为横坐标,以细菌个数为纵坐标,绘制30 min-2 h内细菌数量的变化曲线,分析细菌耐药性。
15.作为对上述方法的进一步优化,所述细菌为大肠埃希菌,选用的药物及其对应浓度分别为:氨苄西林32 μg/ml、头孢唑啉 8 μg/ml、庆大霉素16 μg/ml、阿米卡星64 μg/ml、环丙沙星4 μg/ml、左氧氟沙星8μg/ml、头孢曲松64 μg/ml、头孢吡肟16μg/ml、哌拉西林128 μg/ml、厄他培南8 μg/ml、亚胺培南4μg/ml、头孢呋辛32 μg/ml、氨曲南64 μg/ml、头孢他啶16μg/ml、复方磺胺甲噁唑16 μg/ml。
16.本发明的目的三在于提供所述微流控芯片在细菌耐药性快速检测中的应用。
17.相比于现有技术,本发明具有以下有益效果:
本发明利用微流控技术实现高通量的微流控芯片,所述微流控芯片可实现一菌多药和一药多菌检测。
18.本发明的微流控芯片采用聚二甲基硅氧烷(pdms)和玻璃作为基材,适用于实验室研究,结构简单,制备方便,生物相容性好;采用聚碳酸脂(pc)作为基材,成本低,适用于商业推广。
19.本发明的微流控芯片中药物植入采用液相注入-冻干的预置方法,冻干后的药物粘附于微流控芯片内部并真空包装保存,避免液体药剂的漏液和药物变性风险,便于保存和运输。
20.本发明中微流控芯片可直接在显微镜下观察到细菌的形貌,通过对细菌计数获得其生长曲线,由生长曲线获得细菌对相应药物的耐药特性,所需时间为30 min-2 h。本发明与显微镜配合使用,用于细菌耐药检测,可直接监测细菌的数量变化,而非观察菌液浑浊度,克服了现有技术中存在的比浊法耗时较长的问题。
21.本发明把观察对象从菌液的浑浊度变为细菌的个数,将细菌耐药性检测时间缩短到30 min-2 h,且拥有微流控芯片高通量、微样本的特点,减少了时间成本,节省了样品,提高了效率。
22.本发明通过配合显微镜等成像装置对细菌计数,在短时间内绘制细菌生长曲线,具有高通量、高精度、低成本、低消耗、检测快等优点。可解决目前临床耐药检测周期长、自动化程度低、劳动强度大、易受人为因素干扰等问题,适合广泛应用于医院临床实验室细菌耐药高效检测、耐药机制探究、耐药细菌流行传播防控等领域。
附图说明
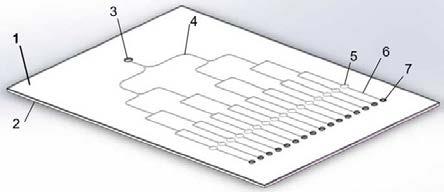
23.图1是本发明微流控芯片构造图;图中:1、芯片流道层;2、封片盖子;3、注菌孔;4、注菌通道;5、反应区;6、注药通道;7、注药孔;图2是本发明微流控芯片的直角弯道弧形结构及其流型特点图;图3是0时刻显微镜明场下采集的细菌图像;图4是30 min后图3对应的细菌图像。
具体实施方式
24.一种用于耐药性快速检测的微流控芯片,所述微流控芯片上微结构由注药区、注菌区、反应区构成,其中:注药区由16个独立的通道构成,所述注药区呈阵列式排列,每个注药通道均可单独使用;所述注菌区由同一个注菌孔注入菌液,由多次分流一次性注入16个注菌通道;所述16个独立注药通道和一次注入的注菌通道可以对换使用,即一次性注入16种细菌和一种药物,即所述微流控芯片可实现一菌多药和一药多菌检测;所述反应区是药物和菌液相遇并发生反应的区域,反应区也是后期细菌数量的观察监测区。
25.所述注菌通道分流弯道采用平滑弧直角弯道,与直角弯道相比减少迪安流和乱流,确保流路畅通性和可控性。
26.微流控芯片中弯道设计管道内流体流形comsol模拟图如图2所示。图中(红色)箭
头是与图例对应的速度大小和方向,彩色线代表等值线。在相同入口(3000 mmhg)和出口(760 mmhg)压强下,圆角流道中流体的速度远远大于直角流道中流体的速度,流体稳定性也优于直角流道。
27.所述微流控芯片的制备方案一,以聚二甲基硅氧烷(pdms)和玻璃为基材,包括下述步骤:(1)用su-8光刻法刻蚀出含上述微流控芯片微结构的母板;(2)配制聚二甲基硅氧烷混合溶液:将聚二甲基硅氧烷与固化剂以10:1的质量比例混合,通过搅拌使其充分混合,置于真空干燥箱中通过抽真空除去混合溶液中的气泡;(3)将聚二甲基硅氧烷混合溶液倒在准备好的母板上,再次置于真空干燥箱中抽出气泡后放入60 ℃干燥箱中至少4 h使其完全固化,固化后取出后打孔备用;(4)芯片键合,将固化后的准备好的pdms微结构层与玻璃片分别置于等离子清洗仪中,起辉后处理20 s,处理后1分钟内将pdms层与玻璃片迅速贴合,并置于60 ℃干燥箱中加热10分钟,使键合更充分。
28.所述微流控芯片的制备方案二,采用成本低廉的pc作为基材,包括下述步骤:(1)选用耐低温(-100 ℃)、高温(130 ℃)的无色透明pc满足耐药性检测芯片的实验需求;(2)用精雕机加工微流控芯片微结构,用0.2 mm超细微粒钨钢铣刀雕刻而成。
29.所述微流控芯片反应区,药物采用冻干预置的方法植入反应区。液相注入后冻干粘附于反应区底部,冻干温度在-40~-60 ℃。所述芯片中药物预置,药物遵循临床实验室标准化委员会(clsi)制定的抗菌药物选择原则。
30.所述的微流控芯片,与显微镜配合使用,用于细菌耐药检测,可直接监测细菌的数量变化,而非观察菌液浑浊度。
31.所述的微流控芯片,用于细菌耐药检测,所需时间短,大约只需30 min-2 h即可判断细菌对抗生素的耐药特性。
32.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述。
33.实施例1(一)一种细菌耐药性快速检测的微流控芯片。
34.所述微流控芯片包括芯片流道层和封片盖子;所述芯片流道层上包括注菌区、注药区和反应区;其中微流控芯片包含16个相互独立的微米尺度反应孔,所述反应孔排成一列形成反应区,每个反应孔两侧分别连接注菌通道和注药通道。注菌通道由多次分流分别到达16个反应孔,16个注药通道相互独立,因此本芯片可同时支持同种细菌对16种不同药物,或同种药物对16种细菌的抑制性检测(参见图1)。
35.该微流控芯片放置于显微镜下,调整放大倍数和焦距即可观察细菌数量,每隔5-10 min计数一次细菌数量的变化,绘制出30 min-2 h内细菌数量的变化曲线,即可获得细菌对相应药物的耐药特性。因此,该微流控芯片是一种可快速检测细菌耐药特性的芯片。
36.(二)抗生素预置。
37.本发明按照不同细菌的耐药检测需求,使用显微注射微泵将配置好的抗生素通过注药孔注入芯片,准确控制注入量,使抗生素完全进入反应区;使用冷冻干燥器冻干芯片,使抗生素预置在芯片反应区内,真空包装备用。使用时仅需注入菌液,使菌液到达反应区与
药物接触,根据菌种需求在适宜环境培养30 min-2 h。
38.以大肠埃希菌耐药性检测芯片为例,参考clsi抗菌药物选择原则,选用如下抗生素及对应浓度:氨苄西林 32 μg/ml、头孢唑啉 8 μg/ml、庆大霉素 16 μg/ml、阿米卡星 64 μg/ml、环丙沙星 4 μg/ml、左氧氟沙星 8μg/ml、头孢曲松 64 μg/ml、头孢吡肟 16μg/ml、哌拉西林 128 μg/ml、厄他培南 8 μg/ml、亚胺培南 4μg/ml、头孢呋辛 32 μg/ml、氨曲南 64 μg/ml、头孢他啶 16μg/ml、复方磺胺甲噁唑 16 μg/ml。
39.(三)一种细菌耐药性快速检测微流控芯片的制备方法一。
40.微流控芯片的基材选用聚二甲基硅氧烷(pdms)和玻璃的杂化材料;用su-8光刻法刻蚀出含上述微流控芯片微结构的母板;配制聚二甲基硅氧烷混合溶液:将聚二甲基硅氧烷与固化剂以10:1的质量比例混合,通过搅拌使其充分混合,置于真空干燥箱中通过抽真空除去混合溶液中的气泡;将聚二甲基硅氧烷混合溶液倒在准备好的母板上,再次置于真空干燥箱中抽出气泡后放入60 ℃干燥箱中至少4 h使其完全固化,固化后取出后打孔备用;微流控芯片键合,将固化后的准备好的pdms微结构层与玻璃片分别置于等离子清洗仪中,起辉后处理20 s,处理后1分钟内将pdms层与玻璃片迅速贴合,并置于60 ℃干燥箱中加热10分钟,使键合更充分。
41.(四)一种细菌耐药性快速检测微流控芯片的制备方法二。
42.本发明用于快速检测细菌耐药性微流控芯片的制备方法,包括下述步骤:微流控芯片的基材选用无色透明pc,成本低廉,耐高、低温性能良好,透光性好。
43.采用精雕机0.2 mm刀片,9000 r/min转速雕刻而成。
44.盖子采用≤1 mm厚度的pc,满足显微镜物镜景深要求。
45.采用真空热压机,真空热压键合芯片,微流控芯片中形成闭合的流道。
46.(五)基于细菌耐药性快速检测微流控芯片的细菌耐药性检测试验。
47.收集临床细菌标本,使用肉汤培养基进行培养;稀释待测细菌标本使其浓度为1
×
104个/ml,使用微量移液器将其注入微流控芯片中,并进入反应区;将芯片放置在微流控检测平台上,打开温控系统,使芯片温度维持在37℃,满足细菌生长需求;打开图像采集系统,对反应区进行自动扫码,采集细菌生长状态图片,按照程序设定,每10分钟进行一次图像采集,总时间长2小时;通过图像自动识别,鉴别并自动计数细菌个数;以时间为横坐标,以细菌个数为纵坐标,绘制细菌生长曲线,自动分析细菌耐药性。
48.需要说明的是,以上所述的实施方案应理解为说明性的,而非限制本发明的保护范围,本发明的保护范围以权利要求书为准。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对本发明作出的一些非本质的改进和调整仍属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1