与玉米高温敏感基因lsht1紧密连锁的分子标记及应用
1.本发明涉及作物分子生物学技术领域,具体涉及与玉米高温敏感基因lsht1紧密连锁的分子标记及应用。
背景技术:
2.玉米是我国一种重要的粮食作物和经济作物。近年来,随着全球气温地不断上升,高温热害已成为影响我国玉米稳产的重要自然灾害之一(wandaka et al.,2017)。植株经高温热害后,玉米果穗易出现“缺粒、畸形穗、秃尖、空秆”等异常现象,从而导致玉米产量和品质严重下降,甚至是绝产(yang and zhang,2006)。因此,培育耐高温玉米新品种对保障玉米安全生产具有十分重要的意义。
3.玉米是一种喜温作物,在不同生育阶段所需的最适温度不同。一般而言,玉米种子的最低发芽温度为8-10℃,24℃最为适宜。拔节期,玉米正常生长的温度范围是18-25℃,20℃是最适宜的生长温度。开花期,最适宜的生长温度范围是25-28℃(mitchell and petolino,1988)。超过上述温度范围,均会造成对玉米植株的高温热害。叶片是植物光合作用的主要器官,高温主要影响类囊体的物理化学性质和结构组织,导致细胞膜的解体和细胞组分的降解,进而影响叶片光合效率和植株产量。
4.耐高温基因及其紧密连锁分子标记的应用可加速耐高温新品种选育的进程。目前,水稻中已鉴定了部分高温胁迫相关遗传位点。ostt1编码一个参与泛素化蛋白降解的26s蛋白酶体α2亚基。过表达ostt1能显著提高水稻、拟南芥和高羊茅的耐热性。slg1编码一个保守的细胞质trna2-硫醇化蛋白2,正调控水稻耐热性。突变体slg1高温敏感,过表达slg1能显著提高水稻对高温耐受性。aet1编码一个trna
his
鸟苷转移酶,对trna行使3’到5’rna聚合酶活性,是前体trna
his
成熟的关键步骤。aet1有助于生长素应答和环境温度适应。然而,关于玉米高温胁迫相关基因的报道还较少。
技术实现要素:
5.为解决上述技术问题,本发明提供了与玉米高温敏感基因lsht1紧密连锁的分子标记及应用,所述的分子标记d65位于玉米突变体第2染色体,具体位置chr2:11047183-11047457,分子标记c29位于玉米突变体第2染色体,具体位置chr2:11390961-11391156,本发明获得的分子标记d65和分子标记c29能够鉴定玉米耐高温种质资源。
6.本发明提供了与玉米高温敏感基因lsht1紧密连锁的分子标记,所述分子标记包括分子标记d65和分子标记c29,二者物理距离为550kb,所述玉米高温敏感基因lsht1位于玉米第2染色体上的分子标记d65和分子标记c29之间;
7.扩增所述分子标记d65的引物d65-f的序列如seq id no.11,d65-r的序列如seq id no.12所示;
8.扩增所述分子标记c29的引物c29-f的序列如seq id no.15,c29-r的序列如seq id no.16所示。
9.进一步地,所述分子标记d65位于玉米第2染色体,具体位置chr2:11047183-11047457。
10.进一步地,所述分子标记c29位于玉米第2染色体,具体位置chr2:11390961-11391156。
11.本发明还提供了用于鉴别所述的分子标记d65的引物,所述引物为d65-f和d65-r。
12.本发明还提供了上述分子标记d65的引物在玉米耐高温种质资源鉴定中的应用,所述分子标记d65在突变体中的扩增序列大小为275bp,扩增序列如seq id no.22所示,所述分子标记d65在野生型中的扩增序列大小为297bp,扩增序列如seq id no.21所示。
13.本发明还提供了用于鉴别所述的分子标记c29的引物,所述引物为c29-f和c29-r。
14.本发明还提供了上述分子标记c29的引物在玉米耐高温种质资源鉴定中的应用,所述分子标记c29在突变体中的扩增序列大小为196bp,扩增序列如seq id no.24所示,所述分子标记c29在野生型中的扩增序列大小为203bp,扩增序列如seq id no.23所示。
15.本发明还提供了与玉米高温敏感基因lsht1紧密连锁的分子标记在玉米耐高温种质资源鉴定中的应用。
16.进一步地,玉米耐高温种质资源鉴定过程为:提取玉米叶片基因组dna,以玉米叶片基因组dna为模板,利用所述引物d65-f和d65-r进行pcr扩增;
17.当检测出所述分子标记d65大小为297bp时,则表示待检样品为耐高温玉米种质,当检测出所述分子标记d65大小为275bp时,则表示待检样品为不耐高温玉米种质。
18.进一步地,玉米耐高温种质资源鉴定过程为:提取玉米叶片基因组dna,以玉米叶片基因组dna为模板,利用所述引物c29-f和c29-r进行pcr扩增;
19.当检测出所述分子标记c29大小为203bp时,则表示待检样品为耐高温玉米种质,当检测出所述分子标记c29大小为196bp,则表示待检样品为不耐高温玉米种质。
20.与现有技术相比,本发明的有益效果在于:
21.1、本发明获得的与玉米高温敏感基因lsht1紧密连锁的分子标记d65和c29能够用于鉴定玉米耐高温种质资源,同时也可为高温敏感基因的克隆奠定基础。
22.2、本发明利用分子标记d65的引物d65-f和d65-r扩增玉米叶片基因组dna,当检测出所述分子标记d65大小为297bp时,则表示待检样品为耐高温玉米种质,当检测出所述分子标记d65大小为275bp时,则表示待检样品为不耐高温玉米种质;
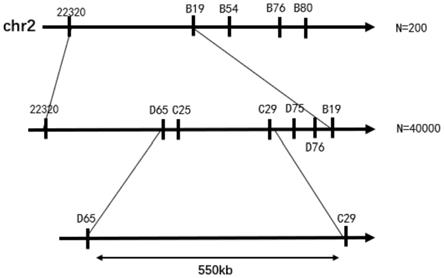
23.3、本发明利用分子标记c29的引物c29-f和c29-r扩增玉米叶片基因组dna,当检测出所述分子标记c29大小为203bp时,则表示待检样品为耐高温玉米种质,当检测出所述分子标记c29大小为196bp时,则表示待检样品为不耐高温玉米种质。
附图说明
24.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
25.图1表示本发明实施例中玉米高温敏感突变体lsht1表型分析;
26.其中,图a为河南夏播表型,从左到右依次为野生型和玉米高温敏感突变体lsht1
表型;
27.图b为海南冬播表型,从左到右依次为野生型和玉米高温敏感突变体lsht1表型;
28.图2表示本发明实施例中玉米高温敏感基因lsht1初定位结果;
29.图3表示本发明中玉米高温敏感基因lsht1精细定位结果;
30.图4为本发明中野生型和高温敏感突变体中分子标记d65与c29的pcr电泳结果;
31.其中,图a为d65分子标记带型,且图a中,第一泳道为marker,第二泳道为野生型,第三泳道为突变型;
32.图b为c29分子标记带型,且图b中,第一泳道为野生型,第二泳道为突变型,第三泳道为marker。
具体实施方式
33.下面对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明各实施例中所述实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
34.实施例1
35.一、玉米高温敏感突变体lsht1表型分析与遗传分析
36.1、玉米高温敏感突变体lsht1表型分析
37.实验室前期发现鉴定到一份玉米高温敏感突变体lsht1(leaf senescence in high temperature 1),田间表型观察发现:该突变体在河南夏季播种,植株叶片在散粉期已全部衰老,而在海南冬季播种突变体叶片表型正常,结果参见图1。
38.2、玉米高温敏感突变体lsht1遗传分析
39.将突变体lsht1与自交系87-1杂交构建f1,自交后获得f2分离群体。f1群体在河南夏播和海南冬播叶片均表现正常;鉴定f2分离群体在河南夏播表型,1310株f2群体中,975株叶片表型正常,335株叶片衰老,卡方测验可知表型比例符合3:1,表明lsht1突变体高温敏感性状受单个隐性核基因控制,结果参见表1。
40.表1 f2群体的卡方测验
[0041][0042]
注:χ
2(0.05)(1)
=3.84
[0043]
二、玉米高温敏感突变体lsht1基因初定位
[0044]
1、f2定位群体的构建
[0045]
以突变体lsht1为母本,与野生型自交系87-1杂交得到f1,f1再自交构建f2分离群体。
[0046]
2、f2群体表型鉴定
[0047]
2018年,f2群体于河南省原阳县夏季(约6月10日)播种,分别在大喇叭口期、抽雄期、散粉期鉴定单株表叶片表型。
[0048]
3、dna提取与分子标记开发
[0049]
利用ctab法提取玉米叶片基因组dna,于-20℃保存备用。
[0050]
从maizegdb(http://www.maizegdb.org/)数据库公布的分子标记中,挑选出玉米第2染色体上0-20mb区间内的80对ssr标记和160对indel标记。
[0051]
4、pcr程序和扩增产物基因型分析
[0052]
pcr扩增体系(10μl)组分包含:2μl dna,1μl引物(上下游引物各0.5μl),5μl 2
×
taq master mix(南京诺维赞生物科技股份有限公司)和2μl ddh2o。利用touchdown pcr扩增程序:95℃5min;95℃30s,65℃30s(每个循环降落1℃),72℃30s,共8个循环;95℃30s,58℃30s,72℃30s,共28个循环;72℃5min。pcr扩增产物利用聚丙烯酰胺凝胶电泳和琼脂糖胶电泳进行基因型分析。
[0053]
5、玉米高温敏感突变体lsht1基因初定位
[0054]
选取f2分离群体中50株野生型与50株突变单株叶片dna混池,构建野生型池和突变型池进行bsa测序,发现在第2染色体上存在一个显著峰,说明玉米高温敏感基因lsht1位于第2染色体0-20mb区间内,结果参见图2。
[0055]
为了验证bsa测序结果,筛选区间内ssr和indel分子标记,共获得5对多态性分子标记,分别为22320、b19、b54、b76、b80,分子标记引物信息参见表2。利用多态性分子标记分析200株f2群体基因型,结合单株叶片表型,将目的基因定位于第2染色体上分子标记22320与b19之间,物理距离为5.54mb,结果参见图3。
[0056]
表2分子标记引物信息
[0057][0058][0059]
三、玉米高温敏感突变体lsht1精细定位
[0060]
1、交换单株筛选
[0061]
碱煮法提取f2群体4万个单株的胚乳dna,以分子标记22320与b80为两端标记筛选交换单株。
[0062]
2、交换单株表型鉴定
[0063]
交换单株于2019年河南省原阳县夏季(约6月10日)播种,分别在大喇叭口期、抽雄期、散粉期鉴定单株叶片表型。
[0064]
3、dna提取和分子标记开发
[0065]
利用sls法提取玉米叶片基因组dna,于-20℃冰箱中保存备用。
[0066]
indel标记开发:开发并合成22320与b80之间115对indel标记。
[0067]
4、pcr程序和扩增产物基因型分析
[0068]
pcr扩增体系(10μl)组分包含:2μl dna,1μl引物(上下游引物各0.5μl),5μl 2
×
taq master mix和2μl ddh2o。利用touchdown pcr扩增程序:95℃5min;95℃30s,65℃30s(每个循环降落1℃),72℃30s,共8个循环;95℃30s,58℃30s,72℃30s,共28个循环;72℃5min。pcr扩增产物利用琼脂糖胶电泳进行基因型分析。
[0069]
5、玉米高温敏感突变体lsht1精细定位
[0070]
在初定位5.54mb区间内筛选到5对多态性分子标记,分别为d65、c25、c29、d75、d76,分子标记引物信息参见表3。利用这5个分子标记分析2019年交换单株叶片基因型,结合交换单株叶片表型,将目的基因定位在第2染色体分子标记d65与c29之间,物理距离为550kb,结果参见图3。分子标记d65位于玉米第2染色体,具体位置chr2:11047183-11047457(zm-b73-reference-nam-5.0),分子标记c29位于玉米第2染色体,具体位置chr2:11390961-11391156(zm-b73-reference-nam-5.0)。
[0071]
野生型中d65扩增序列大小为297bp,扩增序列如seq id no.21所示,突变体中d65扩增序列大小为275bp,扩增序列如seq id no.22所示;野生型中c29扩增序列大小为203bp,扩增序列如seq id no.23所示,突变体中c29扩增序列大小为196bp,扩增序列如seq id no.24所示;如图4所示,图a为d65分子标记带型,且图a中,第一泳道为marker,第二泳道为野生型,第三泳道为突变型;图b为c29分子标记带型,且图b中,第一泳道为野生型,第二泳道为突变型,第三泳道为marker。
[0072]
seq id no.21:
[0073]
acgcacctcttcagaaggaaaagggaaagcacacacacaagcacacgcaaaagagacaacgtcacatgaaggtggtggactcaaacagtcaaactattgggttcacgtgttcgtcggtgaccaatgaccatgaccaccgggttcacggaacaccttgcagctgcggcctaccagcagcctagcgattggtctagcacatagaccagtgcatgcgcacgggcctggcatgtaagccggtggtggcgtggtgctgatttagcttttctgcagcgaagcaaaaggaaggaaggaacacgg;
[0074]
seq id no.22:
[0075]
acgcacctcttcagaaggaaaagggaaagcacacacacaaaagagacaacgtcacatgaaggtggtggactcaaacagtcgaactatattgggttcacgtgttcgtcggtgaccatgaccaccggattcacggaacatcttgcagcttcggcctaccagcagcctagcgattggtctagcacatagaccagtgcatgcgcacgagcctggcatgtaagccggtggtgctgatttagcttttctgcagcgaagcaaaaaggaaggaaggaacacgg;
[0076]
seq id no.23:
[0077]
cgatagaaaaaggaagtccacgattttcaaatgctgttttatgctttaagataagcattttttagctcacttaagtcgtgtcacgttgcctaactcaatgtacctttttctactctaagatagaacaacgaagaacgggtcatatcgtggagggatgggggtggggggttaacacttaagtcaatcaaaaacagaaccgaaca;
[0078]
seq id no.24:
[0079]
cgatagaaaaaggaagtccacgattttcaaatgctgttttatgctttaagataagcatttttttagctcacttaagtcgtgtcacgttgcctaactcaatgtacccttttctactctaagatagaacaacgaagaacgagtcat
atcgtcgaggggtgggggagggggttaagtcaatcaaaaacagaaccgaaca。
[0080]
表3分子标记引物信息
[0081][0082]
四、本发明获得的分子标记d65与c29在玉米耐高温种质资源筛选中的应用
[0083]
鉴定玉米耐高温性状的方法包括以下步骤:
[0084]
(1)提取玉米叶片基因组dna;
[0085]
(2)以玉米叶片基因组dna为模板,利用所述引物d65-f/d65-r、c29-f/c29-r分别进行pcr扩增;
[0086]
(3)琼脂糖凝胶电泳鉴定pcr扩增结果:当采用的引物为d65-f/d65-r时,当检测出所述分子标记d65大小为297bp时,则表示待检样品为耐高温玉米种质,当检测出所述分子标记d65大小为275bp时,则表示待检样品为不耐高温玉米种质;当采用的引物为c29-f/c29-r时,当检测出所述分子标记c29大小为203bp时,则表示待检样品为耐高温玉米种质,当检测出所述分子标记c29大小为196bp时,则表示待检样品为不耐高温玉米种质。
[0087]
上述pcr扩增体系为10μl,包含:2μl dna,正向、反向引物各0.5μl,5μl 2
×
taq master mix和2μl ddh
2 o。
[0088]
上述应用中,利用touchdown pcr扩增程序:95℃5min;95℃30s,65℃30s(每个循环降落1℃),72℃30s,共8个循环;95℃30s,58℃30s,72℃30s,共28个循环;72℃5min。
[0089]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0090]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1