非洲猪瘟病毒p54蛋白抗原表位及其应用
1.本发明属于基因工程技术领域,具体涉及非洲猪瘟病毒p54蛋白抗原表位及其应用。
背景技术:
2.非洲猪瘟是由非洲猪瘟病毒引起猪发病的一种急性烈性传染病,死亡率高达100%。世界动物卫生组织(oie)将其列为必须通报动物疫病,我国列为重点防范的一类动物传染病。自2018年8月传入我国以来,不到一年的时间,疫情遍及全国,至今疫情还未消除,给我国养猪业造成重大的经济损失,生猪存栏数量锐减,猪肉价格飙涨,造成了巨大的经济损失。国务院和国家部委等多部门采取多种综合措施以恢复生猪生产,稳定物价。但疫情的不断蔓延和散发流行,对环境造成了极为严重的污染,截止2021年初,已从田间分离到22个毒株,其中包括大片段基因缺失的弱毒株,说明环境污染严重、毒株复杂,防控困难。我国作为全球最大的养猪大国,猪肉供应超过50%,非洲猪瘟对养猪的打击,不仅威胁养猪业的健康可持续发展,而且关乎民生、食品安全和生物安全等一系列社会和政治问题,已成为国家急需解决的重大动物疫病之一。
3.非洲猪瘟病毒作为一个有百年历史的重要动物病毒,对疫苗的研究从未间断,但至今仍然缺乏可用于实践的安全、有效的疫苗。究其原因,主要是由于非洲猪瘟病毒基因组庞大、结构复杂,保护性抗原,免疫和感染机理不清楚。至今无法解释和解决非洲猪瘟灭活疫苗不能提供免疫保护的理论问题和技术瓶颈;减毒活疫苗引起发病死亡、生产能力下降,可能发生毒力返强、遗传重组等生物安全性问题;基因工程亚单位疫苗、dna疫苗和活载体疫苗保护效果差的理论问题。而国家急需安全、有效、可鉴别诊断的非洲猪瘟疫苗提升我国对非洲猪瘟疫情防控和净化能力和技术水平,保障我国作为全球第一养猪大国养猪业的健康可持续发展,保障动物源性食品安全和生物安全。
4.基于此,针对非洲猪瘟病毒及其复杂,疫苗研究缓慢,缺乏安全、有效、可鉴别疫苗,而国家急需防控产品的现状。须用全新思路、另辟蹊径发掘更多保护性抗原,以解决非洲猪瘟病毒基因组庞大复杂、保护性抗原不清导致基因工程疫苗研究缺乏关键材料的困境。
技术实现要素:
5.针对上述问题,本发明以非洲猪瘟病毒p54 (e183l)膜蛋白的一级结构氨基酸序列为材料,预测并确定了非洲猪瘟病毒p54蛋白的5个抗原表位(肽),这些抗原表位的获得为以抗原表位为材料研发非洲猪瘟检测试剂及其试剂盒、单抗制备和安全、可鉴别诊断表位疫苗等急需战略防控产品奠定了基础。
6.本发明的目的一是提供非洲猪瘟病毒p54蛋白抗原表位,所述抗原表位为单抗原表位(合成肽)、蛋白载体重组单抗原表位或多抗原表位;所述单抗原表位为氨基酸序列如seq id no:1~5任意一种所示的抗原表位肽、载体蛋白/抗原表位重组蛋白;所述多抗原表
位是将两个或两个以上的单抗原表位串联、相邻表位间采用间隔子连接,然后与噬菌体或自组装蛋白连接,表达vlp展示多表位所得。
7.所述单抗原表位优选seqidno:3所示的p54c、seqidno:4所示的p54d或seqidno:5所示的p54e。
8.所述多抗原表位优选p54abc或p54ed,所述p54abc是将seqidno:1所示的p54a、seqidno:2所示的p54b和seqidno:3所示的p54c通过gs依次串联、然后通过ggggs连接ap205所得;所述p54ed是将seqidno:5所示的p54e和seqidno:4所示的p54d通过gs依次串联、然后通过ggggs依次连接spycather、ap205所得。
9.本发明的目的二是提供一种重组蛋白,所述重组蛋白是将上述的抗原表位与表达载体连接后经表达、纯化获得。
10.本发明的目的三是提供一种多核苷酸,所述多核苷酸编码上述的抗原表位或重组蛋白。
11.本发明的目的四是提供一种表达载体,所述表达载体含有上述的多核苷酸。
12.本发明的目的五是提供一种宿主细胞,所述宿主细胞含有上述的表达载体或在基因组中整合有上述的多核苷酸。
13.本发明的目的六是提供上述的抗原表位、融合蛋白、多表位vlp、多核苷酸、表达载体或宿主细胞在制备非洲猪瘟病毒检测药物、抗非洲猪瘟疫苗中的应用。
14.有益效果:本发明以非洲猪瘟病毒p54(e183l)膜蛋白的一级结构氨基酸序列为材料,通过抗原表位数据库,预测其抗原表位并根据氨基酸序列合成相应的肽分子。通过非洲猪瘟病毒阳性血清免疫学检测,确定表1中的5个抗原表位(肽)全部为非洲猪瘟病毒p54蛋白的抗原表位,其中p54d、p54e为优势抗原表位。这些抗原表位的获得,为研发非洲猪瘟检测试剂及其试剂盒、单抗制备和安全、可鉴别诊断表位疫苗等急需战略防控产品奠定了基础,不仅将产生巨大的经济效益,而且具有重要的社会效益。
附图说明
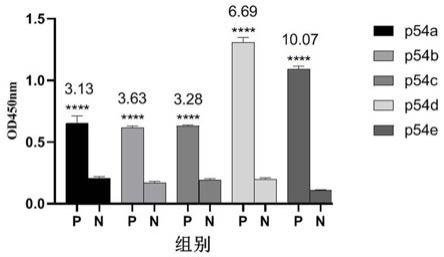
15.图1是非洲猪瘟病毒阳性血清鉴定p54蛋白抗原表位结果图;图2是表位重组蛋白的免疫反应性评价图;图3是本发明获得的抗原表位与文献报道抗原表位的免疫反应性比较图;注释:****p《0.0001,***p《0.001,**p《0.01表示差异极显著;*表示差异显著(p《0.05);p》0.05差异不显著。
具体实施方式
16.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述。
17.、抗原表位预测与筛选以非洲猪瘟病毒的p54蛋白氨基酸序列为材料,利用iedbanalysisresource、abcpred和scratchproteinpredictor在线数据库预测其抗原表位,以上述4个数据库中全部得分值不低于0.6的标准,确定p54蛋白的5个抗原表位(表1)。
18.表1生物信息学和免疫信息学方法预测的china/sy18/2018p54蛋白的抗原表位
2、抗原表位(肽)的合成根据表1相应抗原表位的氨基酸序列委托“金斯瑞生物科技公司”合成与之相对应的短肽分子,纯度不低于95%。
19.、间接elisa方法的建立随机选取3个合成短肽,按1μg/ml浓度,100μl/孔,包被mk100肽96孔elisa板,4℃过夜;甩干板子,用含有5%bsa的pbst于37℃封闭2小时,200μl/孔;甩干板子,用pbst(ph7.4)充分洗涤4-5次;按列(1-12)倍比稀释spf猪阴性血清/asfv标准阳性血清,起始浓度为1:25,8孔重复(1a-1h),100μl/孔,37℃反应1小时;弃掉液体,用pbst(ph7.4)充分洗涤4-5次;然后按行(a-h)倍比稀释hrp标记的兔抗igg,起始浓度为1:2500,12孔重复(a1-a12),37℃反应1小时;用pbst充分洗涤4-5次,加入显色底物作用10-15分钟,测定od
450nm
吸光度值。
20.结果判定标准:样品od
450nm
值(s)/阴性对照(n)的比值,大于或等于2.1为阳性,小于2.1为阴性。
21.、非洲猪瘟病毒阳性血清筛选与鉴定抗原表位以非洲猪瘟病毒阳性血清(购自中国兽医药品监察所)作为标准筛选抗体,通过上述elisa筛选和鉴定p54蛋白的抗原表位。结果显示,预测的5个抗原表位(肽)(表1)均能与非洲猪瘟病毒阳性血清发生特异性免疫反应,与阴性对照血清相比,统计学差异显著(图1),提示预测的5个抗原表位均为p54蛋白的抗原表位,其中p54d和p54e两个抗原表位的免疫反应性最强,为p54蛋白的优势抗原表位。
22.、通过引入载体蛋白gst和表位串联进一步筛选和鉴定抗原表位5.1单抗原表位和串联抗原表位重组表达质粒的构建、蛋白表达及纯化为了进一步验证上述抗原表位的免疫反应性,本发明通过引入gst载体蛋白使抗原表位完全抗原化、表位串联提高抗原表位效价,提升抗原表位的免疫反应性,使筛选结果更为可靠。本研究将上述筛选到的抗原表位p54a、p54b、p54c、p54d、p54e的dna分别克隆到pgex-4t-1表达载体构建重组表达质粒pgex-4t-p54a、pgex-4t-p54b、pgex-4t-p54c、pgex-4t-p54d、pgex-4t-p54e,通过大肠杆菌bl21(de3)表达、纯化获得目的重组蛋白,依次命名为gst-p54a、gst-p54b、gst-p54c、gst-p54d、gst-p54e。采用与上述相同的方法表达了文献报道的p54的抗原表位,该抗原表位通过gst蛋白完全抗原化,经过亲和层析纯化用于免疫反应性比较。
23.将上述抗原表位(表1)的p54a、p54b和p54c三个表位通过gs依次顺序串联(p54abc串联基因如seqidno:10所示,编码氨基酸如seqidno:11所示),然后通过ggggs连接ap205,为多表位融合基因(p54abc-ap205基因序列如seqidno:12所示,编码氨基酸如seq
idno:13所示);p54e、p54d两个优势抗原表位通过gs顺序串联(p54ed串联基因序列如seqidno:14所示,编码氨基酸如seqidno:15所示),然后利用ggggs顺序连接spycather、ap205,为多表位融合基因(p54ed-ap504基因序列如seqidno:16所示,编码氨基酸如seqidno:17所示),将其与噬菌体基因分别克隆到pet-28a(+)表达载体,构建噬菌体展示串联抗原表位的重组表达质粒p54abc、pet-28/p54ed,通过大肠杆菌bl21(de3)表达噬菌体展示多抗原表位的重组蛋白(多表位vlp),分别命名为p54abc、p54ed。
24.sds-page结果显示,所有上述重组蛋白均以可溶性形式表达,用于包被抗原的重组蛋白均采用亲和层析法获得。
25.引入载体蛋白使表位完全抗原化、多表位vlp筛选抗原表位用建立的elisa测定单表位重组蛋白和多表位vlp的免疫反应性,进一步筛选和确定抗原表位。结果显示,引入载体蛋白gst后,抗原表位的免疫反应性增强(p《0.05),优势抗原表位p54d和p54e显著增强;尤其是将其抗原表位串联,以多表位vlp形式表达后,优势抗原表位的强免疫反应性更为突出,优于引入gst蛋白的单表位重组蛋白免疫反应性,进一步确定p54d和p54e为优势抗原表位。总之,多表位vlp的免疫原性最强、其次为单表位重组蛋白的免疫原性优于合成肽,说明抗原表位串联后发挥了明显的协同作用,显著增强了免疫反应性,优势抗原表位之间协同作用尤为显著;载体蛋白亦能提升抗原表位的免疫反应性,其提升强度与抗原表位的性能有关(图2)。该研究方法为精确、高效筛选优势抗原表位提供了新的思路和技术手段,通过本发明研究方法为精准高效筛选抗原表位,设计强免疫活性的多表位重组抗原,研究特异性检测试剂、研发多表位疫苗提供了理论依据和技术支撑。
26.筛选表位与文献报道表位免疫反应性比较为了进一步确定本发明获得抗原表位为新的抗原表位,本研究将文献报道(表2)的抗原表位按照上述方法克隆至pgex-4t-1表达载体,构建重组表达质粒pgex-4t-p54g1、pgex-4t-p54g2、pgex-4t-p54g3和pgex-4t-p54g4,通过bl21(de3)表达重组蛋白,命名为gst-p54g1、gst-p54g2、gst-p54g3和gst-p54g4。
27.采用上述elisa检测了本发明筛选和文献报道抗原表位的免疫反应性。结果显示,本发明获得优势抗原表位p54d、p54e,与非洲猪瘟阳性血清的免疫反应性显著强于文献报道的抗原表位(p《0.0001),尤其是将p54d和p54e串联、以多表位vlp形式表达后,串联表位重组蛋白的免疫反应性显著增强(图3),充分说明本发明获得抗原表位的免疫反应性要优于文献报道的抗原表位。
28.表2文献报道georgia2007毒株p54蛋白的抗原表位命名位置(氨基酸)序列(5
´‑3´
)序列表中位置序号p54g165~75ediqfinpyqd
ꢀꢀꢀꢀꢀꢀ
seqidno:6p54g293~113attasvgkpvtgrpatnrpat
ꢀꢀꢀꢀꢀꢀ
seqidno:7p54g3118~127tdnpvtdrlv
ꢀꢀꢀꢀꢀꢀ
seqidno:8p54g45~9ffqpv
ꢀꢀꢀꢀꢀꢀ
seqidno:97筛选的抗原表位与文献报道抗原表位序列分析基于上述本发明获得优势抗原表位与文献报道抗原表位有明显的免疫活性差异,为了进一步确诊本发明获得抗原表位与文献报道的不同。本研究对本发明获得抗原表位(表1)与文献报道抗原表位(表2)的氨基酸序列进行比对分析,结果显示(表3),抗原表位
p54c(80aa~95aa)为本发明首次发现,未见有报道;优势抗原表位p54d(95aa~110aa)与文献报道抗原表位(93aa~113aa)的氨基酸序列重叠,但在5
´
端少2个氨基酸(at)、3
´
端少3个氨基酸(pat),该抗原表位的免疫反应性则明显优于文献报道的,说明两侧的氨基酸可能影响了抗原表位的免疫效果,故本发明获得抗原表位为p54蛋白的新优势抗原表位;优势抗原表位p54e(115aa~122aa)的氨基酸序列与文献报道的(118aa~127aa)比对后发现,两个抗原表位除了pvtd基序相同外,其长短和两端的氨基酸序列均不同,免疫原性亦不同,本发明获得的抗原表位的免疫原性更优,充分证明本发明获得的该抗原表位为新的抗原表位。
29.表3筛选抗原表位与文学报道抗原表位氨基酸序列差异分析8、抗原表位的用途本发明获得的p54蛋白的抗原表位,尤其是3个新的抗原表位,即p54c、p54d和p54e,尤其是p54d和p54e两个优势抗原表位,免疫反应性显著优于文献报道的抗原表位,且编码氨基酸序列伊不同,为p54蛋白的新抗原表位。这些抗原表位,尤其是强免疫反应性优势抗原表位的获得,不仅丰富了非洲猪瘟病毒抗原表位数据库,也为研发非洲猪瘟血清学检测试剂及其试剂盒(elisa,wb、胶体金层析试纸条等),设计表位抗原,研发表位疫苗(包括表位单价/多价疫苗,合成肽疫苗,与其他病原抗原表位或抗原串联等)提供了物质基础和理论依据,具有十分重要的意义。
30.需要说明的是,以上所述的实施方案应理解为说明性的,而非限制本发明的保护范围,本发明的保护范围以权利要求书为准。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对本发明作出的一些非本质的改进和调整仍属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1