CDI增强的新冠肺炎测试的制作方法
cdi增强的新冠肺炎测试
相关申请的交叉引用
1.本技术涉及2020年11月20日提交的第17/100,289号美国专利申请并要求其优先权,第17/100,289号美国专利申请要求2020年3月5日提交的第62/985,602号和2020年03月16日提交的第62/989,967号美国临时专利申请的优先权,它们公开的内容通过引用并入本文。
技术领域
2.本技术涉及一种用于通用检测sars样冠状病毒和sars-cov-2病毒的检测组合(panel)以及使用该检测组合的方法。本技术的检测组合可被称为发现和创新中心(center for discovery and innovation,“cdi”)检测组合(cdi增强新冠肺炎测试(cdi enhanced covid-19test)),还可包括检测组合中的附加引物/探针组,用于检测对照样本和临床试样中的人类核糖核酸酶p基因(rnase p,rp)。该检测组合设计用于使用e基因(囊膜)检测体系(assay)对sars样冠状病毒进行通用检测,以及使用n2(核衣壳)检测体系特异性检测sars-cov-2。
背景技术:
3.提供检测病毒的特异和敏感的检测体系对于准确诊断病例、评估疫情范围、监测干预策略和监测研究至关重要。用于检测病毒的检测体系包括n3(核衣壳,与人核酸交叉反应)检测体系和n1(核衣壳,被认为是sars-cov-2特异性的)检测体系。然而,n1体系被发现与sars冠状病毒具有轻微交叉反应,导致结果不准确。
技术实现要素:
4.提供了一种检测样本中新型冠状病毒、严重急性呼吸综合征冠状病毒-2(sars-cov-2或covid-19(新冠肺炎))的方法。该方法包括采集疑似包含新型冠状病毒的样本,使用n2体系对样本的至少第一部分的sars-cov-2核衣壳(n)基因中一个区域进行分析,使用e体系检测样本的至少第二部分,以对sars冠状病毒(e)进行通用检测;以及使用人rpp30(h-rpp30或rp)对样本的至少第三部分进行分析以检测人核糖核酸酶p(rp)。该方法还包括组合和评估n2、e和rp体系的结果,以确定是否存在新型冠状病毒。n2体系对新型冠状病毒(“ncov”)有特异性;e体系对所有严重急性呼吸综合征(“sars”)相关的冠状病毒保守;rp体系为内部对照。样本采集自鼻咽、口咽、前鼻腔、中鼻甲、上呼吸道试样或血液、尿液或粪便中的至少一种。
5.在本技术的另一个实施方案中,一种用于检测样本中的新型冠状病毒、严重急性呼吸综合征冠状病毒-2(sars-cov-2或新冠肺炎)的方法包括为多个检测中的每一个准备反应混合物(mastermix),其中所述体系包括:对新型冠状病毒(“ncov”)具有特异性的第一体系;对严重急性呼吸综合征(“sars”)相关冠状病毒保守的第二体系;以及作为内部对照的第三体系。在优选实施方案中,该方法还包括将一定量的反应混合物(例如,15μl)加载到
多个孔的每一个孔中,其中所述孔由板分布图(plate map)限定;并将一定量的核糖核酸(“rna”)(例如5μl)添加到每个孔中,如板分布图所定义。该方法还可以包括将样本转移到磁感应循环仪(“mic”),例如mic-qpcr循环仪(由bio molecular systems出售);并运行mic循环仪。第一、第二和第三体系分别是n2体系、e体系和rp体系。rp体系和n2体系的反应混合物可包括:(1)2
×
一步法rt-pcr缓冲液iii;(2)takara ex taq hs(5u/μl);(3)primescript rt酶混合物ii;(4)不含核糖核酸酶的蒸馏水(dh2o);和(5)组合的引物/探针混合物。rp体系和n2体系的反应混合物还可包括至少10μl/反应的2
×
一步法rt-pcr缓冲液iii;0.4μl/反应的takara ex taq hs(5u/μl);0.4μl/反应的primescript rt酶混合物ii;3μl/反应的无核糖核酸酶蒸馏水;和1.2μl/反应的组合引物/探针混合物。用于e体系的反应混合物可包括:(1)2
×
一步法rt-pcr缓冲液iii;(2)takara ex taq hs(5u/μl);(3)primescript rt酶混合物ii;(4)不含核糖核酸酶的dh2o;和(5)e探针混合物。用于e体系的反应混合物还可包括至少10μl/反应的2
×
一步法rt-pcr缓冲液iii;0.4μl/反应的takara ex taq hs(5u/μl);0.4μl/反应的primescript rt酶混合物ii;1.8μl/无核糖核酸酶蒸馏水的反应;和2.4μl/反应的e探针混合物。
6.所述方法还可以包括使用cdi-新冠肺炎体系创建新的运行;选择样本类型,其中所述样本类型为(1)未知、(2)ntc或(3)阳性对照;将所述样本分组,其中所述组为(1)n2、(2)e或(3)rp;并运行mic循环。cdi-新冠肺炎体系可包括热循环条件。热循环条件可包括第一阶段和第二阶段,第一阶段在42℃下运行5分钟,持续一个循环,第二阶段在95℃下运行5秒,在58℃下运行20秒,持续45个循环。
7.在本技术的另一实施方案中,用于检测新型冠状病毒、严重急性呼吸综合征冠状病毒-2(sars-cov-2或新冠肺炎)的方法包括提供cdi增强的新冠肺炎测试。cdi增强的新冠肺炎测试可能包括使用实时逆转录聚合酶链反应(rt-pcr)检测,使用第一引物和探针组检测sars-cov-2核衣壳(n)基因中的一个区域,使用第二引物和探头组对sars样冠状病毒(e)进行通用检测,以及使用第三引物和探针组检测临床样本中的人类核糖核酸酶p(rp)。所述检测可以以单引物对(singleplex)形式运行,或者多引物对(mutiplex)嵌入到单个反应和扩增设置中。cdi增强的新冠肺炎测试也可能包括无模板阴性对照(ntc),以检查提取和体系试剂是否存在污染。cdi增强的新冠肺炎检测可包括两个阳性对照,以验证正确的体系设置和sars-cov-2试剂的完整性。这两个阳性对照可以是,例如,用于rrt-pcrn2体系和e体系的阳性对照的病毒基因组rna,以及用于rp体系的阳性对照(rppc)的dna阳性对照。cdi增强型新冠肺炎测试可以在单个实时逆转录聚合酶链反应(rt-pcr)测试中进行,每个平板包括一个阳性、一个阴性和一个提取对照,每个临床样本包含一个内部对照。
具体实施方式
8.本文中使用的术语“样本(sample)”是指从受试者(例如,人类,例如疑似感染的人)获取的任何样本,并且包含一种或多种目标核酸。本文使用的术语“核酸”是指包括脱氧核糖核酸(dna)和核糖核酸(rna)两者的总核酸。本文中使用的术语“反应”是指任何涉及化学、酶或物理作用的过程,其指示目标核酸的存在或不存在。“反应”的一个例子是扩增反应,如聚合酶链反应(pcr)。本文使用的术语“孔”是指在受限结构内的预定位置处的反应,例如孔状瓶、细胞或pcr阵列中的腔室。
9.如本文所用,术语“检测组合”是指包括检测特定目标核酸的存在或不存在的至少两种体系的组合。本文使用的术语“试样(specimen)”是将在样本中使用的来自受试者的通用或病毒传输介质中的鼻冲洗液、吸液或拭子中获得的。这里使用的术语“mic循环仪”是指本领域普通技术人员理解的mic qpcr循环仪。
10.本技术的检测组合也称为sars-cov-2体系或cdi增强的新冠肺炎测试,是一种实时转录聚合酶链反应(rt-pcr)测试。检测组合可用于对上呼吸道试样(例如鼻咽或口咽拭子、痰、下呼吸道抽吸物、支气管肺泡灌洗液和鼻咽冲洗/抽吸物或鼻腔抽吸物)、唾液、血清、尿液和粪便样本中的sars-cov-2核酸进行推定定性检测,这些样本来自疑似新冠肺炎的个体。检测组合可包括用于检测sars-cov-2病毒的寡核苷酸引物和探针。特别是,sars-cov-2引物和探针组可被设计为对患者上呼吸道试样中sars-cov-2的rna进行检测,如公共卫生当局指南建议的测试。在一个实施方案中,寡核苷酸引物和探针可以选自病毒核衣壳(n)基因和囊膜蛋白(e)基因的区域。因此,组合可包括n2体系和e体系。在检测组合中,e体系可检测sars样冠状病毒,而n2体系可特异性检测sars-cov-2。检测组合还可包括靶向人核糖核酸酶p基因的内部对照核糖核酸酶p(rp)体系。
11.用于本技术组合的试样中的上呼吸道试样可以从通用或病毒传输介质中的鼻冲洗液、吸液或拭子中获得。特别地,上呼吸道试样可从但不限于鼻咽冲洗/抽吸物、鼻抽吸物、鼻咽拭子、口咽拭、前鼻拭子、中鼻甲鼻拭或气管抽吸物获得。其他试样,如粪便、唾液或尿液,也可被视为检测病毒的合适来源。
12.检测组合的结果用于推定检测和鉴定样本中的sars-cov-2rna。sars-cov-2rna通常在感染的早期和急性阶段在呼吸道试样中可检测到,但在疾病进展的所有阶段均可检测到。阳性结果表明sars-cov-2感染活跃,但可能不排除细菌感染或与其他病毒共同感染。检测到的致病原(agent)可能不是呼吸道疾病的唯一原因。
13.来自所述组合的阴性结果可能不排除sars-cov-2感染,也不应作为患者管理决策的唯一依据。阴性结果应与临床观察、病史和流行病学信息相结合,以确定患者管理。
14.该组合可供clia认证的具有分子诊断开发经验的高复杂度实验室使用,且仅在食品和药物管理局的紧急使用授权下使用。
15.cdi增强的新冠肺炎测试可与带有mipcr软件v2.8.0或更新版本的bio-molecular systems mic qpcr循环仪一起使用,但其他检测设备可能适合使用cdi增强的新冠肺炎测试。
16.表1描述了检测组合中的体系和目的。表1还包括每个体系中包括的引物和探针及其各自的功能。每个引物和探针的序列由seq id no:1-9表示。表1
17.还提供了一种使用检测组合的方法。为了用本发明的检测组合进行测试,可以进行样本的核酸提取。在一个实施方案中,核酸提取可通过rna提取仪器实现,例如magnapure 24系统(roche),其中可从样本(例如上呼吸道试样)中分离和纯化总核酸,包括dna和rna。从上呼吸道试样中提取rna样本后,应将其保存在-80℃直到使用。
18.可根据以下描述制备检测组合中使用的体系。在检测组合中,rna样本可以在三种一步法rt-pcr检测中进行测试。三种一步法rt-pcr体系可包括:1)sars-cov2特异性n2体系;2)所有sars相关冠状病毒保守e体系,以及3)靶向人核糖核酸酶p基因的内部对照rp体系。本技术的发明人已经发现,包括所有三种体系提供了对样本中病毒存在的改进检测。下文将更详细地描述体系和板设置。
19.rt-pcr在mic qpcr循环仪(bio molecular systems)上运行,软件为micpcrv2.8.0。软件的更新版本将向后兼容。其他实时平台也可用于检测。当rt-pcr运行时,探针可以退火到位于正向引物和反向引物之间的特定靶序列。在pcr循环的延伸阶段,taq聚合酶的5
′
核酸酶活性降解探针,导致报告染料与猝灭染料分离,产生荧光信号。在每个循环中,额外的报告染料分子从它们各自的探针上被切割,增加了荧光强度。mic-qpcr循环仪中使用的软件可监测每个pcr循环的荧光强度。
20.诊断组合中可包括阳性对照(ncovpc)。阳性对照(ncovpc)可以是病毒基因组rna,例如,它可以从bei resources(cat#nr-52285)获得,并且可以用于rrt-pcr n2和e体系。病毒基因组rna也可用于检测限(lod)评估。病毒基因组rna对照可在每次反应中使用100个拷贝。组合中的阳性对照还可以包括dna阳性对照,例如从sciencell(cat#7038-pos)购买的用于rp体系的cdc sars-cov-2诊断组合。组合中还可以包括无模板对照(ntc)。ntc可包括但不限于无菌无核酸酶水。ntc可作为小体积的等分制备,例如,每个等分可为约1ml,且可
制备至少50等分。还可包括ntc,以检查试样提取或板设置期间可能发生的污染。每次运行中必须包括阳性对照和ntc。
21.人体试样提取对照(hsc)也可包括在组合中。hsc可以是来自非感染样本的人rna提取物,其可以从例如sciencell(cat#7038-hsc)购买。hsc可在每批提取中用作提取对照。
22.应使用rna提取仪器在每次运行中提取目标样本、人类样本对照和阴性提取对照的核酸。rna提取仪器可以是例如罗氏公司出售的magna pure 24。可使用额外的rna提取仪器,包括qiaamp病毒rna迷你试剂盒、ez1病毒迷你试剂盒和qiagen出售的qiacube或nuclisens出售的easymag。然后将从样本、人类试样对照和阴性提取对照中提取的rna用于实时pcr(rt-pcr)试剂盒。可以使用任何rt-pcr试剂盒来进行提取。
23.诊断组合中使用的优选材料在下表2至表5中描述。表2中提供了用作组合中引物和探针的材料。表3中提供了用作组合中的对照材料。表4中提供了组合的实时pcr反应混合物。在表5中,提供了用于rna提取的材料。诊断组合中包括的每个对照的预期表现如表6所示。表2.体系引物和探针试剂标签描述sars-cov-2_n2sars-cov-2_n2组合引物/探针混合物sars-cov-2_esars-cov-2_e组合引物/探针混合物rp人核糖核酸酶p引物/探针混合物表3.对照材料表4.rrt-pcr酶反应混合物选择
表5.rna提取表6—cdi sars-cov-2实时rt-pcr诊断组合中包括的对照组的预期表现
24.在测试中也可以检测到内部对照核糖核酸酶p。所有临床样本在核糖核酸酶p反应中应显示出荧光增长曲线,该曲线在40.00个循环(《40.00ct)内穿过阈值线,由此表明存在人核糖核酸酶p基因。在任何临床样本中检测不到核糖核酸酶p可能表明:从临床材料中不当提取核酸导致rna丢失和/或rna降解。由于收集不当或样本完整性丢失,缺乏足够的人体细胞材料。体系设置和执行不当。试剂或设备故障。
25.如果rp体系对人体临床试样未产生阳性结果,则应将结果解释如下:如果sars-cov-2e和n2是阳性的,即使在没有阳性rp的情况下,该结果也应被视为有效。由于原始临床试样中的低细胞数,一些样本可能无法显示核糖核酸酶p增长曲线。阴性rp信号并不排除临床样本中存在cdi sars-cov-2病毒rna。如果试样的所有sars-cov-2标记物和核糖核酸酶p均为阴性,则应认为该结果对试样无效。如果剩余试样可用,重复提取程序并重复测试。如果重新测试后所有标记物均为阴性,则将结果报告为无效,如果可能,应收集新样本。
26.在本技术的组合中也检测到sars-cov-2标记物e和n2。当所有对照均表现出预期表现时,如果2019-ncov标记物e和n2的循环阈值增长曲线在40.00个循环(《40.00ct)内未穿过阈值线,且核糖核酸酶p增长曲线在30.00个循环(《40.00ct)中未穿过阈值,则认为样本为阴性。当所有对照组表现出预期表现时,如果标记物e和n2在40.00个循环(《40.00ct)内循环阈值增长曲线穿过阈值线,则认为试样对cdi sars-cov-2呈推定阳性。在本实施方案中,如上所述,核糖核酸酶p标记物可以是阳性的,也可以不是阳性的,但sars-cov-2结果仍然有效。
27.当对照组表现出预期的表现,sars-cov-2标记物e和n2的增长曲线,以及核糖核酸酶p标记物在40.00个循环(《40.00ct)内未穿过循环阈值增长曲线时,结果无效。应重新测试从试样中提取的rna。如果剩余rna不可用,则从剩余试样中重新提取rna并重新测试。如果重新测试的试样对所有标记物和核糖核酸酶p均为阴性,则结果无效,应考虑从患者身上采集新的试样。
28.当所有对照均表现出预期表现,且仅n2(而非e)的循环阈值增长曲线在40.00个循环(《40.00ct)内穿过阈值线时,结果为阳性。
29.当所有对照均表现出预期表现,且仅e(而非n2)的循环阈值增长曲线在40.00个循环(《40.00ct)内穿过阈值线时,结果不确定。重复提取和rrt-pcr。
30.如果hsc对e或n2呈阳性,则在提取或样本处理过程中可能发生污染。重新提取试样和hsc并重新测试。
31.表7列出了本技术的sars-cov-2rrt-pcr诊断组合(cdi增强的新冠肺炎测试)的预期结果。表7.sars-cov-2rrt-pcr诊断组合(cdi增强新冠肺炎测试)的预期结果
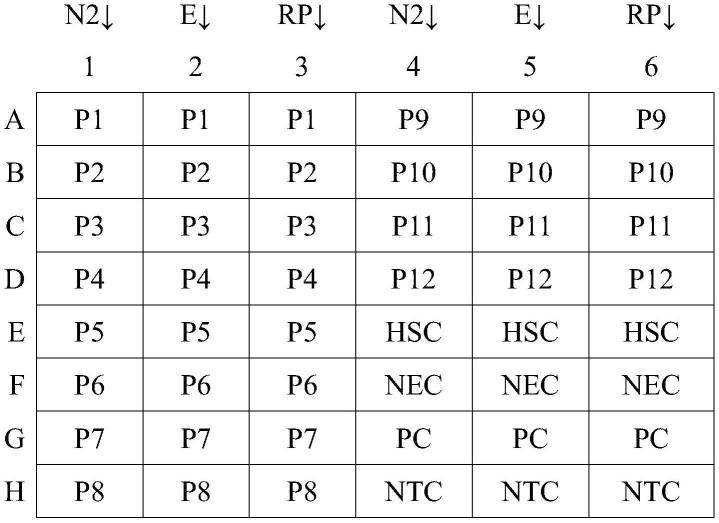
32.在一个特定的实施方案中,当所有对照都表现出预期的表现时,如上所述,如果sars-ncov-2标记物e和n2都不穿过周期阈值增长曲线,则试样被认为是sars-ncov-1病毒的阴性,即,增长曲线在约40.0个循环后小于阈值曲线,且核糖核酸酶p增长曲线在小于约40.1个循环后穿过循环阈值,则认为试样为阴性。在另一个实施方案中,当所有对照表现出预期表现时,如上所述,如果sars-ncov-2标记物e和n2都具有在40.0个循环内穿过阈值线的循环阈值增长曲线,则试样被视为sars-ncov-1阳性。如上所述,核糖核酸酶p可能是阳性的,也可能不是阳性的,但组合的结果可能仍然有效。
33.当检测组合产生阴性结果时,在体系中未检测到sars-cov-2(2019-ncov)rna。阴性结果可能不排除sars-cov-2感染,不应作为治疗或其他患者管理活动的唯一依据。sars-cov-2感染期间病毒水平峰值的最佳样本类型和时间尚未确定。其他样本类型包括胃肠道、组织活检、中枢神经系统和尿液,因患者群体而异。如果患者最近的暴露或临床表现表明sars-cov-2感染是可能的,并且其他疾病原因(即其他呼吸系统疾病)的诊断测试为阴性,则可以考虑假阴性结果的可能性。因此,阴性结果必须与临床观察、病史和流行病学信息相结合。如果在审查额外信息后仍怀疑sars-cov-2感染,应与感染对照或其他传染病专家协商,考虑重新检测。
34.当检测组合产生推定的阳性结果时,这可能表明sars-cov-2的活跃感染,但不排除细菌感染和/或与其他病毒的共同感染。检测到的致病原可能不是疾病的确切原因。推定的阳性结果应与临床观察、患者病史和流行病学信息相结合,用于患者管理决策。试样将按
照州和/或联邦机构的要求进行确认性测试。
35.检测组合也可能产生不确定的结果。在不确定的结果中,由于提交的试样中所有所需成分的扩增不一致,无法可靠地确定试样的结果。如果临床观察表明试样可能受到感染,则应提交试样的额外样本进行测试。
36.验证研究也可以在体系开发期间进行。验证研究可能包括但不限于检测限和交叉反应。检测限研究
37.为了进行检测限研究,可以将rna或灭活病毒掺入人工或真实的临床基质(例如bal液、痰、鼻咽拭子或口咽拭子等)。可对每种浓度三次提取重复的2-3倍稀释系列进行测试,并可通过20次重复确认最终浓度。美国食品和药物管理局(fda)将检测限定义为19/20次复制阳性的最低浓度。
38.检测限(lod)研究确定了sars-cov-2的最低可检测浓度,在该浓度下,约95%的所有(真阳性)重复测试呈阳性。通过使用特征样本的限制稀释研究确定lod。制备了具有已知病毒rna浓度的特征样本。本技术诊断组合中包含的rrt-pcr体系的检测灵敏度在检测限研究中被确定。病毒基因组rna(sars相关冠状病毒2,分离物usa-wa1/2020)从bei resources(目录编号:nr-52285)获得,其已知滴度(rna拷贝数/μl)掺入由悬浮在通用运输介质中的鼻拭子组成的稀释剂中。使用magna pure 24仪器提取样本。根据cdi sars-cov-2实时rt-pcr诊断组合使用说明,使用一步法primescript
tm rt-pcr试剂盒(perfect real time)(takara)(目录编号:rr064b)和bioline sensifast probe no-rox一步法试剂盒在bio molecular systems mic-qpcr循环仪上执行实时rt-pcr体系。
39.通过测试病毒基因组rna(cat#nr-52285)的3倍系列稀释的三份样本,确定了e和n2体系的初步检测限。使用20个重复中的病毒rna的每次反应10和20个拷贝来确定lod确认。lod被确定为最低浓度,其中:≥95%(19/20)的重复均为阳性。检测限试验结果见表8-12。表8.使用takara一步法primescript
tm rt-pcr试剂盒确认cdi sars-cov-2实时rt-pcr诊断组合的检测限1浓度以rna拷贝数/μl表示2报告的稀释平均ct为:≥95%阳性。计算结果仅包括阳性结果。na:不适用表9.cdi sars-cov-2 r-rt-pcr组合,使用3倍序列稀释的病毒基因组rna和takara一步法引物
tm rt-pcr试剂盒
表10.使用3倍系列稀释的病毒基因组rna和bioline sensifast probe no-rox一步法试剂盒的cdi sars-cov-2 r-rt-pcr组合表11.使用3倍系列稀释的病毒基因组rna和bioline sensifast
tm probe no-rox一步法试剂盒的cdi sars-cov-2 r-rt-pcr组合的结果
表12.使用bioline sensifast
tm probe no-rox一步法试剂盒的cdi sars-cov-2 r-rt-pcr诊断组合的lod检测结果a浓度以rna拷贝数/μl表示,b平均浓度报告的稀释度为:≥95%阳性。计算结果仅包括阳性结果。na:不适用包容性研究
40.可进行包容性研究,以证明可通过提出的分子体系检测到的sars-cov-2毒株。可以使用体系的引物和探针对已发表的sars-cov-2序列进行计算机模拟测试。fda预计,100%已发表的sars-cov-2序列将可通过所选引物和探针检测到。
41.sars-cov-2n2体系的计算机模拟测试先前由疾病对照和预防中心(cdc)进行。本技术的计算机模拟测试以类似的方式进行。sars-cov-2 rrt-pcr体系的n2正向引物序列与蝙蝠sars样冠状病毒具有高度序列同源性。反向引物和探针序列与人类基因组、其他冠状病毒或人类微生物菌群无显著同源性。因此,当组合引物和探针时,没有预测潜在的假阳性rrt-pcr结果。
42.还进行了sars-cov-2e的计算机模拟测试。对sars-cov-2 rrt-pcr e体系的正向和反向引物和探针序列的检测表明,其仅与人sars冠状病毒和蝙蝠sars冠状病毒具有显著同源性。未观察到与人类基因组、其他冠状病毒或人类微生物菌群的显著同源性,这将预测潜在的推定阳性rrt-pcr结果。
43.总之,设计用于特异性检测sars-cov-2的cdi sars-cov-2 rrt-pcrn2体系未显示出与人类基因组、其他冠状病毒或人类微生物菌群的显著组合同源性,这将预测潜在的假阳性rrt-pcr结果。sars-cov-2 rrt-pcr e体系法设计用于sars-cov-2、人sars冠状病毒和蝙蝠sars冠病毒的通用检测。作为cdi增强的新冠肺炎测试的一部分,sars-cov-2 rrt-pcr e体系未显示出与人类基因组、除人类sars冠状病毒或人类微生物群以外的其他人类冠状病毒(预测潜在假阳性rrt-pcr结果)的显著组合同源性。交叉反应
44.可以进行与表13中列出的常见呼吸菌群和其他病毒病原体相比的体系引物和探针的计算机模拟分析。fda将计算机模拟交叉反应性定义为其中一个引物/探针与目标微生物中存在的任何序列之间大于80%的同源性。
45.针对公共域核苷酸序列执行sars-cov-2 rrt-pcr检测引物和探针的blastn分析
查询。数据库搜索参数如下:1)核苷酸集合由genbank+embl+ddbj+pdb+refseq序列组成,但不包括est、sts、gss、wgs、tsa;2)数据库是非冗余的。相同序列已合并到一个条目中,同时保留每个条目的登录、gi、标题和分类信息;3)分析于2020年3月10日进行;4)搜索参数自动调整短输入序列,预期阈值为1000;5)匹配和不匹配得分分别为1和-3;6)在路线中创建和延伸空位的惩罚分别为5和2。
46.n2体系探针序列与sars冠状病毒的同源性《78.3%,与下表14中列出的其他生物体无显著相似性。e体系探针与人类sars冠状病毒具有88~100%的同源性,与蝙蝠sars冠冕病毒具有84~100%同源性,但与表14中列出的所有其他生物体无显著相似性。表13.拟在计算机模拟或湿法测试*中进行分析的生物体的推荐列表表13.拟在计算机模拟或湿法测试*中进行分析的生物体的推荐列表对于湿法试验,建议细菌的浓度为106cfu/ml或更高,病毒的浓度为105pfu/ml以上。表14.cdi sars-cov-2 r-rt-pcr组合的分析特异性(交叉反应)
*将探针序列与上文中定义的具有非常低的严格性截止值的所有排他序列进行blast。未发现通过截止点的显著相似性,也未观察到交叉反应问题。临床评价
47.在没有已知阳性样本可供测试的情况下,可通过以随机盲法测试至少30个人工反应试样和30个非反应性试样,用一系列人工临床试样来确认体系的性能。可以通过将rna或灭活病毒刺入代表独特患者的剩余个体临床试样中来创建人工反应试样;这些试样中的大多数可能是残留的呼吸试样,如np拭子、痰液等。20个人工临床试样应以1x-2x lod的浓度加入,其余试样横跨(span)体系测试范围。fda将性能验收标准定义为在1x-2x lod下95%一致,在所有其他浓度和阴性试样下100%一致。
48.为了进行临床评估,使用了30个非反应性鼻咽拭子试样。另外30个人工试样加入病毒基因组rna(目录编号:nr-52285)以产生以下病毒载量:20个(或21个)具有2
×
lod,5个具有3
×
lod和5个(或4个)具有4
×
lod。这60个样本被盲取并在magna pure 24系统上提取。结果列于表15和16中。表15.使用takara一步法primescript
tm
rt-pcr试剂盒的cdi sars-cov-2 r-rt-pcr组合对鼻咽拭子的临床表现
表16.使用bioline sensifast
tm probe no-rox一步法试剂盒的cdi sars-cov-2 r-rt-pcr组合对鼻咽拭子的临床表现
49.还提供了制备在检测组合中的体系的方法。用于检测组合的体系制备为反应混合物。可以根据表17-20为每个检测准备反应混合物。反应混合物的准备取决于用于测试的rt-pcr试剂盒。特别是,发明人发现takara的一步法primescript
tm rt-pcr试剂盒和的bioline的sensifast
tm probe no-rox一步法试剂盒在与本技术的反应混合物一起使用时最有效。
50.一旦制备好反应混合物,就可以制备rt-pcr试剂盒。如果使用一步法primescript
tm rt-pcr试剂盒,应按照表17和18中的体系制备试剂盒。如果使用sensifast
tm probe no-rox一步法试剂盒,则应按照表19和20中的体系制备试剂盒。a.一步法primescript
tm rt-pcr试剂盒(perfect real time)标记了每个成分,并将试管编号指定为1、2、3、4、5、6。试管5和6不用于检测设置。b.每个反应的总体积为20μl(15μl反应混合物+5μl rna)。c.为制备16个反应(“rxn”)所需的足够的反应混合物,按下表所示,对反应混合物中的每个组分乘以17。
51.一旦为将要使用的相应rt-pcr试剂盒制备了反应混合物,则可以如下设置诊断平板。平板设置独立于rt-pcr试剂盒,这意味着平板设置适用于一步法primescript
tm rt-pcr试剂盒和sensifast
tm probe no-rox一步法试剂盒。d.将15μl的反应混合物加载到平板分布图定义的孔中;e.将5μl核糖核酸(“rna”)添加到平板分布图定义的每个孔中;f.关闭盖子,将样本样转移到mic循环仪上。将样本样转移到mic循环仪上。anec:阴性提取对照
52.然后将平板转移到mic-qpcr循环中进行分析,并运行rrt-pcr。可以基于所使用的rt-pcr试剂盒来设置热循环条件。如果使用一步法primescript
tm rt-pcr试剂盒,表21中的热循环条件可用于体系。如果是使用sensifast
tm probe no-rox一步法试剂盒时,可使用表22中的热循环条件进行检测。g.打开mic循环仪和计算机;h.打开mipcr软件,确保仪器被计算机识别;
i.使用体系“cdi-covid19”(基于takara试剂盒)或“bioline-sars-cov2”(基于bioline试剂盒)创建新的运行;j.输入试样名称,并根据需要选择试样类型为“未知”、“ntc”或“阳性对照”;k.将每个样本分成组(n2、e、rp);l.开始运行表21.cdi-covid19热循环条件阶段1:反转录阶段2:pcr反应阶段2:pcr反应表22.bioline-sars-cov2热循环条件阶段1:反转录阶段2:pcr反应
53.应当理解,上述实施例和解释仅用于说明目的,并且鉴于本公开,本发明的各种修改对于本领域技术人员来说是不言而喻的,并且将被包括在本技术的精神和范围以及权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1