寡核苷酸的合成和相关化合物的制作方法
寡核苷酸的合成和相关化合物
1.以引用方式并入任何优先权申请
2.例如在与本技术一起提交的申请数据表或请求中标识了国外或国内优先权要求的任何和所有申请,根据37 cfr 1.57和细则4.18和20.6特此以引用方式并入,包括2020年3月31日提交的美国临时申请号63/003,067。
技术领域
3.本公开涉及经由具有叠氮甲基部分的可裂解载体合成寡核苷酸。本公开还包括可用于合成寡核苷酸的新型中间体。
背景技术:
4.提供以下对背景技术的描述只是为了帮助理解本公开,并且不被认为是描述或构成本公开的现有技术。
5.已知寡核苷酸具有重要的诊断和治疗应用。当前,寡核苷酸常常使用自动固相合成产生,并且经济、大规模的寡核苷酸合成的开发已经成为制药业的重要问题。一些方法牵涉将核苷酸附连到载体以促进寡核苷酸合成过程的纯化和延伸步骤。然而,载体的去除常常导致寡核苷酸上重要保护基的损失。另外,用于寡核苷酸合成的许多方法常常需要大量过量的昂贵试剂并且难以扩大规模。因此,需要开发用于合成寡核苷酸的改善方法,包括在合成期间稳定但可以在温和条件下去除的改善的载体。
技术实现要素:
6.本文提供了在具有叠氮甲基部分的可裂解载体上经由新的中间体合成寡核苷酸的新型方法。在一些实施方案中,该方法可包括多个反应循环(例如,四反应循环),这些反应循环中的每个反应循环包括依次偶联在具有叠氮甲基部分的可裂解载体上的核苷或寡核苷酸亚基和核苷亚磷酰胺或寡核苷酸亚磷酰胺,加帽、氧化/硫醇化和去封闭;接着对叠氮甲基载体进行正交裂解,同时保持所有其他保护基完整。该方法可以与载体部分组合使用以用于固相或液相寡核苷酸合成。可溶性载体通过简单的沉淀促进均相反应和高效分离。该方法还提供可用于合成寡核苷酸缀合物的新型中间体。
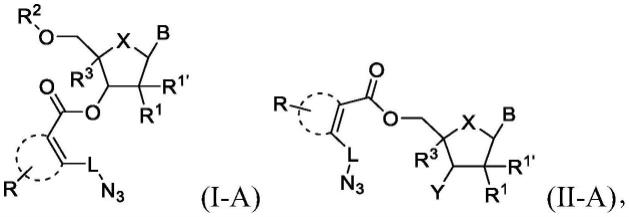
7.一些实施方案涉及一种由式(i)或式(ii)表示的化合物:
[0008][0009]
或其盐,其中
[0010]
nuc为单体核苷或核苷酸或寡聚体核苷或核苷酸,
[0011]
l为任选地被一个或多个选自卤素的取代基取代的c
1-4
烷基,
[0012]
虚曲线表示环状部分;并且
[0013]
r为任选地通过一个或多个接头连接到所述环状部分的载体部分。
[0014]
一些实施方案涉及一种选择性地缀合由式(i-a)或式(ii-a)表示的具有受保护的核碱基的寡聚体的方法,
[0015][0016]
(a)使由式(i-a)或式(ii-a)表示的具有受保护的核碱基的所述寡聚体反应,以形成以下式(iii):
[0017][0018]
其中b为受保护的天然或非天然核碱基;y’为oh、or”或nhr”;r”独立地选自h、芳基、低级烷基和c
1-4
卤代烷基;以及
[0019]
(b)使所述式(iii)的化合物在所述3’位置反应以形成与第二化合物的新共价键。
[0020]
一些实施方案涉及一种下式的化合物:
[0021][0022]
其中
[0023]
nuc为具有1-30个连接的核苷的寡核苷酸亚基;
[0024]
b为受保护的天然或非天然核碱基;
[0025]
x不存在,为o或s;
[0026]
r1选自h、opg、f、or”和o(cr
’2)
1-2
ocr
’3;
[0027]
r2选自h和pg;
[0028]
r3选自h、opg、f和or”,或r1和r3一起形成任选取代的2-4个原子的桥;
[0029]
r’独立地选自h、f、芳基、低级烷基和低级卤代烷基;
[0030]
r”独立地选自h、芳基、低级烷基和低级卤代烷基;
[0031]
pg为保护基;
[0032]
r6选自抗衡离子、甲基和2-氰乙基;并且
[0033]
r为任选地通过一个或多个接头连接到所述环状部分的固体载体或可溶性载体部分。
具体实施方式
[0034]
在各种类型的寡核苷酸治疗剂(诸如反义、适体、sirna和mirna)方面的近期进展已经引起对经济和/或大规模生产的需求不断增长。本文所述的方法提供了用于固相和液相寡核苷酸合成的可行方法。本文所述的合成方法和化合物可与可溶性载体或固体载体一起使用。具体地讲,当本文所述的方法与可溶性载体一起使用时,所得液相合成方法可以避免使用异质反应,降低制造成本,并且因此提供大规模生产的有效方法。
[0035]
本文所述的方法可用于选择性地制备3'和/或5'取代的核苷酸和寡核苷酸。使用本文所述的合成方法的另一个优点在于核苷和磷主链上的保护基可以保持完整,并且保护基可以在不同于用于去除载体的条件下被选择性地裂解。下文更详细地描述了在核苷酸的3'和/或5'位置处的选择性修饰以及核苷酸上的保护基的选择性去除。
[0036]
合成中间体
[0037]
本公开提供了经由新型中间体合成寡核苷酸的方法。
[0038]
本公开的化合物,可以是合成中间体,包括由式(i)或式(ii)表示的化合物:
[0039][0040]
或其盐,其中
[0041]
nuc为单体核苷或核苷酸或寡核苷酸,
[0042]
l为任选地被一个或多个选自卤素的取代基取代的c
1-4
烷基,虚曲线表示环状部分;
[0043]
r为任选地通过一个或多个接头连接到所述环状部分的载体部分。
[0044]
本公开的化合物,可以是合成中间体,包括由式(i-a)或式(ii-a)表示的化合物:
[0045][0046]
或其盐,其中
[0047]
x选自o、s、nr”和c(r’)2;
[0048]
y选自oh、or”、opg、nhpg、配体部分和nhr’;
[0049]
b为任选地受保护的核碱基;
[0050]
r1和r1’
独立地选自h、opg、f、or”和o(cr
’2)
1-2
ocr
’3;
[0051]
r2选自h、低级烷基、低级卤代烷基、pg、任选地受保护的核苷酸、前药部分、配体部分和任选地受保护的寡核苷酸;
[0052]
r3选自h、opg、f和or”,或r1和r3一起形成任选取代的2-4个原子的桥;
[0053]
r’独立地选自h、f、芳基、低级烷基和低级卤代烷基;
[0054]
r”独立地选自h、芳基、低级烷基和低级卤代烷基;并且
[0055]
pg为保护基。
[0056]
本公开的化合物,可以是合成中间体,包括由式(i-1)或式(ii-1)表示的化合物:
[0057][0058]
或其盐,其中
[0059]
x选自o、s、nr”和c(r’)2;
[0060]
y选自oh、or”、opg、nhpg、nhr”和寡核苷酸;
[0061]
b为任选地受保护的天然或非天然核碱基;
[0062]
r1和r1’
独立地选自h、opg、f、or”和o(cr
’2)
1-2
ocr
’3;
[0063]
r2选自h、低级烷基、低级卤代烷基、pg、任选地受保护的核苷酸、前药部分和任选地受保护的寡核苷酸;
[0064]
r3选自h、opg、f和or”,或r1和r3一起形成任选取代的2-4个原子的桥;
[0065]
r’独立地选自h、f、芳基、低级烷基和低级卤代烷基;
[0066]
r”独立地选自h、芳基、低级烷基和低级卤代烷基;
[0067]
pg为保护基;
[0068]
虚曲线表示环状部分;
[0069]
r为任选地通过一个或多个接头连接到所述环状部分的载体部分。
[0070]
在一些实施方案中,l具有的结构,其中rx和ry独立地选自由h、me、et、pr和bu组成的组;或rx、c和ry一起形成4-6元环,并且n为介于1和4之间的整数。在一些实施方案中,l为任选取代的c
1-2
烷基。在一些实施方案中,l为亚甲基。在一些实施方案中,l为亚乙基。
[0071]
其他实施方案包括由式(ia)或式(iia)表示的化合物:
[0072]
[0073]
其中
[0074]
x1、x2、x3和x4独立地选自cr、cr4和n,
[0075]
其中x1、x2、x3和x4中的至少一者是cr,并且两个相邻的x1、x2、x3和x4任选地形成可以被取代的取代的环;
[0076]
r1和r1’
独立地选自h、opg、f、or”和o(cr
’2)
1-2
ocr
’3;
[0077]
r2选自h、低级烷基、低级卤代烷基、pg、任选地受保护的核苷酸、前药部分和任选地受保护的寡核苷酸;
[0078]
r3选自h、opg、f和or”,或r1和r3一起形成任选取代的2-4个原子的桥;
[0079]
r’独立地选自h、f、芳基、低级烷基和低级卤代烷基;
[0080]
r”独立地选自h、芳基、低级烷基和低级卤代烷基;
[0081]
pg为保护基。
[0082]
r4独立地选自h、烷基、烷氧基、芳基、卤离子、no2和取代的羰基。
[0083]
载体部分可以是固体载体部分或可溶性载体部分。将可溶性载体部分连接到本文所述的化合物(例如,核苷酸、核苷或寡核苷酸)在某些条件下可以提供可调的溶解性。在一些实施方案中,可溶性载体部分使化合物在溶剂体系的极性变化时具有可调的溶解性。在一些实施方案中,所述溶剂体系可以是单一溶剂或溶剂的混合物。在一些实施方案中,具有可溶性载体部分的化合物可溶于低极性溶剂,并且在溶剂体系的极性增加时(例如,通过添加一种或多种高极性溶剂)沉淀。在其他实施方案中,具有可溶性载体部分的化合物可溶于极性溶剂,并且在溶剂体系的极性降低时(例如,通过添加一种或多种低极性溶剂)沉淀。在一些实施方案中,可溶性载体部分使化合物可溶于或自由溶于二氯甲烷(dcm)中,并且使化合物几乎不溶于或不溶于二噁烷/水(9:1)中。
[0084]
在一些实施方案中,载体部分通过一个或多个(例如,1、2或3个)接头连接。某些实施方案包括以下情况,其中r由以下表示:
[0085][0086]
l1和l2是任选的接头,并且圆圈是连接到固体载体的部分或为化合物提供选择性溶解性的部分。例如,在一些实施方案中,r由以下表示:
[0087][0088]
其中
[0089]
l1选自键、任选取代的c1-6亚烷基基团、任选取代的c2-6亚烯基基团、任选取代的c2-6亚炔基基团、任选取代的环烷基基团、任选取代的c6-10芳基、任选取代的5-10元杂芳基和任选取代的4-8元杂环基团;
[0090]
l2选自单键、-o-或-n(r’)-和c(o);
[0091]
每个z独立地选自o、nr”和键;
[0092]
每个r5独立地选自烷基基团、烯基基团、炔基基团和乙二醇基团;并且
[0093]
a为1-5的整数。
[0094]
在一些实施方案中,l1为由一个或多个氮原子(例如,1、2或3个n原子)和碳原子组成和/或具有5至7个环原子的饱和杂环基团,并且l2选自单键、-o-或-n(r’)-和c(o)。在一些实施方案中,z为o,并且r5为c
10-40
烷基基团。在一些实施方案中,a为1-3的整数。
[0095]
r可以表示适用于本文所述方法的载体部分。一些实施方案包括以下情况,其中r由以下表示:
[0096]
诸如其他载体基团和接头公开于例如美国公开号2018/0291056、美国公开号2018/0282365、美国专利第10,214,555号、美国专利第9,284,344号、wo/2018/203574中,其各自以引用方式并入。其他适用的可溶性载体包括用于液相合成的载体,液相合成包括基于聚合物的液体合成、离子液体标签辅助合成、氟标签辅助合成、四价聚类合成、金刚烷基甲酯合成、烷基链辅助合成、产物锚定依次合成(pass)方法、使用聚合物载体的溶液相合成;和用于寡核苷酸合成的在synthesis of therapeutic oligonucleotides,2018,isbn:978-981-13-1911-2中描述的液相合成和试剂以引用方式并入。可溶性载体的示例包括聚乙烯醇、peg、基于纤维素的聚合物、基于季戊四醇的载体、环糊精和环糊精衍生物、ajiphase锚、基于(金刚烷-1-基)乙酰基的载体、咪唑鎓离子标签、ass+z-acss载体、基于季戊四醇的四足载体、四(三唑基苯基)-金刚烷衍生载体。适用的载体可以在molina,a.g.,&sanghvi,y.s.(2019).liquid-phase oligonucleotide synthesis:past,present,and future predictions.current protocols in nucleic acid chemistry,e82.doi:10.1002/cpnc.82中找到,其以引用方式并入本文。
[0097]
在一些实施方案中,x为o,r1为f或or”并且r1’
为h。一些实施方案同样r2为任选地受保护的核苷酸或任选地受保护的寡核苷酸。任选地受保护的寡核苷酸可以包括2至40个核苷酸,这些核苷酸任选地以与式(i)或式(ii)中的环部分相同的方式进行修饰。换句话讲,核苷酸可以如针对式(i)或式(ii)公开的那样用x、y、r1、r1’
、r2和r3进行修饰。核苷酸可以包括选自磷酸二酯、硫代磷酸酯、氨基磷酸酯和硫代氨基磷酸酯键的亚基间键。核苷酸的核碱基可以是任选地受保护的天然或非天然核碱基。在一个实施方案中,所有核碱基都受到保护。
[0098]
其他实施方案包括以下情况,其中化合物由以下式(ib)或式(ic)表示:
[0099]
[0100]
其中x5不存在,为o或s并且其余取代基与式(i)或式(ii)(或本文所公开的子实施方案)相同。
[0101]
其他实施方案包括以下式(id)或式(ie)的化合物:
[0102][0103]
其中
[0104]
nuc为具有1-30个连接的核苷的寡核苷酸亚基;
[0105]
b为受保护的天然或非天然核碱基;
[0106]
r1选自h、opg、f、or”和o(cr
’2)
1-2
ocr
’3;
[0107]
r2选自h和pg;
[0108]
r3选自h、opg、f和or”,或r1和r3一起形成任选取代的2-4个原子的桥;
[0109]
r’独立地选自h、f、芳基、低级烷基和低级卤代烷基;
[0110]
r”独立地选自h、芳基、低级烷基和低级卤代烷基;
[0111]
pg为保护基;
[0112]
r6选自抗衡离子、烷基(例如,甲基)和2-氰乙基;并且
[0113]
r为任选地通过一个或多个接头连接到所述环状部分的固体载体或可溶性载体部分。
[0114]
制备方法
[0115]
本公开还包括选择性地缀合寡聚体,诸如寡核苷酸的方法。某些实施方案涉及一种选择性地缀合由式(i-a)或式(ii-a)表示的具有受保护的核碱基的寡聚体或其盐的方法,
[0116][0117]
其中
[0118]
x选自o、s、nr”和c(r’)2;
[0119]
b为受保护的核碱基;
[0120]
r1和r1’
独立地选自h、opg、f、or”和o(cr
’2)
1-2
ocr
’3;
[0121]
r2为任选地受保护的核苷酸或在5'位置处受到保护,包括受保护的核苷酸的寡核苷酸;
[0122]
r3选自h、opg、f和or”,或r1和r3一起形成任选取代的2-4个原子的桥;
[0123]
r’独立地选自h、f、芳基、低级烷基和低级卤代烷基;
[0124]
r”独立地选自h、芳基、低级烷基和c
1-4
卤代烷基;
[0125]
pg为保护基;
[0126]
y选自oh、or”、opg、nhpg、nhr”、任选地受保护的核苷酸和任选地受保护的寡核苷酸;
[0127]
l为任选地被一个或多个取代基取代的c
1-4
烷基。
[0128]
在一些实施方案中,l为crxry,其中rx和ry独立地选自由h、me、et、pr和bu组成的组;或rx、c和ry一起形成3至6元环。在一些实施方案中,l为任选取代的c
1-2
烷基。在一些实施方案中,l为亚甲基。在一些实施方案中,l为亚乙基。
[0129]
虚曲线表示环状部分;
[0130]
r为任选地通过一个或多个接头连接到所述环状部分的载体部分,所述方法包括:
[0131]
(a)使由式(i-a)或式(ii-a)表示的具有受保护的核碱基的寡聚体反应,以形成以下式(iii):并且其中b为受保护的天然或非天然核碱基;y’为oh、or”或nhr”;r”独立地选自h、芳基、低级烷基和c
1-4
卤代烷基;以及
[0132]
(b)使式(iii)的化合物在3’位置反应以形成与第二化合物的新共价键,
[0133]
某些实施方案包括选择性地缀合由式(i-1)表示的具有受保护的核碱基的寡聚体或其盐的方法,
[0134][0135]
其中
[0136]
x选自o、s、nr”和c(r’)2;
[0137]
b为受保护的天然或非天然核碱基;
[0138]
r1和r1’
独立地选自h、opg、f、or”和o(cr
’2)
1-2
ocr
’3;
[0139]
r2为在5’位置受到保护的包含受保护的天然或非天然核碱基的寡核苷酸;
[0140]
r3选自h、opg、f和or”,或r1和r3一起形成任选取代的2-4个原子的桥;
[0141]
r’独立地选自h、f、芳基、低级烷基和低级卤代烷基;
[0142]
r”独立地选自h、芳基、低级烷基和低级卤代烷基;
[0143]
pg为保护基;
[0144]
虚曲线表示环状部分;
[0145]
r为任选地通过一个或多个接头连接到环状部分的载体部分,
[0146]
该方法包括:
[0147]
(a)使由式(i-1)表示的具有受保护的核碱基的寡聚体反应,以形成以下式(iii):
[0148]
并且其中b为受保护的天然或非天然核碱基;y’为oh、or”或nhr”;r”独立地选自h、芳基、低级烷基和c
1-4
卤代烷基;以及
[0149]
(b)使式(iii)的化合物在3’位置反应以形成与第二化合物的新共价键。
[0150]
在一些实施方案中,式(i)的化合物由以下式(if)表示:
[0151][0152]
其中x5为o或s;
[0153]
r2为pg;
[0154]
r6选自抗衡离子、甲基和2-氰乙基;并且
[0155]
b为1至30的整数。
[0156]
在某些实施方案中,步骤(b)包括使式(iii)的化合物在3’位置反应以与第二化合物形成共价键。在一些实施方案中,步骤(b)包括使式(iii)的化合物在3’位置与保护基反应,接着使化合物在5’位置脱保护,并且使所得化合物在5’位置反应以与第二化合物形成共价键。
[0157]
某些实施方案包括例如通过staudinger型反应去除载体。例如,可以通过使化合物与ph3p接触来去除载体。在一些实施方案中,去除载体而不去除核碱基的保护基。另外的实施方案包括在去除载体之后使寡核苷酸的核碱基脱保护。
[0158]
一些实施方案涉及一种偶联第一核苷亚基和核苷亚磷酰胺的方法,该方法包括
[0159]
(a)使第一核苷亚基与核苷亚磷酰胺反应,
[0160]
其中第一核苷亚基与以下部分(a)共价键合:
[0161][0162]
其中r为任选地通过一个或多个接头连接到所述环状部分的载体部分,并且虚线表示另外的键,并且*表示所述部分与所述第一核苷键合的点。
[0163]
在一些实施方案中,r由表示,
[0164]
其中
[0165]
l1选自键、任选取代的c1-6亚烷基基团、任选取代的c2-6亚烯基基团、任选取代的c2-6亚炔基基团、任选取代的环烷基基团、任选取代的c6-10芳基、任选取代的5-10元杂芳基和任选取代的4-8元杂环基团;
[0166]
l2选自单键、-o-或-n(r’)-和c(o);
[0167]
z选自o、nr”和键;
[0168]
r5选自烷基基团、烯基基团、炔基基团和乙二醇基团;并且
[0169]
a为1-3的整数。
[0170]
其他实施方案包括一种偶联第一核苷亚基和核苷亚磷酰胺的方法,该方法包括
[0171]
(a)使第一核苷亚基与核苷亚磷酰胺反应,
[0172]
其中第一核苷亚基与以下部分(a)共价键合:
[0173][0174]
其中虚线表示另外的键,并且*表示所述部分与第一核苷键合的点。在一些实施方案中,另外的键不是与氢的。在一些实施方案中,*连接在核苷酸的3'或5'点处。在一些实施方案中,部分(a)具有以下结构:
[0175][0176]
其中r为任选地通过一个或多个接头连接到环状部分的载体部分。
[0177]
在一些实施方案中,所得化合物可以具有以下的结构:
[0178][0179]
其中
[0180]
nuc为具有1-30个连接的核苷的寡核苷酸亚基;
[0181]
b为受保护的天然或非天然核碱基;
[0182]
x不存在,为o或s;
[0183]
r1选自h、opg、f、or”和o(cr
’2)
1-2
ocr
’3;
[0184]
r2选自h和pg;
[0185]
r3选自h、opg、f和or”,或r1和r3一起形成任选取代的2-4个原子的桥;
[0186]
r’独立地选自h、f、芳基、低级烷基和低级卤代烷基;
[0187]
r”独立地选自h、芳基、低级烷基和低级卤代烷基;
[0188]
pg为保护基;
[0189]
r6选自抗衡离子、甲基和2-氰乙基;并且
[0190]
r为任选地通过一个或多个接头连接到环状部分的固体载体或可溶性载体部分。
[0191]
在一些实施方案中,所得偶联核苷具有以下结构:
[0192][0193]
其中nuc为具有1-30个连接的核苷的寡核苷酸亚基,
[0194]
b为受保护的天然或非天然核碱基;
[0195]
r1选自h、opg、f、or”和o(cr
’2)
1-2
ocr
’3;
[0196]
r2选自h和pg;
[0197]
r3选自h、opg、f和or”,或r1和r3一起形成任选取代的2-4个原子的桥;
[0198]
r’独立地选自h、f、芳基、低级烷基和低级卤代烷基;
[0199]
r”独立地选自h、芳基、低级烷基和低级卤代烷基;
[0200]
pg为保护基;
[0201]
r6选自抗衡离子、甲基和2-氰乙基;并且
[0202]
r为任选地通过一个或多个接头连接到所述环状部分的载体部分。
[0203]
本文公开的实施方案包括经由汇聚式合成来合成寡核苷酸的方法,该方法包括将第一核苷酸与具有任选地通过一个或多个接头连接的载体部分的第二核苷酸偶联;氧化所得产物并且使所得产物在5'位置去封闭。
[0204]
在一些实施方案中,经由汇聚式合成来合成寡核苷酸的方法还包括使具有任选地通过一个或多个接头连接的载体部分的所得5'-去封闭产物与第三核苷酸反应,并且氧化或硫醇化所得产物。在一些实施方案中,该步骤执行多于一次。在一些实施方案中,第三核苷酸包含两个或更多个核苷酸。在一些实施方案中,经由汇聚式合成来合成寡核苷酸的方法包括偶联二聚体、三聚体和/或4聚体以合成具有期望长度的寡核苷酸。
[0205]
应理解,以上步骤可以根据汇聚式合成的需要进行。例如,以下实施方案示出了21聚体核苷酸的示例性汇聚式合成。
[0206][0207]
在上述汇聚式合成方案中,受保护的核苷酸n20可以与连接到可裂解载体(例如,可溶性载体)的核苷酸n21偶联,所得二聚体然后经历氧化和5
’‑
去封闭以提供连接到可裂解载体的二聚体n20n21。然后通过类似的过程将二聚体偶联到n19以产生三聚体n19n2n21。然后将该三聚体偶联到另一个三聚体以生成连接到可裂解载体的六聚体。然后可以将该六聚体偶联到另一个六聚体以生成12聚体。以上方案示出了21聚体的制备的示例,并且可以调整该过程以制备任何所需长度的寡聚体。连接到寡聚体的可裂解载体可以是可溶性载体部分,该可溶性载体部分可以从寡核苷酸裂解并且然后通过选择性沉淀从反应中回收。
[0208]
另外,上述过程可以特别适合于制备含有核苷酸重复序列的寡聚体,此类寡聚体由ac重复序列、ag重复序列、cg重复序列、at重复序列或其他核苷酸重复序列组成。一旦在初始偶联步骤之后形成二聚体,然后就可以重复偶联二聚体以形成具有二聚体核苷酸重复序列的寡聚体。在以上方案中,css是可裂解载体,并且css的一个示例是并且p为亚磷酰胺(例如,),并且pci是亚磷酰化试剂。
[0209]
定义
[0210]
应当了解,本文所用的术语只是为了描述具体实施方案的目的,并非旨在限制本公开的范围。除非另外指明,否则下列定义将适用。
[0211]
值得注意的是,除非上下文清楚决定不是这样,否则本文和所附权利要求中所用的单数形式“一个”、“一种”、“该”和“所述”包括复数指代。还应当注意,权利要求书可制定为排除任何任选的元素。同样地,这一声明旨在当结合权利要求元素的表述“单独地”、“唯一地”等使用此类专用术语时,或使用“负”限制时充当先行基础。
[0212]
如本文所用,术语“约”应被本领域普通技术人员理解并将根据使用其的上下文在
某种程度上变化。如果在给定的使用术语的上下文中,该术语的用途对于本领域的普通技术人员而言不清楚,则“约”将意指最多加上或减去特殊项的10%。
[0213]
通常,对某种元素诸如氢或h的提及意在包括该元素的所有同位素。例如,如果将r基团定义为包括氢或h,则其还包括氘和氚。因此,同位素标记的化合物在本公开的范围内。
[0214]
一般来讲,“取代的”是指如以下定义的有机基团(例如,烷基基团),其中一个或多个与其中所含的氢原子的键被与非氢原子或非碳原子的键置换。取代的基团还包括其中一个或多个与碳原子或氢原子的键被一个或多个与杂原子的键(包括双键或三键)置换。因此,除非另有说明,否则取代的基团将被一个或多个取代基取代。在一些实施方案中,取代的基团被1、2、3、4、5或6个取代基取代。取代基基团的示例包括:卤素(即,f、cl、br和i);羟基;烷氧基、烯氧基、烷氧基、芳氧基、芳烷基氧基、杂环氧基和杂环基烷氧基;羰基(氧代);羧基;酯;氨基甲酸酯;肟;羟胺;烷氧基胺;芳烷氧基胺;硫醇;硫化物;亚砜;砜;磺酰基;磺胺;胺;n-氧化物;肼;酰肼;腙;叠氮化物;酰胺;脲;脒;胍;烯胺;酰亚胺;异氰酸酯;异硫氰酸酯;氰酸酯;硫氰酸酯;亚胺;硝基;腈(即,cn);等。
[0215]
取代的环基团诸如取代的环烷基、芳基、杂环基和杂芳基基团还包括环和稠环系,其中与氢原子的键被与碳原子的键置换。因此,取代的环烷基、芳基、杂环基和杂芳基基团也可以被如以下定义的取代或未取代的烷基、烯基和炔基基团取代。
[0216]
烷基基团包括具有1至约40个碳原子,例如1至约20个碳原子,诸如1至12个碳,或在一些实施方案中,1至8个、1至6个或1至4个碳原子的直链和支链烷基基团。烷基基团还包括如以下定义的环烷基基团。直链烷基基团的示例包括具有1至8个碳原子的那些,诸如甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基和正辛基基团。支链烷基基团的示例包括但不限于异丙基、异丁基、仲丁基、叔丁基、新戊基、异戊基和2,2-二甲基丙基基团。代表性的取代的烷基基团可以被诸如以上所列那些的取代基取代一次或多次。低级烷基可以被任选地取代并且包含1至12个碳,或在一些实施方案中,包含1至8个、1至6个或1至4个碳原子。
[0217]
环烷基基团是环状烷基基团,诸如但不限于环丙基、环丁基、环戊基、环己基、环庚基和环辛基基团。在一些实施方案中,环烷基基团具有3至8个环成员,而在其他实施方案中,环碳原子的数目范围为3至5、3至6或3至7。环烷基基团还包括单环、双环和多环环系,例如如以下所述的桥接环烷基基团,和诸如但不限于十氢化萘基的稠环等。在一些实施方案中,多环环烷基基团具有三个环。取代的环烷基基团可以被如以上所定义的非氢基团和非碳基团取代一次或多次。然而,取代的环烷基基团还包括被如以上所定义的直链或支链烷基取代的环。代表性的取代的环烷基基团可以被单取代或取代多于一次,诸如但不限于可以被诸如以上所列那些的取代基取代的2,2-二取代的、2,3-二取代的、2,4-二取代的、2,5-二取代的或2,6-二取代的环己基基团。
[0218]
芳基基团是不含杂原子的环状芳族烃。芳基基团包括单环、双环和多环环系。因此,芳基基团包括但不限于苯基、甘菊环基(azulenyl)、并环庚烯基(heptalenyl)、亚联苯基、引达省基(indacenyl)、芴基、菲基、三亚苯基、芘基、并四苯基(naphthacenyl,)、屈基(chrysenyl)、联苯基、蒽基、茚基、茚满基、并环戊烯基(pentalenyl)和萘基基团。在一些实施方案中,芳基在基团的环部分中含有6-14个碳,并且在其他实施方案中含有6至12个或甚至6-10个碳原子。尽管短语“芳基基团”包括含有稠环,诸如稠合芳香族-脂肪族环系的基团(例如,茚满基、四氢萘基等),但不包括有其他基团(诸如烷基或卤基基团)与环成员之一键
合的芳基基团。相反,诸如甲苯基的基团被称为取代的芳基基团。代表性的取代的芳基基团可以是单取代的或被取代多于一次。例如,单取代的芳基基团包括但不限于可以被诸如以上所列那些的取代基取代的2-取代的、3-取代的、4-取代的、5-取代的或6-取代的苯基或萘基基团。
[0219]
杂环基基团包括含有3个或更多个环成员的芳族(也称为杂芳基)和非芳族环化合物,其中一个或多个环成员为杂原子,诸如但不限于n、o和s。在一些实施方案中,杂环基基团包含3至20个环成员,而其他此类基团具有3至6个、3至10个、3至12个或3至15个环成员。杂环基基团涵盖不饱和的、部分饱和的和饱和的环系,例如咪唑基、咪唑啉基和咪唑烷基基团。短语“杂环基基团”包括稠环类,包括包含稠合芳族基团和非芳族基团的那些,例如苯并三唑基、2,3-二氢苯并[1,4]二噁英基和苯并[1,3]二氧杂环戊烯基。该短语还包括含有杂原子的桥接多环环系,诸如但不限于奎宁环基。然而,该短语不包括有其他基团(诸如烷基、氧代或卤基基团)与环成员之一键合的杂环基基团。相反,这些被称为“取代的杂环基基团”。杂环基基团包括但不限于氮丙啶基、氮杂环丁烷基、吡咯烷基、咪唑烷基、吡唑烷基、噻唑烷基、四氢噻吩基、四氢呋喃基、二氧杂环戊烯基、呋喃基、噻吩基、吡咯基、吡咯啉基、咪唑基、咪唑啉基、吡唑基、吡唑啉基、三唑基、四唑基、噁唑基、异噁唑基、噻唑基、噻唑啉基、异噻唑基、噻二唑基、噁二唑基、哌啶基、哌嗪基、吗啉基、硫吗啉基、四氢吡喃基、四氢噻喃基、氧硫杂环己烷基、二氧基、二噻烷基、吡喃基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、二氢吡啶基、二氢二硫杂环己二烯基(dihydrodithiinyl)、二氢二硫酮基(dihydrodithionyl)、高哌嗪基(homopiperazinyl)、喹啉环基(quinuclidyl)、吲哚基、吲哚啉基、异吲哚基、氮杂吲哚基(吡咯并吡啶基)、吲唑基、中氮茚基(indolizinyl)、苯并三唑基、苯并咪唑基、苯并呋喃基、苯并噻吩基、苯并噻唑基、苯并噁二唑基、苯并噁嗪基、苯并二硫杂环己二烯基(benzodithiinyl)、苯并氧硫杂环己二烯基(benzoxathiinyl)、苯并噻嗪基、苯并噁唑基、苯并噻唑基、苯并噻二唑基、苯并[1,3]二氧杂环戊烯基、吡唑并吡啶基、咪唑并吡啶基(氮杂苯并咪唑基)、三唑并吡啶基、异噁唑并吡啶基、嘌呤基、黄嘌呤基、腺嘌呤基、鸟嘌呤基、喹啉基、异喹啉基、喹嗪基、喹喔啉基、喹唑啉基、噌啉基、酞嗪基、萘啶基、蝶啶基、硫萘基、二氢苯并噻嗪基、二氢苯并呋喃基、二氢吲哚基、二氢苯并二氧杂环己烯基、四氢吲哚基、四氢吲唑基、四氢苯并咪唑基、四氢苯并三唑基、四氢吡咯并吡啶基、四氢吡唑并吡啶基、四氢咪唑并吡啶基、四氢三唑并吡啶基和四氢喹啉基。代表性的取代的杂环基基团可以被单取代或取代多于一次,诸如但不限于被诸如以上所列那些的各种取代基2-取代、3-取代、4-取代、5-取代或6-取代的或二取代的吡啶基或吗啉基基团。
[0220]
杂芳基基团是含有5个或更多个环成员的芳族环化合物,其中一个或多个环成员是杂原子,诸如但不限于n、o和s。杂芳基基团包括但不限于诸如以下的基团:吡咯基、吡唑基、三唑基、四唑基、噁唑基、异噁唑基、噻唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、噻吩基、苯并噻吩基、呋喃基、苯并呋喃基、吲哚基、氮杂吲哚基(吡咯并吡啶基)、吲唑基、苯并咪唑基、咪唑并吡啶基(氮杂苯并咪唑基)、吡唑并吡啶基、三唑并吡啶基、苯并三唑基、苯并噁唑基、苯并噻唑基、苯并噻二唑基、咪唑并吡啶基、异噁唑并吡啶基、硫萘基、嘌呤基、黄嘌呤基、腺嘌呤基、鸟嘌呤基、喹啉基、异喹啉基、四氢喹啉基、喹喔啉基和喹唑啉基基团。尽管短语“杂芳基基团”包括稠环化合物,诸如吲哚基和2,3-二氢吲哚基,但该短语不包括有其他基团(诸如烷基基团)与环成员之一键合的杂芳基基团。相反,具有此类取代的杂芳基基团被称
为“取代的杂芳基基团”。代表性的取代的杂芳基基团可以被诸如以上所列那些的各种取代基取代一次或多次。
[0221]
烷氧基基团是其中与氢原子的键被与如以上所定义的取代或未取代的烷基基团的碳原子的键置换的羟基基团(-oh)。直链烷氧基基团的示例包括但不限于甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基等。支链烷氧基具有的示例包括但不限于异丙氧基、仲丁氧基、叔丁氧基、异戊氧基、异己氧基等。环烷氧基基团的示例包括但不限于环丙氧基、环丁氧基、环戊氧基、环己氧基等。代表性的取代的烷氧基基团可以被诸如以上所列那些的取代基取代一次或多次。
[0222]“羰基”是指二价基团-c(o)-,其等同于-c(=o)-。取代的羰基意指连接到原子并在其他价点连接到本文公开的部分(例如,任选取代的烷基、芳基、杂芳基等)的羰基。
[0223]
如本文所用的术语“胺”(或“氨基”)是指
–
nhr4和-nr5r6基团,其中r4、r5和r6独立地为氢或如本文所定义的取代或未取代的烷基、烯基、炔基、环烷基、芳基、芳烷基、杂环烷基或杂环基基团。在一些实施方案中,胺为nh2、甲基氨基、二甲基氨基、乙基氨基、二乙基氨基、丙基氨基、异丙基氨基、苯基氨基或苄基氨基。
[0224]“卤基”或“卤离子”或“卤素”是指氟、氯、溴和碘。在一些实施方案中,卤离子为f。
[0225]“任选取代的”是指选自该基团和该基团的经取代形式的基团。“取代的”基团是指被以下描述或定义的任何取代基取代的该基团。在一个实施方案中,取代基选自例如cf3、ocf3、卤基、卤代芳基、烷氧基、芳氧基、卤代烷氧基、二羟基、氨基羟基、羧基、酰胺基、磺氧基、磺酰基、卤代芳氧基、芳基、苄基、苄氧基、杂芳基、腈、c
1-c6烷基、c
1-c6烯基、c
1-c6炔基、c
3-c6环烷基、c
1-c6卤代烷基、c
1-c6卤代烯基、c
1-c6卤代炔基、c
3-c6卤代环烷基、c
6-c
10
芳基、c
3-c8环烷基、c
2-c
10
杂环基、c
1-c
10
杂芳基、-n3、硝基、-co2h或它们的c
1-c6烷基酯、以下描述或定义的官能团中的任一种或它们的组合。
[0226]“环状部分”是指环烷基、芳基、杂芳基或杂环基,其中的每一者可以任选地被取代。
[0227]“载体部分”是指连接到核苷酸的部分,该部分允许在例如偶联、氧化和脱保护步骤之后将载体锚定的寡核苷酸链从单体砌块(building block)及其他小分子试剂和副产物分开。载体部分包括固体载体部分和可溶性载体部分。
[0228]“固体载体部分”具有如在固相载体上进行的有机合成领域的技术人员所理解的其通常含义。适于合成寡核苷酸的许多不同的固体载体和制备方法由pon,1993,methods in molecular biology,第20卷:protocols for oligonucleotides and analogs,humana press给出,其以引用方式全文并入本文。具体而言,固体载体包括可控孔度玻璃或聚合物载体,诸如珠粒,包括聚乙酸乙烯酯或聚苯乙烯珠粒。
[0229]
如本文所用,“可溶性载体部分”意指下述载体部分:能够在某些条件或溶剂极性下选择性地溶解于溶剂体系中而在不同条件或不同溶剂极性下不溶于该溶剂体系且从溶液中沉淀出来并且允许通过沉淀从溶液中大量回收所有载体部分。可溶性载体的示例包括聚乙烯醇、peg、基于纤维素的聚合物、基于季戊四醇的载体、环糊精和环糊精衍生物、ajiphase锚、基于(金刚烷-1-基)乙酰基的载体、咪唑鎓离子标签、ass+z-acss载体、基于季戊四醇的四足载体、四(三唑基苯基)-金刚烷衍生载体。
[0230]“接头”是指分子中的化学部分,该化学部分包含将一个部分或分子连接到另一
个,例如核苷酸/核苷或寡核苷酸的共价键或原子链。“可裂解接头”是指可以在指定条件下裂解以允许固体载体从试剂的其余部分释放的接头。例如,接头在寡核苷酸合成条件下是稳定的,但是对用于使合成寡核苷酸脱保护的条件(例如,在氢氧化铵中55℃或室温温育)不稳定。可裂解接头的示例可以包括但不限于酯、碳酸酯、二异丙基甲硅烷氧基醚、磷酸酯修饰等。
[0231]“核苷”是指由连接到天然β或α异头构型的糖(诸如核糖、阿拉伯糖、木糖和吡喃糖)的c-1'碳的核碱基组成的化合物。核苷可以包括天然存在的核苷,还有经修饰的核苷。糖可以是取代的或未取代的。取代的核糖的糖包括但不限于其中碳原子中的一个或多个碳原子例如2'-碳原子被相同或不同的cl、f、-r、-or、-nr2或卤素基团中的一者或多者取代,其中每个r独立地为x、c1-c6烷基或c5-c15芳基。核糖示例包括核糖、2'-脱氧核糖、2
′
,3
′‑
二脱氧核糖、2'-卤代核糖、2'-氟核糖、2'-氯核糖和2'-烷基核糖,例如2'-o-甲基、4'-α异头核苷酸、1'-α-异头核苷酸(asseline(1991)nucl.acids res.19:4067-74)、2'-4'-和3'-4'-连接的和其他“锁定”或“lna”、双环糖修饰(wo 98/22489;wo 98/39352;wo 99/14226)。糖包括在2'或3'位置的修饰,诸如甲氧基、乙氧基、烯丙氧基、异丙氧基、丁氧基、异丁氧基、甲氧基乙基、烷氧基、苯氧基、叠氮基、氨基、烷基氨基、氟、氯和溴。核苷和核苷酸包括天然d构型异构体(d型),以及l构型异构体(l型)(beigelman,美国专利第6,251,666号;chu,美国专利第5,753,789号;shudo,ep0540742;garbesi(1993)nucl.acids res.21:4159-65;fujimori(1990)j.amer.chem.soc.112:7435;urata,(1993)nucleic acids symposium ser.no.29:69-70)。当核碱基是嘌呤,例如a或g时,核糖糖通常连接到核碱基的n9位置。当核碱基是嘧啶,例如c、t或u时,戊糖糖通常连接到核碱基的n1-位置(kornberg and baker,(1992)dna replication,第2版,freeman,san francisco,calif.)。
[0232]“核苷酸”是指核苷的磷酸酯,作为单体单元或处于核酸或寡聚体内。“核苷酸5'-三磷酸”是指在5'位置具有三磷酸酯基团的核苷酸,并且有时表示为“ntp”或“dntp”和“ddntp”,以特别指出核糖糖的结构特征。三磷酸酯基团可以包括各种氧的硫取代,例如α-硫代核苷酸5'-三磷酸。有关核酸化学的综述,参见:shabarova,z.和bogdanov,a.advanced organic chemistry of nucleic acids,vch,new york,1994。核苷酸可以包括天然存在的核苷酸,还有经修饰的核苷酸。
[0233]
如本文所用,“寡核苷酸”是指核苷酸单体的单链和双链聚合物,包括通过核苷酸间磷酸二酯键,例如3'-5'和2'-5'反向键,例如3'-3'和5'-5'支链结构或核苷酸间类似物连接的2'-脱氧核糖核苷酸(dna)和核糖核苷酸(rna)。多核苷酸具有相关联的抗衡离子,诸如h+、nh4+、三烷基铵、mg2+、na+等。多核苷酸可以完全由脱氧核糖核苷酸组成,完全由核糖核苷酸组成,或由它们的嵌合混合物组成。多核苷酸可以由核碱基和糖类似物组成。多核苷酸通常大小范围为几个单体单元,例如当它们在本领域中更常被称为寡核苷酸时为5-40个单体单元,到几千个单体核苷酸单元。除非另外说明,否则每当表示多核苷酸序列时,应理解核苷酸从左到右是5’至3’的顺序并且“a”、“g”、“c”、“t”在dna中使用时分别表示脱氧腺苷、脱氧鸟苷、脱氧胞苷和胸苷,并且“a”、“g”、“c”、“u”在rna中使用时分别表示腺苷、鸟苷、胞苷和尿苷。
[0234]
本领域技术人员将会知道,本公开的化合物可以表现出互变异构、构象异构、几何异构和/或光学异构的现象。由于说明书和权利要求书内的化学式图可以仅表示可能的互
变异构、构象异构、光学异构或几何异构形式中的一种,因此应当理解,本公开涵盖具有本文所述的实用性中的一种或多种的化合物的任何互变异构、构象异构、光学异构和/或几何异构形式,以及这些不同形式的混合物。
[0235]“互变异构体”是指化合物的彼此平衡的异构形式。异构形式的浓度将取决于发现该化合物的环境,并且可以根据例如化合物是固体还是处于有机溶液或水溶液中而不同。例如,在水溶液中,吡唑可以表现出以下异构形式,这些异构形式称为彼此的互变异构体:
[0236][0237]
如本领域技术人员容易理解的,多种官能团和其他结构可以表现出互变异构,并且如本文所述的化合物的所有互变异构体均在本公开的范围内。
[0238]
除非明确指示特定立体化学结构,否则化合物的立体异构体(也称为“光学异构体”)包括结构的所有手性、非对映异构和外消旋形式。因此,本公开中使用的化合物包括在任何或所有不对称原子处富集或拆分的光学异构体,如从描述中显而易见的。外消旋和非对映异构混合物以及单独的光学异构体都可以分离或合成,使得基本上不含其对映体或非对映异构配偶体,并且这些全部在本公开的范围内。
[0239]“保护基”或“pg”意指适于醇和胺并且在本领域中是众所周知的任何保护基。非限制性示例包括2,2,2-三氯乙基碳酸酯(troc)、2-甲氧基乙氧基甲基醚(mem)、2-萘甲基醚(nap)、4-甲氧基苄基醚(pmb)、乙酸酯(ac)、苯甲酸酯(bz)、苄基醚(bn)、苄氧基甲基缩醛(bom)、苄氧基甲基缩醛(bom)、甲氧基甲基缩醛(mom)、甲氧基丙基缩醛(mop)、甲基醚、四氢吡喃基缩醛(thp)、三乙基甲硅烷基醚(tes)、三异丙基甲硅烷基醚(tips)、三甲基甲硅烷基醚(tms)、叔丁基二甲基甲硅烷基醚(tbs、tbdms)或叔丁基二苯基甲硅烷基醚(tbdps)。在1,2二醇或1,2-氨基醇的情况下,合适的保护基包括缩丙酮、苯甲醛缩醛或碳酸酯等。这些保护基和其他保护基是技术人员众所周知的,如green等人所证明的:greene's protective groups in organic synthesis,第四版,作者:peter g.m.wuts和theodora w.greene首次出版:2006年4月10日,2007john wiley&sons,inc,其公开内容以引用方式并入。
[0240]“脱保护”等意指通过技术人员已知的或green等人提出的任何常规手段来去除保护基。易于显而易见的是,用于脱保护的条件取决于使用的保护基。
[0241]“药学上可接受的”是指非生物学或其他方面不可取的材料,即该材料可以掺入给予患者的药物组合物中,而不会引起任何不良的生物效应或以有害的方式与包含该材料的组合物中的任何其他成分相互作用。当术语“药学上可接受的”用于指药用载体或赋形剂时,其意味着该载体或赋形剂符合所需的毒物学和制造检验标准,或意味着它包括在美国和药物管理局编制的《非活性成分指南》(inactive ingredient guide)内。
[0242]“经修饰的核苷”或“非天然核苷”是指独立地具有经修饰的糖部分和/或经修饰的核碱基的核苷。应当理解,核苷可通过亚基间的键连接,诸如磷酸二酯亚基间的键,硫代磷酸酯亚基间的键,氨基磷酸酯亚基间的键和硫代磷酰胺酯亚基间的键,“经修饰核苷”可以指一起的核苷和亚基间的键。
[0243]“未经修饰”或“天然”核碱基包括嘌呤碱腺嘌呤(a)和鸟嘌呤(g),以及嘧啶碱胸腺
嘧啶(t)、胞嘧啶(c)和尿嘧啶(u)。“经修饰的”或“非天然”核碱基包括其他合成和天然核碱基,诸如5-甲基胞嘧啶(5-me-c),5-羟甲基胞嘧啶,黄嘌呤,次黄嘌呤,2-氨基腺嘌呤,腺嘌呤和鸟嘌呤的6-甲基和其他烷基衍生物,腺嘌呤和鸟嘌呤的2-丙基和其他烷基衍生物,2-硫代尿嘧啶、2-硫代胸腺嘧啶和2-硫代胞嘧啶,5-卤代尿嘧啶和胞嘧啶,5-丙炔基(-c≡c-ch3)尿嘧啶和胞嘧啶以及嘧啶碱的其他炔基衍生物,6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶,5-尿嘧啶(假尿嘧啶),4-硫代尿嘧啶,8-卤代、8-氨基、8-硫醇、8-硫代烷基、8-羟基和其他8-取代的腺嘌呤和鸟嘌呤,5-卤代(具体地5-溴)、5-三氟甲基和其他5-取代的尿嘧啶和胞嘧啶,7-甲基鸟嘌呤和7-甲基腺嘌呤,2-f-腺嘌呤,2-氨基-腺嘌呤,8-氮杂鸟嘌呤和8-氮杂腺嘌呤,7-脱氮鸟嘌呤和7-脱氮腺嘌呤以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。另外的经修饰核碱基包括三环嘧啶诸如吩噁嗪胞苷(1h-嘧啶并[5,4-b][1,4]苯并噁嗪-2(3h)-酮)、吩噻嗪胞苷(1h-嘧啶并[5,4-b][1,4]苯并噻嗪-2(3h)-酮)、g形钳诸如取代的吩噁嗪胞苷(例如,9-(2-氨基乙氧基)-h-嘧啶并[5,4-b][1,4]苯并噁嗪-2(3h)-酮)、咔唑胞苷(2h-嘧啶并[4,5-b]吲哚-2-酮)、吡啶并吲哚胞苷(h-吡啶并[3,2,5]吡咯并[2,3-d]嘧啶-2-酮)。经修饰核碱基还可包括其中嘌呤或嘧啶碱基被其他杂环取代的那些,例如,7-脱氮腺嘌呤、7-脱氮鸟嘌呤、2-氨基吡啶和2-吡啶酮。
[0244]
在一些实施方案中,经修饰核碱基选自5-甲基胞嘧啶、2,6-二氨基嘌呤、5-甲基尿嘧啶和g形钳。在一些实施方案中,g形钳为
[0245][0246]“构象受限的核苷”是指具有桥连或双环糖结构的核苷,其中核苷的构象可被固定在特定构型中。例如,构象受限的核苷包括具有固定的c3’‑
内切糖起皱的那些。示例性实施方案包括桥接的核酸(bna),例如,2’,4
’‑
bna核苷诸如α-l-亚甲氧基(4
′‑
ch
2-o-2
′
)lna、β-d-亚甲氧基(4
′‑
ch
2-o-2
′
)lna、亚乙氧基(4
′‑
(ch2)
2-o-2
′
)ena、2’,4
’‑
bna
nc
[nh]、2’,4
’‑
bna
nc
[nme]、2’,4
’‑
bna
nc
[nbn]、氨基氧基(4
′‑
ch2—o—n(r)-2
′
)bna和氧基氨基(4
′‑
ch2—n(r)—o-2
′
)bna。其他示例性bna结构包括但不限于在糖的4’位置与2'位置之间具有至少一个桥的寡核苷酸,其中这些桥中的每个桥独立地包含1个或2至4个独立地选自以下的连接基团:—[c(r1)(r2)]n—、—c(r1)
═
c(r2)—、—c(r1)
═
n—、—c(
═
nr1)—、—c(
═
o)—、—c(
═
s)—、—o—、—si(r1)2—、—s(
═
o)
x
—和—n(r1)—;其中:x为0、1或2;n为1、2、3或4;每个r1和r2独立地为h、保护基、羟基、c
1-c
12
烷基、取代的c
1-c
12
烷基、c
2-c
12
烯基、取代的c
2-c
12
烯基、c
2-c
12
炔基、取代的c
2-c
12
炔基、c
5-c
20
芳基、取代的c
5-c
20
芳基、杂环基团、取代的杂环基团、杂芳基、取代的杂芳基、c
5-c7脂环族基团、取代的c
5-c7脂环族基团、卤素、oj1、nj1j2、sj1、n3、cooj1、酰基(c(
═
o)—h)、取代的酰基、cn、磺酰基(s(
═
o)
2-j1)或磺氧基(s(
═
o)-j1);并且每个j1和j2独立地为h、c
1-c
12
烷基、取代的c
1-c
12
烷基、c
2-c
12
烯基、取代的c
2-c
12
烯基、c
2-c
12
炔基、取代的c
2-c
12
炔基、c
5-c
20
芳基、取代的c
5-c
20
芳基、酰基(c(
═
o)—h)、取代的酰基、杂环基团、取代的杂环基团、c
1-c
12
氨基烷基、取代的c
1-c
12
氨基烷基或保护基。某些
bna已制备并且在专利文献以及科学文献中进行了公开(参见例如:发布的美国专利第7,053,207号;第6,268,490号;第6,770,748号;第6,794,499号;第7,034,133号;第6,525,191号;第7,696,345号;第7,569,575号;第7,314,923号;第7,217,805号;和第7,084,125号,这些专利特此以引用方式全文并入本文。“构象受限的核苷酸”是指通过亚基间的键连接的构象受限的核苷。
[0247]
在一些实施方案中,构象受限的核苷选自任选取代的lna或任选取代的ena。该任选取代的lna或ena可被烷基部分取代,例如在
–
ch2–
部分中的一个上的甲基或乙基。
[0248]
以下缩写用于该公开中。2
’‑
h(脱氧核糖)核苷用对应于核碱基的大写字母表示,例如a、c、g,并且t.2
’‑
oh(核糖)核苷用小写r和对应于核碱基的大写字母,例如ra、rc、rg和ru来表示。2
’‑
o-me核苷用小写m和对应于核碱基的大写字母,例如ma、mc、mg和mu来表示。2
’‑
moe核苷用小写的“moe”和对应于核碱基的大写字母,例如moea、moec、oeg和moeu来表示。2
’‑
ribo-f核苷用小写“f”和对应于核碱基的大写字母,例如fa、fc、fg和fu来表示。2
’‑
阿拉伯糖-f核苷用小写的“af”和对应于核碱基的大写字母,例如afa、afc、afg和afu来表示。ma*为3
’‑
氨基-2
’‑
ome-2,6-二氨基嘌呤。a*为3
’‑
氨基-2
’‑
脱氧-2,6-二氨基嘌呤。fa*为3
’‑
氨基-2
’‑
f-2,6-二氨基嘌呤。lna核苷用“l”和对应于核碱基的大写字母,例如la、lc、lg、lt来表示。
[0249]
对于核苷酸的主链或亚基间的键、磷酸二酯亚基间的键被称为“po”,或通常不包括在序列细节中;硫代磷酸酯亚基间的键缩写为小写的“ps”;氨基磷酸酯亚基间的键缩写为小写的“np”;并且硫代氨基磷酸酯亚基间的键缩写为小写的“nps”。
[0250]
n3
’→
p5’是指具有亚基间的键的经修饰的核苷酸,其中3’部分含有n(例如,nh)并且通过p连接。例如,以下结构具有n3
’→
p5’键:
[0251][0252]
在提供数值范围的情况下,应当理解,除非上下文另外清楚地指明,否则介于那个范围上限和下限之间的,以及在那个规定的范围内的任何其他规定或介于中间的值的每一个介于中间的值,直至下限单位的十分之一,涵盖在本公开内。这些较小范围的上限和下限可独立地被包括在较小范围内,并且也被涵盖在本公开内,但受到规定范围内的任何具体排除的限制。在所述范围包括限值之一或限值两者的情况下,排除这些包括的限值中的任一者或两者的范围也包括在本公开中。
[0253]
本公开不限于所述的具体实施方案,因为此类实施方案可以有差别。另外应当了解,本文所用的术语只是为了描述具体实施方案的目的,并不旨在进行限制,因为本公开的范围将仅由所附权利要求书来限定。
[0254]
如本领域技术人员在阅读本公开之后所显而易见的,本文所述和所示的单独实施方案中的每个具有分立组分和特征,在不背离本公开的范围或精神的前提下,该组分和特征可容易地与其他若干实施方案中的任一者的特征分开或组合。可按所述事件的次序或按
是o或s,x2是o或nh,并且xz可以与第二环稠合。
[0263]
根据本领域技术人员已知的方案,采用本领域技术人员已知的条件将式(1-iii)的苯甲酸酯水解,并且偶联至受保护的核苷的3'-oh,以提供式(1-v)的化合物,使该化合物在5'-oh下去封闭并进行延伸以提供式(1-vi)的完全受保护的寡核苷酸。
[0264]
通过膦处理或氢化,并且采用本领域技术人员已知的条件进行全局脱保护来选择性地裂解式(1-vi)寡核苷酸的载体,以提供式(1-vii)的寡核苷酸。
[0265]
方案2
[0266][0267]
根据方案2,采用本领域技术人员已知的条件,将可商购获得的或合成易得的式(2-i)的化合物烷基化以提供式(2-ii)的化合物,将该化合物水解并且酸化为式(2-iii)的苯甲酸。化合物(2-iii)的活化,接着与间隔区偶联导致形成式(2-v)的酯或酰胺。采用本领域技术人员已知的条件,化合物(2-v)与化合物(2-vii)偶联产生式(2-viii)的叠氮化物。式(2-viii)的苯甲酸酯水解提供式(2-ix)的可溶性载体,其中a为卤离子,以及活化的离去基团或甲磺酸根/甲苯磺酸根/三氟甲磺酸根,b为保护基或离去基团,k为亲核试剂或离去基团,ra和rc分别为烷基,rb为长链烷基(c10-c18),并且x、y和z分别选自ch和n,并且xz可以与第二环稠合。
[0268]
方案3
[0269][0270]
另选地,根据方案3,通过活化取代的甲苯,接着用叠氮化物盐置换,将叠氮基引入到可溶载体的完全构建的分子支架中。
[0271]
方案4
[0272][0273]
方案5
[0274]
[0275]
方案6
[0276]
单体的裂解:
[0277][0278]
二聚体的裂解:
[0279][0280]
四聚体的裂解:
[0281][0282]
实施例1:2-(叠氮甲基)-4-(4-(3,4,5-三(十八烷氧基)苯甲酰基)哌嗪-1-羰基)苯甲酸。
[0283][0284]
1.cmpd-001-2的合成
[0285][0286]
在室温下,在氮气惰性气氛下,向cmpd-001-1(39g,41mmol,1.0当量)在390ml乙醇中的溶液中添加氢氧化钾(23g,414.5mmol,10.0当量)。将所得溶液在80℃下搅拌3h并减压浓缩。用盐酸(1mol/l)将溶液的ph值调节到1-2,并将混合物在室温下搅拌1h。通过过滤收集固体,并且分别用乙腈、丙酮和乙醇洗涤。获得呈白色固体状的29g(76%)cmpd-001-2。1h nmr(300mhz,氯仿-d)δ7.35(s,2h),4.05(m,5h),3.60-3.31(m,1h),1.91-1.70(m,6h),1.50(m,6h),1.28(s,84h),0.96-0.86(m,9h)。
[0287]
2.cmpd-002-2的合成
[0288][0289]
在室温下,在氮气惰性气氛下,向cmpd-001-2(24g,25.9mmol,1.0当量)在200ml甲苯中的溶液中添加亚硫酰氯(9g,0.77mol,3.0当量)。将所得溶液在50℃下搅拌2h并减压浓缩。获得呈无色油状物的24g(粗制)cmpd-002-2。将其用于下一步骤,无需进一步纯化。
[0290]
3.cmpd-002-3的合成
[0291][0292]
在室温下,向cmpd-002-2(24g,25.4mmol,1.00当量)在240ml二氯甲烷中的溶液中添加三乙胺(12.8g,127mmol,5.0当量)和1-哌嗪羧酸叔丁酯(7.1g,38.1mmol,1.5当量)。将所得溶液在室温下搅拌过夜。用盐酸(4mol/l)将溶液的ph值调节到1~2,并将混合物在室温下搅拌1h。通过添加乙腈沉淀所得溶液。通过过滤收集固体,并且分别用乙腈、丙酮和甲醇洗涤。获得呈白色固体状的15g(68%,经两个步骤)cmpd-002-3。ms m/z[m+h]
+
(esi):982。1h nmr(300mhz,氯仿-d)δ10.14(s,1h),6.59(s,2h),3.98(m,10h),3.25(s,4h),1.79(m,6h),1.45-1.43(m,6h),1.28(m,84h),0.99-0.81(m,9h)。
[0293]
4.cmpd-003-21的合成
[0294][0295]
在室温下,向4-(甲氧基羰基)-3-甲基苯甲酸(6.00g,31mmol,1.0当量)在60ml氯
仿中的溶液中添加n-溴琥珀酰亚胺(6.05g,34mmol,1.10当量)和2,2'-偶氮双(2-甲基丙腈)(3.05g,18.6mmol,0.6当量)。将所得溶液在65℃下搅拌2h。然后冷却至室温并真空浓缩。将残余物通过快速制备hplc用以下条件纯化:柱,c18硅胶;流动相,水(含0.05%hcooh)和乙腈;检测器,uv 254nm。将级分用二氯甲烷稀释。将有机相经无水硫酸钠干燥,过滤并减压浓缩。获得呈灰白色固体状的6g(71%)cmpd-003-21。ms m/z[m-h]-(esi):271。
[0296]
5.cmpd-003-22的合成
[0297][0298]
在室温下,在氮气惰性气氛下,向cmpd-003-21(6g,22.1mmol,1.0当量)在60ml的n,n-二甲基甲酰胺中的溶液中依次添加三乙胺(6.7g,66.3mmol,3.0当量)和叠氮化钠(2.87g,44.2mmol,2.0当量)。将反应溶液在70℃下搅拌2h并浓缩。将残余物通过快速制备hplc用以下条件纯化:柱,c18硅胶;流动相,水(含0.05% hcooh)和乙腈(5%乙腈,最多至50%,15分钟内);检测器,uv 254nm。将级分用二氯甲烷稀释。将有机相经无水硫酸钠干燥,过滤并减压浓缩。获得呈灰白色固体状的4.2g(82%)cmpd-003-22。ms m/z[m-h]-(esi):234。1h nmr(300mhz,dmso-d6)δ13.42(s,1h),8.09(s,1h),8.01(s,2h),4.86(s,2h),3.89(s,3h)。
[0299]
6.cmpd-003-3的合成
[0300][0301]
在室温下,在氮气惰性气氛下,向cmpd-002-3(14.8g,14.9mmol,1.0当量)在150ml二氯甲烷中的溶液中依次添加cmpd-003-22(4.2g,17.8mmol,1.2当量)、4-二甲基氨基吡啶(3.66g,30.0mmol,2.0当量)和二环己基碳二亚胺(6.0g,30.0mmol,2.0当量)。将所得溶液在室温下搅拌6小时。通过添加乙腈沉淀所得溶液。通过过滤收集固体,并且分别用乙醇、乙腈洗涤。获得呈白色固体状的9.0g(60%)cmpd-003-3。ms m/z[m+h]
+
(esi):1213。1h nmr(300mhz,氯仿-d)δ8.09(d,j=8.0hz,1h),7.58(s,1h),7.44(d,j=8.0hz,1h),6.60(s,2h),4.89(s,2h),4.00-3.93(m,8h),3.70(m,5h),3.53-3.39(m,2h),1.86-1.66(m,8h),1.46(m,6h),1.27(m,84h),0.89(m,9h)。
[0302]
7.cmpd-003-0的合成
[0303]
[0304]
在室温下,在氮气惰性气氛下,向cmpd-003-0(9g,7.4mmol,1.0当量)在90ml四氢呋喃/水(5:1)中的溶液中添加氢氧化锂(7.12g,29.7mmol,4.0当量)。将所得溶液在室温下搅拌过夜。通过添加乙腈沉淀所得溶液。用盐酸(1mol/l)将溶液的ph值调节到2,并将混合物在室温下搅拌1h。通过过滤收集固体,并且分别用水、乙腈和乙腈洗涤。将固体在真空下在40℃下干燥24h。获得呈白色固体状的7.5g(84%)cmpd-003-0。ms m/z[m-h]-(esi):1197 1
h nmr(300mhz,氯仿-d)δ7.87(s,1h),7.28(s,2h),6.61(s,2h),4.58(s,1h),4.08-3.86(m,6h),3.54(d,j=61.9hz,6h),2.09(d,j=37.9hz,3h),1.79(d,j=12.1hz,7h),1.44(s,6h),1.40-1.18(m,84h),0.95-0.86(m,9h)。
[0305]
实施例2:2-(叠氮甲基)-4-(2-(n-甲基-3,4,5-三(十八烷氧基)苯甲酰胺基)乙氧基)苯甲酸。
[0306][0307]
步骤a.n-(2-羟乙基)-n-甲基-3,4,5-三(十八烷氧基)苯甲酰胺。
[0308][0309]
向i(5.0g)中添加n-甲基乙醇胺(60ml),并将所得混合物在130℃下搅拌整个周末。nmr分析显示完成不到一半,并将反应温度升高至回流(180℃浴)。然后将反应冷却至室温并且添加dcm(150ml),并将混合物在室温下搅拌。通过过滤收集固体即回收的i,并且通过添加meoh沉淀母液。收集固体并用甲醇洗涤,得到3.4g的90% nmr纯度的ii。
[0310]
步骤b.2-甲基-4-(2-(n-甲基-3,4,5-三(十八烷氧基)苯甲酰胺基)乙氧基)苯甲酸甲酯。
[0311][0312]
向溶解于dcm(10ml)中并且在0℃下搅拌的ii(1.0g)、苯酚(0.36ml)和tpp(0.53g)中添加在甲苯(0.93ml)中的40重量%dead,并将所得混合物在室温下搅拌过夜。通过硅胶柱色谱法(etoac/己烷,0-30%)分离反应混合物,得到0.31g的iii。
[0313]
另选地,向溶解于dcm(5ml)中并且在0℃下搅拌的ii(0.5g)、苯酚(0.17g)和tbp(0.25ml)中添加在甲苯(0.46ml)中的40重量%dead,并将所得混合物在室温下搅拌过夜。通过添加meoh使产物沉淀出来。收集固体并用甲醇洗涤,得到0.25g的iii。
[0314]
步骤c.2-(溴甲基)-4-(2-(n-甲基-3,4,5-三(十八烷氧基)苯甲酰胺基)乙氧基)苯甲酸甲酯。
[0315][0316]
向溶解于ccl4(4ml)中的iii(0.58g)和nbs(0.1g)中添加aibn(0.05g),并将反应在65℃下搅拌3h。tlc显示几乎完成反应。向反应中添加ch3cn(15ml),并且将混合物搅拌15min。收集固体并且通过硅胶柱色谱法(etoac/己烷,0%-30%)分离,得到0.24g产物iv。
[0317]
步骤d.2-(叠氮基甲基)-4-(2-(n-甲基-3,4,5-三(十八烷氧基)苯甲酰胺基)乙氧基)苯甲酸甲酯。
[0318][0319]
将iv(0.31g)和nan3(83mg)在乙醇(3ml)中的混合物在70℃下搅拌过夜。将反应冷却至室温并添加甲醇(10ml)。通过过滤收集沉淀的固体,并用水(3ml)和甲醇洗涤,得到0.19g粗产物v,并且将一小份v的样品用php
3-h2o处理以形成支持分配结构的vi。
[0320]
步骤e.2-(叠氮甲基)-4-(2-(n-甲基-3,4,5-三(十八烷氧基)苯甲酰胺基)乙氧基)苯甲酸。
[0321][0322]
向在thf(5ml)中的v(0.19g)中添加1m lioh(1.62ml),并将反应在室温下搅拌过夜。蒸发挥发物,并将残余物溶解于有限量的dcm中,并且添加meoh,并且通过过滤收集沉淀的固体,并用0.1n hcl(3ml)和甲醇洗涤,以得到44mg产物。
[0323][0324]
实施例3:可溶性载体的温和裂解和5-(4-(3,4,5-三(十八烷氧基)苯甲酰基)哌嗪-1-羰基)异吲哚啉-1-酮的形成。
[0325][0326]
步骤a.(2r,3r,4r,5r)-5-(4-苯甲酰胺基-2-氧嘧啶-1(2h)-基)-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-甲氧基四氢呋喃-3-基-2-(叠氮甲基)-4-(4-(3,4,5-三(十八烷氧基)苯甲酰基)哌嗪-1-羰基)苯甲酸酯。
[0327][0328]
在室温下,在ar惰性气氛下向cmpd-003-0(500mg,0.42mmol,1.0当量)在5ml氯仿/乙腈(10/1,v/v)中的溶液中依次添加cmpd-001-10(553mg,0.84mmol,2.0当量)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(120mg,0.63mmol,1.5当量)和4-二甲基氨基吡啶
(77mg,0.63mmol,1.5当量)。将所得溶液在室温下搅拌过夜。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。获得呈白色固体状的400mg(70%收率)cmpd-003-100。ms m/z[m-h]-(esi):1843。
[0329]
步骤b.5-(4-(3,4,5-三(十八烷氧基)苯甲酰基)哌嗪-1-羰基)异吲哚啉-1-酮。
[0330][0331]
在室温下,在ar惰性气氛下,向cmpd-003-100(100mg,0.05mmol,1.0当量)在1ml二噁烷/水(9/1,v/v)中的溶液中添加三苯基膦(57mg,0.2mmol,4.0当量)。将反应溶液在室温下搅拌过夜。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。分别用乙腈、丙酮和甲醇洗涤固体。获得呈灰白色固体状的50mg(80%收率)去除碎片。ms m/z[m+h]+(esi):1155。1h nmr(300mhz,氯仿-d)δ7.96(d,j=7.7hz,1h),7.58(s,1h),7.52(d,j=7.9hz,1h),6.62(m,3h),4.52(s,2h),3.98(m,6h),3.68(m,8h),1.83-1.76(m,6h),1.50-1.44(m,6h),1.28(m,84h),0.89(m,9h)。
[0332]
实施例4:可溶性载体的温和裂解和o-(((2r,3r,4r,5r)-5-(4-苯甲酰胺基-2-氧嘧啶-1(2h)-基)-3-羟基-4-甲氧基四氢呋喃-2-基)甲基)o-((2r,3r,4r,5r)-5-(6-苯甲酰胺基-9h-嘌呤-9-基)-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-甲氧基四氢呋喃-3-基)o-(2-氰基乙基)硫代磷酸酯的形成。
[0333][0334]
步骤a.(2r,3r,4r,5r)-5-(4-苯甲酰胺基-2-氧嘧啶-1(2h)-基)-2-(羟甲基)-4-甲氧基四氢呋喃-3-基2-(叠氮甲基)-4-(4-(3,4,5-三(十八烷氧基)苯甲酰基)哌嗪-1-羰基)苯甲酸酯。
[0335][0336]
向cmpd-003-100(200mg,0.11mmol,1.0当量)在2ml二氯甲烷中的溶液中添加0.12ml二氯乙酸。将所得溶液在25℃下搅拌1h。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。获得呈灰白色固体状的150mg(90%)cmpd-003-101。ms m/z[m+h]+(esi):1543。
[0337]
步骤b.(2r,3r,4r,5r)-5-(4-苯甲酰胺基-2-氧嘧啶-1(2h)-基)-2-((((((2r,3r,4r,5r)-5-(6-苯甲酰胺基-9h-嘌呤-9-基)-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-甲氧基四氢呋喃-3-基)氧基)(2-氰基乙氧基)膦酰基)氧基)甲基)-4-甲氧基四氢呋喃-3-基2-(叠氮基甲基)-4-(4-(3,4,5-三(十八烷氧基)苯甲酰基)哌嗪-1-羰基)苯甲酸酯。
[0338][0339]
cmpd-003-101通过与无水吡啶和无水甲苯重复进行共蒸发来干燥。在室温下,在ar惰性气氛和3a分子筛下向cmpd-003-101(150mg,0.1mmol,1.0当量)在1.5ml二氯甲烷中的溶液中依次添加在0.1ml乙腈中的(2r,3r,4r,5r)-5-(6-苯甲酰胺基-9h-嘌呤-9-基)-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-甲氧基四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(133mg,0.15mmol,1.5当量)和5-(乙硫基)-1h-四唑(39mg,0.3mmol,3.0当量)。将所得溶液在室温下搅拌1.5h,并且无需进一步纯化即可用于下一步骤。
[0340]
步骤c.(2r,3r,4r,5r)-5-(4-苯甲酰胺基-2-氧嘧啶-1(2h)-基)-2-((((((2r,3r,4r,5r)-5-(6-苯甲酰胺基-9h-嘌呤-9-基)-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-甲氧基四氢呋喃-3-基)氧基)(2-氰基乙氧基)硫代磷酰基)氧基)甲基)-4-甲氧基四氢呋喃-3-基2-(叠氮基甲基)-4-(4-(3,4,5-三(十八烷氧基)苯甲酰基)哌嗪-1-羰基)苯甲酸酯。
[0341][0342]
在室温下,在ar惰性气氛和3a分子筛下向cmpd-003-102(0.1mmol,1.0当量)的所得溶液中依次添加吡啶(80mg,1.0mmol,10.0当量)和氢化黄原素(75mg,0.5mmol,5.0当量)。将所得溶液在室温下搅拌1.5h。过滤所得溶液并通过添加乙腈使其沉淀,并且通过过滤收集固体。获得呈白色固体状的206mg(90%,经两个步骤)cmpd-003-103。ms m/z[m/2+h]
+
(esi):1180。
[0343]
步骤d.o-(((2r,3r,4r,5r)-5-(4-苯甲酰胺基-2-氧嘧啶-1(2h)-基)-3-羟基-4-甲氧基四氢呋喃-2-基)甲基)o-((2r,3r,4r,5r)-5-(6-苯甲酰胺基-9h-嘌呤-9-基)-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-甲氧基四氢呋喃-3-基)o-(2-氰基乙基)硫代磷酸酯和5-(4-(3,4,5-三(十八烷氧基)苯甲酰基)哌嗪-1-羰基)异吲哚啉-1-酮。
[0344][0345]
在室温下,在ar惰性气氛下,向cmpd-003-103(100mg,0.05mmol,1.0当量)在1ml二噁烷/水(9/1,v/v)中的溶液中添加三苯基膦(57mg,0.2mmol,4.0当量)。将反应溶液在室温下搅拌过夜。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。分别用乙腈、丙酮和甲醇洗涤固体。获得呈灰白色固体状的40mg(80%)去除碎片。ms m/z[m+h]
+
(esi):1155。
[0346]
cmpd-003-120(6-iv-2)从可溶性载体的裂解以与cmpd-003-103的裂解相似的方式实现。
[0347]
实施例5:完全受保护的gcac-css
[0348][0349]
1.cmpd-003-100的合成
[0350][0351]
在室温下,在氩气惰性气氛下向cmpd-003-0(3.2g,2.67mmol,1.0当量)在320ml氯仿/乙腈(10/1,v/v)中的溶液中按顺序添加cmpd-001-10(3.5g,5.34mmol,2.0当量)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(0.76g,4.00mmol,1.5当量)和4-二甲基氨基吡啶(0.49mg,4.00mmol,1.5当量))将所得溶液在室温下搅拌过夜。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。获得呈白色固体状的3.2g(65%)cmpd-003-100。[m/2+h]
+
(esi):923。
[0352]
2.cmpd-003-101的合成
[0353][0354]
在室温下,向cmpd-003-100(3.2g,1.73mmol,1.0当量)在320ml二氯甲烷中的溶液中依次添加19.2ml的二氯乙酸和三乙基硅烷(0.5g,5.32mmol,2.5当量)。将所得溶液在25℃下搅拌1h。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。获得呈灰白色固体状的2.5g(93%)cmpd-003-101。ms m/z[m+h]
+
(esi):1543。
[0355]
3.cmpd-003-102的合成
[0356][0357]
cmpd-003-101通过与无水吡啶和无水甲苯重复进行共蒸发来干燥。在室温下,在氩气惰性气氛和3a分子筛下向cmpd-003-101(2.5g,1.62mmol,1.0当量)在25ml二氯甲烷中的溶液中依次添加在2.5ml乙腈中的(2r,3r,4r,5r)-5-(6-苯甲酰胺基-9h-嘌呤-9-基)-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-甲氧基四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(2.87g,3.24mmol,2当量)和5-(乙硫基)-1h-四唑(0.6g,4.86mmol,3.0当量)。将所得溶液在室温下搅拌3h,并且无需进一步纯化即可用于下一步骤。
[0358]
4.cmpd-003-103的合成
[0359][0360]
在室温下,在ar惰性气氛和3a分子筛下向cmpd-003-102(1.62mmol,1.0当量)的所得溶液中依次添加吡啶(96mg,16.0mmol,10.0当量)和氢化黄原素(1.2g,0.5mmol,5.0当
量)。将所得溶液在室温下搅拌1h。过滤所得溶液并通过添加乙腈使其沉淀,并且通过过滤收集固体。获得呈白色固体状的2.4g(65%,经两个步骤)cmpd-003-103。ms m/z[m/2+h]
+
(esi):1181。
[0361]
5.cmpd-003-114的合成
[0362][0363]
向cmpd-003-103(2.4g,1.0mmol,1.0当量)在240ml二氯甲烷中的溶液中添加14.4ml的二氯乙酸和三乙基硅烷(0.29g,2.5mmol,2.5当量)。将所得溶液在25℃下搅拌1h。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。获得呈灰白色固体状的1.8g(90%)cmpd-003-114。ms m/z[m/2+h]+(esi):1030。
31
p nmr(121mhz,dmso-d6)δ68.11,67.68。
[0364]
6.cmpd-003-115的合成
[0365][0366]
cmpd-003-114通过与无水吡啶和无水甲苯重复进行共蒸发来干燥。在室温下,在ar惰性气氛和3a分子筛下向cmpd-003-114(1.8g,0.87mmol,1.0当量)在18ml二氯甲烷中的溶液中依次添加在1.8ml乙腈中的(2r,3r,4r,5r)-5-(4-乙酰胺基-2-氧嘧啶-1(2h)-基)-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-氟四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(1.38g,17.5mmol,2当量)和5-(乙硫基)-1h-四唑(0.34g,2.62mmol,3.0当量)。将所得溶液在室温下搅拌3h,并且无需进一步纯化即可用于下一步骤。
[0367]
7.cmpd-003-116的合成
[0368][0369]
在室温下,在氩气惰性气氛下向cmpd-003-115(0.87mmol,1.0当量)的所得溶液中添加叔丁基过氧化氢(0.56g,4.35mmol,5.0当量)。将所得溶液在室温下搅拌1h。过滤所得溶液并通过添加乙腈使其沉淀,并且通过过滤收集固体。获得呈白色固体状的1.8g(75%,经两个步骤)cmpd-003-116。ms m/z[m/2+h]+(esi):1382。
[0370]
8.cmpd-003-117的合成
[0371][0372]
在室温下,向cmpd-003-116(1.8g,0.65mmol,1.0当量)在18ml二氯甲烷中的溶液中依次添加1.08ml的二氯乙酸和三乙基硅烷(0.19g,1.62mmol,2.5当量)。将所得溶液在25℃下搅拌1h。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。获得呈灰白色固体状的1.5g(94%)cmpd-003-117。ms m/z[m/2+h]
+
(esi):1231。
31
p nmr(121mhz,dmso-d6)δ67.78,67.71,67.38,67.21,-2.26,-2.50。
[0373]
9.cmpd-003-118的合成
[0374][0375]
cmpd-003-117通过与无水吡啶和无水甲苯重复进行共蒸发来干燥。在室温下,在氩气惰性气氛和3a分子筛下向cmpd-003-117(1.5g,0.61mmol,1.0当量)在15ml二氯甲烷中的溶液中依次添加在1.5乙腈中的(2r,3r,4r,5r)-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基))-5-(2-异丁酰胺基-6-氧代-1,6-二氢-9h-嘌呤-9-基)-4-甲氧基四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(1.06g,1.2mmol,2当量)和5-(乙硫基)-1h-四唑(0.24g,1.83mmol,3.0当量)。将所得溶液在室温下搅拌3h,并且无需进一步纯化即可用于下一步骤。
[0376]
10.cmpd-003-119的合成
[0377][0378]
在室温下,在氩气惰性气氛下向cmpd-003-118(0.61mmol,1.0当量)的所得溶液中添加叔丁基过氧化氢(0.39g,3.05mmol,5.0当量)。将所得溶液在室温下搅拌1h。过滤所得溶液并通过添加乙腈使其沉淀,并且通过过滤收集固体。获得呈白色固体状的1.4g(75%,经两个步骤)cmpd-003-119。ms m/z[m/2+h]
+
(esi):1624。
31
p nmr(121mhz,dmso-d6)δ67.53,-2.91,-3.14。
[0379]
实施例6:gcac-css的裂解和全局脱保护
[0380]
选项a:首先裂解叠氮甲基联接,然后去dmt,接着进行氰基乙基和碱基保护基的标准氨脱保护,以提供最终四聚体。
[0381][0382]
1.cmpd-003-200的合成
[0383][0384]
在室温下,在氩气惰性气氛下,向cmpd-003-119(200mg,0.06mmol,1.0当量)在2ml二噁烷/水(9/1,v/v)中的溶液中添加三苯基膦(65mg,0.25mmol,4.0当量)。将反应溶液在室温下搅拌过夜。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。将有机相减压浓缩。将残余物通过快速制备hplc用以下条件纯化:柱,c18硅胶;流动相,水(含0.04% nh4hco3)和乙腈(20%乙腈,最多至100%,15分钟内);检测器,uv 254nm。获得呈白色固体状的100mg(82%)cmpd-003-200。ms m/z[m/2+h]
+
(esi):1033。
[0385]
通过以下条件进行的另选裂解条件:
[0386][0387]
d:环己二烯(10当量)、pd/c(50%,w/w)、thf(50ml/g),室温过夜,sm消失,75% cmpd-003-201,对于20mg规模在sfc-ms中有7%去dmtr离子信号。
[0388]
2.cmpd-003-201的合成
[0389][0390]
向cmpd-003-200(100mg,0.05mmol,1.0当量)在1ml二氯甲烷中的溶液中添加0.03ml的二氯乙酸和三乙基硅烷(14mg,0.12mmol,2.5当量)。将所得溶液在25℃下搅拌1h。将所得溶液溶解于20ml二氯甲烷中,分别用2
×
10ml饱和碳酸氢钠水溶液和1
×
10ml饱和氯化钠水溶液洗涤。获得呈白色固体状的70mg(82%)cmpd-003-200。将其用于下一步骤,无需进一步纯化。ms m/z[m+h]
+
(esi):1764。
[0391]
3.cmpd-003-202的合成
[0392][0393]
向cmpd-003-201(70mg,0.04mmol,1.0当量)的溶液中添加1ml的nh3h2o/二噁烷(v/v=1/1)。将所得溶液在25℃下搅拌过夜。将所得溶液减压浓缩。通过添加二氯甲烷沉淀所得溶液,并且通过过滤收集固体。获得呈白色固体状的20mgcmpd-003-200。ms m/z[m+h]
+
(esi):1282。
[0394]
选项b:首先进行去dmt,然后裂解叠氮甲基联接,接着进行氰基乙基和碱基保护基的标准氨脱保护以提供最终四聚体。
[0395][0396]
1.cmpd-003-300的合成
[0397][0398]
向cmpd-003-119(200mg,0.06mmol,1.0当量)在2ml二氯甲烷中的溶液中添加0.03ml的二氯乙酸和三乙基硅烷(15mg,0.15mmol,2.5当量)。将所得溶液在25℃下搅拌1h。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。获得呈白色固体状的140mg(78%)cmpd-003-300。ms m/z[m/2+h]
+
(esi):1472。
[0399]
3.cmpd-003-201的合成
[0400][0401]
在室温下,在ar惰性气氛下,向cmpd-003-119(140mg,0.05mmol,1.0当量)在1.5ml二噁烷/水(9/1,v/v)中的溶液中添加三苯基膦(52mg,0.20mmol,4.0当量)。将反应溶液在室温下搅拌过夜。通过添加乙腈沉淀所得溶液,并且通过过滤收集固体。将有机相减压浓缩。将残余物通过快速制备hplc用以下条件纯化:柱,c18硅胶;流动相,水(含0.04% nh4hco3)和乙腈(20%乙腈,最多至100%,15分钟内);获得呈白色固体状的50mg(60%)cmpd-003-201。ms m/z[m+h]
+
(esi):1762。
[0402]
4.cmpd-003-202的合成
[0403][0404]
向cmpd-003-201(50mg,0.03mmol,1.0当量)的溶液中添加1ml的nh3`h2o/二噁烷(v/v=1/1)。将所得溶液在25℃下搅拌过夜。将所得溶液减压浓缩。通过添加二氯甲烷沉淀所得溶液,并且通过过滤收集固体。获得呈白色固体状的20mgcmpd-003-200。ms m/z[m+h]
+
(esi):1282。
[0405]
实施例7:五聚体寡核苷酸的5'-胆固醇缀合物的合成
[0406]
[0407]
1.cmpd-004-002
[0408][0409]
cmpd-004-001通过分别与吡啶共蒸发三次,与甲苯共蒸发三次来干燥。在室温下,在氩气惰性气氛和3a分子筛下向cmpd-004-001(50mg,0.015mmol,1.0当量)在0.5ml二氯甲烷中的溶液中添加在二氯甲烷(0.1ml)中的5'-胆固醇基-teg亚磷酰胺(24.7mg,0.03mmol,2.0当量)和4,5-二氰基咪唑(2.67mg,0.02mmol,1.5当量)。将反应溶液在室温下搅拌4h。然后将其用于下一步骤,无需进一步纯化。
[0410]
2.cmpd-004-003
[0411][0412]
在室温下,在氩气惰性气氛下向cmpd-004-002的所得溶液中添加叔丁基过氧化氢(2.7mg,0.03mmol,2.0当量)。将所得溶液在室温下搅拌30min。通过过滤去除3a分子筛,并且通过添加乙腈沉淀滤液。通过过滤收集固体。
[0413]
3.cmpd-004-004
[0414][0415]
在室温下,在氩气惰性气氛下,向cmpd-004-003(50mg,0.012mmol,1.0当量)在1.0ml二噁烷/水(10/1,v/v)中的溶液中添加三苯基膦(13mg,0.05mmol,4.0当量)。将反应溶液在室温下搅拌过夜并通过lcms进行监测。将粗产物在c18柱上用乙腈/水通过快速制备hplc纯化。
[0416]
4.cmpd-004-005
[0417][0418]
在室温下,在氩气惰性气氛下将cmpd-004-004(50mg,0.017mmol,1当量)在0.5ml氢氧化铵/二噁烷(1/1,v/v)中的溶液搅拌12h。通过lcms监测反应。ms m/z[m+h]
+
(esi):
[0419]
实施例8:五聚体寡核苷酸的3'-胆固醇缀合物的合成
[0420][0421]
1.cmpd-005-002
[0422][0423]
cmpd-005-001通过分别与吡啶共蒸发三次,与甲苯共蒸发三次来干燥。在室温下,在氩气惰性气氛和3a分子筛下向cmpd-005-001(50mg,0.02mmol,1.0当量)在1ml二氯甲烷中的溶液中添加5'-胆固醇基-teg亚磷酰胺(33mg,0.04mmol,2.0当量)和4,5-二氰基咪唑(7.1mg,0.06mmol,3.0当量)。将反应溶液在室温下搅拌4h,并且无需进一步纯化即可用于下一步骤。ms m/z[m/2+h]
+
(esi):1640
[0424]
2.cmpd-005-003
[0425][0426]
在室温下,在氩气惰性气氛下向cmpd-005-002(0.02mmol,1.0当量)的所得溶液中添加叔丁基过氧化氢(13mg,0.1mmol,5.0当量)。将所得溶液在室温下搅拌30min。3a分子筛保留在反应系统中,并且在氧化后通过第一次过滤去除。通过添加叔丁基甲基醚来沉淀滤液,过滤。获得呈白色固体状的ph-cmpd-005-003。ms m/z[m/2+h]
+
(esi):1648
[0427]
3.cmpd-005-004
[0428][0429]
向cmpd-005-003(37mg,0.011mmol,1.0当量)在1ml二氯甲烷中的溶液中添加0.03ml的二氯乙酸和三乙基硅烷(3.2mg,0.027mmol,2.5当量)。将所得溶液在室温下搅拌1h。将所得溶液通过叔丁基甲基醚沉淀,并且通过过滤收集固体。获得呈白色固体状的cmpd-005-004。ms m/z[m/2+h]
+
(esi):1496。
[0430]
4.cmpd-005-005
[0431][0432]
将cmpd-005-004(0.008mmol,1.0当量)在3ml氢氧化铵中的混合物在室温下搅拌过夜并用3
×
5ml二氯甲烷洗涤。将水相减压浓缩。获得呈白色固体状的ph-cmpd-005-005。ms m/z[m/2+h]
+
(esi):1135。
[0433]
实施例9:可通过叠氮甲基化学法裂解的cpg-核苷的合成
[0434][0435]
1.cmpd-006-001
[0436][0437]
在室温下,在氮气惰性气氛下向4-(叔丁氧基)-4-氧代丁酸(5g,28.73mmol,1.1当量)在30ml的n,n-二甲基甲酰胺中的溶液中添加o-苯并三唑-n,n,n-四甲基-脲-六氟磷酸酯(12.6g,33.33mmol,1.1当量)、n,n-二异丙基乙胺(15ml,90.9mmol,3.00当量)。5min后,在室温下添加4-氨基-2-甲基苯甲酸甲酯(5g,30.3mmol,1.00当量)在20ml的n,n-二甲基甲酰胺中的溶液。将所得溶液在室温下搅拌16h,然后用200ml乙酸乙酯稀释,用2
×
100ml饱和
氯化钠洗涤。将有机相经无水硫酸钠干燥,过滤并减压浓缩。将粗产物通过快速制备hplc用以下条件纯化:柱,c18硅胶;流动相,含0.04% nh4hco3的水和乙腈(30%乙腈,最高至100%,在15分钟内,并保持100%持续4分钟);检测器,uv 254nm。将级分(800ml)用1000ml二氯甲烷稀释并经无水硫酸钠干燥。滤出固体。将滤液减压浓缩。获得呈褐色油状物的6g cmpd-006-001并且通过lcms确认。ms m/z[m+h]
+
(esi):322。
[0438]
2.cmpd-006-002
[0439][0440]
在25℃下,在氮气惰性气氛下向cmpd-006-001(5.5g,17.13mmol,1.0当量)在60ml四氯化碳中的溶液中按顺序添加2,2'-偶氮双(2-甲基丙腈)(1.68g,10.28mmol,0.6当量)、n-溴代琥珀酰亚胺(4.56g,25.71mmol,1.5当量)。将所得溶液经无水硫酸钠干燥、过滤并减压浓缩。将粗产物通过快速制备hplc用以下条件纯化:柱,c18硅胶;流动相,含0.04% nh4hco3的水和乙腈(30%乙腈,最高至100%,在15分钟内,并保持100%持续4分钟);检测器,uv 254nm。将级分(500ml)用600ml二氯甲烷稀释并经无水硫酸钠干燥。滤出固体。将滤液减压浓缩。获得呈褐色油状物的2.5g cmpd-006-001并且通过lcms确认。ms m/z[m+h]
+
(esi):400。
[0441]
3.cmpd-006-003
[0442][0443]
在25℃下,在氮气惰性气氛下,向cmpd-006-002(1.5g,3.76mmol,1.0当量)在20ml的n,n-二甲基甲酰胺中的溶液中添加叠氮化钠(0.73g,11.28mmol,3.0当量)。将所得溶液在60℃下搅拌1.5h,然后用100ml二氯甲烷稀释,分别用1
×
100ml饱和碳酸氢钠和1
×
100ml饱和氯化钠洗涤(将水相用次氯酸钠溶液处理)。将有机相经无水硫酸钠干燥,过滤并减压浓缩。将粗产物通过快速制备hplc用以下条件纯化:柱,c18硅胶;流动相,含0.04% nh4hco3的水和乙腈(30%乙腈,最高至100%,在15分钟内,并保持100%持续4分钟);检测器,uv254nm。将级分(200ml)用300ml二氯甲烷稀释并经无水硫酸钠干燥。滤出固体。将滤液减压浓缩。获得呈黄色油状物的1.1g cmpd-006-003并且通过lcms确认。ms m/z[m+h]
+
(esi):363。
[0444]
4.cmpd-006-004
[0445]
[0446]
在0℃下,在氮气惰性气氛下向cmpd-006-003(500mg,1.38mmol,1.0当量)的溶液中添加5ml二氯甲烷/三氟乙酸(1:1)。将所得溶液在0℃下搅拌2h,然后减压浓缩。将粗产物通过快速制备hplc用以下条件纯化:柱,c18硅胶;流动相,含0.05% tfa的水和乙腈(20%乙腈,最高至100%,在15分钟内,并保持100%持续4分钟);检测器,uv254nm。将级分(200ml)用300ml二氯甲烷稀释并经无水硫酸钠干燥。滤出固体。将滤液减压浓缩。获得呈黄色油状物的300mg cmpd-006-004并且通过lcms确认。ms m/z[m+h]
+
(esi):307。
[0447]
5.cmpd-006-005
[0448][0449]
将cmpd-006-004(48mg,0.156mmol,1.0当量)、lcaa-cpg(400mg)、4-二甲基氨基吡啶(192mg,1.56mmol,10.0当量)、三乙胺(0.22ml,1.56mmol,10.0当量)、(2-氯乙基)二乙胺盐酸盐(244mg,1.56mmol,10当量)和无水吡啶(0.7ml)的混合物在密封的氩气吹扫的8ml小瓶中组合。将混合物超声处理(超声水浴)1-2分钟,并在振动台上在室温下振荡48h。滤出固体并相继用四氢呋喃、二氯甲烷洗涤。获得呈黄色固体状的360mgcmpd-006-005。
[0450]
6.cmpd-006-006
[0451][0452]
在室温下向cmpd-006-005(100mg,0.041mmol,1.00当量)在0.4ml四氢呋喃/水(4:1)中的混合物中添加氢氧化锂(6.9mg,0.166mmol,4.0当量)。将混合物在振动台上在室温下振荡16h。用盐酸(1mol/l)将该溶液的ph值调节至6。滤出固体并且相继用水、四氢呋喃、二氯甲烷洗涤并通过lcms确认。获得呈灰白色固体状的80mgcmpd-006-006。
[0453]
7.cmpd-006-007
[0454][0455]
在室温下,在氮气惰性气氛下向cmpd-006-006(80mg,0.035mmol,1.00当量)在0.4ml氯仿中的混合物中按顺序添加cmpd-006-007(46mg,0.07mmol,2.0当量)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(10mg,0.052mmol,1.5当量)和4-二甲基氨基吡啶(6.3mg,0.052mmol,1.5当量))将所得溶液在振动台上在室温下振荡16h。滤出混合物并相继用水、四氢呋喃、二氯甲烷洗涤。
[0456]
实施例10:使用具有叠氮甲基接头的固体载体负载的核苷固相合成寡核苷酸
[0457][0458]
方案a:使用具有叠氮甲基接头的固体载体负载的核苷固相合成寡核苷酸
[0459]
1.固相合成以延长序列:
[0460]
序列信息:21聚体
[0461]5’‑
mafgmufumafumufcmafgmgfamafgmufcmufamc-3’[0462]
上述寡核苷酸序列的合成使用标准固相寡核苷酸合成,该合成用亚磷酰胺化学物质使用具有叠氮甲基接头的固体载体负载的核苷。寡核苷酸合成通过将核苷酸残基逐步添加到生长链的5'端来进行,直到组装成所需序列为止。每次添加被称为合成循环(方案a)并且由四个化学反应组成:1)脱三苯甲基化、2)偶联、3)氧化/硫醇化和4)加帽。
[0463]
所有亚磷酰胺及所有其他合成试剂和溶剂均可从商业来源获得并原样使用。用于合成后工作流程的化学品和溶剂购自商业来源,并无需任何纯化或处理即可使用。在合成期间,将溶剂(乙腈)和溶液(单体(amidite)和活化剂)储存在分子筛上。
[0464]
以上序列的合成在abi-394合成仪中以1um规模进行。以0.1m浓度制备亚磷酰胺溶液,并且将乙基硫代四唑(ett)(0.5m的乙腈溶液)用作活化剂。
[0465]
2.柱上脱三苯甲基化和脱氰乙基化(三苯甲基_脱掉)
[0466]
[0467]
方案b:柱上脱三苯甲基化和脱氰乙基化
[0468]
一旦寡核苷酸合成的全长完成,就在连接有固体载体的合成仪上进行最终的脱三苯甲基化和脱氰乙基化(方案b);
[0469]
3.固体载体的裂解和核碱基脱保护(三苯甲基_脱掉)
[0470][0471]
方案c:固体载体裂解和核碱基脱保护
[0472]
然后将固体载体负载的寡核苷酸用在二噁烷/h2o(9:1,v/v)中的ph3p在室温下裂解过夜。过滤去除固体载体后,在55℃下使用浓氨溶液使粗样品的磷酸氰基乙酯和核碱基脱保护过夜。
[0473]
使用丙酮:乙醇(80:20)混合物沉淀粗制序列,并将沉淀重悬于0.02m乙酸钠缓冲液中。通过lc-ms分析来自每个序列的样品以确认一致性,uv定量。
[0474]
然后使用源15q柱在akta探索纯化系统上纯化粗样品。在纯化期间维持65℃的柱温。在自动取样器中进行样品注射和收集。在洗脱液中收集对应于全长序列的单峰。纯化的序列在sephadex g25柱上使用akta纯化器脱盐。分析脱盐的寡核苷酸序列的浓度(在a260处通过un测量进行)及同一性和纯度(通过离子交换hplc或lcms进行)。
[0475]
4.固体载体的裂解和核碱基脱保护(三苯甲基_存在)
[0476][0477]
方案d:固体载体裂解和脱保护(三苯甲基_存在)
[0478]
然后将固体载体负载的寡核苷酸用在二噁烷/h2o(9:1,v/v)中的ph3p在室温下裂解过夜以提供完全受保护的寡核苷酸序列。在过滤去除固体载体之后,使用浓氨溶液在55℃下将粗样品的核碱基和氰基乙基脱保护过夜,接着在室温下用80%乙酸进行最终脱三苯甲基化,以提供完全脱保护的寡核苷酸序列(方案d)。
[0479]
如上所述分离并表征所得粗产物。
[0480]
固体载体上的三聚体5
’‑
fumumc-3’的合成(cmpd-a1)
[0481]
具有上述序列5
’‑
fumumc-3’的寡核苷酸通过使用标准固相合成来合成,该标准固相合成用亚磷酰胺化学物质,使用具有2-(叠氮甲基)苯甲酰基接头的固体载体负载的2
’‑
ome(bz)c。在mm-12合成仪上以2μmol规模进行合成。
[0482]
从固体载体上裂解三聚体cmpd-a1
[0483]
[0484]
将固体载体负载的寡核苷酸cmpd-a1在35℃下用在thf/水(10/1,0.5ml)中的三(环己基)膦(3.6mg,12.7μmol)处理48h。过滤固体。裂解效率为92%(通过固体载体残基的dmtr分析确定)。浓缩滤液。粗滤液的lcms证明是全长受保护的寡核苷酸。ms,m/z 1396(m-1)。未观察到单体或二聚体片段。通过lcms测定的纯度:45%。
[0485]
cmpd-a2的脱保护
[0486][0487]
来自前一步骤的经过蒸发的粗残余物cmpd-a2用在dce中的6%dca在室温下处理2h。原材料消失,通过lcms测定为58%所需产物cmpd-a3:m/z 1096(m+1)。未观察到单体或二聚体片段。cmpd-a3的收率(通过dmtr分析确定)为93%。将反应用tes淬灭并减压浓缩。
[0488]
将经过蒸发的粗残余物用nh3水溶液在55℃下处理2h以获得完全脱保护的三聚体cmpd-a4。未观察到单体或二聚体片段。将反应混合物减压浓缩。将粗残余物溶解于水中,用0.5mhcl水溶液在3℃下调节到ph~3并用et2o在3℃下萃取四次去除dmtr和苯甲酸。cmpd-a4的收率为91%(通过在260nm处通过uv光谱法测量水层的吸收来确定),纯度为65%(通过lcms)。ms,m/z 884(m-1)。
[0489]
固体载体上的四聚体5
’‑
mamgmumc-3’(cmpd-a5)的合成
[0490]
具有上述序列的寡核苷酸通过使用标准固相合成来合成,该使用标准固相合成用亚磷酰胺化学物质,使用具有2-(叠氮甲基)苯甲酰基接头的固体载体负载的2
’‑
ome(bz)c。在mm-12合成仪上以2μmol规模进行合成。
[0491]
从固体载体裂解四聚体cmpd-a5
[0492][0493]
将固体载体负载的寡核苷酸cmpd-a5在35℃下用在thf/水(10/1,0.5ml)中的三(环己基)膦(3mg,10μmol)处理48h。过滤固体。裂解效率为91%(通过固体载体残基的dmtr
分析确定)。浓缩滤液。粗滤液的lcms证明是全长受保护的寡核苷酸cmpd-a6。ms,m/z 1011(m/2+1),纯度46%。未观察到单体、二聚体和三聚体片段。
[0494]
cmpd-a6的脱保护
[0495][0496]
将来自前一步骤的经过蒸发的粗残余物cmpd-a6用在dce中的6%dca在室温下处理2h。原材料消失,对于cmpd-a7通过lcms测定为45%所需产物信号;ms,m/z 1717(m+1)。未观察到单体、二聚体或三聚体片段。cmpd-a7的收率为92%(通过dmtr分析确定)。将反应用tes淬灭并减压浓缩。
[0497]
将经过蒸发的粗残余物用nh3水溶液在55℃下处理2h以获得完全脱保护的四聚体cmpd-a8。未观察到单体、二聚体和三聚体片段。将反应混合物真空浓缩。将粗残余物溶解于水中,用0.5m hcl水溶液在3℃下调节至ph~3并用et2o在3℃下萃取四次以去除dmtr和苯甲酸。cmpd-a8的收率为81%(通过在260nm处通过uv光谱法测量水层的吸收来确定),纯度为60%(通过lcms)。ms,m/z 1278(m-1)。
[0498]
等同方案
[0499]
本公开不限于本专利申请中所述的具体实施方案,其旨在作为本公开的各个方面的单个说明。本公开的许多修改和变型可在不脱离其实质和范围的情况下进行,这对于本领域的技术人员将是显而易见的。除了本文所列举的那些之外,本公开范围内的功能等同的方法和设备对本领域技术人员而言由上述描述将是显而易见的。此类修改和变型旨在落入本公开的范围内。应当理解,本公开不限于具体的方法、试剂、化合物、组合物、或生物系统,当然,该方法、试剂、化合物、组合物、或生物系统可发生变化。另外应当了解,本文所用的术语只是为了描述具体实施方案的目的,并非旨在进行限制。
[0500]
此外,在本公开的特征或方面以马库什组的方式描述时,本领域的技术人员将认识到本公开也因此以马库什组的任何单个成员或成员的亚组的形式描述。
[0501]
如本领域技术人员将理解的,出于任何和所有目的,具体地讲就提供书面描述而言,本文所公开的所有范围也涵盖任何和所有可能的子范围以及它们的子范围的组合。任何列出的范围可以容易被理解为充分描述并且使得相同的范围被分解为至少相等的一半、三分之一、四分之一、五分之一、十分之一等。作为非限制性示例,本文讨论的每个范围以容易地分解成下三分之一、中三分之一和上三分之一等。本领域技术人员还将理解,所有语言,诸如“至多”、“至少”、“大于”、“小于”等包括所列出的数字并是指可随后分解成如上所述的子范围的范围。最后,如本领域的技术人员将理解的,范围包括每个单独的成员。因此,例如,具有1-3个项目的组是指具有1个、2个或3个项目的组。类似地,具有1-5个项目的组是
指具有1个、2个、3个、4个或5个项目等的组。
[0502]
本文提及或引用的所有专利、专利申请、临时申请和公布均全文以引用方式并入,包括所有附图和表格,只要它们与本说明书的明确教导内容不矛盾。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1