用于使用抗CD20/抗CD3双特异性抗体和抗CD79B抗体药物缀合物的治疗的给药的制作方法
本发明涉及b细胞增生性疾病的治疗。更具体地,本发明涉及使用抗分化簇20(cd20)/抗分化簇3(cd3)双特异性抗体结合抗分化簇79b(cd79b)抗体药物缀合物对患有cd20阳性细胞增生性疾病(例如b细胞增生性疾病)的人类受试者进行特异性治疗。
背景技术:
1、癌症的特征在于细胞亚群不受控制的生长。癌症是发达国家的主要死亡原因,并且是发展中国家的第二大死亡原因,每年诊断出的新癌症病例超过1400万例,并且癌症死亡人数超过800万。随着老年人口的增长,癌症的发病率也同时上升,因为七十岁以后罹患癌症的可能性要高出两倍多。因此,癌症护理是一项巨大且日益沉重的社会负担。
2、特别地,血液癌症是癌症相关死亡的第二大主要原因。血液癌症包括b细胞增生性疾病,诸如非霍奇金淋巴瘤(nhl)(例如,弥漫性大b细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤(fl)和套细胞淋巴瘤(mcl)),这些疾病进展迅速并且如果不治疗便会致命。尽管用单克隆抗cd20抗体利妥昔单抗来治疗已导致复发性dlbcl患者减少,但治疗那些复发性或难治性dlbcl患者变得越来越具有挑战性。对于此类患者,替代或二级治疗方式,诸如基于双特异性抗体的免疫疗法,可能特别有效。双特异性抗体能够同时结合细胞毒性细胞(例如,t细胞,经由与cd3结合)和癌细胞(例如,b细胞,经由与cd20结合)上的细胞表面抗原,目的是结合的细胞毒性细胞将破坏结合的癌细胞。抗体药物缀合物能够与细胞表面抗原表位结合(例如,靶向cd79b)以促进结合的药物缀合物的内化,从而靶向递送细胞毒性剂。然而,这种基于抗体和基于抗体药物缀合物的免疫疗法可能会受到不良影响的限制,这些不良影响包括细胞因子引起的毒性(例如,细胞因子释放综合征(crs))、输注相关反应(irr)、严重的肿瘤溶解综合征(tls)和肝毒性。
3、因此,在该领域存在开发使用治疗性双特异性抗体(例如,抗cd20/抗cd3双特异性抗体)和抗体药物缀合物(例如,抗cd79b抗体药物缀合物)的组合给药以用于治疗b细胞增生性疾病的有效方法的需求,这些方法获得更有利的效益-风险特征。
技术实现思路
1、本发明提供了通过在多周期给药方案中通过施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体的组合来治疗患有cd20阳性细胞增生性疾病(例如b细胞增生性疾病(例如nhl,例如dlbcl、fl或mcl))的受试者的方法,该多周期给药方案包括在第一给药周期中分级、递增剂量的双特异性抗体。
2、在一个方面,本发明的特征在于一种治疗患有cd20阳性细胞增生性疾病(例如b细胞增生性疾病)的受试者的方法,该方法包括在包括至少第一给药周期和第二给药周期的给药方案中,向受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括第一剂量(c1d1)的双特异性抗体、第二剂量(c1d2)的双特异性抗体和第三剂量(c1d3)的双特异性抗体,其中双特异性抗体的c1d1介于约0.02mg至约5.0mg之间(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),双特异性抗体的c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg、1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg、约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg),且双特异性抗体的c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;并且(b)第二给药周期包括单次剂量(c2d1)的双特异性抗体,其中双特异性抗体的c2d1等于或大于c1d3。
3、在一些实施例中,双特异性抗体的c1d1为约1mg,双特异性抗体的c1d2为约2mg,且双特异性抗体的c1d3为约9mg。在一些实施例中,双特异性抗体的c2d1为约9mg。
4、在一些实施例中,双特异性抗体的c1d1为约1mg,双特异性抗体的c1d2为约2mg,且双特异性抗体的c1d3为约13.5mg。在一些实施例中,双特异性抗体的c2d1为约13.5mg。
5、在一些实施例中,双特异性抗体的c1d1为约1mg,双特异性抗体的c1d2为约2mg,且双特异性抗体的c1d3为约20mg。在一些实施例中,双特异性抗体的c2d1为约20mg。
6、在一些实施例中,双特异性抗体的c1d1为约1mg,双特异性抗体的c1d2为约2mg,且双特异性抗体的c1d3为约40mg。在一些实施例中,其中双特异性抗体的c2d1为约40mg。
7、在一些实施例中,第一给药周期包括抗cd79b抗体药物缀合物的单次剂量c1d1。在一些实施例中,抗cd79b抗体药物缀合物的单次剂量c1d1为约0.5mg/kg至约10mg/kg(例如,介于约0.5mg/kg至约9mg/kg之间、介于约0.5mg/kg至约8mg/kg之间、介于约0.5mg/kg至约7mg/kg之间、介于约0.5mg/kg至约6mg/kg之间、介于约0.5mg/kg至约5mg/kg之间、介于约0.5mg/kg至约4mg/kg之间、介于约0.5mg/kg至约3mg/kg之间、介于约0.5mg/kg至约2mg/kg之间、介于约0.75mg/kg至约10mg/kg之间、介于约1mg/kg至约10mg/kg之间、介于约1.5mg/kg至约10mg/kg之间、介于约1mg/kg至约5mg/kg之间、介于约1mg/kg至约3mg/kg之间、介于约1.5mg/kg至约2.5mg/kg之间、介于约1.5mg/kg至约2mg/kg之间、或约1.8mg/kg)。在一些实施例中,抗cd79b抗体药物缀合物的单次剂量c1d1为约1.8mg/kg。在一些实施例中,第二给药周期包括抗cd79b抗体药物缀合物的单次剂量c2d1。在一些实施例中,抗cd79b抗体药物缀合物的单次剂量c2d1为约0.5mg/kg至约10mg/kg(例如,介于约0.5mg/kg至约9mg/kg之间、介于约0.5mg/kg至约8mg/kg之间、介于约0.5mg/kg至约7mg/kg之间、介于约0.5mg/kg至约6mg/kg之间、介于约0.5mg/kg至约5mg/kg之间、介于约0.5mg/kg至约4mg/kg之间、介于约0.5mg/kg至约3mg/kg之间、介于约0.5mg/kg至约2mg/kg之间、介于约0.75mg/kg至约10mg/kg之间、介于约1mg/kg至约10mg/kg之间、介于约1.5mg/kg至约10mg/kg之间、介于约1mg/kg至约5mg/kg之间、介于约1mg/kg至约3mg/kg之间、介于约1.5mg/kg至约2.5mg/kg之间、介于约1.5mg/kg至约2mg/kg之间、或约1.8mg/kg)。在一些实施例中,抗cd79b抗体药物缀合物的单次剂量c2d1为约1.8mg/kg。
8、在一些实施例中,分别在或约在第一给药周期的第1天、第8天和第15天向受试者施用c1d1的双特异性抗体、c1d2的双特异性抗体和c1d3的双特异性抗体。在一些实施例中,在第二给药周期的第1天向受试者施用c2d1的双特异性抗体。在一些实施例中,在第一给药周期的第1天向受试者施用抗cd79b抗体药物缀合物的c1d1且/或在第二给药周期的第1天向受试者施用抗cd79b抗体药物缀合物的c2d1。在一些实施例中,第一给药周期和第二给药周期是21天给药周期。在一个实施例中,给药方案包括一个或多个额外给药周期。在一些实施例中,给药方案包括四至15个额外给药周期(例如,四至十个额外给药周期(例如,四个额外给药周期、五个额外给药周期、六个额外给药周期、七个额外给药周期、八个额外给药周期、九个额外给药周期或十个额外给药周期)或11-15个额外给药周期(例如,11个额外给药周期、12个额外给药周期、13个额外给药周期、14个额外给药周期或15个额外给药周期))。在特定实施例中,给药方案包括四个额外给药周期。在一些实施例中,额外给药周期是21天给药周期。
9、在一些实施例中,额外给药周期中的一个或多个包括双特异性抗体的额外单次剂量和抗cd79b抗体药物缀合物的额外单次剂量。在一些实施例中,抗cd79b抗体药物缀合物的额外单次剂量在量上与抗cd79b抗体药物缀合物的c2d1相等。在一些实施例中,在包括抗cd79b抗体药物缀合物的额外剂量的各额外给药周期的第1天,向受试者施用抗cd79b抗体药物缀合物的额外单次剂量。在一些实施例中,额外给药周期中的一个或多个包括双特异性抗体的额外单次剂量,并且不包括施用抗cd79b抗体药物缀合物。在一些实施例中,双特异性抗体的额外单次剂量在量上与双特异性抗体的c2d1相等。在一些实施例中,在包括双特异性抗体的额外剂量的各额外给药周期的第1天向受试者施用额外单次剂量的双特异性抗体。在一些实施例中,给药方案包括六个或更多个额外给药周期,其中六个或更多个额外给药周期中的各者包括双特异性抗体的单次剂量,并且其中六个或更多个额外给药周期中的不超过四者包括施用抗cd79b抗体药物缀合物。
10、在另一方面,本发明的特征在于一种治疗患有cd20阳性细胞增生性疾病(例如b细胞增生性疾病)的受试者的方法,该方法包括在包括至少第一给药周期和第二给药周期的给药方案中,向受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)抗cd79b抗体药物缀合物的单次剂量(c1d1);(ii)双特异性抗体第一剂量(c1d1)和双特异性抗体的第二剂量(c1d2),其中双特异性抗体的c1d1和c1d2各自在抗cd79b抗体药物缀合物的c1d1之后向受试者施用,其中双特异性抗体的c1d1介于约0.02mg至约5.0mg之间(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),并且双特异性抗体的c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg,1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg);并且(b)第二个给药周期包括:(i)抗cd79b抗体药物缀合物的单次剂量(c2d1);和(ii)双特异性抗体的单次剂量(c2d1),其中双特异性抗体的c2d1大于或等于c1d2。在一些实施例中,双特异性抗体的c1d1为约1mg且双特异性抗体的c1d2为约2mg。在一些实施例中,双特异性抗体的c2d1为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg。
11、在一些实施例中,第一给药周期包括抗cd79b抗体药物缀合物的单次剂量c1d1。在一些实施例中,抗cd79b抗体药物缀合物的单次剂量c1d1为约0.5mg/kg至约10mg/kg。在一些实施例中,抗cd79b抗体药物缀合物的单次剂量c1d1为约1.8mg/kg。在一些实施例中,第二给药周期包括抗cd79b抗体药物缀合物的单次剂量c2d1。在一些实施例中,抗cd79b抗体药物缀合物的单次剂量c2d1为约0.5mg/kg至约10mg/kg。在一些实施例中,抗cd79b抗体药物缀合物的单次剂量c2d1为约1.8mg/kg。
12、在一些实施例中,分别在第一给药周期的第8天和第15天或大约第8天和第15天向受试者施用c1d1的双特异性抗体和c1d2的双特异性抗体。在一些实施例中,在第二给药周期的第1天向受试者施用c2d1的双特异性抗体。在一些实施例中,在第一给药周期的第1天向受试者施用抗cd79b抗体药物缀合物的c1d1和在第二给药周期的第1天向受试者施用抗cd79b抗体药物缀合物的c2d1。在一些实施例中,第一给药周期和第二给药周期是21天给药周期。
13、在一个实施例中,给药方案包括一个或多个额外给药周期。在一些实施例中,给药方案包括四至15个额外给药周期(例如,四至十个额外给药周期(例如,四个额外给药周期、五个额外给药周期、六个额外给药周期、七个额外给药周期、八个额外给药周期、九个额外给药周期或十个额外给药周期)或11-15个额外给药周期(例如,11个额外给药周期、12个额外给药周期、13个额外给药周期、14个额外给药周期或15个额外给药周期))。在特定实施例中,给药方案包括四个额外给药周期。在一些实施例中,额外给药周期是21天给药周期。在一些实施例中,额外给药周期中的一个或多个包括双特异性抗体的额外单次剂量和抗cd79b抗体药物缀合物的额外单次剂量。在一些实施例中,抗cd79b抗体药物缀合物的额外单次剂量在量上与抗cd79b抗体药物缀合物的c2d1相等。在一些实施例中,在包括抗cd79b抗体药物缀合物的额外剂量的各额外给药周期的第1天,向受试者施用抗cd79b抗体药物缀合物的额外单次剂量。在一些实施例中,额外给药周期中的一个或多个包括双特异性抗体的额外单次剂量,并且不包括施用抗cd79b抗体药物缀合物。在一些实施例中,双特异性抗体的额外单次剂量在量上与双特异性抗体的c2d1相等。在一些实施例中,在包括双特异性抗体的额外剂量的各额外给药周期的第1天向受试者施用额外单次剂量的双特异性抗体。在一些实施例中,给药方案包括六个或更多个额外给药周期,其中六个或更多个额外给药周期中的各者包括双特异性抗体的单次剂量,并且其中六个或更多个额外给药周期中的不超过四者包括施用抗cd79b抗体药物缀合物。
14、在又一方面,本发明的特征在于一种治疗患有cd20阳性细胞增生性疾病(例如b细胞增生性疾病)的受试者的方法,该方法包括在包括八个或更多个给药周期的给药方案中向受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)双特异性抗体的第一剂量(c1d1)、双特异性抗体的第二剂量(c1d2)和双特异性抗体的第三剂量(c1d3),其中双特异性抗体的c1d1介于约0.02mg至约5.0mg(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),双特异性抗体的c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg、1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg),且双特异性抗体的c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;和(ii)抗cd79b抗体药物缀合物的单次剂量(c1d1);(b)第二给药周期包括双特异性抗体的单次剂量(c2d1)和抗cd79b抗体药物缀合物的单次剂量(c2d1);(c)第三给药周期包括双特异性抗体的单次剂量(c3d1)和抗cd79b抗体药物缀合物的单次剂量(c3d1);(d)第四给药周期包括双特异性抗体的单次剂量(c4d1)和抗cd79b抗体药物缀合物的单次剂量(c4d1);(e)第五给药周期包括双特异性抗体的单次剂量(c5d1)和抗cd79b抗体药物缀合物的单次剂量(c5d1);(f)第六给药周期包括双特异性抗体的单次剂量(c6d1)和抗cd79b抗体药物缀合物的单次剂量(c6d1);(g)第七给药周期包括双特异性抗体的单次剂量(c7d1)并且不包括施用抗cd79b抗体药物缀合物;并且(h)第八给药周期包括双特异性抗体的单次剂量(c8d1)并且不包括施用抗cd79b抗体药物缀合物,其中双特异性抗体的各单次剂量c2d1至c8d1等于或大于c1d3。
15、在一些实施例中,双特异性抗体的c1d3和c2d1至c8d1约等量。在一些实施例中,抗cd79b抗体药物缀合物的c1d1至c6d1约等量。
16、在又一方面,本发明的特征在于一种治疗患有cd20阳性细胞增生性疾病(例如b细胞增生性疾病)的受试者的方法,该方法包括在包括八个或更多个给药周期的给药方案中向受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)双特异性抗体的第一剂量(c1d1)、双特异性抗体的第二剂量(c1d2)和双特异性抗体的第三剂量(c1d3),其中双特异性抗体的c1d1介于约0.02mg至约5.0mg(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),双特异性抗体的c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg、1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg),且双特异性抗体的c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;和(ii)抗cd79b抗体药物缀合物的单次剂量(c1d1);(b)第二给药周期包括双特异性抗体的单次剂量(c2d1)和抗cd79b抗体药物缀合物的单次剂量(c2d1);(c)第三给药周期包括双特异性抗体的单次剂量(c3d1)和抗cd79b抗体药物缀合物的单次剂量(c3d1);(d)第四给药周期包括双特异性抗体的单次剂量(c4d1)和抗cd79b抗体药物缀合物的单次剂量(c4d1);(e)第五给药周期包括双特异性抗体的单次剂量(c5d1)和抗cd79b抗体药物缀合物的单次剂量(c5d1);(f)第六给药周期包括双特异性抗体的单次剂量(c6d1)和抗cd79b抗体药物缀合物的单次剂量(c6d1);(g)第七给药周期包括双特异性抗体的单次剂量(c7d1)并且不包括施用抗cd79b抗体药物缀合物;并且(h)第八给药周期包括双特异性抗体的单次剂量(c8d1)并且不包括施用抗cd79b抗体药物缀合物,其中单次剂量c2d1的量约等于c1d3,并且双特异性抗体的各单次剂量c3d1至c8d1小于c1d3。在一些实施例中,双特异性抗体的各单次剂量c3d1至c8d1介于约10mg和约45mg之间(例如,介于约10mg和约40mg之间、介于约10mg和约35mg之间、介于约15mg和约45mg之间、介于约20mg和约45mg之间、或介于约25mg和约45mg之间;例如约30mg)。
17、在一些实施例中,抗cd79b抗体药物缀合物的c1d1至c6d1中的各者为约0.5mg/kg至约10mg/kg(例如,介于约0.5mg/kg至约9mg/kg之间、介于约0.5mg/kg至约8mg/kg之间、介于约0.5mg/kg至约7mg/kg之间、介于约0.5mg/kg至约6mg/kg之间、介于约0.5mg/kg至约5mg/kg之间、介于约0.5mg/kg至约4mg/kg之间、介于约0.5mg/kg至约3mg/kg之间、介于约0.5mg/kg至约2mg/kg之间、介于约0.75mg/kg至约10mg/kg之间、介于约1mg/kg至约10mg/kg之间、介于约1.5mg/kg至约10mg/kg之间、介于约1mg/kg至约5mg/kg之间、介于约1mg/kg至约3mg/kg之间、介于约1.5mg/kg至约2.5mg/kg之间、介于约1.5mg/kg至约2mg/kg之间、或约1.8mg/kg)。在一些实施例中,抗cd79b抗体药物缀合物的c1d1至c6d1中的各者为约1.8mg/kg。
18、在一些实施例中,分别在或约在第一给药周期的第1天、第8天和第15天向受试者施用c1d1的双特异性抗体、c1d2的双特异性抗体和c1d3的双特异性抗体。在一些实施例中,在各给药周期的第1天向受试者施用c1d1-c8d1的双特异性抗体。在一些实施例中,在各给药周期的第1天向受试者施用抗cd79b抗体药物缀合物的c1d1至c6d1。在一些实施例中,各给药周期是21天给药周期。
19、在又一方面,本发明提供一种治疗患有cd20阳性细胞增生性疾病(例如b细胞增生性疾病)的受试者的方法,该方法包括在包括八个或更多个给药周期的给药方案中,向受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括双特异性抗体的第一剂量(c1d1)和双特异性抗体的第二剂量(c1d2),其中双特异性抗体的c1d1介于约0.02mg至约5.0mg(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg、1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg),并且c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;(b)第;给药周期包括双特异性抗体的单次剂量(c2d1)和抗cd79b抗体药物缀合物的单次剂量(c2d1);(c)第三给药周期包括双特异性抗体的单次剂量(c3d1)和抗cd79b抗体药物缀合物的单次剂量(c3d1);(d)第四给药周期包括双特异性抗体的单次剂量(c4d1)和抗cd79b抗体药物缀合物的单次剂量(c4d1);(e)第五给药周期包括双特异性抗体的单次剂量(c5d1)和抗cd79b抗体药物缀合物的单次剂量(c5d1);(f)第六给药周期包括双特异性抗体单次剂量(c6d1)和抗cd79b抗体药物缀合物的单次剂量(c6d1);(g)第七给药周期包括双特异性抗体的单次剂量(c7d1)并且不包括施用抗cd79b抗体药物缀合物;并且(h)第八给药周期包括双特异性抗体的单次剂量(c8d1)并且不包括施用抗cd79b抗体药物缀合物,其中双特异性抗体的各单次剂量c2d1至c8d1等于或大于c1d3。
20、在一些实施例中,双特异性抗体的c1d3和c2d1至c8d1约等量。
21、在一些实施例中,抗cd79b抗体药物缀合物的c2d1至c6d1约等量。在一些实施例中,抗cd79b抗体药物缀合物的c2d1至c6d1中的每一者为约0.5mg/kg至约10mg/kg(例如,介于约0.5mg/kg至约9mg/kg之间、介于约0.5mg/kg至约8mg/kg之间、介于约0.5mg/kg至约7mg/kg之间、介于约0.5mg/kg至约6mg/kg之间、介于约0.5mg/kg至约5mg/kg之间、介于约0.5mg/kg至约4mg/kg之间、介于约0.5mg/kg至约3mg/kg之间、介于约0.5mg/kg至约2mg/kg之间、介于约0.75mg/kg至约10mg/kg之间、介于约1mg/kg至约10mg/kg之间、介于约1.5mg/kg至约10mg/kg之间、介于约1mg/kg至约5mg/kg之间、介于约1mg/kg至约3mg/kg之间、介于约1.5mg/kg至约2.5mg/kg之间、介于约1.5mg/kg至约2mg/kg之间、或约1.8mg/kg)。在一些实施例中,抗cd79b抗体药物缀合物的c2d1至c6d1中的每一者为约1.8mg/kg。
22、在一些实施例中,分别在或约在第一给药周期的第1天、第8天和第15天向受试者施用c1d1的双特异性抗体、c1d2的双特异性抗体和c1d3的双特异性抗体。在一些实施例中,在各给药周期的第1天向受试者施用c1d1和c2d1至c8d1的双特异性抗体。在一些实施例中,在各给药周期的第1天向受试者施用抗cd79b抗体药物缀合物的c2d1至c6d1。在一些实施例中,各给药周期是21天给药周期。
23、在另一方面,本发明提供一种治疗患有cd20阳性细胞增生性疾病(例如b细胞增生性疾病)的受试者的方法,该方法包括在包括八个或更多个给药周期的给药方案中,向受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)双特异性抗体的第一剂量(c1d1)和第二剂量(c1d2),其中双特异性抗体的c1d1介于约0.02mg至约5.0mg之间(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),并且c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg,1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg);和(ii)单次剂量(c1d1)的抗cd79b抗体药物缀合物;(b)第二给药周期包括:(i)双特异性抗体的单次剂量(c2d1),其中双特异性抗体的c2d1为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;和(ii)抗cd79b抗体药物缀合物的单次剂量(c2d1);(c)第三给药周期包括双特异性抗体的单次剂量(c3d1)和抗cd79b抗体药物缀合物的单次剂量(c3d1);(d)第四个给药周期包括双特异性抗体的单次剂量(c4d1)和抗cd79b抗体药物缀合物的单次剂量(c4d1);(e)第五个给药周期包括双特异性抗体的单次剂量(c5d1)和抗cd79b抗体药物缀合物的单次剂量(c5d1);(f)第六给药周期包括双特异性抗体的单次剂量(c6d1)和抗cd79b抗体药物缀合物的单次剂量(c6d1);(g)第七给药周期包括双特异性抗体的单次剂量(c7d1)并且不包括施用抗cd79b抗体药物缀合物;并且(h)第八给药周期包括双特异性抗体的单次剂量(c8d1)并且不包括施用抗cd79b抗体药物缀合物,其中双特异性抗体的各单次剂量c2d1至c8d1大于c1d2。
24、在一些实施例中,双特异性抗体的c2d1至c8d1约等量。在一些实施例中,抗cd79b抗体药物缀合物的c1d1至c6d1约等量。在一些实施例中,抗cd79b抗体药物缀合物的c1d1至c6d1中的各者为约0.5mg/kg至约10mg/kg(例如,介于约0.5mg/kg至约9mg/kg之间、介于约0.5mg/kg至约8mg/kg之间、介于约0.5mg/kg至约7mg/kg之间、介于约0.5mg/kg至约6mg/kg之间、介于约0.5mg/kg至约5mg/kg之间、介于约0.5mg/kg至约4mg/kg之间、介于约0.5mg/kg至约3mg/kg之间、介于约0.5mg/kg至约2mg/kg之间、介于约0.75mg/kg至约10mg/kg之间、介于约1mg/kg至约10mg/kg之间、介于约1.5mg/kg至约10mg/kg之间、介于约1mg/kg至约5mg/kg之间、介于约1mg/kg至约3mg/kg之间、介于约1.5mg/kg至约2.5mg/kg之间、介于约1.5mg/kg至约2mg/kg之间、或约1.8mg/kg)。在一些实施例中,抗cd79b抗体药物缀合物的c1d1至c6d1中的各者为约1.8mg/kg。在一些实施例中,在抗cd79b抗体药物缀合物的c1d1之后施用c1d1的双特异性抗体。在一些实施例中,在抗cd79b抗体药物缀合物的c1d1之后约七天施用c1d1的双特异性抗体。
25、在一些实施例中,分别在第一给药周期的第8天和第15天或大约第8天和第15天向受试者施用c1d1的双特异性抗体和c1d2的双特异性抗体。在一些实施例中,在各给药周期的第1天向受试者施用c2d1至c8d1的双特异性抗体。在一些实施例中,在各给药周期的第1天向受试者施用抗cd79b抗体药物缀合物的c1d1至c6d1。在一些实施例中,各给药周期是21天给药周期。在一些实施例中,给药方案包括包括双特异性抗体的单次剂量的一个或多个额外给药周期。在一些实施例中,给药方案包括包括双特异性抗体的单次剂量的一至九个额外给药周期。在一些实施例中,额外给药周期中的每一者不包括施用抗cd79b抗体药物缀合物。在一些实施例中,额外给药周期中的每一者是21天给药周期。
26、在一些实施例中,当与单独的双特异性抗体或抗cd79b抗体药物缀合物比较时,双特异性抗体和抗cd79b抗体药物缀合物在小鼠nsg:人wsu-dlcl2模型系统中具有协同效应。
27、在上述任一方面的一些实施例中,该方法进一步包括向受试者施用一种或多种额外治疗剂。在一些实施例中,该一种或多种额外治疗剂是皮质类固醇或il-r6拮抗剂。在一些实施例中,il-r6拮抗剂为托珠单抗。在一些实施例中,以约8mg/kg的单次剂量向受试者静脉内施用托珠单抗,并且其中单次剂量不超过800mg。在一些实施例中,该一种或多种额外治疗剂是皮质类固醇。在一些实施例中,皮质类固醇是地塞米松、强的松或甲泼尼龙。在一些实施例中,该一种或多种额外治疗剂包括一种或多种化学治疗剂。在一些实施例中,该一种或多种化学治疗剂包括环磷酰胺或阿霉素。
28、在另一方面,本发明提供了一种降低患有cd20阳性细胞增生性疾病(例如,b细胞增生性疾病)的受试者的群体中细胞因子释放综合征的比率的方法,该受试者被施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中该方法包括依据根据本文所述实施例中的任一者的方法向群体中的一个或多个受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体。
29、在另一方面,本发明提供了降低患有cd20阳性细胞增生性疾病(例如,b细胞增生性疾病)的受试者的群体中细胞因子释放综合征的比率的方法,该受试者被施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,该方法包括在包括至少第一给药周期和第二给药周期的给药方案中向群体中的一个或多个受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括第一剂量(c1d1)的双特异性抗体、第二剂量(c1d2)的双特异性抗体和第三剂量(c1d3)的双特异性抗体,其中双特异性抗体的c1d1介于约0.02mg至约5.0mg之间(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),双特异性抗体的c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg、1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg、约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg),且双特异性抗体的c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;并且(b)第二给药周期包括单次剂量(c2d1)的双特异性抗体,其中双特异性抗体的c2d1等于或大于c1d3,其中与尚未施用抗cd79b抗体药物缀合物的受试者的参考群体相比,受试者的群体中不良事件的比率降低。
30、在进一步的方面,本发明提供了一种降低患有cd20阳性细胞增生性疾病(例如,b细胞增生性疾病)的受试者的群体中细胞因子释放综合征的比率的方法,该受试者被施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,该方法包括在包括至少第一给药周期和第二给药周期的给药方案中向群体中的一个或多个受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)抗cd79b抗体药物缀合物的单次剂量(c1d1);(ii)双特异性抗体的第一剂量(c1d1)和双特异性抗体的第二剂量(c1d2),其中c1d1和c1d2的双特异性抗体各自在c1d1的抗cd79b抗体药物缀合物之后向受试者施用,其中双特异性抗体的c1d1介于约0.02mg至约5.0mg之间(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),并且双特异性抗体的c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg,1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg);并且(b)第二给药周期包括:(i)抗cd79b抗体药物的缀合物的单次剂量(c2d1);和(ii)双特异性抗体的单次剂量(c2d1),其中双特异性抗体的c2d1大于或等于双特异性抗体的c1d2,其中与没有施用抗cd79b抗体药物缀合物的受试者参考群体相比,受试者的群体中不良事件的比率降低。
31、在又一方面,本发明提供了一种降低患有cd20阳性细胞增生性疾病(例如,b细胞增生性疾病)的受试者的群体中细胞因子释放综合征的比率的方法,该受试者被施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,该方法包括在包括八个或更多个给药周期的给药方案中,向群体中的一个或多个受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)双特异性抗体的第一剂量(c1d1)、双特异性抗体的第二剂量(c1d2)和双特异性抗体的第三剂量(c1d3),其中双特异性抗体的c1d1介于约0.02mg至约5.0mg(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),双特异性抗体的c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg、1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg),且双特异性抗体的c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;和(ii)抗cd79b抗体药物缀合物的单次剂量(c1d1);(b)第二给药周期包括双特异性抗体的单次剂量(c2d1)和抗cd79b抗体药物缀合物的单次剂量(c2d1);(c)第三给药周期包括双特异性抗体的单次剂量(c3d1)和抗cd79b抗体药物缀合物的单次剂量(c3d1);(d)第四给药周期包括双特异性抗体的单次剂量(c4d1)和抗cd79b抗体药物缀合物的单次剂量(c4d1);(e)第五给药周期包括双特异性抗体的单次剂量(c5d1)和抗cd79b抗体药物缀合物的单次剂量(c5d1);(f)第六给药周期包括双特异性抗体的单次剂量(c6d1)和抗cd79b抗体药物缀合物的单次剂量(c6d1);(g)第七给药周期包括双特异性抗体的单次剂量(c7d1)并且不包括施用抗cd79b抗体药物缀合物;并且(h)第八给药周期包括双特异性抗体的单次剂量(c8d1)并且不包括施用抗cd79b抗体药物缀合物,其中双特异性抗体的各单次剂量c2d1至c8d1等于或大于c1d3,并且其中与没有施用抗cd79b抗体药物缀合物的受试者参考群体相比,受试者的群体中不良事件的比率降低。
32、在又一方面,本发明提供了一种降低患有cd20阳性细胞增生性疾病(例如,b细胞增生性疾病)的受试者群体中的细胞因子释放综合征的比率的方法,该受试者被施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,该方法包括在包括八个或更多个给药周期的给药方案中,向群体中的一个或多个受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)双特异性抗体的第一剂量(c1d1)、双特异性抗体的第二剂量(c1d2)和双特异性抗体的第三剂量(c1d3),其中双特异性抗体的c1d1介于约0.02mg至约5.0mg(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),双特异性抗体的c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg、1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg),且双特异性抗体的c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;和(ii)抗cd79b抗体药物缀合物的单次剂量(c1d1);(b)第二给药周期包括单次剂量(c2d1)的双特异性抗体和抗cd79b抗体药物缀合物的单次剂量(c2d1);(c)第三给药周期包括单次剂量(c3d1)的双特异性抗体和抗cd79b抗体药物缀合物的单次剂量(c3d1);(d)第四给药周期包括双特异性抗体的单次剂量(c4d1)和抗cd79b抗体药物缀合物的单次剂量(c4d1);(e)第五给药周期包括双特异性抗体的单次剂量(c5d1)和抗cd79b抗体药物缀合物的单次剂量(c5d1);(f)第六给药周期包括双特异性抗体的单次剂量(c6d1)和抗cd79b抗体药物缀合物的单次剂量(c6d1);(g)第七给药周期包括双特异性抗体的单次剂量(c7d1)并且不包括施用抗cd79b抗体药物缀合物;并且(h)第八给药周期包括双特异性抗体的单次剂量(c8d1)并且不包括施用抗cd79b抗体药物缀合物,其中单次剂量c2d1的量约等于c1d3,并且双特异性抗体的各单次剂量c3d1至c8d1小于c1d3,并且其中与没有施用抗cd79b抗体药物缀合物的受试者参考群体相比,受试者的群体中不良事件的比率降低。在一些实施例中,双特异性抗体的各单次剂量c3d1至c8d1介于约10mg和约45mg之间(例如,介于约10mg和约40mg之间、介于约10mg和约35mg之间、介于约15mg和约45mg之间、介于约20mg和约45mg之间、或介于约25mg和约45mg之间;例如约30mg)。
33、在又一方面,本发明提供了一种降低患有cd20阳性细胞增生性疾病(例如,b细胞增生性疾病)的受试者的群体中细胞因子释放综合征的比率的方法,该受试者被施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,该方法包括在包括八个或更多个给药周期的给药方案中,向群体中的一个或多个受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括双特异性抗体的第一剂量(c1d1)和双特异性抗体的第二剂量(c1d2),其中双特异性抗体的c1d1介于约0.02mg至约5.0mg(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg、1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg),并且c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;(b)第二给药周期包括双特异性抗体的单次剂量(c2d1)和抗cd79b抗体药物缀合物的单次剂量(c2d1);(c)第三给药周期包括双特异性抗体的单次剂量(c3d1)和抗cd79b抗体药物缀合物的单次剂量(c3d1);(d)第四给药周期包括双特异性抗体的单次剂量(c4d1)和抗cd79b抗体药物缀合物的单次剂量(c4d1);(e)第五给药周期包括双特异性抗体的单次剂量(c5d1)和抗cd79b抗体药物缀合物的单次剂量(c5d1);(f)第六给药周期包括双特异性抗体的单次剂量(c6d1)和抗cd79b抗体药物缀合物的单次剂量(c6d1);(g)第七给药周期包括双特异性抗体的单次剂量(c7d1)并且不包括施用抗cd79b抗体药物缀合物;并且(h)第八给药周期包括双特异性抗体的单次剂量(c8d1)并且不包括施用抗cd79b抗体药物缀合物,其中双特异性抗体的各单次剂量c2d1至c8d1等于或大于c1d2,并且其中与没有施用抗cd79b抗体药物缀合物的受试者参考群体相比,受试者群体中的不良事件的比率降低。
34、在另一方面,本发明提供了一种降低患有cd20阳性细胞增生性疾病(例如,b细胞增生性疾病)的受试者的群体中细胞因子释放综合征的比率的方法,该受试者被施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,该方法包括在包括八个或更多个给药周期的给药方案中,向群体中的一个或多个受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)双特异性抗体的第一剂量(c1d1)和第二剂量(c1d2),其中双特异性抗体的c1d1介于约0.02mg至约5.0mg之间(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),且c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg,1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13m g至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg);和(ii)抗cd79b抗体药物缀合物的单次剂量(c1d1);(b)第二给药周期包括:(i)双特异性抗体的单次剂量(c2d1),其中双特异性抗体的c2d1为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;和(ii)抗cd79b抗体药物缀合物的单次剂量(c2d1);(c)第三个给药周期包括双特异性抗体的单次剂量(c3d1)和抗cd79b抗体药物缀合物的单次剂量(c3d1);(d)第四个给药周期包括双特异性抗体的单次剂量(c4d1)和抗cd79b抗体药物缀合物的单次剂量(c4d1);(e)第五个给药周期包括双特异性抗体的单次剂量(c5d1)和抗cd79b抗体药物缀合物的单次剂量(c5d1);(f)第六给药周期包括双特异性抗体的单次剂量(c6d1)和抗cd79b抗体药物缀合物的单次剂量(c6d1);(g)第七给药周期包括双特异性抗体的单次剂量(c7d1)并且不包括施用抗cd79b抗体药物缀合物;并且(h)第八给药周期包括双特异性抗体的单次剂量(c8d1)并且不包括施用抗cd79b抗体药物缀合物,其中双特异性抗体的各单次剂量c2d1至csd1等于或大于c1d2,并且其中与没有施用抗cd79b抗体药物缀合物的受试者参考群体相比,受试者的群体中不良事件的比率降低。
35、在一些实施例中,受试者群体中细胞因子释放综合征的比率小于或等于约20%(例如,小于或等于约18%、小于或等于约15%、小于或等于至约14%、小于或等于约13%、小于或等于约12%、小于或等于约11%、小于或等于约10%、小于或等于约9%、小于或等于约8%、小于或等于约7%、小于或等于约6%、小于或等于约5%、小于或等于约4%、小于或等于约3%、小于或等于约2%、小于或等于约1%;例如,在约0%至约20%之间、在约1%至约20%之间、在约5%至约20%之间、在约10%至约20%之间、在约15%至约20%之间、在约0%至约5%之间、在约1%至约5%之间、在约1%至约10%之间、在约5%至约10%之间、在约10%至约15%之间或在约5%至约15%之间;例如,约20%、约15%、约10%、约7%、约5%、约4%、约3%、约2%、约1%或约0%)。在一些实施例中,受试者群体中细胞因子释放综合征的比率小于或等于约10%(例如,小于或等于约9%、小于或等于约8%、小于或等于约7%、小于或等于约6%、小于或等于约5%、小于或等于约4%、小于或等于约3%、小于或等于约2%、或小于或等于约1%;例如在约0.1%至约10%之间、在约0.5%和约10%之间、在约1%和约10%之间、在约1%和约7%之间、在约1%和约5%之间、在约1%和约3%之间、或在约5%和约10%之间;例如,约10%、约7%、约5%、约4%、约3%、约2%、约1%、或约0%)。在一些实施例中,受试者群体中细胞因子释放综合征的比率小于或等于约5%(例如,约1%至约5%、约2%至约5%、约3%至约5%、约4%至约5%、约0%至约4%、约1%至约4%、约2%至约4%、约3%至约4%、约0%至约3%、约1%至约3%、约2%至约3%、约0%至约2%、约1%至约2%、或约0%至约1%;例如,约5%、约4%、约3%、约2%、约1%、或约0%)。在一些实施例中,受试者群体中细胞因子释放综合征的比率小于或等于约3%。在一些实施例中,具有2级或更高的细胞因子释放综合征(由美国移植和细胞治疗学会(astct)定义,2019)的比率小于或等于约20%(例如,小于或等于约18%、小于或等于约15%、小于或等于至约14%、小于或等于约13%、小于或等于约12%、小于或等于约11%、小于或等于约10%、小于或等于约9%、小于或等于约8%、小于或等于约7%、小于或等于约6%、小于或等于约5%、小于或等于约4%、小于或等于约3%、小于或等于约2%、小于或等于约1%;例如,在约0%至约20%之间、在约1%至约20%之间、在约5%至约20%之间、在约10%至约20%之间、在约15%至约20%之间、在约0%至约5%之间、在约1%至约5%之间、在约1%至约10%之间、在约5%至约10%之间、在约10%至约15%之间或在约5%至约15%之间;例如,约20%、约15%、约10%、约7%、约5%、约4%、约3%、约2%、约1%、或约0%)。在一些实施例中,具有2级或更高的细胞因子释放综合征(由astct定义)的比率小于或等于约5%(例如,约1%至约5%、约2%至约5%、约3%至约5%、约4%至约5%、约0%至约4%、约1%至约4%、约2%至约4%、约3%至约4%、约0%至约3%、约1%至约3%、约2%至约3%、约0%至约2%、约1%至约2%、或约0%至约1%;例如,约5%、约4%、约3%、约2%、约1%、或约0%)。在一些实施例中,具有2级或更高的等级(由astct定义)的细胞因子释放综合征的比率为约0%。
36、在一些实施例中,cd20阳性细胞增生性疾病是b细胞增生性疾病。在一些实施例中,b细胞增生性疾病是非霍奇金淋巴瘤(nhl)、慢性淋巴细胞白血病(cll)或中枢神经系统淋巴瘤(cnsl)。在一些实施例中,nhl是弥漫性大b细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤(fl)、套细胞淋巴瘤(mcl)、高级别b细胞淋巴瘤(high-grade b cell lymphoma)、原发性纵隔(胸腺)大b细胞淋巴瘤(pmlbcl)、弥漫性b细胞淋巴瘤、小淋巴细胞淋巴瘤,边缘区淋巴瘤、伯基特氏淋巴瘤、淋巴浆细胞性淋巴瘤。在一些实施例中,nhl为复发性或难治性nhl。在一些实施例中,nhl为fl。在一些实施例中,nhl为dlbcl。在一些实施例中,nhl为mcl。在一些实施例中,dlbcl为复发性或难治性dlbcl。在一些实施例中,dlbcl为richter转化。在一些实施例中,fl为复发性或难治性fl。在一些实施例中,fl为转化的fl。在一些实施例中,mcl为复发性或难治性mcl。在一些实施例中,b细胞增生性疾病是复发性和/或难治性的。
37、在上述任一方面的一些实施例中,抗cd79b抗体药物缀合物是泊洛妥珠单抗或抗cd79b-mc-vc-pab-mmae。在一些实施例中,抗cd79b抗体药物缀合物是泊洛妥珠单抗。
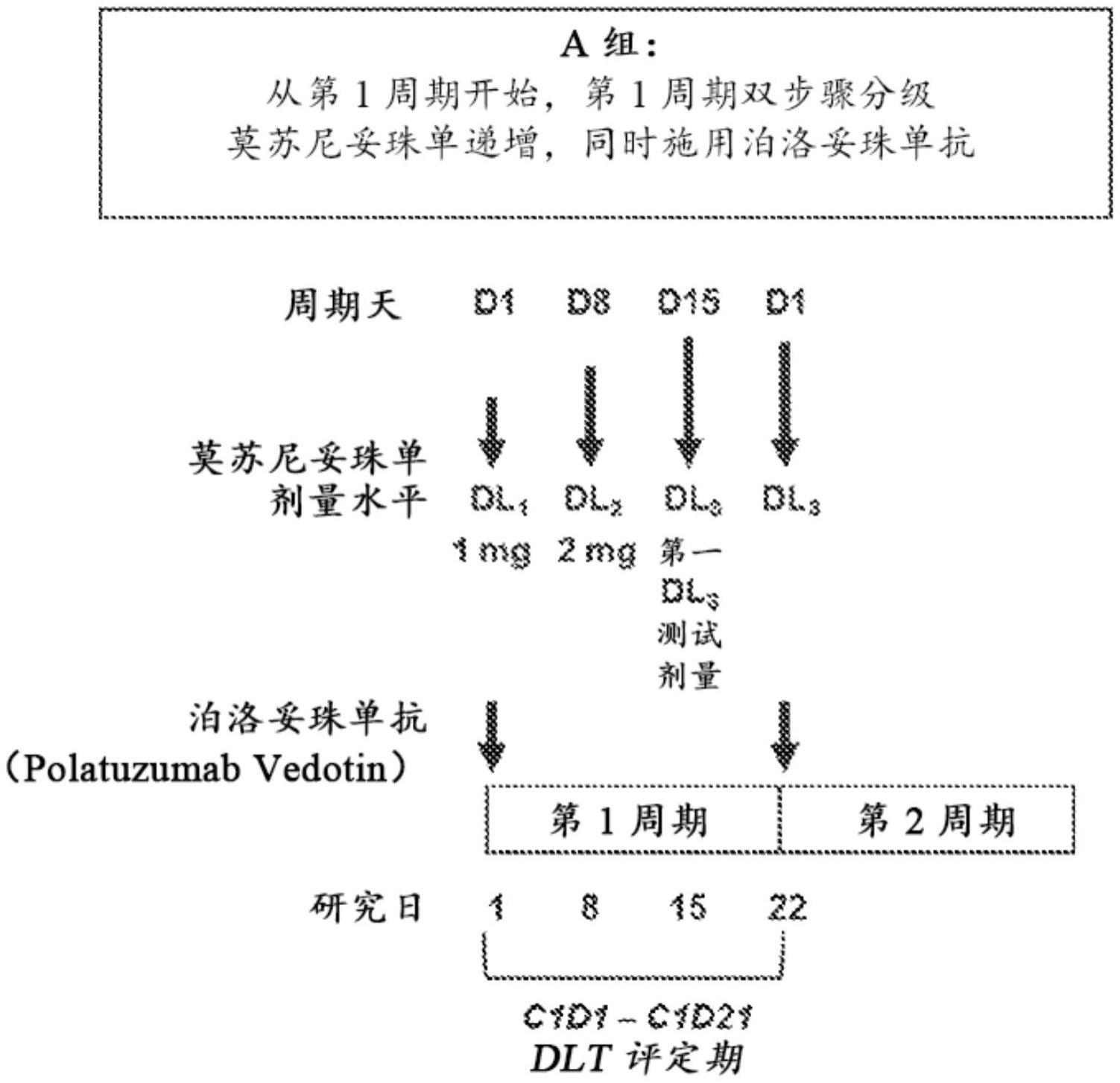
38、在上述任一方面的一些实施例中,双特异性抗体包含抗cd20臂,该抗cd20臂包含含有以下六个高变区(hvr)的第一结合结构域:(a)hvr-h1,其包含gytftsynmh(seq id no:1)的氨基酸序列;(b)hvr-h2,其包含aiypgngdtsynqkfkg(seq id no:2)的氨基酸序列;(c)hvr-h3,其包含vvyysnsywyfdv(seq id no:3)的氨基酸序列;(d)hvr-l1,其包含rasssvsymh(seq id no:4)的氨基酸序列;(e)hvr-l2,其包含apsnlas(seq id no:5)的氨基酸序列;以及(f)hvr-l3,其包含qqwsfnppt(seq id no:6)的氨基酸序列。在一些实施例中,双特异性抗体包含抗cd20臂,该抗cd20臂包含第一结合结构域,该第一结合结构域包含(a)重链可变(vh)结构域,其包含与seq id no:7的氨基酸序列具有至少95%序列同一性的氨基酸序列;(b)轻链可变(vl)结构域,其包含与seq id no:8的氨基酸序列具有至少95%的序列同一性的氨基酸序列;或(c)如(a)中所述的vh结构域和如(b)中所述的vl结构域。在一些实施例中,第一结合结构域包含vh结构域,其包含seq id no:7的氨基酸序列;以及vl结构域,其包含seq id no:8的氨基酸序列。
39、在上述任一方面的一些实施例中,双特异性抗体包含抗cd3臂,该抗cd3臂包含含有以下六个hvr的第二结合结构域:(a)hvr-h1,其包含nyyih(seq id no:17)的氨基酸序列;(b)hvr-h2,其包含wiypgdgntkynekfkg(seq id no:18)的氨基酸序列;(c)hvr-h3,其包含dsysnyyfdy(seq id no:19)的氨基酸序列;(d)hvr-l1,其包含kssqsllnsrtrknyla(seqid no:20)的氨基酸序列;(e)hvr-l2,其包含wastres(seq id no:21)的氨基酸序列;和(f)hvr-l3,其包含tqsfilrt(seq id no:22)的氨基酸序列。在一些实施例中,双特异性抗体包含抗cd3臂,该抗cd3臂包含第二结合结构域,该第二结合结构域包含(a)vh结构域,其包含与seq id no:23的氨基酸序列具有至少95%序列同一性的氨基酸序列;(b)vl结构域,其包含与seq id no:24的氨基酸序列具有至少95%的序列同一性的氨基酸序列;或(c)如(a)中所述的vh结构域和如(b)中所述的vl结构域。在一些实施例中,第二结合结构域包含vh结构域,其包含seq id no:23的氨基酸序列;以及vl结构域,其包含seq id no:24的氨基酸序列。
40、在一些实施例中,双特异性抗体包含(a)抗cd20臂,其包含(i)重链,该重链包含与seq id no:85的氨基酸序列具有至少95%序列同一性的氨基酸序列,和(ii)轻链,该轻链包含与seq id no:86的氨基酸序列具有至少95%序列同一性的氨基酸序列;以及(b)抗cd3臂,其包含(i)重链,该重链包含与seq id no:83的氨基酸序列具有至少95%序列同一性的氨基酸序列,和(ii)轻链,该轻链包含与seq id no:84的氨基酸序列具有至少95%序列同一性的氨基酸序列。在一些抗体中,(a)抗cd20臂包含含有seq id no:85的氨基酸序列的重链和含有seq id no:86的氨基酸序列的轻链,并且(b)抗cd3臂包含含有seq id no:83的氨基酸序列的重链和含有seq id no:84的氨基酸序列的轻链。
41、在上述任一方面的一些实施例中,双特异性抗体为人源化抗体。在一些实施例中,双特异性抗体为嵌合抗体。在一些实施例中,双特异性抗体是结合cd20和cd3的抗体片段。在一些实施例中,该抗体片段选自由fab、fab′-sh、fv、scfv和(fab′)2片段所组成的组。在一些实施例中,双特异性抗体为全长抗体。在一些实施例中,双特异性抗体为igg抗体。在一些实施例中,igg抗体为igg1抗体。在一些实施例中,igg抗体包含在氨基酸残基n297(eu编号)处的导致糖基化不存在的突变。在一些实施例中,氨基酸残基n297处的突变是取代突变。在一些实施例中,氨基酸残基n297处的突变降低fc区的效应子(effector)功能。在一些实施例中,突变为n297g或n297a突变。在一些实施例中,双特异性抗体包含在fc区中的降低效应子功能的突变。在一些实施例中,该突变为取代突变。在一些实施例中,取代突变位于氨基酸残基l234、l235、d265和/或p329(eu编号)处。在一些实施例中,取代突变选自由以下项所组成的组:l234a、l235a、d265a和p329g。
42、在上述任一方面的一些实施例中,双特异性抗体包含一个或多个重链恒定结构域,其中,所述一个或多个重链恒定结构域选自:第一ch1(ch11)结构域、第一ch2(ch21)结构域、第一ch3(ch31)结构域、第二ch1(ch12)结构域、第二ch2(ch22)结构域和第二ch3(ch32)结构域。在一些实施例中,该一个或多个重链恒定结构域中的至少一者与另一个重链恒定结构域配对。在一些实施例中,ch31和ch32结构域分别包含突起或空腔,其中,ch31结构域中的突起或空腔分别可定位在ch32结构域的空腔或突起中。在一些实施例中,ch31和ch32结构域在该突起和空腔之间的界面处相遇。在一些实施例中,ch21和ch22结构域分别包含突起或空腔,其中,ch21结构域中的突起或空腔分别可定位在ch22结构域的空腔或突起中。在一些实施例中,ch21和ch22结构域在该突起和空腔之间的界面处相遇。
43、在一些实施例中,双特异性抗体的抗cd20臂进一步包含t366w和n297g取代突变(eu编号)。在一些实施例中,双特异性抗体的抗cd3臂进一步包含t366s、l368a、y407v和n297g取代突变(eu编号)。在一些实施例中,(a)抗cd20臂进一步包含t366w和n297g取代突变,并且(b)抗cd3臂进一步包含t366s、l368a、y407v和n297g取代突变(eu编号)。
44、在另一方面,本发明提供了一种治疗患有nhl的受试者的方法,该方法包括在包括至少第一给药周期和第二给药周期的给药方案中向受试者施用泊洛妥珠单抗和莫苏尼妥珠单抗,其中:(a)第一给药周期包括莫苏尼妥珠单抗的第一剂量(c1d1)、莫苏尼妥珠单抗的第二剂量(c1d2)和莫苏尼妥珠单抗的第三剂量(c1d3),其中莫苏尼妥珠单抗的c1d1为约1mg,莫苏尼妥珠单抗的c1d2为约2mg,并且莫苏尼妥珠单抗的c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;并且(b)第二给药周期包括单次剂量(c2d1)的莫苏尼妥珠单抗,其中莫苏尼妥珠单抗的c2d1等于或大于c1d3。
45、在又一方面,本发明提供了一种治疗患有nhl(例如,复发性和/或难治性nhl)的受试者的方法,该方法包括在包括至少第一给药周期和第二给药周期的给药方案中向受试者施用泊洛妥珠单抗和莫苏尼妥珠单抗,其中:(a)第一给药周期包括:(i)泊洛妥珠单抗的单次剂量(c1d1);和(ii)莫苏尼妥珠单抗的第一剂量(c1d1)和莫苏尼妥珠单抗的第二剂量(c1d2),其中莫苏尼妥珠单抗的c1d1和c1d2各自在c1d1的泊洛妥珠单抗之后向受试者施用,其中莫苏尼妥珠单抗的c1d1为约1mg,莫苏尼妥珠单抗的c1d2为约2mg;并且(b)第二给药周期包括:(i)泊洛妥珠单抗的单次剂量(c2d1);和(ii)莫苏尼妥珠单抗的单次剂量(c2d1),其中莫苏尼妥珠单抗的c2d1为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg,并且泊洛妥珠单抗的c1d1和c2d2各自为约1.8mg/kg。
46、在进一步的方面,本发明提供了一种治疗患有nhl(例如,复发性和/或难治性nhl)的受试者的方法,该方法包括在包括八个或更多个给药周期的给药方案中,向受试者施用泊洛妥珠单抗和莫苏尼妥珠单抗,其中:(a)第一给药周期包括:(i)第一剂量(c1d1)的莫苏尼妥珠单抗、第二剂量(c1d2)的莫苏尼妥珠单抗和第三剂量(c1d3)的莫苏尼妥珠单抗,其中莫苏尼妥珠单抗的c1d1为约1mg,莫苏尼妥珠单抗的c1d2为约2mg,并且莫苏尼妥珠单抗的c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;和(ii)单次剂量(c1d1)的泊洛妥珠单抗;(b)第二给药周期包括单次剂量(c2d1)的莫苏尼妥珠单抗和单次剂量(c2d1)的泊洛妥珠单抗;(c)第三给药周期包括单次剂量(c3d1)的莫苏尼妥珠单抗和单次剂量(c3d1)的泊洛妥珠单抗;(d)第四给药周期包括单次剂量(c4d1)的莫苏尼妥珠单抗和单次剂量(c4d1)的泊洛妥珠单抗;(e)第五给药周期包括单次剂量(c5d1)的莫苏尼妥珠单抗和单次剂量(c5d1)的泊洛妥珠单抗;(f)第六给药周期包括单次剂量(c6d1)的莫苏尼妥珠单抗和单次剂量(c6d1)的泊洛妥珠单抗;(g)第七给药周期包括单次剂量(c7d1)的莫苏尼妥珠单抗,并且不包含施用泊洛妥珠单抗;并且(h)第八给药周期包括单次剂量(c8d1)的莫苏尼妥珠单抗,并且不包括施用泊洛妥珠单抗,其中莫苏尼妥珠单抗的各单次剂量c2d1至c8d1约等于或小于c1d3,并且泊洛妥珠单抗的各单次剂量c1d1至c6d1为约1.8mg/kg。
47、在又一方面,本发明提供了一种治疗患有nhl(例如,复发性和/或难治性nhl)的受试者的方法,该方法包括在包括八个或更多个给药周期的给药方案中,向受试者施用泊洛妥珠单抗和莫苏尼妥珠单抗,其中:(a)第一给药周期包括第一剂量(c1d1)的莫苏尼妥珠单抗、第二剂量(c1d2)的莫苏尼妥珠单抗和第三剂量的莫苏尼妥珠单抗,其中莫苏尼妥珠单抗的c1d1在约0.02mg至约5.0mg之间(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg,1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg),并且c1d3为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;(b)第二给药周期包括单次剂量(c2d1)的莫苏尼妥珠单抗和单次剂量(c2d1)的泊洛妥珠单抗;(c)第三给药周期包括单次剂量(c3d1)的莫苏尼妥珠单抗和单次剂量(c3d1)的泊洛妥珠单抗;(d)第四给药周期包括单次剂量(c4d1)的莫苏尼妥珠单抗和单次剂量(c4d1)的泊洛妥珠单抗;(e)第五给药周期包括单次剂量(c5d1)的莫苏尼妥珠单抗和单次剂量(c5d1)泊洛妥珠单抗;(f)第六给药周期包括单次剂量(c6d1)的莫苏尼妥珠单抗和单次剂量(c6d1)的泊洛妥珠单抗;(g)第七给药周期包括单次剂量(c7d1)的莫苏尼妥珠单抗,并且不包括施用泊洛妥珠单抗;并且(h)第八给药周期包括单次剂量(c8d1)的莫苏尼妥珠单抗并且不包含施用泊洛妥珠单抗,其中莫苏尼妥珠单抗的各单次剂量c2d1至c8d1约等于或小于c1d3并且各单次剂量泊洛妥珠单抗的c2d1至c6d1为约1.8mg/kg。
48、在又一方面,本发明提供了一种治疗患有nhl的受试者的方法,该方法包括在包括八个或更多个给药周期的给药方案中,向受试者施用泊洛妥珠单抗和莫苏尼妥珠单抗,其中:(a)第一给药周期包括:(i)第一剂量(c1d1)和第二剂量(c1d2)的莫苏尼妥珠单抗,其中莫苏尼妥珠单抗的c1d1介于约0.02mg至约5.0mg之间(例如,约0.05mg至约5mg、约0.1mg至约5.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约2mg至约5.0mg、约3mg至约5.0mg、约0.05mg至约4.0mg、约0.05mg至约3.0mg、约0.05mg至约2.0mg、约0.1mg至约2.0mg、约0.5mg至约2.0mg、约2mg至约4.0mg、约1mg至约3.0mg、约1mg、约2mg或约5mg),并且c1d2介于约0.05mg至约10.0mg之间(例如,约0.1mg至约10.0mg、约0.5mg至约10.0mg、1mg至约10.0mg、约2mg至约3.0mg、约5mg至约10.0mg、约8mg至约10.0mg、约0.5mg至约7.0mg、约0.5mg至约5.0mg、约1mg至约5.0mg、约1mg至约3.0mg、约3mg至约8.0mg、约1mg、约2mg或约5mg)或介于约10mg至约60mg之间(例如,约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约10mg至约15mg、约20mg至约50mg、约30mg至约50mg、约40mg至约50mg、约45mg至约50mg、约13mg至约17mg、约43mg至约48mg、约15mg至约35mg、约25mg至约45mg、约15mg、约30mg或约45mg);和(ii)单次剂量(c1d1)的泊洛妥珠单抗;(b)第二个给药周期包括:(i)单次剂量(c2d1)的莫苏尼妥珠单抗,其中莫苏尼妥珠单抗的c2d1为约9mg、约13.5mg、约20mg、约40mg、约45mg或约60mg;和(ii)单次剂量(c2d1)的泊洛妥珠单抗;(c)第三给药周期包括单次剂量(c3d1)的莫苏尼妥珠单抗和单次剂量(c3d1)的泊洛妥珠单抗;(d)第四给药周期包括单次剂量(c4d1)的莫苏尼妥珠单抗和单次剂量(c4d1)的泊洛妥珠单抗;(e)第五给药周期包括单次剂量(c5d1)的莫苏尼妥珠单抗和单次剂量(c5d1)的泊洛妥珠单抗;(f)第六给药周期包括单次剂量(c6d1)的莫苏尼妥珠单抗和单次剂量(c6d1)的泊洛妥珠单抗;(g)第七给药周期包括单次剂量(c7d1)的莫苏尼妥珠单抗,并且不包含施用泊洛妥珠单抗;并且(h)第八给药周期包括单次剂量(c8d1)的莫苏尼妥珠单抗,并且不包括施用泊洛妥珠单抗,其中莫苏尼妥珠单抗的各单次剂量c2d1-c8d1约等于或小于c1d3,并且泊洛妥珠单抗的各单次剂量c1d1至c6d1为约1.8mg/kg。
49、在一些实施例中,nhl是侵袭性nhl(例如,新生(de novo)dlbcl、转化的fl或3b级fl)。在一些实施例中,nhl为dlbcl。在一些实施例中,nhl为r/r mcl。
50、在一个方面,本发明提供一种治疗患有cd20阳性细胞增生性疾病的受试者群体的方法,该方法包括在包括至少第一给药周期和第二给药周期的给药方案中向受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)双特异性抗体的第一剂量(c1d1)、双特异性抗体的第二剂量(c1d2)和双特异性抗体的第三剂量(c1d3),其中双特异性抗体的c1d1介于约0.02mg至约2.0mg之间(例如,介于约0.05mg至约2mg之间、介于约0.1mg至约2mg之间、介于约0.5mg至约2mg之间、介于约0.5mg至约1.5mg之间、介于约0.8mg至约1.2mg之间、介于约0.5mg至约1mg之间或介于约1mg至约2mg之间,例如约0.5mg、约0.8mg、约0.9mg、约1mg、约1.1mg、约1.2mg、约1.5mg或约2mg),双特异性抗体的c1d2介于约0.05mg至约5mg之间(例如,介于约0.1mg至约5mg之间、介于约0.1mg至约4mg之间、介于约0.1mg至约3mg之间、介于约0.5mg至约3mg之间、介于约1mg至约3mg之间、介于约1.5mg至约2.5mg之间、介于约1.8mg至约2.2mg之间、介于约3mg至约5mg之间、介于约2mg至约4mg之间或介于约1mg至约5mg之间;例如约0.5mg、约1mg、约1.5mg、约1.8mg、约1.9mg、约2mg、约2.1mg、约2.2mg、约2.5mg、约3mg、约4mg或约5mg),且双特异性抗体的c1d3为约9mg、约13.5mg、约20mg或约40mg;和(ii)单次剂量(c1d1)的抗cd79b抗体药物缀合物;并且(b)第二给药周期包括:(i)双特异性抗体的单次剂量(c2d1),其中双特异性抗体的c2d1在量上与c1d3大约相等;和(ii)抗cd79b抗体药物缀合物的单次剂量(c2d1),其中抗cd79b抗体药物缀合物的c1d1和抗cd79b抗体药物缀合物的c2d1各自为约1.8mg/kg。
51、在另一方面,本发明提供一种治疗患有cd20阳性细胞增生性疾病的受试者群体的方法,该方法包括在包括至少第一给药周期和第二给药周期的给药方案中向受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)双特异性抗体的第一剂量(c1d1)、双特异性抗体的第二剂量(c1d2)和双特异性抗体的第三剂量(c1d3),其中双特异性抗体的c1d1为约1mg,双特异性抗体的c1d2为约2mg,双特异性抗体的c1d3为约9mg、约13.5mg、约20mg或约40mg;和(ii)抗cd79b抗体药物缀合物的单次剂量(c1d1);并且(b)第二给药周期包括:(i)双特异性抗体的单次剂量(c2d1),其中双特异性抗体的c2d1在量上与c1d3大约相等;和(ii)抗cd79b抗体药物缀合物的单次剂量(c1d1),其中抗cd79b抗体药物缀合物的c1d1和抗cd79b抗体药物缀合物的c2d1各自为约1.8mg/kg。
52、在另一方面,本发明提供一种治疗患有cd20阳性细胞增生性疾病的受试者群体的方法,该方法包括在包括八个或更多个给药周期的给药方案中,向受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括:(i)双特异性抗体的第一剂量(c1d1)、双特异性抗体的第二剂量(c1d2)和双特异性抗体的第三剂量(c1d3),其中双特异性抗体的c1d1介于约0.02mg至约2.0mg之间(例如,介于约0.05mg至约2mg之间、介于约0.1mg至约2mg之间、介于约0.5mg至约2mg之间、介于约0.5mg至约1.5mg之间、介于约0.8mg至约1.2mg之间、介于约0.5mg至约1mg、或介于约1mg至约2mg之间,例如约0.5mg、约0.8mg、约0.9mg、约1mg、约1.1mg、约1.2mg、约1.5mg或约2mg),双特异性抗体的c1d2介于约0.05mg至约5mg之间(例如,介于约0.1mg至约5mg之间、介于约0.1mg至约4mg之间、介于约0.1mg至约3mg之间、介于约0.5mg至约3mg、介于约1mg至约3mg之间、介于约1.5mg至约2.5mg之间、介于约3mg至约5mg之间、介于约2mg至约4mg之间或介于1mg至约5mg之间;例如,约0.5mg、约1mg、约1.5mg、约1.8mg、约1.9mg、约2mg、约2.1mg、约2.2mg、约2.5mg、约3mg、约4mg或约5mg),且双特异性抗体的c1d3为约9mg、约13.5mg、约20mg或约40mg;和(ii)单次剂量(c1d1)的抗cd79b抗体药物缀合物;(b)第二给药周期包括双特异性抗体的单次剂量(c2d1)和抗cd79b抗体药物缀合物的单次剂量(c2d1);(c)第三给药周期包括双特异性抗体的单次剂量(c3d1)和抗cd79b抗体药物缀合物的单次剂量(c3d1);(d)第四给药周期包括双特异性抗体的单次剂量(c4d1)和抗cd79b抗体药物缀合物的单次剂量(c4d1);(e)第五给药周期包括双特异性抗体的单次剂量(c5d1)和抗cd79b抗体药物缀合物的单次剂量(c5d1);(f)第六给药周期包括双特异性抗体的单次剂量(c6d1)和抗cd79b抗体药物缀合物的单次剂量(c6d1);(g)第七给药周期包括双特异性抗体的单次剂量(c7d1)并且不包含施用抗cd79b抗体药物缀合物;并且(h)第八给药周期包括双特异性抗体的单次剂量(c8d1)并且不包括施用抗cd79b抗体药物缀合物,其中双特异性抗体的各单次剂量c2d1-c8d1在量上大约等于c1d3,并且其中抗cd79b抗体药物缀合物的各单次剂量c1d1至c6d1为约1.8mg/kg。
53、在另一方面,本发明提供一种治疗患有cd20阳性细胞增生性疾病的受试者群体的方法,该方法包括在包括八个或更多个给药周期的给药方案中,向受试者施用抗cd79b抗体药物缀合物和与cd20和cd3结合的双特异性抗体,其中:(a)第一给药周期包括双特异性抗体的第一剂量(c1d1)、双特异性抗体的第二剂量(c1d2)和双特异性抗体的第三剂量,其中双特异性抗体的c1d1介于约0.02mg至约5.0mg之间,c1d2介于约0.05mg至约60mg之间,并且c1d3为约9mg、约13.5mg、约20mg或约40mg;(b)第二给药周期包括双特异性抗体的单次剂量(c2d1)和抗cd79b抗体药物缀合物的单次剂量(c2d1);(c)第三给药周期包括双特异性抗体的单次剂量(c3d1)和抗cd79b抗体药物缀合物的单次剂量(c3d1);(d)第四给药周期包括双特异性抗体的单次剂量(c4d1)和抗cd79b抗体药物缀合物单次剂量(c4d1);(e)第五给药周期包括双特异性抗体的单次剂量(c5d1)和抗cd79b抗体药物缀合物的单次剂量(c5d1);(f)第六给药周期包括双特异性抗体的单次剂量(c6d1)和抗cd79b抗体药物缀合物的单次剂量(c6d1);(g)第七给药周期包括双特异性抗体的单次剂量(c7d1)并且不包含施用抗cd79b抗体药物缀合物;并且(h)第八给药周期包括双特异性抗体的单次剂量(c8d1)并且不包含施用抗cd79b抗体药物缀合物,其中双特异性抗体的各单次剂量c2d1-c8d1在量上大约等于c1d3,其中抗cd79b抗体药物缀合物的各单次剂量c1d1至c6d1为约1.8mg/kg。
54、在一些实施例中,cd20阳性细胞增生性疾病是nhl。在一些实施例中,总体反应率为至少55%(例如,至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%;例如,介于55%和100%之间、介于55%和90%之间、介于55%和80%之间、介于55%和70%之间、介于55%和65%之间、介于55%和60%之间、介于60%和65%之间、介于60%和70%之间、介于60%和90%之间、或介于70%和90%之间;例如,约55%、约60%、约65%、约66%、约67%、约68%、约69%、约70%、约75%、约80%、约85%、约90%、或约95%)。在一些实施例中,总体反应率为至少65%。在一些实施例中,完全反应率为至少45%(例如,至少50%、至少55%、至少60%、至少65%、至少70%、至少80%、至少85%、至少90%、或至少95%;例如,介于45%和100%之间、介于45%和80%之间、介于45%和60%之间、介于45%和55%之间、介于45%和50%之间、介于50%和55%之间、介于50%和65%之间、介于50%和70%之间、介于60%和70%之间、或介于70%和90%之间;例如,约45%、约50%、约53%、约54%、约55%、约56%、约57、约60%、约65%、约70%、约75%、约80%、约85%、约90%、或约95%)。在一些实施例中,完全反应率为至少55%。
55、在一些实施例中,cd20阳性细胞增生性疾病是侵袭性nhl(例如,新生dlbcl、转化的fl或3b级fl)。在一些实施例中,总体反应率为至少50%(例如,至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、或至少95%;例如介于50%和100%之间、介于50%和80%之间、介于50%和60%之间、介于50%和55%之间、介于55%和60%之间、介于55%和65%之间、介于50%和70%之间、介于60%和70%、或介于70%和90%之间;例如约50%、约55%、约60%、约61%、约62%、约63%、约64%、约65%、约70%、约75%、约80%、约85%、约90%、或约95%)。在一些实施例中,总体反应率为至少60%。在一些实施例中,完全反应率为至少35%(例如,至少40%、至少45%、至少50%、至少55%、至少60%、至少70%、至少80%、或至少90%;例如,介于35%和100%之间、介于35%和80%之间、介于35%和60%之间、介于35%和55%之间、介于35%和50%之间、介于35%和45%之间、介于40%和60%之间、介于45%和50%之间、介于45%和55%之间、介于45%和60%之间、或介于50%和70%之间;例如,约35%、约40%、约45%、约46%、约47%、约48%、约49%、约50%、约55%、约60%、约70%、约80%、约90%、或约95%)。在一些实施例中,完全反应率为至少45%。
56、在一些实施例中,cd20阳性细胞增生性疾病是nhl,并且其中受试者群体是car-t后受试者(例如,在施用第一研究治疗(例如,抗cd20/抗cd3双特异性抗体和/或抗cd79b抗体药物缀合物;例如,莫苏尼妥珠单抗和/或泊洛妥珠单抗)之前至少30天用car-t疗法治疗的患者)。在一些实施例中,总体反应率为至少50%(例如,至少55%、至少60%、至少65%、至少70%、至少80%、至少85%、至少90%、或至少95%;例如介于50%和100%之间、介于50%和80%之间、介于50%和60%之间、介于50%和55%之间、介于55%和60%之间、介于55%和65%之间、介于50%和70%之间、介于60%和70%、或介于70%和90%之间;例如约50%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、或约95%)。在一些实施例中,总体反应率为至少55%。在一些实施例中,完全反应率为至少20%(例如,至少25%、至少30%、至少35%、至少40%、至少50%、至少60%、至少70%、或至少90%;例如,介于20%和100%之间、介于20%和80%之间、介于20%和60%之间、介于20%和40%之间、介于20%和30%之间、介于20%和25%之间、介于25%和30%之间、介于25%和35%之间、介于25%和50%之间、介于30%和60%之间、或介于50%和70%之间;例如,约20%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约35%、约50%、约60%、约70%、约80%、约90%、约95%)。在一些实施例中,完全反应率为至少25%。
57、在一些实施例中,cd20阳性细胞增生性疾病是fl。在一些实施例中,总体反应率为至少80%(例如,至少85%、至少90%、至少95%、至少97%、至少98%、或至少99%;例如,介于80%和100%之间、介于80%和95%之间、介于80%和90%之间、介于80%和85%之间、介于85%和95%之间、介于90%和100%之间或介于95%和100%之间;例如、约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%、或约100%)。在一些实施例中,总体反应率为至少90%。在一些实施例中,完全反应率为至少80%(例如,至少85%、至少90%、至少95%、至少97%、至少98%、或至少99%;例如,介于80%和100%之间、介于80%和95%之间、介于80%和90%之间、介于80%和85%之间、介于85%和95%之间、介于90%和100%之间或介于95%和100%之间;例如、约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%、或约100%)。在一些实施例中,完全反应率为至少90%。
58、在一些实施例中,双特异性抗体是莫苏尼妥珠单抗。在一些实施例中,抗cd79b抗体药物缀合物是泊洛妥珠单抗。
59、在任一上述方面的一些实施例中,该受试者为人。
- 还没有人留言评论。精彩留言会获得点赞!