用于皮下施用的包含(S)-2-((S)-2-乙酰氨基-3-(1H-吲哚-3-基)丙酰氨基)-6-重氮基-5-氧代己酸异丙酯的冻干组合物及其用途的制作方法
用于皮下施用的包含(s)-2-((s)-2-乙酰氨基-3-(1h-吲哚-3-基)丙酰氨基)-6-重氮基-5-氧代己酸异丙酯的冻干组合物及其用途
1.发明背景
2.6-重氮基-5-氧代-l-正亮氨酸(don)是一种谷氨酰胺拮抗剂,其在临床前模型中表现出治疗多种疾病诸如癌症的有前途的活性。参见,例如,ahluwalia等人,pharmac the.46:243-371(1990)。但是,don的临床开发一直受到其对人体、尤其是在肠上皮中的剂量限制毒性的阻碍。参见,例如,rosenfeld和roberts,cancer research 41:1324-1328(1981)以及lynch等人,am j clin oncol(cct)5:541-543(1982)。将don作为前药施用可能有助于减轻这种毒性。
3.us 10,336,778b2公开了用于治疗癌症和其它疾病的(s)-2-((s)-2-乙酰氨基-3-(1h-吲哚-3-基)丙酰氨基)-6-重氮基-5-氧代己酸异丙酯(“化合物1”)和don的其它前药。需要用于皮下施用给有此需要的受试者的包含化合物1的药物组合物。
4.发明简述
5.在一个方面,本公开内容提供了用于皮下施用给有此需要的受试者的包含化合物1的冻干物。
6.在另一个方面,本公开内容提供了一种冻干物,其包含化合物1和填充剂,例如,甘露醇。
7.在另一个方面,本公开内容提供了一种冻干物,其包含化合物1和基于纤维素的悬浮调节剂,例如,羧甲基纤维素钠。
8.在另一个方面,本公开内容提供了一种冻干物,其包含化合物1和基于泊洛沙姆的悬浮调节剂,例如,泊洛沙姆188。
9.在另一个方面,本公开内容提供了一种冻干物,其包含化合物1和基于卵磷脂的悬浮调节剂,例如,大豆卵磷脂。
10.在另一个方面,本公开内容提供了一种冻干物,其包含化合物1和缓冲剂,例如,l-组氨酸。
11.在另一个方面,本公开内容提供了一种包含已经悬浮在药学上可接受的赋形剂(例如,溶剂,例如,水)中的冻干物的药物组合物,所述冻干物包含化合物1。
12.在另一个方面,本公开内容提供了一种用于在有此需要的受试者中治疗癌症的方法,所述方法包含皮下地施用治疗有效量的包含冻干物的药物组合物,所述冻干物包含化合物1。
13.在另一个方面,本公开内容提供了一种制备包含化合物1的冻干物的方法。
14.在另一个方面,本公开内容提供了一种制备包含冻干物的药物组合物的方法,所述冻干物包含化合物1。
15.在另一个方面,本公开内容提供了一种试剂盒,其包含作为单一单位剂量被包装在管形瓶中的包含化合物1的冻干物。
16.附图简述
17.图1的图像显示了五种包含化合物1的冻干物的冻干饼外观。
18.图2的图像显示了悬浮于2.5ml注射用水中的包含化合物1的药物组合物的外观。
19.发明详述
20.i.本公开内容的冻干物
21.在一个实施方案中,本公开内容提供了用于皮下施用给有此需要的受试者的包含化合物1的冻干物。
22.在另一个实施方案中,本公开内容提供了一种冻干物,其包含化合物1和填充剂。在另一个实施方案中,所述化合物1/填充剂重量比是约5至约0.05。在另一个实施方案中,所述化合物1/填充剂重量比是约3至约0.1。在另一个实施方案中,所述化合物1/填充剂重量比是约1至约0.2。在另一个实施方案中,所述化合物1/填充剂重量比是约3、约2、约1、约0.9、约0.8、约0.7、约0.6、约0.5、约0.4、约0.3、约0.2或约0.1。在另一个实施方案中,所述填充剂是甘露醇。
23.在另一个实施方案中,本公开内容提供了一种冻干物,其包含化合物1和基于纤维素的悬浮调节剂。在另一个实施方案中,所述化合物1/基于纤维素的悬浮调节剂重量比是约25至约0.3。在另一个实施方案中,所述化合物1/基于纤维素的悬浮调节剂重量比是约15至约0.5。在另一个实施方案中,所述化合物1/基于纤维素的悬浮调节剂重量比是约10至约1。在另一个实施方案中,所述化合物1/基于纤维素的悬浮调节剂重量比是约5至约2。在另一个实施方案中,所述化合物1/基于纤维素的悬浮调节剂重量比是约10、约9、约8、约7.5、约7、约6、约5、约4、约3、约2.7、约2或约1。在另一个实施方案中,所述基于纤维素的悬浮调节剂是羧甲基纤维素钠。
24.在另一个实施方案中,本公开内容提供了一种冻干物,其包含化合物1和基于泊洛沙姆的悬浮调节剂。在另一个实施方案中,所述化合物1/基于泊洛沙姆的悬浮调节剂重量比是约80至约1。在另一个实施方案中,所述化合物1/基于泊洛沙姆的悬浮调节剂重量比是约40至约2。在另一个实施方案中,所述化合物1/基于泊洛沙姆的悬浮调节剂重量比是约20、约19、约18、约17、约16、约15、约14、约13、约12、约11、约10、约9、约8.8、约7、约6、约5、约4、约3或约2。在另一个实施方案中,所述基于泊洛沙姆的悬浮调节剂是泊洛沙姆188(聚氧乙烯和聚氧丙烯的共聚物)。
25.在另一个实施方案中,本公开内容提供了一种冻干物,其包含化合物1和基于卵磷脂的悬浮调节剂。在另一个实施方案中,所述化合物1/基于卵磷脂的悬浮调节剂重量比是约15至约0.15。在另一个实施方案中,所述化合物1/基于卵磷脂的悬浮调节剂重量比是约8至约0.3。在另一个实施方案中,所述化合物1/基于卵磷脂的悬浮调节剂重量比是约5至约0.6。在另一个实施方案中,所述化合物1/基于卵磷脂的悬浮调节剂重量比是约3至约1。在另一个实施方案中,所述化合物1/基于卵磷脂的悬浮调节剂重量比是约5、约4、约3、约2、约1.5、约1、约0.6。在另一个实施方案中,所述基于卵磷脂的悬浮调节剂是大豆卵磷脂。
26.在另一个实施方案中,本公开内容提供了一种冻干物,其包含化合物1和缓冲剂。在另一个实施方案中,所述化合物1/缓冲剂重量比是约50至约1。在另一个实施方案中,所述化合物1/缓冲剂重量比是约25至约10。在另一个实施方案中,所述化合物1/缓冲剂重量比是约20至约15。在另一个实施方案中,所述化合物1/缓冲剂重量比是约25、约24、约23、约22、约21、约20、约21、约20、约19、约18、约17.4、约17、约16、约15、约14、约13、约12、约11或
约10。在另一个实施方案中,所述缓冲剂是l-组氨酸。
27.在另一个实施方案中,本公开内容提供了一种冻干物,其包含:化合物1,填充剂,基于纤维素的悬浮调节剂、基于泊洛沙姆的悬浮调节剂或基于卵磷脂的悬浮调节剂中的至少一种,以及任选的缓冲剂。
28.在另一个实施方案中,本公开内容提供了一种冻干物,其包含:化合物1,填充剂,和基于纤维素的悬浮调节剂、基于泊洛沙姆的悬浮调节剂或基于卵磷脂的悬浮调节剂中的至少两种,以及任选的缓冲剂。
29.在另一个实施方案中,本公开内容提供了一种冻干物,其包含:化合物1,填充剂,基于纤维素的悬浮调节剂,基于泊洛沙姆的悬浮调节剂,和基于卵磷脂的悬浮调节剂,以及任选的缓冲剂。
30.在另一个实施方案中,本公开内容提供了一种冻干物,其包含约20%wt/wt至约45%wt/wt的化合物1和约35%wt/wt至约55%wt/wt的填充剂。
31.在另一个实施方案中,本公开内容提供了一种冻干物,其包含化合物1、甘露醇、羧甲基纤维素钠、泊洛沙姆188和大豆卵磷脂、以及任选的l-组氨酸。
32.在另一个实施方案中,本公开内容提供了一种冻干物,其包含约10mg至约120mg化合物1。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约20mg至约110mg化合物1。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约30mg至约100mg化合物1。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约40mg至约90mg化合物1。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约50mg至约80mg化合物1。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约60mg至约70mg化合物1。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约42mg、约45mg、约50mg、约55mg、约60mg、约62.5mg、约65mg、约67.5mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约105mg、约110mg或约120mg化合物1。
33.在另一个实施方案中,本公开内容提供了一种冻干物,其包含约50mg至约250mg填充剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约60mg至约210mg填充剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约70mg至约200mg填充剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约80mg至约190mg填充剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约90mg至约180mg填充剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约100mg至约170mg填充剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约110mg至约160mg填充剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约120mg至约150mg填充剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约125mg至约140mg填充剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约105、约110mg、约115mg、约120mg、约125mg、约130mg、约135mg、约140mg、约145mg、约150mg、约155mg、约160mg、约165mg、约170mg、约175mg、约180、约185mg、约190mg、约195mg、约200mg、约205mg、约210mg、约215mg或约220mg填充剂。在另一个实施方案中,所述填充剂是甘露醇。
34.在另一个实施方案中,本公开内容提供了一种冻干物,其包含约1mg至约100mg基
于纤维素的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约5mg至约75mg基于纤维素的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约5mg至约50mg基于纤维素的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约5mg至约10mg基于纤维素的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约20mg至约30mg基于纤维素的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约24mg、约25mg、约25.2mg、约26mg、约27mg、约28mg、约29mg、约30mg、约31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约44mg、约45mg、约46mg、约47mg、约48mg、约49mg或约50mg基于纤维素的悬浮调节剂。在另一个实施方案中,所述基于纤维素的悬浮调节剂是羧甲基纤维素钠。
35.在另一个实施方案中,本公开内容提供了一种冻干物,其包含约0.5mg至约70mg基于泊洛沙姆的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约1mg至约40mg基于泊洛沙姆的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约2mg至约30mg基于泊洛沙姆的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约3mg至约20mg基于泊洛沙姆的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约4mg至约10mg基于泊洛沙姆的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约3mg、约4mg、约5mg、约6mg、约7mg、约7.65mg、约8、约9、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg或约20mg基于泊洛沙姆的悬浮调节剂。在另一个实施方案中,所述基于泊洛沙姆的悬浮调节剂是泊洛沙姆188。
36.在另一个实施方案中,本公开内容提供了一种冻干物,其包含约1mg至约100mg基于卵磷脂的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约10mg至约80mg基于卵磷脂的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约20mg至约70mg基于卵磷脂的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约30mg至约60mg基于卵磷脂的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约40mg至约50mg基于卵磷脂的悬浮调节剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约30mg、约31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约44mg、约45mg、约46mg、约47mg、约48mg、约49mg、约50mg、约51mg、约52mg、约53mg、约54mg、约55mg、约56mg、约57mg、约58mg、约59或约60mg基于卵磷脂的悬浮调节剂。在另一个实施方案中,所述基于卵磷脂的悬浮调节剂是大豆卵磷脂
37.在另一个实施方案中,本公开内容提供了一种冻干物,其包含约0.1mg至约20mg缓冲剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约0.5mg至约15mg缓冲剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约1mg至约10mg缓冲剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约2mg至约8mg缓冲剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约3mg至约5mg缓冲剂。在另一个实施方案中,本公开内容提供了一种冻干物,其包含约0.1mg、约0.5mg、约1mg、约1.5mg、约2mg、约2.5mg、约3mg、约3.5mg、约3.9mg、约4mg、约4.5mg、约5mg、约5.5mg、约6mg、约6.5mg、约7mg、
约7.5mg、约8mg、约8.5mg、约9mg、约9.5mg、约10mg、约10.5mg、约11mg、约11.5mg、约12mg、约12.5mg、约13mg、约13.5mg、约14mg、约14.5mg或约15mg缓冲剂。在另一个实施方案中,所述缓冲剂是l-组氨酸。
38.本公开内容提供了下述特定实施方案:
39.实施方案i.用于皮下施用给受试者的包含约60mg至约70mg化合物1的冻干物。
40.实施方案ii.实施方案i的冻干物,其包含约125mg至约140mg填充剂,例如,甘露醇。
41.实施方案iii.实施方案i或ii的冻干物,其包含约8mg至约30mg基于纤维素的悬浮调节剂,例如,羧甲基纤维素钠。
42.实施方案iv.实施方案i-iii中的任一个的冻干物,其包含约5mg至约10mg基于泊洛沙姆的悬浮调节剂,例如,泊洛沙姆188。
43.实施方案v.实施方案i-iv中的任一个的冻干物,其包含约40mg至约50mg基于卵磷脂的悬浮调节剂,例如,大豆卵磷脂。
44.实施方案vi.实施方案i-v中的任一个的冻干物,其包含约2mg至约5mg缓冲剂,例如,l-组氨酸。
45.本公开内容提供了下述特定实施方案:
46.实施方案i-a.用于皮下施用给受试者的包含约110mg至约130mg化合物1的冻干物。
47.实施方案ii-a.实施方案i-a的冻干物,其包含约110mg至约250mg填充剂,例如,甘露醇。
48.实施方案iii-a.实施方案i-a或ii-a的冻干物,其包含约5mg至约30mg基于纤维素的悬浮调节剂,例如,羧甲基纤维素钠。
49.实施方案iv-a.实施方案i-a至iii-a中的任一个的冻干物,其包含约5mg至约15mg基于泊洛沙姆的悬浮调节剂,例如,泊洛沙姆188。
50.实施方案v-a.实施方案i-a至iv-a中的任一个的冻干物,其包含约40mg至约90mg基于卵磷脂的悬浮调节剂,例如,大豆卵磷脂。
51.实施方案vi-a.实施方案i-a至v-a中的任一个的冻干物,其包含约2mg至约10mg缓冲剂,例如,l-组氨酸。
52.本公开内容的代表性冻干物(命名为l1-l5)包含下述量的化合物1、甘露醇、nacmc、泊洛沙姆188,nf、组氨酸和大豆卵磷脂:
53.[0054][0055]
在另一个实施方案中,通过karl fischer方法确定,所述冻干物的含水量是约4%或更低。在另一个实施方案中,所述冻干物的含水量是约3%或更低。在另一个实施方案中,所述冻干物的含水量是约2%或更低。在另一个实施方案中,所述冻干物的含水量是约1%或更低。在另一个实施方案中,所述冻干物的含水量是约0.9%。在另一个实施方案中,所述冻干物的含水量是约0.8%。在另一个实施方案中,所述冻干物的含水量是约0.7%。在另一个实施方案中,所述冻干物的含水量是约0.6%。在另一个实施方案中,所述冻干物的含水量是约0.5%。在另一个实施方案中,所述冻干物的含水量是约0.4%。在另一个实施方案中,所述冻干物的含水量是约0.3%。在另一个实施方案中,所述冻干物的含水量是约0.2%。在另一个实施方案中,所述冻干物的含水量是约0.1%。
[0056]
在另一个实施方案中,通过hplc测得,所述冻干物中化合物1的化学纯度是约96%至约99.9%。在另一个实施方案中,所述冻干物中化合物1的化学纯度是约96%。在另一个实施方案中,所述冻干物中化合物1的化学纯度是约96.5%。在另一个实施方案中,所述冻干物中化合物1的化学纯度是约97%。在另一个实施方案中,所述冻干物中化合物1的化学纯度是约97.5%。在另一个实施方案中,所述冻干物中化合物1的化学纯度是约98%。在另一个实施方案中,所述冻干物中化合物1的化学纯度是约98.5%。在另一个实施方案中,所述冻干物中化合物1的化学纯度是约99.0%。在另一个实施方案中,所述冻干物中化合物1的化学纯度是约99.5%。
[0057]
在另一个实施方案中,本公开内容提供了一种冻干物,其包含约67.5mg化合物1、约135mg甘露醇、约25.2mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸和约45mg大豆卵磷脂。
[0058]
在另一个实施方案中,本公开内容提供了一种冻干物,其基本上由约67.5mg化合物1、约135mg甘露醇、约25.2mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸和约45mg大豆卵磷脂组成。
[0059]
在另一个实施方案中,本公开内容提供了一种冻干物,其由约67.5mg化合物1、约135mg甘露醇、约25.2mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸和约45mg大豆卵磷脂组成。
[0060]
在另一个实施方案中,本公开内容提供了一种冻干物,其包含约67.5mg化合物1、约135mg甘露醇、约9.0mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸和约45mg大豆卵磷脂。
[0061]
在另一个实施方案中,本公开内容提供了一种冻干物,其基本上由约67.5mg化合物1、约135mg甘露醇、约9.0mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸和约45mg大豆卵磷脂组成。
[0062]
在另一个实施方案中,本公开内容提供了一种冻干物,其由约67.5mg化合物1、约135mg甘露醇、约9.0mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸和约45mg大豆卵磷脂组成。
[0063]
在另一个实施方案中,本公开内容提供了一种冻干物,其包含约62.5mg化合物1、约125mg甘露醇、约8.33mg羧甲基纤维素钠、约7.08mg泊洛沙姆188、约4.31mg l-组氨酸和约41.7mg大豆卵磷脂。
[0064]
在另一个实施方案中,本公开内容提供了一种冻干物,其基本上由约62.5mg化合物1、约125mg甘露醇、约8.33mg羧甲基纤维素钠、约7.08mg泊洛沙姆188、约4.31mg l-组氨酸和约41.7mg大豆卵磷脂组成。
[0065]
在另一个实施方案中,本公开内容提供了一种冻干物,其由约62.5mg化合物1、约125mg甘露醇、约8.33mg羧甲基纤维素钠、约7.08mg泊洛沙姆188、约4.31mg l-组氨酸和约41.7mg大豆卵磷脂组成。
[0066]
在另一个实施方案中,本公开内容提供了一种冻干物,其包含约120.2mg化合物1、约240.4mg甘露醇、约16mg羧甲基纤维素钠、约13.6mg泊洛沙姆188、约8.3mg l-组氨酸、约80.2mg大豆卵磷脂。
[0067]
在另一个实施方案中,本公开内容提供了一种冻干物,其基本上由约120.2mg化合物1、约240.4mg甘露醇、约16mg羧甲基纤维素钠、约13.6mg泊洛沙姆188、约8.3mg l-组氨酸、约80.2mg大豆卵磷脂组成。
[0068]
在另一个实施方案中,本公开内容提供了一种冻干物,其由约120.2mg化合物1、约240.4mg甘露醇、约16mg羧甲基纤维素钠、约13.6mg泊洛沙姆188、约8.3mg l-组氨酸、约80.2mg大豆卵磷脂组成。
[0069]
在另一个实施方案中,本公开内容提供了一种冻干物,其包含约120.2mg化合物1、约120.2mg甘露醇、约8mg羧甲基纤维素钠、约6.8mg泊洛沙姆188、约4.1mg l-组氨酸、约40.1mg大豆卵磷脂。
[0070]
在另一个实施方案中,本公开内容提供了一种冻干物,其基本上由约120.2mg化合物1、约120.2mg甘露醇、约8mg羧甲基纤维素钠、约6.8mg泊洛沙姆188、约4.1mg l-组氨酸、约40.1mg大豆卵磷脂组成。
[0071]
在另一个实施方案中,本公开内容提供了一种冻干物,其由约120.2mg化合物1、约120.2mg甘露醇、约8mg羧甲基纤维素钠、约6.8mg泊洛沙姆188、约4.1mg l-组氨酸、约40.1mg大豆卵磷脂组成。
[0072]
在该部分中描述的冻干物被统称为“本公开内容的冻干物”。
[0073]
ii.本公开内容的药物组合物
[0074]
在另一个实施方案中,本公开内容提供了一种药物组合物,其包含悬浮在溶剂中
的本公开内容的冻干物。在一个实施方案中,所述溶剂包含水。在一个实施方案中,所述溶剂是水,例如,美国药典无菌注射用水。
[0075]
在另一个实施方案中,本公开内容提供了一种药物组合物,其包含悬浮在溶剂中的本公开内容的冻干物,其中化合物1的浓度是约20mg/ml至约60mg/ml,例如,约24mg/ml至约35mg/ml。在另一个实施方案中,化合物1的浓度是约25mg/ml至约30mg/ml。在另一个实施方案中,化合物1的浓度是约20mg/ml。在另一个实施方案中,化合物1的浓度是约21mg/ml。在另一个实施方案中,化合物1的浓度是约22mg/ml。在另一个实施方案中,化合物1的浓度是约23mg/ml。在另一个实施方案中,化合物1的浓度是约24mg/ml。在另一个实施方案中,化合物1的浓度是约25mg/ml。在另一个实施方案中,化合物1的浓度是约26mg/ml。在另一个实施方案中,化合物1的浓度是约27mg/ml。在另一个实施方案中,化合物1的浓度是约28mg/ml。在另一个实施方案中,化合物1的浓度是约29mg/ml。在另一个实施方案中,化合物1的浓度是约30mg/ml。在另一个实施方案中,化合物1的浓度是约31mg/ml。在另一个实施方案中,化合物1的浓度是约32mg/ml。在另一个实施方案中,化合物1的浓度是约33mg/ml。在另一个实施方案中,化合物1的浓度是约34mg/ml。在另一个实施方案中,化合物1的浓度是约35mg/ml。在另一个实施方案中,化合物1的浓度是约40mg/ml。在另一个实施方案中,化合物1的浓度是约45mg/ml。在另一个实施方案中,化合物1的浓度是约50mg/ml。在另一个实施方案中,化合物1的浓度是约55mg/ml。在另一个实施方案中,化合物1的浓度是约60mg/ml。
[0076]
在另一个实施方案中,本公开内容提供了一种药物组合物,其包含悬浮在溶剂中的本公开内容的冻干物,其中在2-8℃在3天以后,所述悬浮液中化合物1的平均粒度分布是约0.1μm至约50μm。在另一个实施方案中,在2-8℃在3天以后,所述悬浮液中化合物1的平均粒度分布是约1μm至约40μm。在另一个实施方案中,在2-8℃在3天以后,所述悬浮液中化合物1的平均粒度分布是约10μm至约30μm。在另一个实施方案中,所述悬浮液中化合物1的平均粒度分布是约10μm至约30μm。在另一个实施方案中,在2-8℃在3天以后,所述悬浮液中化合物1的平均粒度分布是约10μm。在另一个实施方案中,在2-8℃在3天以后,所述悬浮液中化合物1的平均粒度分布是约15μm。在另一个实施方案中,在2-8℃在3天以后,所述悬浮液中化合物1的平均粒度分布是约20μm。在另一个实施方案中,在2-8℃在3天以后,所述悬浮液中化合物1的平均粒度分布是约25μm。
[0077]
在另一个实施方案中,本公开内容提供了一种药物组合物,其包含约67.5mg化合物1、约135mg甘露醇、约25.2mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸、约45mg大豆卵磷脂和约2.5ml美国药典无菌注射用水(wfi usp)。
[0078]
在另一个实施方案中,本公开内容提供了一种药物组合物,其基本上由约67.5mg化合物1、约135mg甘露醇、约25.2mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸、约45mg大豆卵磷脂和约2.5ml美国药典无菌注射用水组成。
[0079]
在另一个实施方案中,本公开内容提供了一种药物组合物,其由约67.5mg化合物1、约135mg甘露醇、约25.2mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸、约45mg大豆卵磷脂和约2.5ml美国药典无菌注射用水组成。
[0080]
在另一个实施方案中,本公开内容提供了一种药物组合物,其包含约67.5mg化合物1、约135mg甘露醇、约9.0mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸、约45mg大豆卵磷脂和约2.25ml美国药典无菌注射用水。
[0081]
在另一个实施方案中,本公开内容提供了一种药物组合物,其基本上由约67.5mg化合物1、约135mg甘露醇、约9.0mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸、约45mg大豆卵磷脂和约2.25ml美国药典无菌注射用水组成。
[0082]
在另一个实施方案中,本公开内容提供了一种药物组合物,其由约67.5mg化合物1、约135mg甘露醇、约9.0mg羧甲基纤维素钠、约7.65mg泊洛沙姆188、约3.88mg l-组氨酸、约45mg大豆卵磷脂和约2.25ml美国药典无菌注射用水组成。
[0083]
在另一个实施方案中,本公开内容提供了一种药物组合物,其包含约62.5mg化合物1、约125mg甘露醇、约8.33mg羧甲基纤维素钠、约7.08mg泊洛沙姆188、约4.31mg l-组氨酸、约41.7mg大豆卵磷脂和约2.5ml美国药典无菌注射用水。
[0084]
在另一个实施方案中,本公开内容提供了一种药物组合物,其基本上由约62.5mg化合物1、约125mg甘露醇、约8.33mg羧甲基纤维素钠、约7.08mg泊洛沙姆188、约4.31mg l-组氨酸、约41.7mg大豆卵磷脂和约2.5ml美国药典无菌注射用水组成。
[0085]
在另一个实施方案中,本公开内容提供了一种药物组合物,其由约62.5mg化合物1、约125mg甘露醇、约8.33mg羧甲基纤维素钠、约7.08mg泊洛沙姆188、约4.31mg l-组氨酸、约41.7mg大豆卵磷脂和约2.5ml美国药典无菌注射用水组成。
[0086]
在另一个实施方案中,本公开内容提供了一种药物组合物,其包含约120.2mg化合物1、约240.4mg甘露醇、约16mg羧甲基纤维素钠、约13.6mg泊洛沙姆188、约8.3mg l-组氨酸、约80.2mg大豆卵磷脂和约2.5ml美国药典无菌注射用水。
[0087]
在另一个实施方案中,本公开内容提供了一种药物组合物,其基本上由约120.2mg化合物1、约240.4mg甘露醇、约16mg羧甲基纤维素钠、约13.6mg泊洛沙姆188、约8.3mg l-组氨酸、约80.2mg大豆卵磷脂和约2.5ml美国药典无菌注射用水组成。
[0088]
在另一个实施方案中,本公开内容提供了一种药物组合物,其由约120.2mg化合物1、约240.4mg甘露醇、约16mg羧甲基纤维素钠、约13.6mg泊洛沙姆188、约8.3mg l-组氨酸、约80.2mg大豆卵磷脂和约2.5ml美国药典无菌注射用水组成。
[0089]
在另一个实施方案中,本公开内容提供了一种药物组合物,其包含约120.2mg化合物1、约120.2mg甘露醇、约8.0mg羧甲基纤维素钠、约6.8mg泊洛沙姆188、约4.1mg l-组氨酸、约40.1mg大豆卵磷脂和约2.5ml美国药典无菌注射用水。
[0090]
在另一个实施方案中,本公开内容提供了一种药物组合物,其基本上由约120.2mg化合物1、约120.2mg甘露醇、约8.0mg羧甲基纤维素钠、约6.8mg泊洛沙姆188、约4.1mg l-组氨酸、约40.1mg大豆卵磷脂和约2.5ml美国药典无菌注射用水组成。
[0091]
在另一个实施方案中,本公开内容提供了一种药物组合物,其由约120.2mg化合物1、约120.2mg甘露醇、约8.0mg羧甲基纤维素钠、约6.8mg泊洛沙姆188、约4.1mg l-组氨酸、约40.1mg大豆卵磷脂和约2.5ml美国药典无菌注射用水组成。
[0092]
在另一个实施方案中,本公开内容提供了一种药物组合物,其包含冻干物l1、l2、l3、l4或l5(参见上表)和1ml wfi usp、1.5ml wfi usp、2.0ml wfi usp、2.5ml wfi usp、3.0ml wfi usp、3.5ml wfi usp、4.0ml wfi usp、4.5ml wfi usp或5ml wfi usp。
[0093]
在该部分中描述的药物组合物被统称为“本公开内容的药物组合物”。
[0094]
iii.治疗方法
[0095]
在另一个实施方案中,本公开内容提供了一种用于在有此需要的受试者中治疗癌
症的方法,所述方法包含给所述受试者皮下地施用治疗有效量的本公开内容的药物组合物。
[0096]
在另一个实施方案中,本公开内容提供了一种用于在有此需要的受试者中治疗癌症的方法,所述方法包含给所述受试者皮下地施用治疗有效量的本公开内容的药物组合物、以及一种或多种任选的治疗剂。
[0097]
在另一个实施方案中,本公开内容提供了用于在受试者中治疗癌症的本公开内容的药物组合物。
[0098]
在另一个实施方案中,本公开内容提供了用于在受试者中治疗癌症的本公开内容的药物组合物,其中将皮下地施用本公开内容的药物组合物、以及一种或多种任选的治疗剂。
[0099]
在另一个实施方案中,根据间歇给药方案将本公开内容的药物组合物皮下地施用给所述受试者。例如,每周3天在非连续天,例如,星期一-星期三-星期五,或每周2天在非连续天,例如,星期一和星期四,可以将本公开内容的药物组合物施用给受试者。
[0100]
在一个实施方案中,所述癌症是实体瘤。
[0101]
在另一个实施方案中,所述癌症是血液学癌症。在另一个实施方案中,所述血液学癌症是急性淋巴细胞性白血病、慢性淋巴细胞性白血病(包括b-细胞慢性淋巴细胞性白血病)或急性髓样白血病。
[0102]
在另一个实施方案中,所述癌症是表1的癌症中的任何一种或多种。
[0103]
表1
[0104]
[0105]
[0106][0107]
在另一个实施方案中,所述癌症是表2的癌症中的任何一种或多种。
[0108]
表2
[0109]
急性淋巴细胞性白血病(all)急性嗜酸性粒细胞性白血病急性髓样白血病(aml)急性红白血病慢性淋巴细胞性白血病(cll)急性成淋巴细胞性白血病小淋巴细胞性淋巴瘤(sll)急性巨核母细胞性白血病多发性骨髓瘤(mm)急性单核细胞性白血病霍奇金淋巴瘤(hl)急性早幼粒细胞性白血病非霍奇金淋巴瘤(nhl)急性骨髓性白血病套细胞淋巴瘤(mcl)b-细胞幼淋巴细胞性白血病边缘区b细胞淋巴瘤b-细胞淋巴瘤脾边缘区淋巴瘤malt淋巴瘤滤泡性淋巴瘤(fl)前体t-成淋巴细胞性淋巴瘤沃尔登斯特伦巨球蛋白血症(wm)t-细胞淋巴瘤弥漫性大b细胞性淋巴瘤(dlbcl)肥大细胞白血病边缘区淋巴瘤(mzl)成年t细胞白血病/淋巴瘤毛细胞白血病(hcl)侵袭性nk-细胞白血病伯基特氏淋巴瘤(bl)血管免疫母细胞性t-细胞淋巴瘤richter氏转化 [0110]
在另一个实施方案中,所述癌症选自由以下成员组成的集合:头和颈的鳞状细胞癌(scchn)、食管的腺癌鳞状细胞癌、胃的腺癌、结肠的腺癌、肝细胞癌、胆道系统的胆管癌、胆囊的腺癌、胰腺的腺癌、乳房的原位导管癌、乳房的腺癌、肺的腺癌、肺的鳞状细胞癌、膀胱的移行细胞癌、膀胱的鳞状细胞癌、子宫颈的鳞状细胞癌、子宫颈的腺癌、子宫内膜癌、阴茎鳞状细胞癌和皮肤的鳞状细胞癌。
[0111]
在另一个实施方案中,癌变前肿瘤选自由以下成员组成的集合:头和颈的白斑、巴雷特食管、胃的组织转化、结肠的腺瘤、慢性肝炎、胆管增生、胰腺上皮内瘤形成、肺的非典型腺瘤性增生、膀胱的发育异常、宫颈上皮内瘤形成、阴茎上皮内瘤形成和皮肤的光化性角化病。
[0112]
在另一个实施方案中,所述癌症选自由以下成员组成的集合:肝细胞癌、胶质母细胞瘤、肺癌、乳腺癌、头颈癌、前列腺癌、黑素瘤和结肠直肠癌。
[0113]
在另一个实施方案中,所述癌症选自由以下成员组成的集合:结肠直肠癌、乳腺
癌、淋巴瘤、黑素瘤、肾癌和肺癌。
[0114]
在另一个实施方案中,所述癌症已经变得对常规癌症治疗具有抗性。本文中使用的术语“常规癌症治疗”表示任何癌症药物、生物制品或放射疗法,或癌症药物和/或生物制品和/或放射疗法的组合,它们已经经过试验和/或被美国食品和药品监督管理局、欧洲药品管理局或类似的管理机构批准用于人类中的治疗用途。
[0115]
iv.任选的治疗剂
[0116]
在本公开内容的某些治疗方法和用途中,将本公开内容的药物组合物作为单一药剂施用给患有癌症的受试者。在本公开内容的其它治疗方法和用途中,将本公开内容的药物组合物与一种或多种任选的治疗剂联合施用给患有癌症的受试者。在一个实施方案中,将本公开内容的药物组合物与一种任选的治疗剂联合施用。在另一个实施方案中,将本公开内容的药物组合物与两种任选的治疗剂联合施用。在另一个实施方案中,将本公开内容的药物组合物与三种任选的治疗剂联合施用。可用于治疗癌症患者的任选治疗剂包括本领域已知的那些以及在将来开发的那些。
[0117]
以提供其期望治疗效果的量施用任选的治疗剂。每种任选的治疗剂的有效剂量范围是本领域已知的,并且任选的治疗剂在这样的确定的范围内施用给有此需要的个体。
[0118]
本公开内容的药物组合物和任选的治疗剂可以作为多单位剂量以任何顺序分开施用,例如,其中在任选的治疗剂之前施用本公开内容的药物组合物,或反之亦然。可以向受试者施用一个或多个剂量的本公开内容的药物组合物和任选的治疗剂。
[0119]
在一个实施方案中,所述任选治疗剂包含一种或多种免疫检验点抑制剂。免疫检验点抑制剂的例子包括pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂、lag3抑制剂、tim3抑制剂、cd47抑制剂、tigit抑制剂和b7-h1抑制剂。因而,在一个实施方案中,所述免疫检验点抑制剂选自由以下成员组成的集合:pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂、lag3抑制剂、tim3抑制剂和cd47抑制剂。
[0120]
在另一个实施方案中,所述免疫检验点抑制剂是程序性细胞死亡(pd-1)抑制剂。pd-1是一种t-细胞共抑制性受体,其在肿瘤细胞的逃避宿主免疫系统的能力中起着关键作用。pd-1和pd-l1(pd-1的配体)之间的相互作用的阻断会增强免疫功能并介导抗肿瘤活性。pd-1抑制剂的例子包括特异性地结合pd-1的抗体。特定抗-pd-1抗体包括、但不限于纳武单抗、派姆单抗、sti-a1014、pidilzumab和西米普利单抗(cemiplimab-rwlc)。关于抗-pd-1抗体的可用性、生产方法、作用机理和临床研究的一般讨论,参见u.s.2013/0309250、u.s.6,808,710、u.s.7,595,048、u.s.8,008,449、u.s.8,728,474、u.s.8,779,105、u.s.8,952,136、u.s.8,900,587、u.s.9,073,994、u.s.9,084,776,和naido等人,british journal of cancer 111:2214-19(2014)。
[0121]
在另一个实施方案中,所述免疫检验点抑制剂是pd-l1(也被称作b7-h1或cd274)抑制剂。pd-l1抑制剂的例子包括特异性地结合pd-l1的抗体。特定抗-pd-l1抗体包括、但不限于阿维鲁单抗、阿特朱单抗、度伐利尤单抗和bms-936559。关于可用性、生产方法、作用机理和临床研究的一般讨论,参见u.s.8,217,149、u.s.2014/0341917、u.s.2013/0071403、wo 2015036499和naido等人,british journal of cancer111:2214-19(2014)。
[0122]
在另一个实施方案中,所述免疫检验点抑制剂是ctla-4抑制剂。ctla-4也被称作细胞毒性的t-淋巴细胞抗原4,是一种下调免疫系统的蛋白受体。ctla-4被表征为结合抗原
呈递细胞上的共刺激性分子的“制动器”,其阻止与t细胞上的cd28的相互作用并且还产生明显的抑制信号,该信号限制t细胞活化。ctla-4抑制剂的例子包括特异性地结合ctla-4的抗体。特定抗-ctla-4抗体包括、但不限于伊匹木单抗和曲美木单抗。关于可用性、生产方法、作用机理和临床研究的一般讨论,参见u.s.6,984,720、u.s.6,207,156和naido等人,british journal of cancer 111:2214-19(2014)。
[0123]
在另一个实施方案中,所述免疫检验点抑制剂是lag3抑制剂。lag3(淋巴细胞活化基因3)是一种调节t细胞稳态、增殖和活化的负共刺激性受体。此外,已经报道,lag3参与调节性t细胞(tregs)抑制功能。大部分的lag3分子被保留在靠近微管组织中心的细胞中,并且仅在抗原特异性的t细胞活化后被诱导。u.s.2014/0286935。lag3抑制剂的例子包括特异性地结合lag3的抗体。特定抗-lag3抗体包括、但不限于gsk2831781。关于可用性、生产方法、作用机理和研究的一般讨论,参见,u.s.2011/0150892、u.s.2014/0093511、u.s.20150259420和huang等人,immunity 21:503-13(2004)。
[0124]
在另一个实施方案中,所述免疫检验点抑制剂是tim3抑制剂。tim3(t-细胞免疫球蛋白和粘蛋白结构域3)是一种免疫检验点受体,其作用是限制th1和tc1 t-细胞应答的持续时间和强度。由于tim3在功能失调的cd8
+
t细胞和tregs(它们是两种据报道在肿瘤组织中构成免疫抑制的免疫细胞群体)上的表达,tim3途径被认为是抗癌免疫疗法的靶标。anderson,cancer immunology research 2:393-98(2014)。tim3抑制剂的例子包括特异性地结合tim3的抗体。关于tim3抑制剂的可用性、生产方法、作用机理和研究的一般讨论,参见u.s.20150225457、u.s.20130022623、u.s.8,522,156、ngiow等人,cancer res 71:6567-71(2011)、ngiow,等人,cancer res 71:3540-51(2011)和anderson,cancer immunology res 2:393-98(2014)。
[0125]
在另一个实施方案中,所述免疫检验点抑制剂是cd47抑制剂。参见unanue,e.r.,pnas 110:10886-87(2013)。
[0126]
在另一个实施方案中,所述免疫检验点抑制剂是tigit抑制剂。参见和guillerey,clin exp immunol 200:108-119(2019)。
[0127]
所述一种或多种免疫检验点抑制剂以治疗有效量施用给受试者。这些量由标准临床实践指导,例如,根据与免疫检验点抑制剂相关的处方信息。
[0128]
例如,当免疫检验点抑制剂是单克隆抗体时,可以每2-4周作为静脉内输注施用约1至约2000mg。例如,可以施用约10mg、约20mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1100mg、约1200mg、约1300mg、约1400mg、约1500mg、约1600mg、约1700mg、约1800mg、约1900mg或约2000mg抗体。
[0129]
例如,当免疫检验点抑制剂是纳武单抗时,可以每2周通过静脉内输注给受试者施用240mg,或可以每4周通过静脉内输注施用480mg。
[0130]
例如,当免疫检验点抑制剂是派姆单抗时,可以每3周通过静脉内输注给受试者施用200mg,或可以每6周通过静脉内输注给受试者施用400mg。
[0131]
例如,当免疫检验点抑制剂是阿维鲁单抗时,可以每2周通过静脉内输注给受试者施用800mg。
[0132]
例如,当免疫检验点抑制剂是阿特朱单抗时,可以每2周通过静脉内输注施用840mg,或可以每3周通过静脉内输注施用1200mg,或可以每4周通过静脉内输注施用1680mg。
[0133]
例如,当免疫检验点抑制剂是伊匹木单抗时,可以每3周通过静脉内输注给受试者施用3mg/kg。
[0134]
例如,当免疫检验点抑制剂是曲美木单抗时,可以每4周通过静脉内输注给受试者施用3-20mg/kg。
[0135]
例如,当免疫检验点抑制剂是gsk2831781时,可以每2-4周通过静脉内输注给受试者施用1.5至5mg/kg。
[0136]
治疗某些癌症的某些免疫检验点抑制剂的代表性给药方案提供在表3中。
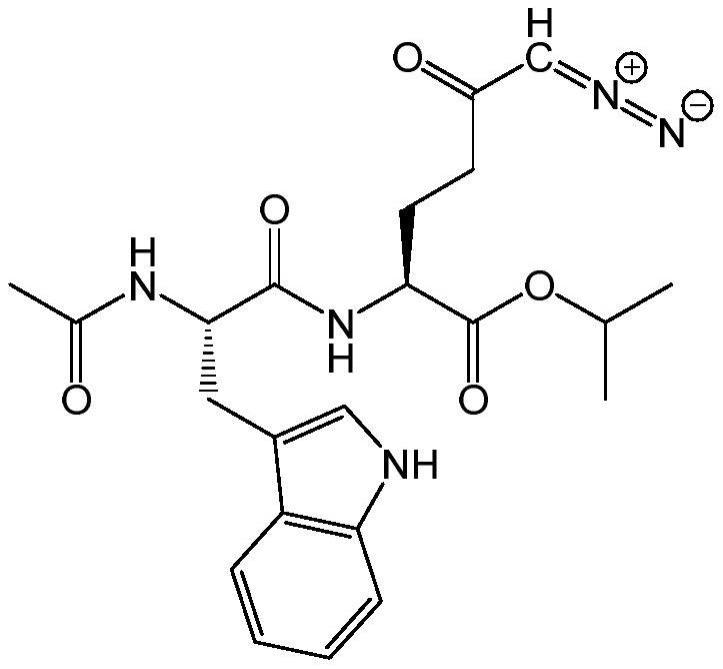
[0137]
表3
[0138][0139]
[0140]
在一个实施方案中,所述免疫检验点抑制剂是抗体,并且每2-4周通过静脉内输注给受试者施用1-20mg/kg。在另一个实施方案中,每2-4周通过静脉内输注给受试者施用20-2000mg抗体。在另一个实施方案中,在施用所述抗体之前施用化合物1。在另一个实施方案中,在施用所述抗体当天之前1、2、3、4、5、6或7天给受试者施用化合物1。在另一个实施方案中,在施用所述抗体当天给受试者施用化合物1。在另一个实施方案中,在施用所述抗体当天之后1、2、3、4、5、6或7天给受试者施用化合物1。
[0141]
例如,所述受试者接受每3周通过静脉内输注施用的派姆单抗和每周两次通过皮下输注施用的化合物1,其中在派姆单抗的第一剂量之前施用化合物1的第一剂量,在派姆单抗的第一剂量同一天施用化合物1的第一剂量,或在派姆单抗的第一剂量之后施用化合物1的第一剂量,例如,直到疾病进展或直到不存在治疗益处。
[0142]
例如,所述受试者接受每2周通过静脉内输注施用的纳武单抗和每周两次通过皮下输注施用的化合物1,其中在纳武单抗的第一剂量之前施用化合物1的第一剂量,在纳武单抗的第一剂量同一天施用化合物1的第一剂量,或在纳武单抗的第一剂量之后施用化合物1的第一剂量,例如,直到疾病进展或直到不存在治疗益处。
[0143]
在另一个实施方案中,用化合物1和一种或多种免疫检验点抑制剂对癌症患者的治疗比当单独施用免疫检验点抑制剂时更快地诱导抗增殖应答。
[0144]
术语“抗体”意在包括完整的单克隆抗体、多克隆抗体、由至少两个完整抗体形成的多特异性抗体和抗体片段,只要它们表现出期望的生物活性即可。在另一个实施方案中,“抗体”意在包括不具有抗体的fc部分的可溶性受体。在一个实施方案中,所述抗体是借助于重组基因工程制备的人源化单克隆抗体及其片段。
[0145]
另一类免疫检验点抑制剂包括结合并阻断t细胞上的pd-1受体而不触发抑制剂信号转导的多肽。这样的肽包括如美国专利8,114,845中所公开的b7-dc多肽、b7-h1多肽、b7-1多肽和b7-2多肽及其可溶性片段。
[0146]
另一类免疫检验点抑制剂包括具有抑制pd-1信号传递的肽部分的化合物。这样的化合物的例子公开在美国专利8,907,053中。
[0147]
另一类免疫检验点抑制剂包括某些代谢酶的抑制剂,诸如由浸润性髓样细胞和肿瘤细胞表达的吲哚胺2,3双加氧酶(ido)和在白血病细胞中发生突变的异柠檬酸脱氢酶(idh)。idh酶的突变体导致2-羟基戊二酸(2-hydroxyglutarate,2-hg)的水平升高,其阻止髓样分化。stein等人,blood 130:722-31(2017);wouters,blood 130:693-94(2017)。特定突变体idh阻滞剂包括、但不限于艾伏尼布和恩西地平甲磺酸盐。dalle和dinardo,ther adv hematol 9(7):163-73(2018);nassereddine等人,onco targets ther 12:303-08(2018)。ido酶通过耗竭t细胞中的合成代谢功能所必需的氨基酸或通过合成能够改变淋巴细胞功能的细胞溶质受体的特定天然配体来抑制免疫应答。pardoll,nature reviews.cancer12:252-64(2012);cancer immunol immunother 58:153-57(2009)。特定ido阻滞剂包括、但不限于左旋-1-甲基色氨酸(l-1mt)和1-甲基-色氨酸(1mt)。qian等人,cancer res 69:5498-504(2009);和等人,cancer immunol immunother 58:153-7(2009)。
[0148]
在一个实施方案中,所述免疫检验点抑制剂是纳武单抗、派姆单抗、皮地利珠单抗、sti-a1110、阿维鲁单抗、阿特朱单抗、度伐利尤单抗、sti-a1014、伊匹木单抗、曲美木单
抗、gsk2831781、bms-936559或med14736。
[0149]
在另一个实施方案中,所述任选的治疗剂是表观遗传药物。本文中使用的术语“表观遗传药物”表示靶向表观遗传调节剂的治疗剂。表观遗传调节剂的例子包括组蛋白赖氨酸甲基转移酶、组蛋白精氨酸甲基转移酶、组蛋白脱甲基酶、组蛋白脱乙酰基酶、组蛋白乙酰基酯酶和dna甲基转移酶。组蛋白脱乙酰基酶抑制剂包括、但不限于伏立诺他和乳酸帕比司他。
[0150]
可以与本公开内容的药物组合物联合使用的常规疗法和抗癌剂的另外例子包括外科手术、放射疗法(例如,γ-辐射、中子束放射疗法、电子束放射疗法、质子疗法、近距离放射疗法和全身性放射性同位素)、内分泌疗法、生物应答调节剂(例如干扰素、白介素、肿瘤坏死因子(tnf))、高热和冷冻疗法、减轻任何不良作用的药剂(例如,止吐药)、以及任何其它经批准的生物学疗法或化学疗法(例如,使用药物通过杀死癌细胞或通过阻止它们分裂来阻止癌细胞生长的治疗方案)。化学疗法可以通过口服、注射或输注或在皮肤上施用,取决于所治疗的癌症的类型和阶段。
[0151]
非限制性的示例性的抗增殖化合物包括:芳香酶抑制剂;抗雌激素;抗雄激素;促性激素释放素激动剂;拓扑异构酶i抑制剂;拓扑异构酶ii抑制剂;微管活性剂;烷化剂,例如,替莫唑胺;类视色素,类胡萝卜素,或生育酚;环加氧酶抑制剂;mmp抑制剂;mtor抑制剂;抗代谢药;铂化合物;甲硫氨酸氨肽酶抑制剂;二膦酸盐;抗增殖抗体;类肝素酶抑制剂;ras致癌异形体的抑制剂;端粒末端转移酶抑制剂;蛋白酶体抑制剂;用于治疗恶性血液病的化合物;flt-3抑制剂;hsp90抑制剂;驱动蛋白纺锤体蛋白抑制剂;mek抑制剂;抗肿瘤抗生素;亚硝基脲;靶向/降低蛋白或脂质激酶活性的化合物,靶向/降低蛋白或脂质磷酸酶活性的化合物,或任何其它抗血管生成的化合物。
[0152]
非限制性的示例性的芳香酶抑制剂包括类固醇,诸如阿他美坦、依西美坦和福美坦,和非类固醇,诸如氨鲁米特、洛太米特、吡啶并格鲁米特、曲洛司坦、睾内酯、酮康唑、伏氯唑、法倔唑、阿那曲唑和来曲唑。
[0153]
非限制性的抗雌激素包括他莫昔芬、氟维司群、雷洛昔芬和盐酸雷洛昔芬。抗雄激素包括、但不限于比卡鲁胺和阿帕鲁胺。促性激素释放素激动剂包括、但不限于阿巴瑞克、戈舍瑞林和醋酸戈舍瑞林。
[0154]
非限制性的示例性的拓扑异构酶i抑制剂包括托泊替康、吉马替康、伊立替康、喜树碱及其类似物、9-硝基喜树碱和大分子喜树碱缀合物pnu-166148。拓扑异构酶ii抑制剂包括、但不限于蒽环类抗生素,诸如多柔比星、柔红霉素、表柔比星、伊达比星和奈莫柔比星;蒽醌,诸如米托蒽醌和洛索蒽醌;和鬼臼毒素,诸如依托泊苷和替尼泊苷。
[0155]
微管活性剂包括微管稳定化合物、微管失稳化合物和微管蛋白聚合抑制剂,包括、但不限于紫杉烷,诸如紫杉醇和多西他赛;圆皮海绵内酯;秋水仙碱和埃博霉素及其衍生物。
[0156]
非限制性的示例性的烷化剂包括环磷酰胺、异环磷酰胺、美法仑、曲贝替定和亚硝基脲,诸如卡莫司汀和洛莫司汀。
[0157]
非限制性的示例性的基质金属蛋白酶抑制剂(“mmp抑制剂”)包括胶原肽模拟物和非肽模拟物抑制剂、四环素衍生物、巴马司他、马立马司他、普啉司他、metastat、bms-279251、bay 12-9566、taa211、mmi270b和aaj996。
[0158]
非限制性的示例性的mtor抑制剂包括抑制哺乳动物雷帕霉素靶蛋白(mtor)且具有抗增殖活性的化合物诸如西罗莫司、依维莫司、cci-779和abt578。
[0159]
非限制性的示例性的抗代谢药包括5-氟尿嘧啶(5-fu)、卡培他滨、吉西他滨、dna脱甲基化化合物(诸如5-氮胞苷和地西他滨)、甲氨蝶呤和依达曲沙和叶酸拮抗剂(诸如培美曲塞)。
[0160]
非限制性的示例性的铂化合物包括卡铂、顺铂(cis-platin)、顺铂(cisplatinum)和奥沙利铂。
[0161]
非限制性的示例性的甲硫氨酸氨肽酶抑制剂包括bengamide或其衍生物和ppi-2458。
[0162]
非限制性的示例性的二膦酸盐包括羟乙磷酸、氯甲双磷酸、替鲁膦酸、帕米磷酸、阿仑膦酸、伊班膦酸、利塞膦酸和唑来膦酸。
[0163]
非限制性的示例性的类肝素酶抑制剂包括靶向、降低或抑制硫酸肝素降解的化合物,诸如pi-88和ogt2115。
[0164]
非限制性的示例性的靶向、降低或抑制的ras的致癌活性的化合物包括法呢基转移酶抑制剂,诸如l-744832、dk8g557、替匹法尼和洛那法尼。
[0165]
非限制性的示例性的端粒末端转移酶抑制剂包括靶向、降低或抑制端粒末端转移酶的活性的化合物,诸如抑制端粒末端转移酶受体的化合物,诸如端粒抑素。
[0166]
非限制性的示例性的蛋白酶体抑制剂包括靶向、降低或抑制蛋白酶体的活性的化合物,包括、但不限于硼替佐米。在某些实施方案中,所述蛋白酶体抑制剂是卡非佐米或伊沙佐米。
[0167]
非限制性的示例性的fms-样酪氨酸激酶抑制剂,作为靶向、降低或抑制fms-样酪氨酸激酶受体(flt-3r)的活性的化合物,包括吉瑞替尼、干扰素、ι-β-d-阿拉伯呋喃糖基胞嘧啶(阿糖胞苷)和白消安;和alk抑制剂,作为靶向、降低或抑制间变性淋巴瘤激酶的化合物,包括阿来替尼、布加替尼和劳拉替尼。
[0168]
非限制性的示例性的flt-3抑制剂包括pkc412、米哚妥林、星形孢菌素衍生物、su11248、mln518和吉瑞替尼。
[0169]
非限制性的示例性的hsp90抑制剂包括靶向、降低或抑制hsp90的固有atp酶活性的化合物;或通过泛素蛋白酶体途径降解、靶向、降低或抑制hsp90客户蛋白的化合物。靶向、降低或抑制hsp90的固有atp酶活性的化合物特别地是抑制hsp90的atp酶活性的化合物、蛋白或抗体,诸如17-烯丙基氨基、17-脱甲氧基格尔德霉素(17aag)、格尔德霉素衍生物;其它格尔德霉素相关化合物;根赤壳菌素和hdac抑制剂。
[0170]
非限制性的示例性的蛋白酪氨酸激酶和/或丝氨酸和/或苏氨酸激酶抑制剂或脂质激酶抑制剂包括:a)靶向、降低或抑制血小板衍生的生长因子受体(pdgfr)的活性的化合物,诸如靶向、降低或抑制pdgfr的活性的化合物,包括奥拉单抗和n-苯基-2-嘧啶-胺衍生物,诸如伊马替尼、sulol、su6668和gfb-111;b)靶向、降低或抑制成纤维细胞生长因子受体(fgfr)的活性的化合物,诸如厄达替尼和乐伐替尼;c)靶向、降低或抑制胰岛素-样生长因子受体i(igf-ir)的活性的化合物,诸如布加替尼;d)靶向、降低或抑制血管内皮生长因子受体(vegfr)的活性的化合物,诸如乐伐替尼;e)靶向、降低或抑制trk受体酪氨酸激酶家族的活性的化合物,或蝶素(ephrin)b4抑制剂,诸如拉罗替尼;f)靶向、降低或抑制axl受体酪
氨酸激酶家族的活性的化合物;g)靶向、降低或抑制ret受体酪氨酸激酶的活性的化合物,诸如阿来替尼;h)靶向、降低或抑制kit/scfr受体酪氨酸激酶的活性的化合物,诸如伊马替尼;i)靶向、降低或抑制c-kit受体酪氨酸激酶的活性的化合物,诸如伊马替尼;j)靶向、降低或抑制c-abl家族的成员、其基因融合产物(例如bcr-abl激酶)和突变体的活性的化合物,诸如n-苯基-2-嘧啶-胺衍生物,诸如伊马替尼或尼洛替尼;pd180970;ag957;nsc 680410;pd173955;或达沙替尼;k)靶向、降低或抑制丝氨酸/苏氨酸激酶的蛋白激酶c(pkc)和raf家族的成员、mek、src、jak、fak、pdk1、pkb/akt和ras/mapk家族成员的成员、和/或细胞周期蛋白依赖性的激酶家族(cdk)的成员的活性的化合物,诸如在美国专利号5,093,330中公开的星形孢菌素衍生物,诸如米哚妥林;其它化合物的例子包括ucn-01、沙芬戈、bay 43-9006、苔藓抑素1、哌立福新;伊莫福新;ro 318220和ro 320432;go 6976;isis 3521;ly333531/ly379196;异喹啉化合物;法呢基转移酶抑制剂;pd184352或qan697或at7519;阿贝西利;比美替尼;考比替尼;康奈非尼;奈拉替尼;帕博西尼;瑞博西尼;l)靶向、降低或抑制蛋白-酪氨酸激酶的活性的化合物,诸如阿卡替尼、甲磺酸伊马替尼或酪氨酸磷酸化抑制剂,诸如酪氨酸磷酸化抑制剂a23/rg-50810;ag 99;酪氨酸磷酸化抑制剂ag 213;酪氨酸磷酸化抑制剂ag 1748;酪氨酸磷酸化抑制剂ag 490;酪氨酸磷酸化抑制剂b44;酪氨酸磷酸化抑制剂b44(+)对映异构体;酪氨酸磷酸化抑制剂ag 555;ag 494;酪氨酸磷酸化抑制剂ag 556,ag957和adaphostin(4-{[(2,5-二羟基苯基)甲基]氨基}-苯甲酸金刚烷基酯;nsc 680410,adaphostin);m)靶向、降低或抑制受体酪氨酸激酶(egfr、erbb2、erbb3、erbb4作为同源或异源二聚体)及其突变体的表皮生长因子家族的活性的化合物,诸如布加替尼、cp 358774、zd 1839、zm 105180;曲妥珠单抗、西妥昔单抗、吉非替尼、厄洛替尼、奥希替尼、达可替尼、奈昔木单抗、奈拉替尼、osi-774、cl-1033、ekb-569、gw-2016、抗体el.l、e2.4、e2.5、e6.2、e6.4、e2.11、e6.3和e7.6.3和7h-吡咯并-[2,3-d]嘧啶衍生物;n)靶向、降低或抑制磷脂酰肌醇3-激酶(pi3k)的活性的化合物,诸如阿培利司、库潘尼西和达维利西;和o)靶向、降低或抑制c-met受体的活性的化合物。
[0171]
非限制性的示例性的靶向、降低或抑制蛋白或脂质磷酸酶的活性的化合物包括磷酸酶1、磷酸酶2a或cdc25的抑制剂,诸如冈田酸或其衍生物。
[0172]
其它血管生成的化合物包括具有与蛋白或脂质激酶抑制无关的另一种其活性机制的化合物,例如,沙利度胺和tnp-470。
[0173]
另外的、非限制性的、示例性的化疗化合物(其中一种或多种可以与本公开内容的药物组合物联合使用)包括:安维汀、柔红霉素、阿霉素、阿糖胞苷、vp-16、替尼泊苷、米托蒽醌、伊达比星、卡铂、pkc412、6-巯基嘌呤(6-mp)、磷酸氟达拉滨、奥曲肽、som230、fty720、6-硫鸟嘌呤、克拉屈滨、6-巯基嘌呤、喷司他丁、羟基脲、2-羟基-lh-异吲哚-l,3-二酮衍生物,l-(4-氯苯胺基)-4-(4-吡啶基甲基)酞嗪或其药学上可接受的盐、1-(4-氯苯胺基)-4-(4-吡啶基甲基)酞嗪琥珀酸盐、血管抑素、内皮他丁、邻氨基苯甲酸酰胺、zd4190、zd6474、su5416、su6668、贝伐珠单抗、rhumab、rhufab、macugon;flt-4抑制剂、flt-3抑制剂、vegfr-2iggi抗体、rpi 4610、卟吩姆钠、阿奈可他、曲安西龙、氢化可的松、11-a-epihydrocotisol、皮甾酮、17a-羟孕酮、皮质酮、去氧皮质酮、睾酮、雌酮、地塞米松、肤轻松、植物生物碱、激素化合物和/或拮抗剂、生物应答调节剂诸如淋巴因子或干扰素、反义寡核苷酸或寡核苷酸衍生物、shrna和sirna。
[0174]
许多合适的任选的治疗剂(例如,抗癌剂)被考虑用于本文提供的治疗方法中。实际上,本文提供的方法可以包括、但不限于施用众多任选的治疗剂,诸如:诱导细胞凋亡的药剂;多核苷酸(例如,反义、核酶、sirna);多肽(例如,酶和抗体);生物模拟物(例如,棉酚或bh3模拟物);与bcl-2家族蛋白诸如bax结合(例如,寡聚化或形成复合物)的药剂;生物碱;烷化剂;抗肿瘤抗生素;抗代谢药;激素;铂化合物;单克隆或多克隆抗体(例如,与抗癌药物、毒素、防卫素缀合的抗体)、毒素;放射性核素;生物应答调节剂(例如,干扰素(例如,ifn-α)和白介素(例如,il-2));过继免疫疗法药剂;造血生长因子;诱导肿瘤细胞分化的药剂(例如,全反式-视黄酸);基因疗法药剂(例如,反义疗法药剂和核苷酸);肿瘤疫苗;血管生成抑制剂;蛋白酶体抑制剂:nf-кb调节剂;抗-cdk化合物;hdac抑制剂;等。适合与所公开的化合物共同施用的任选的治疗剂(诸如化疗化合物和抗癌疗法)的众多其它例子是本领域技术人员已知的。
[0175]
在某些实施方案中,任选的治疗剂包含诱导或刺激细胞凋亡的药剂。诱导或刺激细胞凋亡的药剂包括,例如,与dna相互作用或修饰dna(诸如通过嵌入、交联、烷基化或以其它方式破坏或化学修饰dna)的药剂。诱导细胞凋亡的药剂包括、但不限于辐射(例如,x-射线、γ射线、uv);肿瘤坏死因子(tnf)相关的因子(例如,tnf家族受体蛋白、tnf家族配体、trail、针对trail-r1或trail-r2的抗体);激酶抑制剂(例如,表皮生长因子受体(egfr)激酶抑制剂)。另外的抗癌剂包括:血管生长因子受体(vgfr)激酶抑制剂、成纤维细胞生长因子受体(fgfr)激酶抑制剂、血小板衍生的生长因子受体(pdgfr)激酶抑制剂和bcr-abl激酶抑制剂(诸如格列卫));反义分子;抗体(例如,赫赛汀、rituxan、泽娃灵和安维汀);抗雌激素(例如,雷洛昔芬和他莫昔芬);抗雄激素(例如,氟他胺、阿帕鲁胺、比卡鲁胺、非那雄胺、氨鲁米特、酮康唑和皮质类固醇);bcl-2抑制剂(例如,维奈托克);环加氧酶2(cox-2)抑制剂(例如,塞来考昔、美洛昔康、ns-398和非甾体类抗炎药物(nsaid));抗炎药物(例如,保泰松、地卡特隆、deltasone、地塞米松、dexamethasone intensol、dexone、hexadrol、羟氯喹、meticorten、oradexon、orasone、羟布宗、pediapred、保泰松、plaquenil、泼尼松龙、泼尼松、prelone和tandearil);和癌症化疗药物(例如,伊立替康(camptosar)、cpt-11、氟达拉滨(福达华)、达卡巴嗪(dtic)、地塞米松、米托蒽醌、麦罗塔、vp-16、顺铂、卡铂、奥沙利铂、5-fu、多柔比星、吉西他滨、硼替佐米、吉非替尼、贝伐珠单抗、泰索帝或泰素);细胞信号传递分子;神经酰胺和细胞因子;星形孢菌素等。
[0176]
在再其它的实施方案中,本文提供的治疗方法包括给患有癌症的受试者(癌症患者)施用治疗有效量的本公开内容的药物组合物、免疫检验点抑制剂和至少一种另外的任选的治疗剂,例如,选自烷化剂、抗代谢药和天然产物(例如,草药和其它植物和/或动物衍生的化合物)的抗过度增殖剂或抗肿瘤剂。
[0177]
适用于本发明方法的烷化剂包括、但不限于:1)氮芥(例如,二氯甲基二乙胺、环磷酰胺、异环磷酰胺、美法仑(l-沙可来新);和苯丁酸氮芥);2)乙烯亚胺和甲基三聚氰胺(例如,六甲蜜胺和塞替派);3)烷基磺酸酯(例如,白消安);4)亚硝基脲(例如,卡莫司汀(bcnu);洛莫司汀(ccnu);司莫司汀(甲基环己亚硝脲);和链佐星(链脲霉素));和5)三氮烯(例如,达卡巴嗪(dtic;二甲基三氮烯咪唑羧酰胺)。
[0178]
在某些实施方案中,适用于本发明方法的抗代谢药包括、但不限于:1)叶酸类似物(例如,甲氨蝶呤(氨甲蝶呤));2)嘧啶类似物(例如,氟尿嘧啶(5-氟尿嘧啶;5-fu)、氟尿苷
(氟脱氧尿苷;fudr)和阿糖胞苷(胞嘧啶阿糖胞苷));和3)嘌呤类似物(例如,巯基嘌呤(6-巯基嘌呤;6-mp)、硫鸟嘌呤(6-硫代鸟嘌呤;tg)和喷司他丁(2'-脱氧助间型霉素))。
[0179]
在再其它实施方案中,适用于本公开内容的方法的化学治疗剂包括、但不限于:1)长春花生物碱(例如,长春碱(vlb)、长春新碱);2)表鬼臼毒素(例如,依托泊苷和替尼泊苷);3)抗生素(例如,更生霉素(放线菌素d)、柔红霉素(道诺霉素;红比霉素)、多柔比星、博来霉素、普卡霉素(普卡霉素)和丝裂霉素(丝裂霉素c));4)酶(例如,l-天门冬酰胺酶);5)生物应答调节剂(例如,干扰素-α);6)铂配位络合物(例如,顺铂(顺式-ddp)和卡铂);7)蒽二酮(例如,米托蒽醌);8)被取代的脲(例如,羟基脲);9)甲基肼衍生物(例如,丙卡巴肼(n-甲基肼;mih));10)肾上腺皮质抑制剂(例如,米托坦(o,p'-ddd)和氨鲁米特);11)肾上腺皮质类固醇(例如,泼尼松);12)孕激素(例如,羟孕酮己酸酯、醋酸甲羟孕酮和醋酸甲地孕酮);13)雌激素(例如,己烯雌酚和炔雌醇);14)抗雌激素(例如,他莫昔芬);15)雄激素(例如,丙酸睾酮和氟甲睾酮);16)抗雄激素(例如,氟他胺);和17)促性腺素释放激素类似物(例如,亮丙瑞林)。
[0180]
在癌症疗法背景下常规地使用的任何溶瘤剂可以用于本公开内容的治疗方法中。例如,美国食品和药品监督管理局(fda)保留了一份获准在美国使用的溶瘤剂的处方集。fda的国际对应机构拥有类似的处方集。本领域技术人员将理解,所有美国批准的化疗剂所需的“产品标签”描述了示例性药剂的批准适应症、给药信息、毒性数据等。
[0181]
抗癌剂进一步包括已被鉴定为具有抗癌活性的化合物。例子包括、但不限于3-ap、12-o-十四烷酰基佛波醇-13-乙酸酯、17aag、852a、abi-007、abr-217620、abt-751、adi-peg 20、ae-941、ag-013736、agro100、阿拉诺新、amg 706、抗体g250、抗瘤酮、ap23573、阿帕齐醌、apc8015、阿替莫德、atn-161、阿曲生坦、阿扎胞苷、bb-10901、bcx-1777、贝伐珠单抗、bg00001、比卡鲁胺、bms 247550、硼替佐米、苔藓抑素-1、布舍瑞林、长效聚乙二醇化天冬酰胺酶、骨化三醇、cci-779、cdb-2914、头孢克肟、西妥昔单抗、cg0070、西仑吉肽、氯法拉滨、考布他汀a4磷酸酯、cp-675、206、cp-724、714、cpg 7909、姜黄素、达雷妥尤单抗、地西他滨、denspm、地努妥昔单抗、度骨化醇、e7070、e7389、海鞘素743、乙法昔罗、依氟鸟氨酸、ekb-569、依洛珠单抗、恩扎妥林、厄洛替尼、依昔舒林、芬维a胺、夫拉平度、氟达拉滨、氟他胺、福莫司汀、fr901228、g17dt、加利昔单抗、吉非替尼、染料木黄酮、格拉吉布、葡膦酰胺、gti-2040、组氨瑞林、hki-272、高三尖杉酯碱、hsppc-96、hu14.18-白介素-2融合蛋白、humax-cd4、伊洛前列素、咪喹莫特、英夫利昔单抗、奥英妥珠单抗、白介素-12、ipi-504、伊罗夫文、伊沙匹隆、拉帕替尼、来那度胺、来妥替尼、亮丙瑞林、lmb-9免疫毒素、洛那法尼、鲁昔单抗、镥lu 177dotatate、马磷酰胺、mb07133、mdx-010、mln2704、莫格利珠单抗、单克隆抗体3f8、单克隆抗体j591、莫特沙芬、moxetumomab pasudotox-tdfk、ms-275、mva-muc1-il2、尼鲁米特、尼拉帕尼、硝基喜树碱、盐酸诺拉曲塞、诺瓦得士、ns-9、o6-苄基鸟嘌呤、奥利美生钠、onyx-015、奥戈伏单抗、osi-774、帕木单抗、伯尔定、pd-0325901、培美曲塞、phy906、吡格列酮、吡非尼酮、匹克生琼、泊洛妥珠单抗、ps-341、psc 833、pxd101、吡唑并吖啶、r115777、rad001、豹蛙酶、蝴蝶霉素类似物、重组人血管抑素蛋白、rhumab 2c4、罗格列酮、卢比替康、芦卡帕尼、s-1、s-8184、沙铂、sb-、15992、sgn-0010、sgn-40、索尼德吉、索拉非尼、sr31747a、st1571、su011248、辛二酰苯胺异羟肟酸、舒拉明、tagraxofusp-erzs、talabostat、他仑帕奈、他拉唑帕尼、他立喹达、坦罗莫司、tgfa-pe38免疫毒素、沙利度胺、
胸腺法新、替匹法尼、替拉扎明、tlk286、曲贝替定、曲氟尿苷和盐酸替吡嘧啶、葡糖醛酸三甲曲沙、trovax、ucn-1、丙戊酸、长春氟宁、vnp40101m、伏洛昔单抗、伏立诺他、vx-680、zd1839、zd6474、齐留通和三盐酸佐舒喹达。
[0182]
在一个实施方案中,所述任选治疗剂包含在表5中列出的抗癌药物或抗癌药物组合之一。
[0183]
表5
[0184]
[0185]
[0186]
[0187]
[0188]
[0189]
[0190]
[0191][0192]
关于抗癌剂和其它任选治疗剂的更详细描述,本领域技术人员参考任何数目的指导手册,包括、但不限于physician's desk reference以及goodman和gilman的“pharmaceutical basis of therapeutics”第十版,hardman等人编,2002。
[0193]
在另一个实施方案中,本文提供的治疗癌症的方法包括将本公开内容的药物组合物与辐射疗法以及任选的免疫检验点抑制剂联合施用给受试者。本文提供的方法不受用于向患者递送治疗剂量的辐射的类型、量或递送和施用系统限制。例如,所述患者可以接受光子放射疗法、粒子束辐射疗法、其它类型的放射疗法及其组合。在某些实施方案中,使用线性加速器将辐射递送至患者。在再其它的实施方案中,使用伽玛刀递送辐射。
[0194]
辐射源可以是在患者外部或内部。外部辐射疗法是最常见的,并涉及使用例如线性加速器将高能辐射束穿过皮肤引导至肿瘤部位。虽然辐射束定位至肿瘤部位,但几乎不可能避免正常的健康组织的暴露。但是,患者通常较好地耐受外部辐射。内部辐射疗法涉及在体内在肿瘤部位处或附近植入辐射发射源,诸如珠子、线、丸、胶囊、颗粒等,包括使用特异性地靶向癌细胞的递送系统(例如,使用附着至癌细胞结合配体的颗粒)。这样的植入物
可以在治疗后被移除,或留在体内处于无活性状态。内部辐射疗法的类型包括、但不限于近距离放射疗法、间质辐照、腔体内辐照、放射免疫疗法等。
[0195]
患者可以任选地接受放射敏化剂(例如,甲硝唑、米索硝唑、动脉内budr、静脉内碘脱氧尿苷(iudr)、硝基咪唑、5-取代的-4-硝基咪唑、2h-异吲哚二酮、[[(2-溴乙基)-氨基]甲基]-硝基-1h-咪唑-1-乙醇、硝基苯胺衍生物、dna亲和性的低氧选择性细胞毒素、卤化的dna配体、1,2,4苯并三嗪氧化物、2-硝基咪唑衍生物、含氟的硝基唑衍生物、苯甲酰胺、烟酰胺、吖啶-嵌入剂、5-硫代四唑衍生物、3-硝基-1,2,4-三唑、4,5-二硝基咪唑衍生物、羟基化的texaphrins、顺铂、丝裂霉素、替拉扎明、亚硝基脲、巯基嘌呤、甲氨蝶呤、氟尿嘧啶、博来霉素、长春新碱、卡铂、表柔比星、多柔比星、环磷酰胺、长春地辛、依托泊苷、紫杉醇、热(高热)等)、辐射防护剂(例如,半胱胺、二氢硫代磷酸氨基烷基酯、氨磷汀(wr 2721)、il-1、il-6等)。放射敏化剂增强对肿瘤细胞的杀死。辐射防护剂保护健康组织免于辐射的有害影响。
[0196]
可以将任何类型的辐射施用给患者,只要患者耐受辐射剂量且没有不可接受的负面副作用即可。合适类型的放射疗法包括例如电离(电磁)放射疗法(例如,x-射线或γ射线)或粒子束辐射疗法(例如,高线性能量辐射)。电离辐射被定义为包含粒子或光子的辐射,所述粒子或光子具有足够的能量来产生电离,即电子的增加或损失(如例如u.s.5,770,581中所述,其通过引用整体并入本文)。临床医师可以至少部分地控制辐射的影响。在一个实施方案中,辐射剂量被分级以实现最大的靶细胞暴露和降低的毒性。
[0197]
在一个实施方案中,施用给患者的辐射的总剂量是约0.01戈瑞(gy)至约100gy。在另一个实施方案中,在治疗过程中施用约10gy至约65gy(例如,约15gy、20gy、25gy、30gy、35gy、40gy、45gy、50gy、55gy或60gy)。虽然在某些实施方案中可以在一天的过程中施用完整辐射剂量,但理想地将总剂量分割并在几天内施用。理想地,在至少约3天的过程中施用放射疗法,例如,至少5、7、10、14、17、21、25、28、32、35、38、42、46、52或56天(约1-8周)。因此,每天的辐射剂量将包含大约1-5gy(例如,约1gy、1.5gy、1.8gy、2gy、2.5gy、2.8gy、3gy、3.2gy、3.5gy、3.8gy、4gy、4.2gy或4.5gy)或1-2gy(例如,1.5-2gy)。每天的辐射剂量应足以诱导靶细胞的破坏。如果延伸一段时间,在一个实施方案中,并非每天都施用辐射,从而允许动物休息并实现治疗的效果。例如,对于每周的治疗,理想地连续5天施用辐射,并且2天不施用,从而允许每周休息2天。但是,可以施用辐射1天/周、2天/周、3天/周、4天/周、5天/周、6天/周或所有7天/周,取决于动物的应答性和任何潜在的副作用。可以在治疗阶段中的任何时间开始辐射疗法。在一个实施方案中,在第1周或第2周开始辐射,并在治疗阶段的剩余持续时间内施用。例如,对于治疗例如实体瘤,在包含6周的治疗阶段的第1-6周或第2-6周中施用辐射。可替换地,在包含5周的治疗阶段的第1-5周或第2-5周中施用辐射。但是,这些示例性的放射疗法施用计划并不旨在限制本文提供的方法。
[0198]
v.制备本公开内容的冻干物的方法
[0199]
在另一个实施方案中,本公开内容提供了一种制备本公开内容的冻干物的方法,所述方法包含:
[0200]
(i)制备包含化合物1、填充剂和水的冻干前(pre-lyophilization)溶液;
[0201]
(ii)冷却所述冻干前溶液直到将它冷冻;和
[0202]
(iii)向所述冷冻的冻干前溶液施加真空以产生所述冻干物。
[0203]
在另一个实施方案中,所述填充剂是甘露醇。
[0204]
在另一个实施方案中,所述冻干前溶液进一步包含乙醇。在另一个实施方案中,所述冻干前溶液进一步包含叔丁醇。
[0205]
在另一个实施方案中,本公开内容提供了一种制备本公开内容的冻干物的方法,所述方法包含:
[0206]
(i)在约20℃至约50℃的温度将化合物1和填充剂(例如,甘露醇)溶解在叔丁醇、乙醇和水的混合物中以产生冻干前溶液;
[0207]
(ii)冷却所述冻干前溶液直到将它冷冻或部分冷冻;和
[0208]
(iii)向所述冷冻或部分冷冻的冻干前溶液施加真空以产生所述冻干物。
[0209]
在另一个实施方案中,在约25℃至约35℃的温度将化合物1溶解在叔丁醇、乙醇和水的混合物中。在另一个实施方案中,所述温度是约25℃至约30℃。在另一个实施方案中,所述温度是约25℃。在另一个实施方案中,所述温度是约30℃。
[0210]
在另一个实施方案中,所述冻干前溶液进一步包含羧甲基纤维素钠。在另一个实施方案中,所述冻干前溶液进一步包含泊洛沙姆188。在另一个实施方案中,所述冻干前溶液进一步包含大豆卵磷脂。在另一个实施方案中,所述冻干前溶液进一步包含l-组氨酸。在另一个实施方案中,所述冻干前溶液进一步包含乙醇、叔丁醇、羧甲基纤维素钠、泊洛沙姆188、大豆卵磷脂和l-组氨酸。
[0211]
在另一个实施方案中,所述冻干前溶液中化合物1的浓度是约1mg/ml至约15mg/ml。在另一个实施方案中,所述冻干前溶液中化合物1的浓度是约10mg/ml。
[0212]
vi.制备药物组合物的方法
[0213]
在另一个实施方案中,本公开内容提供了一种制备本公开内容的药物组合物的方法,所述方法包含将本公开内容的冻干物悬浮在溶剂中。在另一个实施方案中,所述溶剂包含水。
[0214]
vii.试剂盒
[0215]
在另一个实施方案中,本公开内容提供了一种试剂盒,其包含作为单一单位剂量包装在管形瓶中的本公开内容的冻干物。在另一个实施方案中,所述管形瓶具有塞和帽。在另一个实施方案中,所述管形瓶是玻璃瓶。
[0216]
在另一个实施方案中,本公开内容提供了用于治疗受试者的癌症的试剂盒,其包含作为单一单位剂量包装在管形瓶中的本公开内容的冻干物。
[0217]
在另一个实施方案中,所述试剂盒进一步包含关于将所述冻干物悬浮在溶剂中以产生本公开内容的药物组合物的说明书。
[0218]
在另一个实施方案中,所述试剂盒进一步包含关于将本公开内容的药物组合物施用给受试者的说明书。
[0219]
在另一个实施方案中,所述试剂盒进一步包含任选的治疗剂。
[0220]
在另一个实施方案中,所述试剂盒进一步包含适合用于将本公开内容的药物组合物皮下地施用给受试者的装置。
[0221]
viii.定义
[0222]
术语“(s)-2-((s)-2-乙酰氨基-3-(1h-吲哚-3-基)丙酰氨基)-6-重氮基-5-氧代己酸异丙酯”和“化合物1”表示具有以下结构的6-重氮基-5-氧代-l-正亮氨酸(don)的前药:
[0223][0224]
化合物1描述于us 10,336,778b2中。
[0225]
本文中使用的术语“冻干物”表示通过冻干得到的粉末。
[0226]
本文中使用的术语“冻干(lyophilization)”、“冻干(lyophilizing)”和“冻干(lyophilized)”表示冷冻干燥过程,通过该过程将化合物1冷冻,并且在仍处于冷冻状态时,通过在真空下升华来除去水和其它溶剂(如果存在的话)。可以将化合物1在有其它试剂(例如,填充剂、基于纤维素的悬浮调节剂、基于泊洛沙姆的悬浮调节剂、基于卵磷脂的悬浮调节剂、缓冲剂)存在下冻干,以便增强由此获得的冻干物的性质和/或包含冻干物的任何药物组合物的性质。
[0227]
本文中使用的术语“溶剂”表示液体(例如,水)或液体的混合物(例如,水和乙醇),其适合作为药物组合物或制剂的一部分施用给受试者。在一个实施方案中,所述溶剂包含水和一种、两种、三种或四种另外的药学上可接受的水可混溶的溶剂(例如,二氧杂环戊烷、二甲基乙酰胺、丁二醇、聚乙二醇、甘油、乙醇等或它们的组合)的组合。在另一个实施方案中,所述溶剂是水。在另一个实施方案中,所述溶剂是水和一种另外的药学上可接受的水可混溶的溶剂的组合。在另一个实施方案中,所述溶剂是水和乙醇的组合。在另一个实施方案中,所述溶剂包含水和一种、两种、三种或四种另外的药学上可接受的水不可混溶的溶剂(例如,花生油、油酸乙酯等)的组合。在另一个实施方案中,所述溶剂包含约10%至约30%的水和约70%至约90%的水可混溶的溶剂,例如,乙醇。在另一个实施方案中,所述溶剂包含约15%至约25%的水和约75%至约85%的水可混溶的溶剂。在另一个实施方案中,所述溶剂基本上由约20%的水和约80%的水可混溶的溶剂组成。
[0228]
本文中使用的术语“填充剂”表示药学上可接受的赋形剂,其为冻干饼提供结构以防止收缩和塌陷。示例性的非限制性的填充剂包括甘露醇、乳糖、蔗糖、聚乙二醇和甘氨酸。
[0229]
本文中使用的术语“基于纤维素的悬浮调节剂”表示由直链的β(1
→
4)连接的d-葡萄糖单元组成的多糖。示例性的非限制性的基于纤维素的悬浮调节剂包括羟丙基纤维素、羟基甲基纤维素和羧甲基纤维素钠。
[0230]
本文中使用的术语“基于泊洛沙姆的悬浮调节剂”表示非离子三嵌段共聚物,其包含聚氧丙烯的中心疏水链,其侧接聚氧乙烯的两条亲水链。示例性的非限制性的基于泊洛沙姆的悬浮调节剂包括泊洛沙姆188,nf(f-68)和泊洛沙姆407(f-127)。
[0231]
本文中使用的术语“基于卵磷脂的悬浮调节剂”表示一种混合物,其包含甘油磷
脂,例如,磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰丝氨酸和磷脂酸。一种示例性的非限制性的基于卵磷脂的悬浮调节剂是大豆卵磷脂。
[0232]
本文中使用的术语“缓冲剂”表示有助于在冻干过程中和在所得冻干物重构后维持ph的药学上可接受的赋形剂。示例性的非限制性的缓冲剂包括甘氨酸、l-组氨酸、磷酸盐、乙酸、乳酸、柠檬酸和tris。
[0233]
本文中使用的术语“稀释剂”表示在胃肠外施用给受试者之前用于稀释药物组合物的液体。在一个实施方案中,所述稀释剂是生理盐水、5%右旋糖、乳酸盐林格氏溶液或设计成与向人类施用(例如,通过静脉内输注)相容的任何其它无菌液体。在另一个实施方案中,所述稀释剂是生理盐水。
[0234]
本文中使用的术语“重量比”表示冻干物中化合物1的质量除以另一种试剂(例如,填充剂或缓冲剂)的质量。例如,在包含67.5mg化合物1和135mg甘露醇的冻干物中,化合物1/填充剂重量比是0.5。在包含67.5mg化合物1、135mg甘露醇和3.88mg l-组氨酸的冻干物中,化合物1/缓冲剂重量比是17.4。
[0235]
本文中使用的术语“%wt/wt”表示一种冻干物成分的质量除以所有冻干物成分的合并质量,乘以100。例如,包含62.5mg化合物1、125mg甘露醇、8.33mg羧甲基纤维素钠(nacmc)、7.08mg泊洛沙姆188,nf、4.31mg组氨酸和41.7mg大豆卵磷脂的冻干物中化合物1的%wt/wt是25.1%(62.5mg/248.92mg=0.251x 100=25.1%wt/wt)。
[0236]
本文中使用的术语“平均粒度分布”或“d
50”是这样的直径:通过激光衍射确定,其中50质量%的颗粒具有较大的当量直径,而另外50质量%的颗粒具有较小的当量直径。
[0237]
本文中使用的术语“间歇剂量施用”、“间歇给药方案”和类似的术语表示本公开内容的药物组合物向受试者的非连续施用。可用在本公开内容中的间歇剂量施用方案涵盖向有此需要的受试者提供治疗有效量的本公开内容的药物组合物的任何不连续施用方案。间歇给药方案可以使用与连续给药方案中所使用的剂量相等、更低或更高剂量的本公开内容的药物组合物。间歇剂量施用的优点包括、但不限于提高的安全性、降低的毒性(例如减少的体重减轻)、增加的暴露、增加的效力和/或增加的受试者顺应性。当本公开内容的药物组合物作为单一药剂施用时或当与一种或多种另外的治疗剂(例如,免疫检验点抑制剂)联合施用时,可以实现这些优点。
[0238]
在一个实施方案中,根据间歇给药方案将本公开内容的药物组合物施用给受试者以治疗癌症。在另一个实施方案中,所述间歇给药方案增加本公开内容的药物组合物的治疗指数。治疗指数是引起治疗效果(例如,肿瘤块减小、至肿瘤进展的时间增加和/或受试者存活时间增加)的本公开内容的药物组合物的量与引起毒性(例如体重减轻)的量的对比。
[0239]
在一个实施方案中,每隔一天将本公开内容的药物组合物施用给受试者。
[0240]
在另一个实施方案中,每周一次将本公开内容的药物组合物施用给受试者。
[0241]
在另一个实施方案中,每周两次在连续天(例如,在星期一和星期二)将本公开内容的药物组合物施用给受试者。
[0242]
在另一个实施方案中,每周两次在非连续天(例如,在星期一和星期三、在星期一和星期四或在星期二和星期五)将本公开内容的药物组合物施用给受试者。
[0243]
在另一个实施方案中,每周两次在星期一和星期四将本公开内容的药物组合物施用给受试者。
[0244]
在另一个实施方案中,每周两次在星期二和星期五将本公开内容的药物组合物施用给受试者。
[0245]
在另一个实施方案中,每周三次在连续天(例如,在星期一、星期二和星期三)将本公开内容的药物组合物施用给受试者。
[0246]
在另一个实施方案中,每周三次在非连续天(例如,在星期一、星期三和星期五)将本公开内容的药物组合物施用给受试者。
[0247]
在另一个实施方案中,每周四次在连续天(例如,在星期一、星期二、星期三和星期四)将本公开内容的药物组合物施用给受试者。
[0248]
在另一个实施方案中,每周四次在非连续天(例如,在星期一、星期二、星期四和星期五)将本公开内容的药物组合物施用给受试者。
[0249]
在另一个实施方案中,每周五次在连续天(例如,在星期一、星期二、星期三、星期四和星期五)将本公开内容的药物组合物施用给受试者。
[0250]“并行施用”、“联合施用”、“同时施用”和类似的短语是指,将两种或更多种药剂并行地施用给正在治疗的受试者。“并行地”是指,每种药剂同时地或以任何顺序在不同时间点依次施用。但是,如果不同时施用,则是指它们按顺序和在时间上足够接近地施用给个体,从而提供期望的治疗效果并且可以协同起作用。例如,本公开内容的药物组合物可以与任选的治疗剂同时或以任何顺序在不同时间点依次施用给受试者。本公开内容的药物组合物和任选的治疗剂可以以任何适当的形式并通过任何合适的途径分开施用。当本公开内容的药物组合物和任选的治疗剂不并行地施用时,应当理解,它们可以以任何顺序施用给有此需要的受试者。例如,可以在任选的治疗剂之前(例如,之前5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周或更久)、伴随地或之后(例如,之后5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周或更久)施用本公开内容的药物组合物。
[0251]
术语“一个”和“一种”表示一个/种或超过一个/种。
[0252]
本文中使用的术语“约”包括所列举的数字
±
10%。因而,“约10”是指9-11。
[0253]
本文中使用的术语“治疗(treat)”、“治疗(treating)”、“治疗(treatment)”、“治疗方法”等表示消除、减少或改善疾病或病症和/或与其相关的症状。尽管不排除,但治疗疾病或病症不需要完全消除疾病、病症或与其相关的症状。但是,在一个实施方案中,化合物1以及任选的一种或多种任选的治疗剂的施用导致癌症的缓解。
[0254]
本文中使用的术语“治疗有效量”表示足以导致障碍的一种或多种症状的改善、或预防障碍的进展或引起障碍的消退的治疗剂的量。例如,关于癌症的治疗,在一个实施方案中,治疗有效量将表示引起治疗应答的治疗剂的量,所述治疗应答是例如血细胞计数的正常化、肿瘤生长速率降低、肿瘤质量减小、转移灶数目减少、至肿瘤进展的时间增加和/或受试者存活时间增加至少约2%、至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约100%或更多。
[0255]
术语“药学上可接受的载体”或“药学上可接受的媒介物”涵盖任何标准药物载体、溶剂、表面活性剂或媒介物。合适的药学上可接受的媒介物包括水性媒介物和非水性媒介
物。标准药物载体和它们的制剂描述于remington's pharmaceutical sciences,mack publishing co.,easton,pa,1995年第19版。
[0256]
术语“容器”是指任何贮器和封闭物,其因此适用于储存、运输、分配和/或处理药物产品。在一个实施方案中,所述容器是管形瓶。
[0257]
术语“插页”是指伴随药物产品的信息,其提供如何施用所述产品的描述,以及允许医师、药剂师和患者就产品使用做出明智决定所需的安全性和效力数据。包装插页通常被视为药物产品的“标签”。
[0258]
在某些实施方案中,当联合施用时,两种或更多种药剂可以具有协同效应。本文中使用的术语“协同作用”、“协同的”、“协同地”及其派生词,诸如在“协同效应”或“协同组合”或“协同组合物”中,表示这样的情况:其中药剂与至少一种另外的治疗剂的组合的生物活性大于当单独施用时各药剂的生物活性的总和。例如,本文中使用的术语“协同地有效的”表示化合物1与一种或多种免疫检验点抑制剂之间的相互作用,其造成所述药物的总效应大于每种药物的单独效应的总和。参见,例如,berenbaum,pharmacological reviews 41:93-141(1989)。
[0259]
ix.特定实施方案
[0260]
在另一个方面,本公开内容提供了下述特定实施方案。
[0261]
实施方案1.一种冻干物,其包含化合物1和填充剂。
[0262]
实施方案2.实施方案1的冻干物,其包含约67.5mg化合物1。
[0263]
实施方案3.实施方案1或2的冻干物,其中所述化合物1/填充剂重量比是约5至约0.05。
[0264]
实施方案4.实施方案3的冻干物,其中所述化合物1/填充剂重量比是约1至约0.2。
[0265]
实施方案5.实施方案5的冻干物,其中所述化合物1/填充剂重量比是约0.5。
[0266]
实施方案6.实施方案1-5中的任一个的冻干物,其中所述填充剂是甘露醇。
[0267]
实施方案7.实施方案6的冻干物,其包含约135mg甘露醇。
[0268]
实施方案8.实施方案1-7中的任一个的冻干物,其进一步包含基于纤维素的悬浮调节剂。
[0269]
实施方案9.实施方案8的冻干物,其中所述化合物1/基于纤维素的悬浮调节剂比例是约25至约0.3。
[0270]
实施方案10.实施方案9的冻干物,其中所述化合物1/基于纤维素的悬浮调节剂重量比是约5至约2。
[0271]
实施方案11.实施方案10的冻干物,其中所述化合物1/基于纤维素的悬浮调节剂重量比是约2.7或约7.5。
[0272]
实施方案12.实施方案8-11中的任一个的方法,其中所述基于纤维素的悬浮调节剂是羧甲基纤维素钠。
[0273]
实施方案13.实施方案12的冻干物,其包含约25.2mg或约9.0mg羧甲基纤维素钠。
[0274]
实施方案14.实施方案1-13中的任一个的冻干物,其进一步包含基于泊洛沙姆的悬浮调节剂。
[0275]
实施方案15.实施方案14的冻干物,其中所述化合物1/基于泊洛沙姆的悬浮调节剂比例是约80至约1。
[0276]
实施方案16.实施方案15的冻干物,其中所述化合物1/基于泊洛沙姆的悬浮调节剂重量比是约10至约6。
[0277]
实施方案17.实施方案16的冻干物,其中所述化合物1/基于泊洛沙姆的悬浮调节剂重量比是约8.8。
[0278]
实施方案18.实施方案14-17中的任一个的冻干物,其中所述基于泊洛沙姆的悬浮调节剂是泊洛沙姆188。
[0279]
实施方案19.实施方案18的冻干物,其包含约7.65mg泊洛沙姆188。
[0280]
实施方案20.实施方案1-19中的任一个的冻干物,其进一步包含基于卵磷脂的悬浮调节剂。
[0281]
实施方案21.实施方案20的冻干物,其中所述化合物1/基于卵磷脂的悬浮调节剂比例是约20至约0.1。
[0282]
实施方案22.实施方案21的冻干物,其中所述化合物1/基于卵磷脂的悬浮调节剂重量比是约10至约0.5。
[0283]
实施方案23.实施方案22的冻干物,其中所述化合物1/基于卵磷脂的悬浮调节剂重量比是约1.5。
[0284]
实施方案24.实施方案20-23中的任一个的冻干物,其中所述基于卵磷脂的悬浮调节剂是大豆卵磷脂。
[0285]
实施方案25.实施方案24的冻干物,其包含约45mg大豆卵磷脂。
[0286]
实施方案26.实施方案1-25中的任一个的冻干物,其进一步包含缓冲剂。
[0287]
实施方案27.实施方案26的冻干物,其中所述化合物1/缓冲剂重量比是约50至约1。
[0288]
实施方案28.实施方案27的冻干物,其中所述化合物1/缓冲剂重量比是约20至约10。
[0289]
实施方案29.实施方案28的冻干物,其中所述化合物1/缓冲剂重量比是约17.4。
[0290]
实施方案30.实施方案26-29中的任一个的冻干物,其中缓冲剂是l-组氨酸。
[0291]
实施方案31.实施方案30的冻干物,其包含约3.88mg l-组氨酸。
[0292]
实施方案32.一种药物组合物,其包含实施方案1-31中的任一个的冻干物,其中所述冻干物悬浮在溶剂中。
[0293]
实施方案33.实施方案32的药物组合物,其中所述溶剂包含水。
[0294]
实施方案34.实施方案32或33的药物组合物,其中所述化合物1的浓度是约25mg/ml至约30mg/ml。
[0295]
实施方案35.实施方案32-34中的任一个的药物组合物,其中在2-8℃在3天以后,所述悬浮液中化合物1的平均粒度分布是约1μm至约30μm。
[0296]
实施方案36.一种用于在有此需要的受试者中治疗癌症的方法,所述方法包含给所述受试者施用治疗有效量的实施方案32-35中的任一个的药物组合物。
[0297]
实施方案37.实施方案36的方法,其中将所述药物组合物皮下施用给所述受试者。
[0298]
实施方案38.实施方案36或37的方法,所述方法进一步包含给所述受试者施用任选的治疗剂。
[0299]
实施方案39.一种制备实施方案1的冻干物的方法,所述方法包含:
[0300]
(i)制备包含化合物1、填充剂和水的冻干前溶液;
[0301]
(ii)冷却所述冻干前溶液直到将它冷冻或部分冷冻;和
[0302]
(iii)向所述冷冻或部分冷冻的冻干前溶液施加真空以产生所述冻干物。
[0303]
实施方案40.实施方案39的方法,其中所述填充剂是甘露醇。
[0304]
实施方案41.实施方案39或40的方法,其中所述冻干前溶液进一步包含乙醇。
[0305]
实施方案42.实施方案39-41中的任一个的方法,其中所述冻干前溶液进一步包含叔丁醇。
[0306]
实施方案43.实施方案39-42中的任一个的方法,其中所述冻干前溶液进一步包含羧甲基纤维素钠。
[0307]
实施方案44.实施方案39-43中的任一个的方法,其中所述冻干前溶液进一步包含泊洛沙姆188。
[0308]
实施方案45.实施方案39-44中的任一个的方法,其中所述冻干前溶液进一步包含大豆卵磷脂。
[0309]
实施方案46.实施方案39-45中的任一个的方法,其中所述冻干前溶液进一步包含l-组氨酸。
[0310]
实施方案47.一种制备实施方案32的药物组合物的方法,所述方法包含将所述冻干物悬浮在溶剂中。
[0311]
实施方案48.实施方案47的方法,其中所述溶剂包含水。
[0312]
实施方案49.一种试剂盒,其包含作为单一单位剂量包装在管形瓶中的实施方案1-31中的任一个的冻干物。
[0313]
实施方案50.用于在有此需要的受试者中治疗癌症的实施方案49的试剂盒。
[0314]
实施方案51.实施方案49或50的试剂盒,所述试剂盒进一步包含关于将所述冻干物悬浮在溶剂中以产生药物组合物的说明书。
[0315]
实施方案52.实施方案49-51的试剂盒,所述试剂盒进一步包含关于给所述受试者施用所述药物组合物的说明书。
[0316]
在另一个方面,本公开内容提供了下述特定实施方案。
[0317]
实施方案a1.一种冻干物,其包含约20%wt/wt至约45%wt/wt的化合物1和约35%wt/wt至约55%wt/wt的填充剂。
[0318]
实施方案a2.实施方案a1的冻干物,其进一步包含约1%wt/wt至约10%wt/wt的基于纤维素的悬浮调节剂。
[0319]
实施方案a3.实施方案a1或a2的冻干物,其进一步包含约1%wt/wt至约5%wt/wt的基于泊洛沙姆的悬浮调节剂。
[0320]
实施方案a4.实施方案a1-a3中的任一个的冻干物,其进一步包含约10%wt/wt至约20%wt/wt的基于卵磷脂的悬浮调节剂。
[0321]
实施方案a5.实施方案a1-a5中的任一个的冻干物,其进一步包含约0.5%wt/wt至约2.5%wt/wt的缓冲剂。
[0322]
实施方案a6.实施方案a1-a5中的任一个的冻干物,其包含:
[0323]
(i)约20%wt/wt至约30%wt/wt的化合物1;
[0324]
(ii)约45%wt/wt至约55%wt/wt的填充剂;
[0325]
(iii)约1%wt/wt至约9%wt/wt的基于纤维素的悬浮调节剂;
[0326]
(iv)约1%wt/wt至约4%wt/wt的基于泊洛沙姆的悬浮调节剂;
[0327]
(v)约12%wt/wt至约20%wt/wt的基于卵磷脂的悬浮调节剂;和
[0328]
(vi)约1%wt/wt至约2%wt/wt的缓冲剂。
[0329]
实施方案a7.实施方案a1-a6中的任一个的冻干物,其包含约25.1%wt/wt的化合物1。
[0330]
实施方案a8.实施方案a1-a7中的任一个的冻干物,其包含约50.2%wt/wt的填充剂。
[0331]
实施方案a9.实施方案a1-a8中的任一个的冻干物,其包含约3.3%wt/wt的基于纤维素的悬浮调节剂。
[0332]
实施方案a10.实施方案a1-a9中的任一个的冻干物,其包含约2.8%wt/wt的基于泊洛沙姆的悬浮调节剂。
[0333]
实施方案a11.实施方案a1-a10中的任一个的冻干物,其包含约16.8%wt/wt的基于卵磷脂的悬浮调节剂。
[0334]
实施方案a12.实施方案a1-a11中的任一个的冻干物,其包含约1.7%wt/wt的缓冲剂。
[0335]
实施方案a13.实施方案a1-a12中的任一个的冻干物,其中所述填充剂是甘露醇。
[0336]
实施方案a14.实施方案a1-a13中的任一个的冻干物,其中所述基于纤维素的悬浮调节剂是羧甲基纤维素钠。
[0337]
实施方案a15.实施方案a1-a14中的任一个的冻干物,其中所述基于泊洛沙姆的悬浮调节剂是泊洛沙姆188(环氧乙烷和环氧丙烷的共聚物)。
[0338]
实施方案a16.实施方案a1-a15中的任一个的冻干物,其中所述基于卵磷脂的悬浮调节剂是大豆卵磷脂。
[0339]
实施方案a17.实施方案a1-a16中的任一个的冻干物,其中所述缓冲剂是组氨酸。
[0340]
实施方案a18.实施方案a1的冻干物,其包含:
[0341]
(i)约62.5mg化合物1;
[0342]
(ii)约125mg甘露醇;
[0343]
(iii)约8.3mg羧甲基纤维素钠;
[0344]
(iv)约7.1mg泊洛沙姆188,nf;
[0345]
(v)约41.7mg大豆卵磷脂;和
[0346]
(vi)约4.3mg组氨酸。
[0347]
实施方案a19.一种药物组合物,其包含实施方案a1-a18中的任一个的冻干物,其中所述冻干物被悬浮在药学上可接受的载体中。
[0348]
实施方案a20.实施方案a19的药物组合物,其中所述药学上可接受的载体包含水。
[0349]
实施方案a21.实施方案a19或a20的药物组合物,其中所述化合物1的浓度是约20mg/ml至约60mg/ml。
[0350]
实施方案a22.实施方案a21的药物组合物,其中所述化合物1的浓度是约25mg/ml。
[0351]
实施方案a23.实施方案a19-22中的任一个的药物组合物,其中所述悬浮液中化合物1的平均粒度分布是约1μm至约30μm。
[0352]
实施方案a24.一种用于在有此需要的受试者中治疗癌症的方法,所述方法包含给所述受试者施用治疗有效量的实施方案a19-a23中的任一个的药物组合物。
[0353]
实施方案a25.实施方案a24的方法,其中所述癌症是实体瘤。
[0354]
实施方案a26.实施方案a24的方法,其中所述癌症是血液学癌症。
[0355]
实施方案a27.实施方案a24的方法,其中所述癌症是在表1中列出的癌症中的一种或多种。
[0356]
实施方案a28.实施方案a24的方法,其中所述癌症是肝细胞癌、胶质母细胞瘤、肺癌、乳腺癌、头颈癌、前列腺癌、黑素瘤或结肠直肠癌。
[0357]
实施方案a29.实施方案a24的方法,其中所述癌症是结肠直肠癌、乳腺癌、淋巴瘤、黑素瘤、肾癌或肺癌。
[0358]
实施方案a30.实施方案a24的方法,其中所述癌症是晚期实体瘤、非小细胞肺癌或头和颈的鳞状细胞癌。
[0359]
实施方案a31.实施方案a24-30中的任一个的方法,其中将所述药物组合物皮下地施用给所述受试者。
[0360]
实施方案a32.实施方案a31的方法,其中根据间歇给药方案将所述药物组合物施用给所述受试者。
[0361]
实施方案a33.实施方案a32的方法,其中每周两次在非连续天将所述药物组合物施用给所述受试者。
[0362]
实施方案a34.实施方案a24-3a3中的任一个的方法,所述方法进一步包含将一种或多种任选的治疗剂施用给所述受试者。
[0363]
实施方案a35.实施方案a34的方法,其中所述一种或多种任选的治疗剂包含一种或多种免疫检验点抑制剂。
[0364]
实施方案a36.实施方案a35的方法,其中所述一种或多种免疫检验点抑制剂包含pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂、lag3抑制剂、tim3抑制剂或tigit抑制剂或它们的组合。
[0365]
实施方案a37.实施方案a36的方法,其中所述一种或多种免疫检验点抑制剂包含抗-pd-1抗体。
[0366]
实施方案a38.实施方案a37的方法,其中所述抗-pd-1抗体是纳武单抗、派姆单抗、皮地利珠单抗、sti-a1110、(斯巴达珠单抗(spartalizumab))、jtx-4014、信迪利单抗、medi 0680、agen2034、bgb-a317、ab122、多塔利单抗(dostarlimab)、pf-06801591、西米普利单抗、替雷利珠单抗、特瑞普利单抗、卡瑞利珠单抗、sym021、jnj 63723283、hlx10、lzm009或mga012。
[0367]
实施方案a39.实施方案a35-a38中的任一个的方法,其中所述一种或多种免疫检验点抑制剂包含抗-pd-l1抗体。
[0368]
实施方案a40.实施方案a39的方法,其中所述抗-pd-l1抗体是阿维鲁单抗、阿特朱单抗、度伐利尤单抗、kn035或sti-a1014。
[0369]
实施方案a41.实施方案a35-a40中的任一个的方法,其中所述一种或多种免疫检验点抑制剂包含抗-ctla-4抗体。
[0370]
实施方案a42.实施方案a41的方法,其中所述抗-ctla-4抗体是伊匹木单抗或曲美
木单抗。
[0371]
实施方案a43.实施方案a35-a42中的任一个的方法,其中所述一种或多种免疫检验点抑制剂包含抗-lag3抗体。
[0372]
实施方案a44.实施方案a43的方法,其中所述抗-lag3抗体是gsk2831781。
[0373]
实施方案a45.实施方案a35-a44中的任一个的方法,其中所述一种或多种免疫检验点抑制剂包含抗-tim3抗体。
[0374]
实施方案a46.实施方案a35-a45中的任一个的方法,其中所述一种或多种免疫检验点抑制剂包含抗-tigit抗体。
[0375]
实施方案a47.实施方案a46的方法,其中所述抗-tigit抗体是维博利单抗(mk-7684)、替瑞利尤单抗(rg6058)、eos-448、bms-986207、bgb-a1217、mtig7192a、ab154、asp8374或mk-7684。
[0376]
实施方案a48.实施方案a35-a47中的任一个的方法,其中所述癌症对用至少一种免疫检验点抑制剂的治疗具有抗性或已经变得具有抗性。
[0377]
实施方案a49.一种试剂盒,其包含作为单一单位剂量被包装在容器中的实施方案a1-a18中的任一个的冻干物。
[0378]
实施方案a50.实施方案a49的试剂盒,所述试剂盒进一步包含关于将所述冻干物悬浮在溶剂中以产生药物组合物的说明书。
[0379]
实施方案a51.实施方案a49或a50的试剂盒,所述试剂盒进一步包含标签,所述标签具有关于如何根据实施方案a24-48中的任一个的方法使用所述试剂盒的说明书。
[0380]
实施方案a52.实施方案a51的试剂盒,其中所述标签被美国食品和药品监督管理局(fda)、欧洲药品管理局(ema)、中国食品和药品监督管理局(cfda)或日本厚生劳动省(the japanese ministry of health labor and welfare,mhlw)批准。
[0381]
实施方案a53.一种制备实施方案a1的冻干物的方法,所述方法包含:
[0382]
(i)制备包含化合物1、填充剂和水的冻干前溶液;
[0383]
(ii)冷却所述冻干前溶液直到将它冷冻或部分冷冻;和
[0384]
(iii)向所述冷冻或部分冷冻的冻干前溶液施加真空以产生所述冻干物。
[0385]
实施方案a54.实施方案a54的方法,其中所述填充剂是甘露醇。
[0386]
实施方案a55.实施方案a53或a54的方法,其中所述冻干前溶液进一步包含乙醇。
[0387]
实施方案a56.实施方案a53-a55中的任一个的方法,其中所述冻干前溶液进一步包含叔丁醇。
[0388]
实施方案a57.实施方案a53-a56中的任一个的方法,其中所述冻干前溶液进一步包含羧甲基纤维素钠。
[0389]
实施方案a58.实施方案a53-a57中的任一个的方法,其中所述冻干前溶液进一步包含泊洛沙姆188。
[0390]
实施方案a59.实施方案a53-a58中的任一个的方法,其中所述冻干前溶液进一步包含大豆卵磷脂。
[0391]
实施方案a60.实施方案a53-a59中的任一个的方法,其中所述冻干前溶液进一步包含l-组氨酸。
[0392]
实施方案a61.一种制备实施方案a19的药物组合物的方法,所述方法包含将所述
冻干物悬浮在溶剂中。
[0393]
实施方案a62.实施方案a61的方法,其中所述溶剂包含水。
[0394]
实施方案a63.一种用于实现实施方案a24-a48中的任一个的方法的试剂盒,所述试剂盒包含被包装在容器中的单一单位剂量的实施方案a1-18中的任一个的冻干物。
[0395]
实施方案a64.实施方案a63的试剂盒,所述试剂盒进一步包含关于将所述冻干物悬浮在溶剂中以产生药物组合物的说明书。
[0396]
实施方案a65.实施方案a63或a64的试剂盒,所述试剂盒进一步包含标签,所述标签被美国食品和药品监督管理局(fda)、欧洲药品管理局(ema)、中国食品和药品监督管理局(cfda)或日本厚生劳动省(mhlw)批准。
[0397]
实施方案a66.用于在有此需要的受试者中治疗癌症的实施方案a19-a23中的任一个的药物组合物。
[0398]
实施方案a67.用于实施方案a66的用途的药物组合物,其中所述癌症是实体瘤。
[0399]
实施方案a68.用于实施方案a66的用途的药物组合物,其中所述癌症是血液学癌症。
[0400]
实施方案a69.用于实施方案a66的用途的药物组合物,其中所述癌症是在表1中列出的癌症中的一种或多种。
[0401]
实施方案a70.用于实施方案a66的用途的药物组合物,其中所述癌症是肝细胞癌、胶质母细胞瘤、肺癌、乳腺癌、头颈癌、前列腺癌、黑素瘤或结肠直肠癌。
[0402]
实施方案a71.用于实施方案a66的用途的药物组合物,其中所述癌症是结肠直肠癌、乳腺癌、淋巴瘤、黑素瘤、肾癌或肺癌。
[0403]
实施方案a72.用于实施方案a66的用途的药物组合物,其中所述癌症是晚期实体瘤、非小细胞肺癌或头和颈的鳞状细胞癌。
[0404]
实施方案a73.用于实施方案a66-a72中的任一个的用途的药物组合物,其中将所述药物组合物皮下地施用给所述受试者。
[0405]
实施方案a74.用于实施方案a73的用途的药物组合物,其中根据间歇给药方案将所述药物组合物施用给所述受试者。
[0406]
实施方案a75.用于实施方案a74的用途的药物组合物,其中每周两次在非连续天将所述药物组合物施用给所述受试者。
[0407]
实施方案a76.用于实施方案a66-a75中的任一个的用途的药物组合物,其中将所述药物组合物与一种或多种任选的治疗剂一起施用给所述受试者。
[0408]
实施方案a77.用于实施方案a76的用途的药物组合物,其中所述一种或多种任选的治疗剂包含一种或多种免疫检验点抑制剂。
[0409]
实施方案a78.用于实施方案a77的用途的药物组合物,其中所述一种或多种免疫检验点抑制剂包含pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂、lag3抑制剂、tim3抑制剂或tigit抑制剂或它们的组合。
[0410]
实施方案a79.用于实施方案a78的用途的药物组合物,其中所述一种或多种免疫检验点抑制剂包含抗-pd-1抗体。
[0411]
实施方案a80.用于实施方案a79的用途的药物组合物,其中所述抗-pd-1抗体是纳武单抗、派姆单抗、皮地利珠单抗、sti-a1110、(斯巴达珠单抗)、jtx-4014、信迪利单抗、
medi 0680、agen2034、bgb-a317、ab122、多塔利单抗、pf-06801591、西米普利单抗、替雷利珠单抗、特瑞普利单抗、卡瑞利珠单抗、sym021、jnj 63723283、hlx10、lzm009或mga012。
[0412]
实施方案a81.用于实施方案a77-a80中的任一个的用途的药物组合物,其中所述一种或多种免疫检验点抑制剂包含抗-pd-l1抗体。
[0413]
实施方案a82.用于实施方案a81的用途的药物组合物,其中所述抗-pd-l1抗体是阿维鲁单抗、阿特朱单抗、度伐利尤单抗、kn035或sti-a1014。
[0414]
实施方案a83.用于实施方案a77-a82中的任一个的用途的药物组合物,其中所述一种或多种免疫检验点抑制剂包含抗-ctla-4抗体。
[0415]
实施方案a84.用于实施方案a83的用途的药物组合物,其中所述抗-ctla-4抗体是伊匹木单抗或曲美木单抗。
[0416]
实施方案a85.用于实施方案a77-a84中的任一个的用途的药物组合物,其中所述一种或多种免疫检验点抑制剂包含抗-lag3抗体。
[0417]
实施方案a86.用于实施方案a85的用途的药物组合物,其中所述抗-lag3抗体是gsk2831781。
[0418]
实施方案a87.用于实施方案a77-a86中的任一个的用途的药物组合物,其中所述一种或多种免疫检验点抑制剂包含抗-tim3抗体。
[0419]
实施方案a88.用于实施方案a77-a87中的任一个的用途的药物组合物,其中所述一种或多种免疫检验点抑制剂包含抗-tigit抗体。
[0420]
实施方案a89.用于实施方案a88的用途的药物组合物,其中所述抗-tigit抗体是维博利单抗(mk-7684)、替瑞利尤单抗(rg6058)、eos-448、bms-986207、bgb-a1217、mtig7192a、ab154、asp8374或mk-7684。
[0421]
实施方案a90.用于实施方案a77-a89中的任一个的用途的药物组合物,其中所述癌症对用至少一种免疫检验点抑制剂的治疗具有抗性或已经变得具有抗性。
[0422]
实施方案a91.实施方案a19-a23中的任一个的药物组合物在制备药物中的用途,所述药物用于在有此需要的受试者中治疗癌症。
[0423]
实施方案a92.实施方案a91的用途,其中所述癌症是实体瘤。
[0424]
实施方案a93.实施方案a91的用途,其中所述癌症是血液学癌症。
[0425]
实施方案a94.实施方案a91的用途,其中所述癌症是在表1中列出的癌症中的一种或多种。
[0426]
实施方案a95.实施方案a91的用途,其中所述癌症是肝细胞癌、胶质母细胞瘤、肺癌、乳腺癌、头颈癌、前列腺癌、黑素瘤或结肠直肠癌。
[0427]
实施方案a96.实施方案a91的用途,其中所述癌症是结肠直肠癌、乳腺癌、淋巴瘤、黑素瘤、肾癌或肺癌。
[0428]
实施方案a97.实施方案a91的用途,其中所述癌症是晚期实体瘤、非小细胞肺癌或头和颈的鳞状细胞癌。
[0429]
实施方案a98.实施方案a91-a97中的任一个的用途,其中将所述药物组合物皮下地施用给所述受试者。
[0430]
实施方案a99.实施方案a98的用途,其中根据间歇给药方案将所述药物组合物施用给所述受试者。
[0431]
实施方案a100.实施方案a99的用途,其中每周两次在非连续天将所述药物组合物施用给所述受试者。
[0432]
实施方案a101.实施方案a91-a100中的任一个的用途,其中将所述药物组合物与一种或多种任选的治疗剂一起施用给所述受试者。
[0433]
实施方案a102.实施方案a101的用途,其中所述一种或多种任选的治疗剂包含一种或多种免疫检验点抑制剂。
[0434]
实施方案a103.实施方案a102的用途,其中所述一种或多种免疫检验点抑制剂包含pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂、lag3抑制剂、tim3抑制剂或tigit抑制剂或它们的组合。
[0435]
实施方案a104.实施方案a103的用途,其中所述一种或多种免疫检验点抑制剂包含抗-pd-1抗体。
[0436]
实施方案a105.实施方案a104的用途,其中所述抗-pd-1抗体是纳武单抗、派姆单抗、皮地利珠单抗、sti-a1110、(斯巴达珠单抗)、jtx-4014、信迪利单抗、medi 0680、agen2034、bgb-a317、ab122、多塔利单抗、pf-06801591、西米普利单抗、替雷利珠单抗、特瑞普利单抗、卡瑞利珠单抗、sym021、jnj 63723283、hlx10、lzm009或mga012。
[0437]
实施方案a106.实施方案a102-a105中的任一个的用途,其中所述一种或多种免疫检验点抑制剂包含抗-pd-l1抗体。
[0438]
实施方案a107.实施方案a106的用途,其中所述抗-pd-l1抗体是阿维鲁单抗、阿特朱单抗、度伐利尤单抗、kn035或sti-a1014。
[0439]
实施方案a108.实施方案a102-a107中的任一个的用途,其中所述一种或多种免疫检验点抑制剂包含抗-ctla-4抗体。
[0440]
实施方案a109.实施方案a108的用途,其中所述抗-ctla-4抗体是伊匹木单抗或曲美木单抗。
[0441]
实施方案a110.实施方案a102-a109中的任一个的用途,其中所述一种或多种免疫检验点抑制剂包含抗-lag3抗体。
[0442]
实施方案a111.实施方案a110的用途,其中所述抗-lag3抗体是gsk2831781。
[0443]
实施方案a112.实施方案a102-a111中的任一个的用途,其中所述一种或多种免疫检验点抑制剂包含抗-tim3抗体。
[0444]
实施方案a113.实施方案a102-a112中的任一个的用途,其中所述一种或多种免疫检验点抑制剂包含抗-tigit抗体。
[0445]
实施方案a114.实施方案a113的用途,其中所述抗-tigit抗体是维博利单抗(mk-7684)、替瑞利尤单抗(rg6058)、eos-448、bms-986207、bgb-a1217、mtig7192a、ab154、asp8374或mk-7684。
[0446]
实施方案a115.实施方案a102-a114中的任一个的用途,其中所述癌症对至少一种免疫检验点抑制剂的治疗具有抗性或已经变得具有抗性。
[0447]
实施例1
[0448]
冻干物筛选研究
[0449]
研究编号1
[0450]
从在表4中提供的成分制备冻干物。在每种情况下,使用13.4mg化合物1。
[0451]
表4
[0452]
[0453][0454]
p3、p4、p7、p8和p9的冻干饼具有不同的外观,其中p7产生最最佳成形的饼。参见图1。
[0455]
在表5和表6中提供了冻干饼的筛选性能的结果。用于悬浮表6中的冻干物的溶剂是1ml注射用水(wfi)。
[0456]
表5
[0457]
[0458][0459]
*时间包括用于悬浮的时间+另外1分钟。
[0460]
表6
[0461][0462]
研究编号2
[0463]
在表7中提供了包含化合物1和其它成分的冻干物。在每种情况下,使用15mg/ml的化合物1。
[0464]
表7
[0465][0466][0467]
实施例2
[0468]
用于皮下施用给受试者的单位剂量形式的包含化合物1的药物组合物的制备
[0469]
在表8中给出了用于制备冻干物l1、l2和l3的化合物1、甘露醇、羧甲基纤维素钠、泊洛沙姆188、组氨酸和其它成分的量。
[0470]
表8
[0471]
冻干物idl1l2l3成分量(g)量(g)量(g)化合物1(g)0.067500.067500.0625甘露醇(g)0.1350.1350.125羧甲基纤维素钠*(g)0.02520.0090.00833泊洛沙姆188,nf***0.007650.007650.00708大豆卵磷脂**0.04500.04500.04167组氨酸(g)0.003880.003880.00431乙醇(g)0.3550.3550.3945乙醇(l)(d=0.789)0.0004500.0004500.0005叔丁醇(g)1.2991.22851.365叔丁醇(l)(d=0.780)0.001580.001580.00175qs至(用wfi)(l)0.00450.00450.00501m hcl(滴定至ph 6.6-6.8)(ml)0.00420.004160.00462
[0472]
*cmc钠7lf(ashland part号891158);**lipoid s 100;***spectrum chemical mfg corp.产品代码p1169
[0473]
1.溶解以产生冻干前溶液:
[0474]
首先,将甘露醇、羧甲基纤维素钠、泊洛沙姆188和组氨酸溶解在40℃的水中。溶解后,可以将溶液冷却至25℃而不出现沉淀。
[0475]
其次,使用1m hcl将溶液滴定至ph 6.6-6.8(目标6.7)。
[0476]
第三,将溶液与温热的叔丁醇和乙醇混合。
[0477]
第四,将大豆卵磷脂溶解在30℃的溶液中。
[0478]
第五,将化合物1完全溶解在30℃的溶液中(这可能需要几个小时)。该溶液任选地避光。
[0479]
第六,将温度降低至20-25℃。
[0480]
第七,使用目标qs值使溶液达到正确的质量(或体积),添加室温wfi直至达到目标。
[0481]
在室温12小时以后,l2冻干前溶液含有沉淀的固体,其可以通过在30℃混合重新溶解。
[0482]
2.无菌过滤
[0483]
使用冗余的1)millipore polysep ii预过滤器和2)冗余的millipore durapore 0.22微米胶囊过滤器对步骤1的药物产品溶液进行无菌过滤。应当将压强保持在20psi或更低。
[0484]
在l2冻干前溶液的过滤过程中发生沉淀。
[0485]
3.冻干
[0486]
最初的架子温度是室温。将架子温度降低至-40℃,并将压强降低至45毫托。保持此条件44.5小时。然后,将架子温度经历5小时升至0℃,并在该温度保持12小时。然后,将架子温度经历1小时升至35℃,并在该温度保持28小时。将架子温度经历1小时回调至室温,然
后氮气平衡,并然后插入塞子。根据以下程序之一完成冷冻/干燥。
[0487]
程序1
[0488][0489]
程序2
[0490][0491][0492]
如此得到的冻干物中化合物1的化学纯度大于或等于97%。
[0493]
4.药物组合物的制备
[0494]
对于l1和l3,将2.5ml的wfi加入冻干物中,并将容器(例如,管形瓶)摇动以产生悬浮液。对于l2,将2.25ml的wfi加入冻干物中,并将容器(例如,管形瓶)摇动以产生悬浮液。
[0495]
实施例3
[0496]
冻干物优化研究
[0497]
研究编号1
[0498]
在表9中提供了用于制备100ml规模(制备100ml的每种制剂)的冻干物l4-l11的混合成分,并在表10中提供了这些冻干物的观察结果。
[0499][0500][0501]
表10
[0502][0503]
研究编号2
[0504]
在表11中提供了用于制备100ml规模(制备100ml的每种制剂)的冻干物l12-l17的混合成分,并在表12和表13中提供了这些冻干物的观察结果。
[0505]
表11
[0506][0507][0508]
表12
[0509][0510]
表13
[0511][0512]
实施例4
[0513]
悬浮研究
[0514]
将冻干物l2(参见实施例2)悬浮于1.5、2.0、2.25和2.5ml的wfi中。该药物组合物
的试验结果提供在表14中。
[0515]
表14
[0516][0517]
*悬浮液在重构后约15-20分钟变稠,无法进行psd试验
[0518]
使用instron仪器(bd 3ml注射器,27g1/2英寸针头,注射速率1mm/s)试验注射力。在表15中提供了结果。
[0519]
表15
[0520]
wfi体积2.25ml2.5ml力(n)6.85.6注射器id(mm)8.18.1面积(mm2)51.251.2手工注射能力轻容易
[0521]
实施例5
[0522]
皮下药物组合物研究
[0523]
为了评估根据实施例2制备的l1药物组合物(也被称作e8h)在2-8℃在5天中的稳定性,进行了一项研究以确定两种浓度——用2.5ml wfi和10.0ml wfi的冻干物的悬浮液的化学和胶体稳定性。在每种浓度,使用5个管形瓶。将全部在时间零点悬浮,并随后在不同的保持时间后对其性能进行测定。关于悬浮(重构)时间和外观的数据总结在下表16中。
[0524]
表16
[0525][0526]
在前3天中,管形瓶可以容易地重新悬浮(再次摇动以获得均匀的药物产品),但在第5天,外观不再均匀。
[0527]
在整个研究过程中测量粒度分布(psd),将每个试验瓶在第0天悬浮并保持直到在其预定的试验时间重新悬浮和取样。关于psd的数据总结在表17中。
[0528]
表17
[0529][0530]
psd直到第3天是均匀的,但在第5天它已经向上转移。在为期5天的研究中,没有看到通过hplc测得的杂质变化。在第5天,在10ml重新悬浮液中看到化合物1的减少。该数据总结在表18所示的标签声明(label claim)百分比的表中。
[0531]
表18
[0532][0533]
在重新悬浮以后,试验使用0.5ml结核菌素注射器(tuberculin syringe)从药物组合物递送化合物1的准确度。在注射器中吸上150微升悬浮液并注射进容量瓶中进行测定。使用新鲜注射器进行重复试验以确认相对标准差(rsd),一式两份地进行hplc测定。将
数据列于下表中。
[0534][0535]
用10ml重构的e8h的平均%lc
[0536][0537]
用2.5ml重构的e8h的精确度和准确度
[0538][0539][0540]
用2.5ml重构的e8的平均%lc
[0541][0542]
实施例6
[0543]
l3药物组合物的使用中研究
[0544]
在该研究中,以3、6和50mg的剂量递送模拟注射以便评估化合物1在l3药物组合物的重新悬浮和施用期间的稳定性和吸收。在0、4和24小时进行测定。在表19、表20、表21和表22中提供了结果。
[0545]
表19
[0546]
管形瓶稳定性研究
[0547][0548][0549]
*低于定量限2.48μg/ml
[0550]
表20
[0551]
instron注射力测量
[0552] t0t
4小时
t
24小时
力(n)*5.56.58.0
[0553]
*注射器id:8.1mm;注射器面积:51.2mm2[0554]
表21
[0555]
注射器稳定性研究(bd 3ml注射器,27g1/2英寸针头,注射速率1mm/s)
[0556][0557][0558]
表22
[0559]
注射器递送模拟注射研究
[0560][0561]
实施例7
[0562]
药代动力学研究
[0563]
将在实施例2中描述的l1和l2药物组合物以0.83mg/kg经由皮下(sc)注射施用给狗。在皮下组中在给药前、给药后0.25、0.5、1、2、4、6、8、12、24、36、48、60和72小时通过隐静脉或头静脉从所有动物收集血液样品到含有乙二胺四乙酸钾(k2edta)的试管中。通过在4℃离心将血浆与血液分离并储存在-80℃直至分析。使用液相色谱-串联质谱(lc-ms/ms)方法,对血浆中的化合物1和don浓度进行定量。
[0564]
在狗中以0.83mg/kg单次皮下给药l1药物组合物以后,在给药后0.500小时(中位t
max
)达到化合物1的平均峰血浆浓度(c
max
=120
±
33.5nm)。平均终末t
1/2
为8.71
±
3.90小时。auc
最后
和auc
inf
分别计算为1270
±
469和1430
±
468小时*nm。mrt
最后
和mrt
inf
分别为9.31
±
2.30小时和13.0
±
4.98小时。
[0565]
在狗中以0.83mg/kg单次皮下给药l2药物组合物以后,在给药后4.00小时(中位t
max
)达到化合物1的平均峰血浆浓度(c
max
=70.7
±
18.9nm)。平均终末t
1/2
为12.1
±
12.3小时。auc
最后
和auc
inf
分别计算为759
±
230和1030
±
478小时*nm。mrt
最后
和mrt
inf
分别为7.61
±
2.09小时和17.0
±
16.5小时。
[0566]
相反,在狗中以0.15mg/kg单次皮下给药化合物1的溶液制剂(媒介物:5%乙醇、45%peg 400和0.2%泊洛沙姆188在磷酸盐缓冲液中)以后,在给药后0.50小时(中位t
max
)在狗中达到化合物1的平均峰血浆浓度(c
max
=170nm)。平均终末t
1/2
为0.71小时。auc
最后
计算为0.249小时*μm。
[0567]
应当理解,前面描述的实施方案和例证无意在任何方面限制本公开内容的范围,并且本文提出的权利要求意图涵盖所有实施方案和例证,无论是否在本文中明确提出。
[0568]
本文引用的所有专利和出版物通过引用以其整体完整地并入。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1