猪繁殖和呼吸障碍综合症病毒快速检测试纸条及其制备方法和应用与流程
1.本发明属于病毒疫病诊断技术领域,具体涉及猪繁殖和呼吸障碍综合症病毒快速检测试纸条及其制备方法和应用。
背景技术:
2.猪繁殖和呼吸障碍综合症(porcine reproductive and respiratory syndrome,简称prrs),俗称蓝耳病(blue ear disease),是由猪繁殖与呼吸综合征病毒(prrsv)引起的一种严重危害养猪业的传染病。prrs可导致母猪出现繁殖障碍及仔猪出现严重呼吸道疾病,是一种严重影响经济效益的猪传染病。
3.prrsv为单股正链rna(大小约15kb),不分节段病毒,该病毒属动脉炎病毒科动脉炎病毒属。prrsv是一种有囊膜的病毒,似球状,直径45~65nm,囊膜表面有纤突,相对平滑。prrsv可在猪肺泡巨噬细胞上生长(pam细胞),在marc-145细胞上培养可出现细胞圆缩、聚集和崩解等明显的细胞病变(cpe)。prrsv的rna其5
‘
端具有帽子结构(5
‘‑
cap),3’端具有多聚腺嘌呤核苷酸尾结构(3
’‑
polya),共含有9个开放阅读框(orf),分别为1a、1b、2a、2b、3、4、5、6、7。相邻orf间有重叠区域。prrsv的主要结构蛋白包括gp5蛋白(囊膜糖蛋白)、m蛋白(基质蛋白)、n蛋白(核衣壳蛋白),次要结构蛋白则有gp2、gp3、gp4等。
4.gp5蛋白由orf5编码,约26~30kd,是一个糖基化蛋白,含有4个糖基化位点,有6个抗原决定簇。有证据表明gp5在prrsv的抗体识别过程中起关键作用,是诱导机体产生中和抗体的主要结构蛋白,是公认的prrsv的主要保护性抗原,也是prrsv诊断的靶标抗原之一。
技术实现要素:
5.为了弥补现有技术的不足,本发明的目的之一,提供一种prrsv gp5蛋白的单克隆抗体及其制备方法;本发明的目的之二,提供了一种使用本发明制备的gp5蛋白和单克隆抗体制备猪繁殖与呼吸综合征病毒检测试剂盒。
6.因此,本发明一方面公开了一种一种猪繁殖与呼吸综合征病毒单克隆抗体,所述的单克隆抗体均能特异性结合prrsv gp5蛋白;所述的单克隆抗体3的的重链可变区序列如seq id no.2所示,所述的单克隆抗体3的轻链可变区序列如seq id no.3所示;所述的单克隆抗体8的的重链可变区序列如seq id no.4所示,所述的单克隆抗体8的轻链可变区序列如seq id no.5所示。
7.优选地,本发明所述的单克隆抗体3结合的抗原表位位于优化后的prrsv gp5蛋白的aa34-aa48位,所述的优化后的prrsv gp5蛋白的aa34-aa48位氨基酸序列为etfvifpvlthivsy。
8.优选地,本发明所述的单克隆抗体8的抗原表位位于优化后的prrsv gp5蛋白的aa96-aa109位,所述的优化后的prrsv gp5蛋白的aa96-aa109位氨基酸序列为lakncmswrysctr。
9.另一方面,本发明还公开了一种制备所述的单克隆抗体的方法,所述方法包括以下步骤:1)prrsv gp5蛋白的制备;2)特异性表达抗prrsv gp5蛋白单克隆抗体的杂交瘤细胞的制备;3)使用步骤2)制备的杂交瘤细胞制备小鼠腹水,从腹水中纯化抗prrsv gp5蛋白单克隆抗体。
10.优选地,本发明所述的步骤1)中制备prrsv gp5蛋白时,表达gp5蛋白的核苷酸序列如seq id no.1所示。
11.再一方面,本发明还公开了一种用于检测猪繁殖与呼吸综合征病毒的试剂盒,所述试剂盒包括有效量的权利要求1所述的单克隆抗体3和单克隆抗体8;以及配套的检测试剂。
12.优选地,本发明所述试剂盒为胶体金检测试纸条,所述胶体金检测试纸条包括包含有单克隆抗体3和单克隆抗体8的试纸条以及样品稀释液。
13.优选地,本发明所述试剂盒中试纸条包括样品垫、乳胶微球垫、检测线、质控线、吸收垫。
14.优选地,本发明所述试剂盒中试纸条中的乳剂微球垫包含有单克隆抗体3,所述的检测线包含有单克隆抗体8。
15.本发明制备的prrsv gp5蛋白适用于制备不同的猪繁殖与呼吸综合征病毒诊断试剂,如胶体金、化学发光检测试剂盒等。本发明制备的抗prrsv gp5蛋白的单克隆抗体3和单克隆抗体8具有良好的特异性和敏感性,适用于制备不同的猪繁殖与呼吸综合征病毒诊断试剂,如胶体金、elisa、化学发光等检测试剂盒。
16.本发明所提供的猪繁殖与呼吸综合征病毒检测试剂盒(胶体金检测试纸条)适用于猪血清、组织、全血和抗凝血中猪繁殖与呼吸综合征病毒的检测,其特异性强、灵敏度高、稳定性好、检测速度快(10min内完成),可用于猪繁殖与呼吸综合征病毒的早期筛查,特别适合现场猪繁殖与呼吸综合征感染诊断、流行病学调查等。
附图说明
17.图1 prrsv gp5蛋白纯化后sds-page图,1是纯化后的prrsv gp5蛋白。
18.图2试纸条的组装示意图,其中a:样品垫,b:乳胶微球垫,c:检测线,d:质控线,e:吸收垫。
19.图3试纸条检测结果判定模式图。
20.图4特异性检验部分结果,1-7分别为21101批试纸条检测猪口蹄疫o型病毒抗原、猪伪狂犬病毒、猪瘟病毒、猪细小病毒、猪圆环病毒2型、猪流行性腹泻病毒、猪传染性胃肠炎病毒的结果图。
具体实施方式
21.以下结合具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
22.除非特别说明,以下实施例所用试剂和材料均为市购。
23.实施例1:猪繁殖与呼吸综合征病毒gp5蛋白的制备
24.将genbank:mh579772.1的prrsv gp5蛋白去除n端31个氨基酸(信号肽序列)后的
核苷酸序列进行密码子优化,将密码子优化后的prrsv gp5蛋白的核苷酸序列(如seq id no.1所示)克隆到原核表达载体中,并进行蛋白表达纯化。具体方法简述如下:以密码子优化的prrsv gp5蛋白的核苷酸序列为模板,分别用ecori、bamhi并在c端加入6个his标签,克隆到载体pet-30a中。把重组质粒转化e.coli bl21(de3),挑取单菌落于含有卡那霉素(终浓度为50μg/ml)的lb培养基中,37℃、225r/min摇床培养至对数生长期(od600约为0.6)时,加入iptg转入16℃,过夜诱导表达目的蛋白。表达的重组蛋白采用常规的镍柱纯化方法进行纯化,最后用300mm的咪唑洗脱目的蛋白,并用10kd超滤管浓缩洗脱液,将蛋白透析换液至pbs中,取20μl gp5蛋白使用sds-page蛋白凝胶进行电泳检验,在19.8kda左右有一条清晰条带,纯度大于等于95%(图1)。使用bca试剂盒检测蛋白含量,蛋白浓度为1.3mg/ml。
25.实施例2:prrsv gp5蛋白单克隆抗体的制备、纯化
26.疫苗制备与动物免疫:将制备的prrsv gp5蛋白与等质量的弗氏完全佐剂乳化后,皮下多点注射6~8周龄balb/c小鼠(100μg/只)。两周后,改用不完全弗氏佐剂乳化,皮下多点免疫(100μg/只),间隔两周后,重复一次,第三次免疫后,测定抗体效价。细胞融合前3天腹腔注射加强免疫一次(100μg/只)。
27.测定小鼠血清elisa效价为1:105,并采集该小鼠的脾细胞。采集脾细胞方法如下:balb/c小鼠加强免疫后3天,脱颈致死,75%酒精浸泡尸体5min后,无菌采集balb/c小鼠脾脏,置于含rpmi 1640(含三抗100u)的无菌平皿中,用rpmi 1640清洗两次后转移脾脏于200目铜网上,用灭菌研棒碾压脾脏,逐步将脾细胞挤入液相中。反复吹打分散细胞后,再经200目铜网过滤转入50ml无菌离心管中1000rpm室温离心10min,弃上清,用rpmi 1640重悬清洗一次后台盼蓝染色计数(活细胞数》90%),备用。
28.细胞融合方法如下:取对数生长期的骨髓瘤细胞置于50ml离心管中,室温1000rpm离心10min,弃上清,用rpmi 1640清洗一次计数。将骨髓瘤细胞与脾细胞按1:10的比例混合,室温1000rpm离心10min,吸去上清,rpmi 1640清洗一次,将50ml离心管置37℃水浴。于1min内加入37℃预温的1ml 50%peg 1450溶液进行融合,静置1min后逐量加入rpmi1640终止融合,室温1000rpm离心10min,弃上清,加入50ml含有hat的20%新生牛血清的完全rpmi 1640,将融合好的细胞加到96孔板内,每孔100μl。将培养板置37℃、5%co2培养箱中培养,15天后改用含ht的20%犊牛血清的完全rpmi 1640。
29.单克隆筛选:将elisa检测为阳性的杂交瘤细胞用有限稀释法进行克隆化筛选,筛选出抗体效价高、形态良好的细胞株继续采用有限稀释法进行克隆,直至获得单克隆,扩大培养并保存。最后获得4株阳性杂交瘤细胞,其编号为3、8、11、18。
30.腹水制备:取6-8周龄balb/c小鼠腹腔注射1ml灭菌的液体石蜡,每只0.5ml,7日后每只小鼠分别注射杂交瘤细胞(3、8、11、18)1
×
106个,7日后,抽取小鼠腹水,在2~8℃下,以1000rpm离心10分钟,收集上清液,将腹水分装5ml/管,-20℃保存备用。
31.抗体纯化,为辛酸-硫酸铵沉淀法,简述如下:取腹水10ml,融化后4℃1000rpm离心10分钟,收集上清,加入40ml醋酸盐缓冲液(0.06mol/l,ph值4.5),用磁力搅拌混合均匀后在室温加入330μl辛酸,边滴加边搅拌,室温混合30分钟后,2~8℃静置2小时,在2~8℃下,以10000rpm离心30分钟,收集上清,记上清体积并在冰浴下于30分钟内缓慢加入相同体积2~8℃保存的饱和硫酸铵溶液,2~8℃静置16小时,在2~8℃下,以5000rpm离心30分钟,收集沉淀。用5ml,pbs溶解沉淀后用pbs 1l透析16小时,期间换透析液至少3次。取透析好的单
克隆抗体经0.22μm微孔滤膜过滤除菌,分装于离心管中,0.1ml/管。使用bca试剂盒对4株单抗进行浓度检测,检测结果分别为1.82mg/ml、1.76mg/ml、0.98mg/ml、1.55mg/ml。
32.实施例3单克隆抗体的系统鉴定
33.抗体特异性检测:分别取单克隆抗体对猪瘟病毒csfv、猪伪狂犬病病毒prv、猪圆环病毒2型pcv2、猪乙型脑炎病毒jev、猪细小病毒ppv进行检测,以判断其特异性,结果显示,4株单克隆抗体检测均为阴性,说明单克隆抗体的特异性良好
34.类及亚类测定:取单克隆抗体,用小鼠单抗ig类/亚类鉴定用elisa试剂盒(购自北京博奥龙免疫技术有限公司)按照说明书进行检测。经检测,4株单克隆抗体亚类均为igg1。
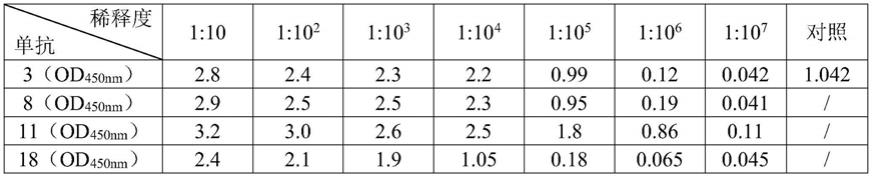
35.反应性测定:用间接elisa方法(包被原prrsv gp5蛋白的包被量为1μg/ml、100μl/孔)测定4株单克隆抗体(3、8、11、18)的elisa效价(单克隆抗体进行梯度稀释),结果依次为1:106、1:106、1:107、1:105(od450nm值大于0.1为阳性)。说明4株单克隆抗体的效价均很好,均可用于后续试剂开发。具体结果见下表所示。
[0036][0037]
hrp标记效价测定:使用hrp偶联试剂盒(ab102890)对4株单克隆抗体进行标记,并使用直接elisa方法(包被原prrsv gp5蛋白的包被量为1μg/ml、100μl/孔)测定4株单克隆抗体标记效价(od值≥1.0时判阳性),结果依次为1:10000、1:10000、1:5000、1:20000。说明4株单克隆抗体的标记效价均不错,均可用于后续试剂开发。
[0038]
单克隆抗体配对验证:将筛选的4株单克隆抗体分别按照1μg/ml、100μl/孔包被酶标板,使用制备的prrsv gp5蛋白作为样品(稀释到50ng/ml,每孔100μl),37℃孵育30min;洗涤后加入配对的hrp标记的单克隆抗体(1:10000倍稀释),37℃孵育30min,洗涤后加tmb显影液(37℃孵育10min)和终止液,再检测od450值。结果显示,3号抗体包被、8号抗体检测时,od450值最高,说明此时的反应最好,故选择3号包被、8号检测作为后续prrsv检测的配对抗体。具体结果下表所示:
[0039][0040]
单克隆抗体可变区序列的测定:参见中国发明专利(cn 111393525 b、cn 113354734a)的方法对制备的单克隆抗体(3号和8号)进行重链可变区和轻链可变区的测
定,经过测序,3号抗体的重链可变区和轻链可变区的序列如seq id no.2、seq id no.3所示;8号抗体的重链可变区和轻链可变区的序列如seq id no.4、seq id no.5所示。3号抗体和8号抗体的氨基酸序列信息见下表所示:
[0041][0042]
抗原识别位点的测定:委托南京金斯瑞生物科技有限公司对单克隆抗体(3号和8号)识别的抗原表位进行检测,结果显示,本发明的3号抗体结合的抗原表位位于优化后的prrsv gp5蛋白的aa34-aa48位(氨基酸序列具体etfvifpvlthivsy),8号抗体的抗原表位位于优化后的prrsv gp5蛋白的aa96-aa109位(氨基酸序列具体lakncmswrysctr)。其中,优化后的prrsv gp5蛋白的氨基酸序列如下所示(其中加粗并倾斜的为抗原识别位点):
[0043]
实施例4 prrsv的检测(乳胶法)
[0044]
1试纸条的制备
[0045]
硝酸纤维素膜的制备:将硝酸纤维素膜(购自赛多利斯)贴于pvc底板(杭州瑞建)的相应位置,用包被缓冲液(pbs缓冲液)将单克隆抗体8稀释至1mg/ml,调整划膜机的划线位置及高度,划线为t线,即为检测线,t线靠近乳胶微球垫端,用包被缓冲液将羊抗小鼠igg抗体(购自索莱宝公司)稀释到1mg/ml,调整划膜机的划线位置及高度,划线为c线,即为质控线,c线靠近吸收垫,两线距离5~8mm。置37℃烘箱烘干20小时,装入放有干燥剂的铝箔袋中密封,常温保存备用。
[0046]
乳胶垫的制备:将单克隆抗体3按1mg/ml乳胶微球(购自上海辉质)的量加入到乳
胶微球中,标记2小时。加入bsa至终浓度为1%,封闭1小时。4℃,12000rpm离心30分钟,弃上清,收集沉淀,沉淀用1ml保存液(含1%bsa的0.05m tris缓冲液,ph8.0)重悬超声1分钟。将重悬好的乳胶微球标记抗体均匀的铺在已处理的乳胶微球垫上,置37℃烘箱烘干20小时,铝箔袋封装,室温保存备用。
[0047]
样品垫的处理:将样品垫(购自通成纸业,300mm
×
20mm)浸泡于封闭液(10%bsa溶液)中30分钟后,37℃烘箱烘干20小时,铝箔袋封装,室温保存备用。
[0048]
组装:如图2所示,将样品垫,乳胶微球垫,吸收垫依次粘贴到已粘有硝酸纤维素膜的pvc底板的相应位置,使乳胶微球垫、吸水垫分别与硝酸纤维素膜部分接触,样品垫与乳胶微球垫部分接触,制成大板。.
[0049]
包装:用切条机将大板切成3mm宽的试纸条,装上外壳,用铝箔袋密封包装,内含试纸条一个,吸管一个,干燥剂一包,室温避光贮存备用,保存期为18个月。
[0050]
样品稀释液的制备:为1
×
pbs缓冲液,常温保存备用。
[0051]
2试纸条的检测
[0052]
样本处理:组织样本与pbs按照1:1的比例研磨后离心取上清直接用于检测;血液(含全血、抗凝血、血清和血浆)样本直接用于检测。
[0053]
操作步骤:取适量样本(30~40μl或滴管1滴),滴加到样品孔中,然后滴加一滴样品稀释液。加样完成后将试纸条平放在桌面上,10分钟左右观察结果。
[0054]
判定(如图3所示):在试纸条上出现两条条带(t:检测线,c:质控线),判为阳性;在试纸条上仅出现一条条带(c:质控线),判为阴性;在试纸条质控线处不出现条带,判为无效。
[0055]
3试纸条的性能验证
[0056]
特异性检验:使用制备的3批试纸条检测7份猪相关的特异性样品及10份pcr检测prrsv为阴性的样品,结果显示,3批试纸条检测结果均为阴性。具体结果见下表和图4(部分结果):
[0057]
[0058][0059]
注:
“‑”
表示检测为阴性。
[0060]
敏感性检验:使用制备的3批试纸条对不同滴度的prrsv病毒进行检测,结果显示,3批试纸条的最低检测限均能达到102tcid
50
/ml。使用制备的3批试纸条对不同浓度的prrsv gp5蛋白进行检测,结果显示,3批试纸条的最低检测限均能达到2.5ng/ml。说明制备的试纸条具有良好的敏感性。结果见下表:
[0061][0062]
注:
“‑”
表示检测为阴性,“+”表示检测为阳性。
[0063]
重复性检验:使用制备的3批试纸条对7份特异性样品和5份阳性样品进行检测,无论是批间和批内,均具有良好的重复性。具体结果见下表:
[0064]
[0065]
[0066][0067]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1