一种组织微生物基因组去宿主化提取方法
1.本发明涉及一种去除宿主基因组的微生物基因组提取方法,特别涉及在微生物基因组测序样品处理中的应用。
背景技术:
2.肠道微生物对于人体的健康十分重要,已有多项研究均揭示其与疾病的关联。目前发现多种肿瘤和动脉硬化(atherosclerotic,as)斑块内部中存在细菌。肿瘤内部微生物已被认为是肿瘤微环境的一部分,斑块菌群也在物理空间上与免疫微环境发挥相互作用。相较于肠道微生物通过代谢产物等间接调控,肿瘤和动脉斑块等实体内部的微生物可能更直接地参加了该疾病的发生和发展。但由于肿瘤组织内细菌含量低,肿瘤微生物组的研究极具有挑战性,目前综合性分析报道较少。其中一个重要原因是缺乏合适的微生物基因组提取方法。
3.目前常见的dna提取方法酚-氯仿法在提取微生物基因组中存在宿主dna污染的问题,已有去宿主微生物基因组提取方法主要针对粪便和液体样品,还没有针对肿瘤和斑块样品中的微生物提取方法。
技术实现要素:
4.针对现有技术中存在的缺陷,本发明的目的在于提供一种新的去除宿主基因组的微生物基因组提取方法,及在微生物基因组测序样品处理中的应用。
5.本发明采用的技术方案是:
6.一种组织微生物基因组去宿主化提取方法,包括以下步骤:
7.1)取组织剪碎置于无酶无菌组织匀浆管中,加入研磨珠和pbs缓冲液。使用biospec迷你珠磨器最高速度研磨,然后冷却。
8.2)取一定量步骤1)得到的组织匀浆置于一新的无酶无菌ep管中,加入与组织匀浆等量的宿主dna去除溶液。
9.3)室温上下颠倒混匀后,加无菌水,室温30秒,加入nacl溶液,颠倒混匀后10,000x g离心5min后去上清,保留沉淀。
10.4)加入微生物裂解缓冲液重悬沉淀,孵育一段时间;
11.5)将步骤4)得到的溶液加入到无酶无菌组织匀浆管中,加入研磨珠和微生物裂解缓冲液,使用biospec迷你珠磨器最高速度研磨,然后冷却,重复三至五次。
12.6)10,000x g离心1min,取上清置于一新的无酶无菌ep管中。
13.7)向步骤6)的无酶无菌ep管中加入步骤6)中所述上清3倍体积的商品化dna结合缓冲液,轻柔混匀。
14.8)将步骤7)得到的的溶液分两次,过商品化dna纯化柱,10,000x g离心1min。
15.9)向dna纯化柱中心加入80%乙醇,10,000x g离心1min,弃离心液。
16.10)重复步骤9。
17.11)加入无菌无酶水至纯化柱,室温孵育,离心,收集离心溶液,再次过柱,离心后得到去除宿主基因组的微生物基因组,-80℃保存,以备后续测序。
18.12)对去除宿主基因组的微生物基因组样本进行宏基因组测序。
19.步骤1)具体为:取组织30-50mg剪碎置于2ml无酶无菌组织匀浆管中,加入直径2.8mm的研磨珠,250μl 1x pbs缓冲液。使用biospec迷你珠磨器最高速度研磨1min,冷却5min;研磨、冷却步骤重复三至五次。
20.步骤2)具体为:取步骤1)得到的组织匀浆200μl置于一新的1.5ml无酶无菌ep管中,加入200μl宿主dna去除溶液。
21.步骤3)中,室温上下颠倒混匀15min后,加300μl无菌水,室温30秒,加入10μl nacl溶液,nacl溶液的浓度为5mol/l。
22.步骤4)具体为:加入100μl新鲜配置的微生物裂解缓冲液重悬沉淀,37℃孵育30min;微生物裂解缓冲液由1x pbs、蛋白酶k1mg/ml、溶菌酶0.5mg/ml混合制成。
23.步骤5)中,将步骤4得到的溶液加入到2ml无酶无菌组织匀浆管中,加入等比例0.1&0.5mm玻璃研磨珠和700μl步骤4所述微生物裂解缓冲液。
24.步骤6)中,取400μl上清置于一新的1.5ml无酶无菌ep管中。
25.步骤9)中,加入80%乙醇600μl。
26.步骤11)中,加入20μl无菌无酶水至纯化柱,室温孵育5min,10,000x g离心1min。
27.步骤12)中,测序平台为illumina novaseq 6000pe150。
28.本发明适用于冷冻组织样品、动脉斑块等,但是否适用其他类型样品还需要再进行实验。
29.本发明的有益效果:
30.本发明提供了一种新的去除宿主基因组的微生物基因组提取方法,使能对组织中的微生物样品进行宏基因组测序。相较于16s测序,宏基因组测序能够对基因和功能进行深入研究,能够注释微生物到种水平甚至菌株水平。但是宏基因组对测序dna样品的质量要求更高。去除组织中微生物样品中的宿主污染,有助于提高测序基因组质量,满足对实体瘤或动脉硬化斑块等组织样品的宏基因组测序要求。
附图说明
31.本发明有如下附图:
32.图1为测序样品电泳质检结果;m-1:2k marker,上样2μl,m-2:15k marker,上样2μl,s:标准品(5μl,10ng/μl)。1:环境对照,2、5:正常胃壁组织,3、6:胃癌组织,4、7:as斑块(1-4,7上样5μl,5,上样2μl,6上样1μl)。
具体实施方式
33.以下结合附图对本发明作进一步详细说明,但本发明的保护范围并不仅限于此。
34.新的适应情况:用于组织和斑块中微生物基因组的提取,有助于去除宏基因组测序中来自宿主的污染。
35.实验证据支持新适应情况:
36.1)实验步骤
37.1.取组织30-50mg剪碎置于2ml无酶无菌组织匀浆管中,加入直径2.8mm的研磨珠,250μl 1x pbs缓冲液。使用biospec迷你珠磨器最高速度研磨1min,冷却5min。研磨、冷却步骤重复三至五次。
38.2.取步骤1得到的组织匀浆200μl置于一新的1.5ml无酶无菌ep管中。加入200μl宿主dna去除溶液(5%皂苷溶液,至终浓度2.5%)。
39.3、室温上下颠倒混匀15min后,加300μl无菌水,室温30秒,加入10μl nacl溶液(5mol/l),颠倒混匀后10,000x g离心5min后去上清,保留沉淀。
40.4、加入100μl新鲜配置的微生物裂解缓冲液(由1x pbs、蛋白酶k1mg/ml、溶菌酶0.5mg/ml混合制成)重悬沉淀,37℃孵育30min。
41.5、将步骤4得到的溶液加入到2ml无酶无菌组织匀浆管中,加入等比例0.1&0.5mm玻璃研磨珠和700μl步骤4所述微生物裂解缓冲液。
42.6、使用biospec迷你珠磨器最高速度研磨1min,冷却5min,重复五次。
43.7、10,000x g离心1min,取400μl上清置于一新的1.5ml无酶无菌ep管中。
44.8、向步骤7的无酶无菌ep管中加入1200μl(3倍体积)商品化dna结合缓冲液,轻柔混匀。
45.9、将得到的1600μl溶液分两次,过商品化dna纯化柱,10,000x g离心1min。
46.10、向dna纯化柱中心加入600μl 80%乙醇,10,000x g离心1min,弃离心液。
47.11、重复步骤10。
48.12、加入20μl无菌无酶水至纯化柱,室温孵育5min,10,000x g离心1min,收集离心溶液,可再次过柱,离心后得到去除宿主基因组的微生物基因组,-80℃保存,以备后续测序。
49.13、对去除宿主基因组的微生物基因组样本进行宏基因组测序,测序平台为illumina novaseq 6000pe150。
50.2)实验结果
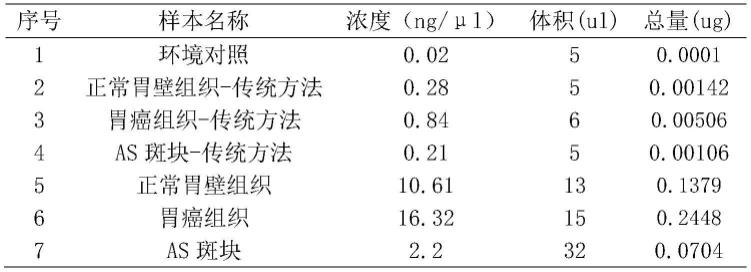
51.1、除了采用本发明的方法进行基因组提取(表1中序号1、5、6、7),也采用了菌群研究中常用粪便和液体样本的去宿主提取方法作为对照(表1中2、3、4)。qubit fluorometer检测样品浓度结果如表1所示。电泳质检结果如图1所示。
52.表1测序样品检测结果
[0053][0054]
2、宏基因组测序:
[0055]
本发明的方法提取的环境对照,以及传统提取方法提取的正常胃壁组织、胃癌组织和as斑块的基因组含量低,无法建库。使用本发明的方法提取的正常胃壁组织、胃癌组织
和as斑块的基因组含量高,宏基因组测序质检结果如表2所示:
[0056]
表2宏基因组测序数据产出情况
[0057][0058]
从表2可以看出,本去宿主dna提取方法制备的宏基因测序样品满足测序需要。宏基因组测序种水平测序含量排名top 10菌株结果如表3所示:
[0059]
表3不同样品宏基因组种水平测序含量排名top 10
[0060][0061]
以上实施方式仅用于说明本发明,而并非对本发明的限制,有关技术领域的普通技术人员,在不脱离本发明的实质和范围的情况下,还可以做出各种变化和变型,因此所有等同的技术方案也属于本发明的保护范围。
[0062]
本说明书中未作详细描述的内容属于本领域专业技术人员公知的现有技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1