一种(β,S)构型羟丙基四氢吡喃三醇的结晶方法与流程
一种(
β
,s)构型羟丙基四氢吡喃三醇的结晶方法
技术领域
1.本发明属于化学生物领域,具体涉及一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法。
背景技术:
2.羟丙基四氢吡喃三醇,又名玻色因,是一种从木糖衍生而来的糖蛋白混合物。由于木糖大量存在于山毛榉树中,且具有促进葡糖氨基葡聚糖即粘多糖生成的能力。羟丙基四氢吡喃三醇能通过刺激粘多糖的生成,提高细胞外基质间的水分仿含量。从而充分地填充ecm的间隙,使得肌肤减少皱纹,显得更加细腻。同时在dej处发挥作用,促进胶原蛋白vii和胶原蛋白iv的合成,使人们的表皮和真皮链接得更紧密,让使整个皮肤重现饱满,更显紧致和弹性。
3.羟丙基四氢吡喃三醇作为一种β-木糖衍生物,最早是由欧莱雅公司开发的抗衰老活性物质,结构式如下:
[0004][0005]
2006年欧莱雅将羟丙基四氢吡喃三醇添加到护肤品中,2018年欧莱雅旗下众多品牌开始大规模推出,羟丙基四氢吡喃三醇抗衰老作用明显,因此受到了美容界的喜爱。化合物的生物活性和安全性与其立体结构与有关,不同的立体结构可能有不同的活性。按活性物质化学结构对生物活性影响的程度,通常分为结构非特异性化合物和结构体异性化合物,羟丙基四氢吡喃三醇就是一种结构特异性化合物,它的立体化学特性对生物活性有重大影响。
[0006]
cn200510071732.0中报道,(β,s)构型为优势构型,其生物活性远远大于(β,s)和(β,r)构型的混合物,(β,s)构型在混合物中的比例越高,生物活性越高。
[0007]
cn200510071732.0中报道了一种以d-吡喃木糖苷-2-(s)丙酮为原料,在异丙醇溶液中,加入硼氢化钠和乙酸,从而选择性得到c-β-吡喃木糖苷-2-(s)羟基丙烷化合物,dr≥90%。但该方法需加入易制爆化合物硼氢化钠,反应中有大量氢气放出,有一定的危险性,并且最后产品需过硅胶柱纯化,不利于工业化。
[0008]
cn201910785216.6中公开了一种利用稀土金属配合物合成羟丙基四氢吡喃三醇的方法,利用稀土金属配合物作催化剂,使d-木糖与乙酰乙酸乙酯反应,再进一步还原为羟丙基四氢吡喃三醇。该方法收率只有80%,而且无法选择性得到c-β-吡喃木糖苷-2-(s)羟基丙烷化合物。
[0009]
cn202010629023.4中公开了一种利用生物酶一锅法制备羟丙基四氢吡喃三醇的方法。该方法方法简单,环境友好。但是收率只有80%,但是同样无法选择性得到c-β-吡喃
木糖苷-2-(s)羟基丙烷化合物。
[0010]
因此,亟待开发一种结晶得到单一构型的固体,纯度高,质量好的(β,s)构型羟丙基四氢吡喃三醇的结晶方法。
技术实现要素:
[0011]
针对现有技术的不足,本发明的目的在于提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,本发明选择了一种高的立体选择性和针对特定底物d-吡喃木糖苷-2-(s)丙酮的羰基还原酶,合成得到高纯度的(β,s)构型的羟丙基四氢吡喃三醇,并从特定溶剂中结晶得到单一构型的固体,纯度高,质量好。
[0012]
为达此目的,本发明采用以下技术方案:
[0013]
第一方面,本发明提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,所述(β,s)构型羟丙基四氢吡喃三醇的结晶方法具体包括以下步骤:
[0014]
(1)在羰基还原酶和辅酶再生酶的存在下,d-吡喃木糖苷-2-(s)丙酮发生不对称还原反应,得到(β,s)构型羟丙基四氢吡喃三醇的粗品;
[0015]
(2)将步骤(1)得到的反应体系依次进行萃取、浓缩和结晶,得到(β,s)构型羟丙基四氢吡喃三醇的晶体。
[0016]
在现有技术中,因为无法获得高纯的(β,s)构型的羟丙基四氢吡喃三醇,因此大多数羟丙基四氢吡喃三醇是以水溶液或冻干粉存在,存在含量低,杂质多,使用效果不好的缺点。本发明使用特别筛选出一种高立体选择性的羰基还原酶,并且使用混合溶媒结晶,得到高纯的(β,s)构型的羟丙基四氢吡喃三醇,纯度高,质量好。
[0017]
优选地,步骤(1)中,所述辅酶再生酶包括甲酸脱氢酶、葡萄糖脱氢酶或醇脱氢酶中的任意一种或至少两种的组合。
[0018]
优选地,步骤(1)的具体操作为:将d-吡喃木糖苷-2-(s)丙酮、共底物以及含羰基还原酶和辅酶再生酶液体混合,进行保温反应,得到含(β,s)构型羟丙基四氢吡喃三醇的粗品的反应液。
[0019]
优选地,在反应体系中,所述d-吡喃木糖苷-2-(s)丙酮的浓度为20-1000g/l,例如可以是20g/l、50g/l、100g/l、200g/l、400g/l、600g/l、800g/l、1000g/l等,优选为100-200g/l,例如可以是100g/l、120g/l、140g/l、160g/l、180g/l、200g/l等。
[0020]
优选地,所述共底物与含羰基还原酶和辅酶再生酶液体的体积比为(0.5-2):1,例如可以是0.5:1、0.6:1、0.8:1、1:1、1.2:1、1.4:1、1.6:1、1.8:1、2:1等,优选为1:1。
[0021]
优选地,所述共底物包括异丙醇水溶液、葡萄糖水溶液或甲酸水溶液中的任意一种或至少两种的组合,优选异丙醇水溶液。
[0022]
优选地,所述共底物的质量百分含量为30-50%,例如可以是30%、32%、34%、36%、38%、40%、42%、44%、46%、48%、50%等。
[0023]
优选地,所述保温反应的温度为25-30℃,例如可以是25℃、26℃、27℃、28℃、29℃、30℃等。
[0024]
优选地,所述保温反应的时间为8-24h,例如可以是8h、10h、12h、14h、16h、18h、20h、22h、24h等,优选为10-12h。
[0025]
优选地,所述含羰基还原酶和辅酶再生酶液体由以下制备方法制备得到:
[0026]
(a)将羰基还原酶和辅酶再生酶重组后,与工程大肠杆菌共同接种于液体培养基中进行培养;
[0027]
(b)通过对步骤(a)培养得到的体系进行离心,收集菌体;将菌体置于缓冲溶液后破碎,再通过离心收集上清液,得到含羰基还原酶和辅酶再生酶液体。
[0028]
优选地,步骤(a)中,所述重组具体包括以下步骤:提取基因组、羰基还原酶基因克隆、e.coli/pet-28a(+)-kr01等重组工程菌的构建及表达。
[0029]
优选地,所述提取得到的基因组为streptomyces cyaneogriseus和rhodococcus ruber dsm 44541基因组。
[0030]
优选地,所述羰基还原酶基因克隆包括以下步骤:将提取得到的基因组一依次通过密码子优化及化学合成羰基还原酶基因、从微生物基因组中克隆羰基还原酶基因、定点突变克隆羰基还原酶基因,得到pet-28a(+)-lk02和pet-28a(+)-lk03质粒。
[0031]
优选地,所述e.coli/pet-28a(+)-kr01等重组工程菌的构建及表达包括以下步骤:将克隆得到的质粒分别转化至bl21(de3)感受态细胞,获得分别表达kr01、kr02等羰基还原酶的重组工程菌。
[0032]
优选地,步骤(2)中,所述萃取用溶剂为乙酸乙酯、乙酸甲酯或甲酸甲酯中的任意一种或至少两种的组合,优选为乙酸乙酯。
[0033]
优选地,步骤(2)中,所述结晶的具体步骤为:将浓缩后的产物与结晶溶媒混合后,依次进行搅拌结晶、降温养晶、过滤、洗涤和干燥,得到(β,s)构型羟丙基四氢吡喃三醇的晶体。
[0034]
优选地,所述结晶溶媒包括第一溶媒和第二溶媒,采用第一溶媒溶解浓缩后的产物,并在搅拌下滴加第二溶媒,使结晶析出。
[0035]
优选地,所述第一溶媒包括乙醇、异丙醇、乙酸乙酯或乙酸甲酯中的任意一种或至少两种的组合,优选为乙醇。
[0036]
优选地,所述第二溶媒包括丙酮、甲基异丁基酮、甲叔醚或异丙醚中的任意一种或至少两种的组合,优选为丙酮。
[0037]
优选地,所述第二溶媒和第一溶媒的体积比为(1-10):1,例如可以是1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1等,优选为(1-5):1。
[0038]
优选地,所述搅拌结晶的转速为50-300rpm,例如可以是50rpm、100rpm、150rpm、200rpm、250rpm、300rpm等,搅拌结晶的温度为-10~25℃,例如可以是-10℃、-5℃、0℃、5℃、10℃、15℃、20℃、25℃等,搅拌结晶的时间为1-2h,例如可以是1h、1.2h、1.4h、1.6h、1.8h、2h等。
[0039]
优选地,所述降温养晶的温度为0-5℃,例如可以是0℃、1℃、2℃、3℃、4℃、5℃等,降温养晶的时间为0.5-2h,例如可以是0.5h、0.6h、0.8h、1h、1.2h、1.4h、1.6h、1.8h、2h等。
[0040]
优选地,所述洗涤采用的溶剂包括丙酮、甲基异丁基酮、甲叔醚或异丙醚中的任意一种或至少两种的组合,优选为丙酮。
[0041]
优选地,所述(β,s)构型羟丙基四氢吡喃三醇的结晶方法具体包括以下步骤:
[0042]
(1)将d-吡喃木糖苷-2-(s)丙酮、共底物以及含羰基还原酶和辅酶再生酶液体混合,在25-30℃下进行保温反应8-24h,得到含(β,s)构型羟丙基四氢吡喃三醇的粗品的反应液;
[0043]
(2)将步骤(1)得到的含(β,s)构型羟丙基四氢吡喃三醇的粗品的反应液萃取后浓缩;采用第一溶媒溶解浓缩后的产物,并以50-300rpm搅拌1-2h,同时滴加第二溶媒,使结晶析出;再将体系降温至0-5℃养晶0.5-2h,洗涤后干燥,得到(β,s)构型羟丙基四氢吡喃三醇的晶体。
[0044]
相对于现有技术,本发明具有以下有益效果:
[0045]
(1)本发明选择了一种高的立体选择性和针对特定底物d-吡喃木糖苷-2-(s)丙酮的羰基还原酶,合成得到高纯度的(β,s)构型的羟丙基四氢吡喃三醇,并从特定溶剂中结晶得到单一构型的固体,纯度高,质量好;
[0046]
(2)本发明制备得到的(β,s)构型的羟丙基四氢吡喃三醇经检测纯度达到99%以上,收率达到85%以上,de值为100%。
具体实施方式
[0047]
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0048]
制备例
[0049]
本制备例构建一种羰基还原酶,所述羰基还原酶由以下方法制备得到:
[0050]
s1基因组提取
[0051]
将streptomyces cyaneogriseus甘油菌和rhodococcus ruber dsm 44541甘油菌在培养基中培养至对数生长期时收集菌体。根据《分子克隆实验指南》中的方法,用溶菌酶裂解菌体,高浓度盐溶解多糖,sds和有机溶剂变性蛋白,最后通过预冷的乙醇沉淀dna从而提取基因组。将提取得到的streptomyces cyaneogriseus和rhodococcus ruber dsm 44541基因组保存于-20℃冰箱,备用。
[0052]
s2羰基还原酶基因克隆
[0053]
s21密码子优化及化学合成羰基还原酶基因
[0054]
针对大肠杆菌的密码子偏好性,对羰基还原酶kr01-kr11(除kr09和kr10)、lkcr、lk01、lk04、lk05的基因序列进行密码子优化及化学合成(优化后的基因序列连接在puc57载体中,且优化后的基因序列中间部分没有ndei和hindiii酶切位点)。选择ndei和hindiii酶切位点,利用分子克隆方法将上述羰基还原酶目的基因如kr01、lkcr等构建到表达载体pet-28a(+)中。具体操作如下:在37℃条件下,用ndei和hindiii两种酶双酶切连接上述羰基还原酶目的基因的puc57质粒和pet-28a(+)载体;通过凝胶电泳回收具有粘性末端的pet-28a(+)载体及kr01、lkcr等目的基因,并使用试剂盒对其进行纯化;用t4dnaligase酶连接回收纯化后的产物,最后构建得到pet-28a(+)-kr01和pet-28a(+)-lkcr等质粒。
[0055]
s22从微生物基因组中克隆羰基还原酶基因
[0056]
羰基还原酶kr09和kr10是通过设计的引物分别从streptomyces cyaneogriseus和rhodococcus ruberdsm 44541的基因组中扩增获得。选择ndei和hindiii酶切位点通过同源重组试剂盒连接上述羰基还原酶目的基因和表达载体pet-28a(+)。具体操作如下:根据clonexpress试剂盒,设计相应的扩增引物kr09-f、kr09-r、kr10-f和kr10-r(详见2.1.4),并扩增上述两个羰基还原酶kr09和kr10;选择ndei和hindiii两个酶双酶切pet-28a(+)载体,使其线性化;通过exnase同源重组酶重组回收后的kr09和pet-28a(+)载体及
kr10和pet-28a(+)载体,最后构建得到pet-28a(+)-kr09和pet-28a(+)-kr10质粒。
[0057]
s23定点突变克隆羰基还原酶基因
[0058]
为了改变羰基还原酶lk01的选择性,在羰基还原酶lk01的氨基酸序列gly190和val 94处依次引入tyr和ala突变。本实验合成引入突变位点的引物(lk02-f、lk02-r和lk03-f、lk03-r)。以羰基还原酶puc57-lk01质粒为模板,用gxl酶扩增整个质粒;通过凝胶电泳及试剂盒纯化回收扩增后的产物;再用t4dna ligase连接线性化质粒,构建得到突变后puc57-lk02和puc57-lk03质粒;再按s1的分子克隆方法,构建得到pet-28a(+)-lk02和pet-28a(+)-lk03质粒。
[0059]
s3 e.coli/pet-28a(+)-kr01等重组工程菌的构建及表达
[0060]
将上面构建得到的pet-28a(+)-kr01、pet-28a(+)-kr02等质粒分别转化至bl21(de3)感受态细胞,获得分别表达kr01、kr02等羰基还原酶的重组工程菌,并分别命名为e.coli/pet-28a(+)-kr01、e.coli/pet-28a(+)-kr02等。
[0061]
e.coli/pet-28a(+)-kr01等重组工程菌接种于含终浓度50μg/ml kana的25ml种子培养基中,在37℃条件下培养过夜。第二天,按1.5%接种量将e.coli/pet-28a(+)-kr01等重组工程菌的种子液分别转接到含终浓度50μg/ml kana的100ml发酵培养基。在37℃条件下培养3h(od600值大于2)后,降温到25℃,加入0.1ml的100mmol的iptg(终浓度0.1mmol)诱导培养过夜后,收集e.coli/pet-28a(+)-kr01等重组工程菌的菌体(4000g,30min,4℃离心),并保存于-20℃冰箱,备用。
[0062]
实施例1
[0063]
本实施例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,所述结晶方法包括以下步骤:
[0064]
(1)将羰基还原酶和辅酶再生酶重组(制备例提供的重组酶)后,与0.5%的工程大肠杆菌共同接种于液体培养基(蛋白胨10g,酵母提取物5g,氯化钠10g,加入1l去纯化水)中进行培养;37℃培养16h,离心收集菌体,将菌体放入磷酸盐缓冲液(k2hpo4·
3h2o 1.392g,kh2po40.53g,加入纯化水1l配制成ph7.0的磷酸盐缓冲液),用破壁机破碎,破碎功率60w和破碎时间1min。,然后离心收集上清液;
[0065]
取d-吡喃木糖苷-2-(s)丙酮63g,加入100ml水,100ml异丙醇,控制温度25℃,加入上步收集的粗酶液200ml,保温反应12h,hplc监控反应,当底物≤1%时,终止反应。
[0066]
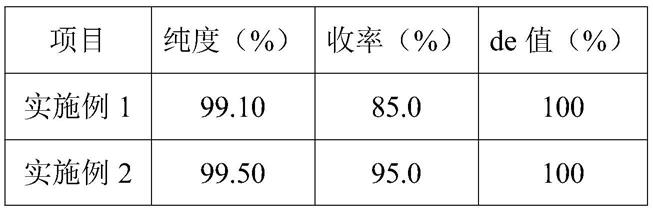
(2)加入乙酸乙酯200ml萃取,静置分层,收集上层乙酸乙酯相备用,下层水相再加入乙酸乙酯100ml搅拌萃取,静置分层,收集上层乙酸乙酯相备用,下层水相再加入乙酸乙酯50ml搅拌萃取,静置分层,将3次萃取的有机相混合,小于25℃减压浓缩脱溶至干,加入100ml乙醇搅拌溶解,滴加400ml甲叔醚,结晶缓慢析出,滴加完毕,降温至0-5℃养晶1h,过滤,丙酮洗涤,真空干燥得产品54.12g。经检测纯度为99.1%,收率85%,de值为100%
[0067]
实施例2
[0068]
本实施例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,所述结晶方法包括以下步骤:
[0069]
(1)将羰基还原酶和辅酶再生酶重组(制备例提供的重组酶)后,与0.5%工程大肠杆菌共同接种于液体培养基(琼脂10g,酵母提取物5g,氯化钠10g,加入1l去纯化水组成的液体培养基)中进行培养;37℃培养16h,离心收集菌体,将菌体放入ph=7.0的磷酸盐缓冲
液(k2hpo4·
3h2o 1.392g,kh2po40.53g,加入纯化水1l配制成ph7.0的磷酸盐缓冲液)中,用破壁机100w、破碎0.5min,然后离心收集上清液;
[0070]
取d-吡喃木糖苷-2-(s)丙酮63g,加入100ml水,100ml异丙醇,控制温度30℃,加入上步收集的粗酶液200ml,保温反应12h,hplc监控反应,当底物≤1%时,终止反应;
[0071]
(2)加入乙酸乙酯200ml萃取,静置分层,收集上层乙酸乙酯相备用,下层水相再加入乙酸乙酯100ml搅拌萃取,静置分层,收集上层乙酸乙酯相备用,下层水相再加入乙酸乙酯50ml搅拌萃取,静置分层,将3次萃取的有机相混合,小于25℃减压浓缩脱溶至干,加入100ml乙醇搅拌溶解,滴加400ml丙酮,结晶缓慢析出,滴加完毕,降温至0-5℃养晶1h,过滤,丙酮洗涤,真空干燥得产品60.5g。经检测纯度为99.5%,收率95%,de值100%。
[0072]
实施例3
[0073]
本实施例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,所述结晶方法包括以下步骤:
[0074]
(1)将羰基还原酶和辅酶再生酶重组(制备例提供的重组酶)后,与0.5%工程大肠杆菌共同接种于液体培养基(大豆蛋白12g,酵母提取物5g,氯化钠10g,加入1l去纯化水)进行培养;37℃培养16h,离心收集菌体,将菌体放入ph=7.0的磷酸盐缓冲液(k2hpo4·
3h2o 1.392g,kh2po
4 0.53g,加入纯化水1l配制成ph7.0的磷酸盐缓冲液)中,用60w破壁机,破碎1min,然后离心收集上清液;
[0075]
取d-吡喃木糖苷-2-(s)丙酮63g,加入100ml水,100ml异丙醇,控制温度25℃,加入上步收集的粗酶液200ml,保温反应12h,hplc监控反应,当底物≤1%时,终止反应;
[0076]
(2)加入乙酸乙酯200ml萃取,静置分层,收集上层乙酸乙酯相备用,下层水相再加入乙酸乙酯100ml搅拌萃取,静置分层,收集上层乙酸乙酯相备用,下层水相再加入乙酸乙酯50ml搅拌萃取,静置分层,将3次萃取的有机相混合,小于25℃减压浓缩脱溶至干,加入100ml乙醇搅拌溶解,滴加200ml丙酮,结晶缓慢析出,滴加完毕,降温至0-5℃养晶1h,过滤,丙酮洗涤,真空干燥得产品59.3g。经检测纯度为99.65%,收率93.1%,de值100%。
[0077]
实施例4
[0078]
本实施例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,与实施例1的区别仅在于,步骤(1)中,将异丙醇替换为等质量的葡萄糖。
[0079]
实施例5
[0080]
本实施例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,与实施例1的区别仅在于,步骤(1)中,将异丙醇替换为等质量的葡萄糖。
[0081]
实施例6
[0082]
本实施例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,与实施例1的区别仅在于,在第(1)步的反应体系中,d-吡喃木糖苷-2-(s)丙酮的浓度为20g/l。
[0083]
实施例7
[0084]
本实施例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,与实施例1的区别仅在于,在第(1)步的反应体系中,d-吡喃木糖苷-2-(s)丙酮的浓度为300g/l。
[0085]
实施例8
[0086]
本实施例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,与实施例1的区别仅在于,在第(1)步中,保温反应8h。
[0087]
实施例9
[0088]
本实施例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,与实施例1的区别仅在于,在第(1)步中,保温反应8h。
[0089]
实施例10
[0090]
本实施例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,与实施例1的区别仅在于,步骤(2)中不滴加甲叔醚,减压浓缩脱溶至干后直接加入100ml乙醇和400ml的甲叔醚的混合液中搅拌析晶。
[0091]
对比例1
[0092]
本对比例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,与实施例1的区别仅在于,不添加醇脱氢酶。
[0093]
对比例2
[0094]
本对比例提供一种(β,s)构型羟丙基四氢吡喃三醇的结晶方法,与实施例1的区别仅在于,不添加羰基还原酶。
[0095]
性能测试
[0096]
测试样品:实施例1-10和对比例1-2提供的(β,s)构型羟丙基四氢吡喃三醇的晶体;
[0097]
测试方法:hplc检测:色谱柱:sinochrom ods-bp c18,5μm,4.6mm
×
250mm;流动相:70%乙腈水;检测波长:240nm。
[0098]
具体测试结果如下表1所示:
[0099]
表1
[0100]
[0101][0102]
由表1测试结果可知,本发明制备得到的(β,s)构型的羟丙基四氢吡喃三醇经检测纯度达到99%以上,收率达到85%以上,de值为100%。说明本发明选择了一种高的立体选择性和针对特定底物d-吡喃木糖苷-2-(s)丙酮的羰基还原酶,合成得到高纯度的(β,s)构型的羟丙基四氢吡喃三醇,并从特定溶剂中结晶得到单一构型的固体,纯度高,质量好。
[0103]
申请人声明,本发明通过上述实施例来说明本发明的(β,s)构型羟丙基四氢吡喃三醇的结晶方法,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1