光固化酪蛋白水凝胶的制法及在止血和皮肤修复上的应用
1.本发明主要涉及一种光固化酪蛋白水凝胶止血敷料的制备方法及在止血及皮肤修复等生物医学材料领域的应用。
背景技术:
2.聚合物水凝胶是由柔性聚合物链组成的三维交联网络,其中含有大量的水,但保留了固体的性质。三维网络使液体保留形成膨胀的凝胶相,内部的液体可以防止聚合物网络的崩溃,这赋予了类似于软组织的特征。多种聚合物已用于合成水凝胶,包括天然高分子水凝胶、合成高分子水凝胶和衍生水凝胶。水凝胶性能取决于聚合物浓度,交联水平,温度,ph值,老化和盐浓度。水凝胶的多孔结构使其具有保护和运输生物活性化合物的能力。因此,水凝胶在生物医学和医药领域备受青睐。由食品级生物聚合物制成的水凝胶还具有安全性、低成本和商业可用性等优点。
3.牛奶中蛋白质含量为每升30-35克,其中酪蛋白约占80%。牛奶中的酪蛋白主要有四种类型:αs
1-、αs
2-、β-和κ-酪蛋白,摩尔比为11:3:10:4。由于它们的营养和功能特性,它们在食品工业中被广泛使用,也被认为是生物活性物质(如维生素、脂肪酸等)的天然载体。此外,它们成本低,容易获得,高度稳定且无毒。酪蛋白具有天然的生物相容性和可生物降解性,是一种gras(通常被认为是安全的)蛋白质。
4.酪蛋白由于其独特的结构和物理化学性质,如结合离子和小分子、与大分子形成复合物、无与伦比的表面活性和稳定性、巨大的乳化和自组装性能以及良好的凝胶性和水结性,也被广泛应用于传统的和新型的药物输送系统。酪蛋白的ph响应性凝胶膨胀特性使其有利于持续释放。此外,酪蛋白具有多种屏蔽能力,对于保护敏感的包裹型生物活性物质至关重要,从而控制这些生物活性物质的生物可及性和生物利用度。酪蛋白具有很强的紫外线吸收特性,这可以使酪蛋白起到抵御辐射,特别是紫外线辐射的作用。
5.目前已报道的酪蛋白水凝胶主要通过酶制剂(酪氨酸酶、转谷氨酰胺酶)交联形成以及与阴离子多糖(海藻酸钠、透明质酸等)静电作用形成。上述方法普遍存在反应条件复杂,凝胶时间长,产品性质不稳定,难以产业化等缺陷。
6.目前现有的酪蛋白水凝胶的制备方法为:将酪蛋白与交联剂包括戊二醛(glu)、京尼平 (gp)以化学改性共混为方式进行成胶。其存在交联效率低和交联速度慢等不足之处。使用小分子交联剂制备的生物材料可能有细胞毒性和致突变性,导致前基质受损,不能原位交联细胞。此外,水凝胶的结构也很难控制,很难实现光交联和3d打印。
7.目前现有较为成熟的方法是利用甲基丙烯酸酐对蛋白进行改性,然后在光引发剂lap 和紫外光作用下交联成胶。但该方法需要复杂的前处理改性,且成胶过程中的紫外线对细胞损害,需严格控制交联条件以减少细胞损伤。同时,由于酪蛋白具有很强的紫外线吸收特性,使得紫外穿透深度有限,限制了水凝胶的制备尺度和力学性质在深度方向的均一性。然而,以钌/过硫酸钠为光引发剂的可见光诱导交联由于以下三个优点引起了人们的广泛关注。
8.上述现有技术,没有使用可见光进行光固化制备水凝胶。
技术实现要素:
9.本发明要解决的技术问题是提供一种光固化酪蛋白水凝胶的制备方法,并提供了该水凝胶材料在止血及皮肤修复等生物医学领域的应用。
10.为解决上述技术问题,本发明提供一种光固化酪蛋白水凝胶的制备方法,包括以下步骤:
11.1)、将酪蛋白在室温(20~25℃)下充分溶解于碱性溶液中,配制成浓度为6.5~7.5g/100 ml的酪蛋白粉原液;
12.2)、向步骤1)所得的酪蛋白粉原液中加入过硫酸钠搅拌混合均匀,使得过硫酸钠终浓度为55~65mmol/l;再加入氯化三(2,2'-联吡啶)钌(ii)六水合物(ru)作为光引发剂后混匀,光引发剂的终浓度为0.25~0.35mmol/l,形成酪蛋白工作液;
13.3)、用可见光(400~450nm)或紫外线(365~405nm)照射步骤2)所得的酪蛋白工作液,制成光固化酪蛋白水凝胶;
14.当采用可见光时,可见光强度为20~40mw/cm2,照射时间为30~40s,水凝胶厚度《8mm;
15.当采用紫外线时,紫外线光强度为10~40mw/cm2;照射时间为30~90s,水凝胶厚度《8mm。
16.作为的光固化酪蛋白水凝胶的制备方法的改进:
17.步骤1):配制成浓度为7g/100ml的酪蛋白粉原液;
18.步骤2):过硫酸钠终浓度为60mmol/l;光引发剂的终浓度为0.3mmol/l;
19.步骤3):当采用可见光时,可见光强度为30mw/cm2,照射时间为30s;当采用紫外线时,紫外线光强度为30mw/cm2;照射时间为50s。
20.作为的光固化酪蛋白水凝胶的制备方法的改进:所述碱性溶液为浓度为0.1mol/l的氢氧化钠水溶液。
21.本发明还同时提供了利用上述方法制备所得的光固化酪蛋白水凝胶在制备止血剂/敷料、皮肤修复剂中的应用。
22.采用本发明方法制备而得的光固化酪蛋白水凝胶(酪蛋白水凝胶生物材料)具有良好的细胞相容性,无毒性,可快速成型、力学性能可调,凝胶具有优良的止血、皮肤修复等功效,可以应用在生物医学等领域。
23.在本发明中:
24.酪蛋白(酪蛋白粉)为食品级酪蛋白(蛋白浓度》90%),例如可购自恒天然合作社集团有限公司。
25.过硫酸钠作为氧化剂,将光引发剂氧化为过渡态。
26.在本发明中,首先在酪蛋白溶液中加入一定量的过硫酸钠和光引发剂,在室温下充分搅拌混合,形成工作液。将工作液在紫外或者可见光照射下,在30s左右即可形成水凝胶。本发明所涉及的水凝胶制备工艺简单易行,反应条件温和,产品性质稳定,适于工业化生产。
27.首先,ru可以吸收400-450nm范围内的可见光,这可以防止紫外线对细胞的损害。
其次,由于其摩尔消光系数高,相对较低的引发剂浓度具有良好的固化效果。第三,高透过率使其能够整体固化大型结构。在可见光和过硫酸钠存在下,ru主要作用于酪氨酸基团,该基团进一步转化为酪氨酸自由基,与附近的酪氨酸自由基形成共价二酪氨酸键。
28.ru引发剂的最佳吸收波段在可见光范围内,因此相同光强度条件下,可见光成胶快于紫外线。可见光的优势在于成本低、安全性高、凝胶速度快等方面。
29.本发明具有以下优势:
30.(1)、本发明首次采用酪蛋白作为原料,原料来源安全,成本低廉,原料丰富。本发明将成本低廉的食品原料转化为具有生物活性的水凝胶医用材料,大大提高了经济效益。
31.(2)、条件简单:本发明可采用可见光或紫外光,成胶速度快,凝胶强度高;当采用可见光时,能避免紫外线对细胞的损害,且波长较长,穿透深度更大。
32.(3)、本发明所研制的水凝胶属于乳源蛋白医用材料,其安全系数高,产量大,价格比大多同类医用材料更加低廉。
33.(4)、本发明所采用的成胶工艺简单易行,无需复杂的前处理;
34.即,本发明以单纯酪蛋白为原料,不需要前处理修饰即可在可见光照射下交联成胶;酪蛋白凝胶具有良好的组织粘附性,可促进伤口愈合。
35.(5)、本发明所研制的水凝胶生物相容性好,用途广泛,如皮肤修复,骨损伤修复等,具有广阔的应用前景。
36.(6)、止血效果好,优于商业的对照产品;促进伤口愈合效果也优于商业产品。
37.综上所述,本发明制备的以酪蛋白为基质的水凝胶,将酪蛋白转化为具有生物活性的医用材料,可用于解决生物医药等领域。
附图说明
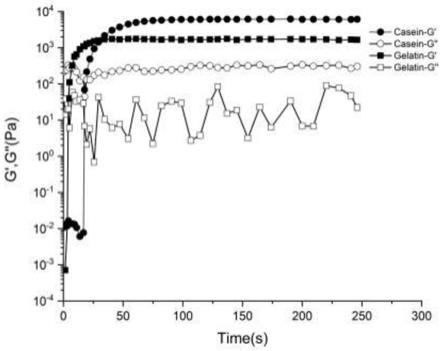
38.下面结合附图对本发明的具体实施方式作进一步详细说明。
39.图1为实施例1的酪蛋白水凝胶;
40.图2为实施例3的酪蛋白水凝胶浸提液培养细胞24h的活/死染色图;
41.图3为实施例4的酪蛋白水凝胶的3d打印;
42.图4为实施例5的酪蛋白水凝胶的组织器官表面粘附性(说明酪蛋白原位成胶与组织粘附性优良);
43.图4中:上左为利用酪蛋白工作液原位成胶成功封堵猪心伤口;上右为在猪肝上原位成胶的酪蛋白凝胶在水流冲洗下未破损和掉落;下图为在猪皮上原位成胶,通过拉伸、扭转、扩张和冲洗,酪蛋白凝胶未发生破损和掉落。
44.图5为对比实验1的酪蛋白水凝胶与明胶水凝胶的流变特性;
45.casein-g’代表酪蛋白成胶过程中储能模量,casein-g”代表酪蛋白成胶过程中损耗模量, gelatin-g’代表明胶成胶过程中储能模量,gelatin-g”代表明胶成胶过程中损耗模量;
46.图6为对比实验2的酪蛋白水凝胶与明胶水凝胶的微观结构;
47.图7为对比实验4的酪蛋白水凝胶、明胶水凝胶及商业水凝胶的鼠尾止血效果;
48.图8为对比实验5的酪蛋白水凝胶、明胶水凝胶及商业水凝胶的创面愈合形态;
49.注:从上而下是三个重复试验;
50.每幅小图中:从外圈至内圈分别对应“day 0”、“day 4”、“day 8”、“day 12”,即,代表不同时间点(0、4、8和12天)伤口愈合情况;
51.图9为对比实验6的酪蛋白水凝胶的创伤愈合后组织染色切片。
具体实施方式
52.下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
53.本发明中:酪蛋白粉为食品级酪蛋白(蛋白浓度》90%),例如可购自恒天然合作社集团有限公司。
54.实施例1、一种可见光光固化酪蛋白水凝胶的制备方法:
55.1)、将酪蛋白粉在室温(20~25℃)下充分溶解于碱性溶液中,配制成浓度为7g/100ml 的酪蛋白粉原液。
56.所述碱性溶液为浓度为0.1mol/l的氢氧化钠水溶液,ph约为10;
57.2)、向步骤1)所得的酪蛋白粉原液中加入过硫酸钠,搅拌混合均匀,过硫酸钠终浓度为60mmol/l;再向上述溶液中加入氯化三(2,2'-联吡啶)钌(ii)六水合物(ru)作为光引发剂后混匀,光引发剂的终浓度为0.3mmol/l,形成酪蛋白工作液。
58.3)、用可见光(400~450nm)照射步骤2)所得厚度为6mm的酪蛋白工作液30s后,即可制成直径为8mm,厚度为6mm的水凝胶,可见光强度为30mw/cm2。所得酪蛋白水凝胶的形态如图1。通过压缩试验计算了水凝胶的压缩模量46kpa,断裂韧性96mj/m3。
59.说明:可见光强度是采用光强测试仪检测所得。
60.实施例2、一种紫外线光固化酪蛋白水凝胶的制备方法
61.用紫外线(365~405nm)照射实施例1步骤2)所得厚度为6mm酪蛋白工作液50s后,即可制成直径为8mm,厚度为6mm的水凝胶,紫外线光强度为30mw/cm2。
62.实验1、酪蛋白水凝胶的体外细胞相容性:
63.1)、将实施例1制备所得的酪蛋白水凝胶,采用dmem标准培养基浸提酪蛋白水凝胶,酪蛋白水凝胶与培养基的质量体积比为1g/20ml,浸提时间为24h,浸提温度为37℃;制备得酪蛋白水凝胶浸提液。
64.2)、选用小鼠皮肤成纤维l929细胞进行培养,所用培养基为90%高糖dmem+10%fbs,培养条件为37℃,得到细胞悬液后进行细胞计数,按细胞数量将细胞悬液稀释至5万/ml。
65.3)、在96孔板中接种步骤2)所得的l929细胞悬液,每孔接种100μl,培养条件为37℃,培养12h使细胞粘附于孔板底部。
66.4)、去除原先培养基(90%高糖dmem+10%fbs),向实验组各孔中加入100μl酪蛋白水凝胶浸提液;空白对照组各孔加入100μl dmem培养基(90%高糖dmem+10%fbs)。
67.5)、将培养板放入培养箱中孵育24h,孵育温度为37℃。
68.6)、配置含10%(v/v)cck-8的培养基,以换液的形式加入孔板。
69.上述含10%cck-8的培养基为:90%高糖dmem+10%cell counting kit-8。
70.7)、将培养板放入培养箱中孵育2h,孵育温度为37℃。
71.8)、用酶标仪测定450nm处的吸光度(od)。
72.表1、酪蛋白水凝胶对细胞活性影响的cck8试验
[0073] 空白对照酪蛋白水凝胶od值0.517
±
0.0610.509
±
0.043
[0074]
酪蛋白水凝胶的细胞毒性试验如图2所示,且酪蛋白水凝胶组od值与空白对照无显著性差异(p》0.05)。该试验结果表明,本发明中的酪蛋白水凝胶几乎无细胞毒性,小鼠皮肤成纤维细胞存活率可达99%,细胞相容性优良。
[0075]
实验2、酪蛋白水凝胶的可3d打印性
[0076]
1)、采用clip打印机,将实施例1的步骤2)中的酪蛋白工作液注入到加样槽中。
[0077]
2)、打印机光源光强度为3mw/cm2,凝胶逐层打印厚度设置为50μm,每层照射时间为 30s,打印3层,打印图案如图3所示。
[0078]
利用clip打印技术,可打印出高分辨率高精确度的酪蛋白水凝胶复杂结构。
[0079]
实验3、酪蛋白水凝胶的组织器官表面粘附性
[0080]
1)、将实施例1的步骤2)所得的酪蛋白工作液滴加到器官组织表面(猪心、猪肝以及猪皮),采用可见光(400~450nm)照射该酪蛋白工作液30s。
[0081]
2)、如图4所示,用较大水流冲洗猪心、猪肝以及猪皮上的酪蛋白水凝胶表面未见破损脱落现象。将猪皮拉伸、扭转,未见酪蛋白水凝胶破损脱落。
[0082]
因此,酪蛋白可在组织表面原位成胶,并与组织表面的酪氨酸基团形成共价交联,增强组织粘附性。酪蛋白水凝胶可作为一种生物胶粘剂,广泛应用于医疗领域。
[0083]
对比实验1、酪蛋白水凝胶与明胶水凝胶的流变特性比较
[0084]
1)、将明胶粉末在37℃水浴中充分溶解于0.1mol/l氢氧化钠溶液中,配制成浓度为10 g/100ml的明胶原液;
[0085]
2)、以上述明胶原液替代实施例1中的酪蛋白粉原液,其余等同于实施例1的步骤2),得到明胶工作液。
[0086]
3)、将实施例1的步骤3)可见光光强度由30mw/cm2改为1.5mw/cm2,凝胶厚度(流变仪设置的高度)设置为0.25mm,照射时间由0s直至为250s;其余等同于实施例1的步骤3);
[0087]
将实施例1步骤2)所得的“酪蛋白工作液”以及对比实验1步骤2)所得的“明胶工作液”,按照上述条件进行检测,从而比较酪蛋白水凝胶和明胶水凝胶的流变特性。
[0088]
按照常规的流变学测量方法,采用mcr302流变仪测定酪蛋白水凝胶和明胶水凝胶的流变特性,应力为1%,频率为30hz,酪蛋白和明胶水凝胶的储能模量(g')和损耗模量(g") 随时间的变化参见图5,两者对应的凝胶时间和储能模量(g')见表2。
[0089]
表2、酪蛋白水凝胶和明胶水凝胶的凝胶时间以及储能模量
[0090] 酪蛋白水凝胶明胶水凝胶凝胶时间(s)18.9a8.8b储能模量(pa)6115.8a1729.2b[0091] 根据图5和表1可知,本发明的酪蛋白水溶液的凝胶时间仅约为19s(从溶液转变为凝胶的临界点时间),其凝胶速度虽不及明胶水溶液,但酪蛋白水凝胶的储能模量远远高于明胶。该实例中酪蛋白水凝胶具有较高的储能模量,特性优良,可用于软骨损伤修复,具有良好的应用前景。
[0092]
对比实验2、酪蛋白水凝胶与明胶水凝胶的微观结构比较
[0093]
1)、将实施例1的步骤2)所得的酪蛋白工作液与对比实验1的步骤2)所得的明胶工作液进行光固化(光固化条件为光强度为30mw/cm2可见光照射30s),制成直径为8mm,厚度为6mm的水凝胶。
[0094]
2)、将步骤1)制备所得的酪蛋白水凝胶和明胶水凝胶,-80℃预冻6h,然后-80℃冷冻干燥48h。
[0095]
3)、将冻干后的酪蛋白水凝胶和明胶水凝胶进行切片,扫描电镜成像观察微观结构如图 6。
[0096]
从水凝胶的横截面形貌和微观结构上验证了酪蛋白水凝胶不同于明胶水凝胶。酪蛋白水凝胶具有致密均匀的多孔结构,且孔径小于明胶水凝胶,说明酪蛋白水凝胶的交联位点远高于明胶水凝胶,且具有更高的力学强度。
[0097]
对比实验3、酪蛋白水凝胶与明胶水凝胶的溶胀率比较
[0098]
1)、将实施例1的步骤2)所得的酪蛋白工作液与对比实验1的步骤2)所得的明胶工作液进行光固化(光固化条件为光强度为30mw/cm2可见光照射30s),制成直径为8mm,厚度为6mm的水凝胶,并称重m0。
[0099]
2)、将步骤1)所得的2种水凝胶分别进行如下处理:放入15ml无菌离心管中,加入 10ml 1
×
pbs缓冲液(ph7~8)浸泡48h,对水凝胶进行称重记录m
48
,计算溶胀率见表3。
[0100][0101]
表3、酪蛋白水凝胶和明胶水凝胶的溶胀率
[0102] 酪蛋白水凝胶明胶水凝胶溶胀率%0.19b14.04a[0103]
酪蛋白水凝胶在pbs缓冲液中能够良好保持结构形状,可在体内长时间维持固有形状。
[0104]
对比实验4、酪蛋白水凝胶、明胶水凝胶及商业水凝胶的鼠尾止血效果比较
[0105]
1)、小鼠麻醉箱诱导后使用2%异氟烷浓度+0.5l/min氧流量维持麻醉。
[0106]
2)、固定步骤1)中小鼠体位后剪尾1/3,10秒后,在断尾处分别滴加实施例1的步骤2) 所得的酪蛋白工作液、对比实验1的步骤2)所得的明胶工作液、商业水凝胶;分别作为酪蛋白组(casein)、明胶组(gelatin)、商业水凝胶组(fibrin gel);以不做任何处理作为空白对照(blanck);
[0107]
商业水凝胶为购自合肥博美生物科技有限公司的编号为xf6522的水凝胶。
[0108]
3)、酪蛋白组与明胶组光照30s(光照强度为30mw/cm2)进行止血,商业水凝胶37℃孵育3min止血,空白对照自然状态止血;用小片滤纸接收各组出血如图7。通过滤纸前后重量差值比较出血量见表4。
[0109]
表4、不同水凝胶材料处理后的小鼠断尾出血量
[0110] 空白对照酪蛋白水凝胶明胶水凝胶商业水凝胶出血量(g)0.2468a0.0179b0.0318b0.0192b[0111]
酪蛋白水凝胶具有良好的止血效果,与目前市面上的商业水凝胶止血效果无显著差异,后续可开发为用于伤口止血的生物医学材料。
[0112]
对比实验5、酪蛋白水凝胶、明胶水凝胶及商业水凝胶的体外凝血指数比较
[0113]
1)、小鼠过量戊巴比妥麻醉,眼球摘除快速取血。
[0114]
2)、立即取步骤1)中小鼠血50μl与各试验管内的100μl材料混合。
[0115]
以实施例1的步骤2)所得的酪蛋白工作液、对比实验1的步骤2)所得的明胶工作液、商业水凝胶分别作为试验管内的100μl材料;分别作为酪蛋白组、明胶组、商业水凝胶组;以自然凝血作为空白对照(blanck);
[0116]
3)、酪蛋白组与明胶组光照1min进行固化凝血;商业水凝胶37℃孵育3min进行凝血;小鼠血自然凝血1min为空白对照。
[0117]
4)、沿步骤3)中各组管壁加入1ml ddh2o,并在不吹散血凝块的程度下轻柔混匀,使溶液颜色上下均一。各管吸取上清100μl
×
3至96孔板,在545nm检测波长下记录od值。以新鲜鼠血加入1ml ddh2o为阳性对照,测得od值,计算体外凝血指数(bci)见表5。
[0118][0119]
表5、不同凝胶材料的体外凝血指数
[0120] 空白对照酪蛋白水凝胶明胶水凝胶商业水凝胶体外凝血指数61.67a2.37c2.46c5.54b[0121]
酪蛋白水凝胶具有良好的凝血效果,与明胶水凝胶无显著差异,但明显优于商业水凝胶的凝血效果。
[0122]
对比实验6、酪蛋白水凝胶、明胶水凝胶及商业水凝胶的皮肤修复比较
[0123]
1)、常规异氟烷+氧流麻醉下,小鼠背部备皮、消毒,轻柔提起小鼠背部皮肤,避免用力牵拉变形,同时利用multitex圆形取样器作一对平行脊柱的对称8mm直径的圆形皮肤缺损,深及真皮全层,确认伤口大小一致。
[0124]
2)、伤面覆盖不同测试材料后敷贴tegaderm薄膜。在0,4,8,12天利用体式镜拍摄记录大体愈合形态(图8和表5),并在12天于创缘切取标本同时切取部分创面底部及周边健康皮肤组织。标本置于福尔马林中固定。
[0125]
以实施例1的步骤2)所得的酪蛋白工作液、对比实验1的步骤2)所得的明胶工作液、商业水凝胶分别作为上述测试材料;从而分别形成酪蛋白组(casein)、明胶组(gelatin)、商业水凝胶组(fibrin gel);以不做处理作为空白对照(blanck);
[0126]
3)石蜡切片he染色拍照具体流程如下所示:
[0127]
(1)组织脱水:标本组织依次经75%酒精(4h)-85%酒精(2h)-90%酒精(1.5h)-95%酒精(1h)-无水乙醇ⅰ(0.5h)-无水乙醇ⅱ(0.5h)完成组织脱水。
[0128]
(2)组织透明:脱水组织依次经过无水乙醇:二甲苯(1:1)(10min)-二甲苯ⅰ(10min)
ꢀ‑
二甲苯ⅱ(7min)完成组织透明过程。
[0129]
(3)浸蜡:透明后的组织块依次经3缸石蜡(60℃)进行浸蜡。石蜡ⅰ(60℃)(1h)
‑ꢀ
石蜡ⅱ(60℃)(1h)-石蜡ⅲ(60℃)(1h)。
[0130]
以上步骤都在生物组织脱水机里面完成。
[0131]
(4)包埋:包埋用蜡的温度应略高于浸蜡温度,保证组织块与包埋石蜡完全融为一体,使浸透蜡的组织块包裹在石蜡块中。
[0132]
(5)切片和烤片:切片前蜡块切面在冻台上冷冻数分钟,标本夹固定目标包埋块,使包埋块外切面与标本夹截面平行,并使包埋块稍突出。将刀台推至外缘后松开刀片夹的螺旋,上好刀片,使切片刀平面与组织切面间呈15
°
左右的夹角,包埋块上下边与刀口平行。在微动装置上调节切片要求的厚度(4μm),将刀台移至近标本台处,让刀口与组织切面稍稍接触,开始进行切片。右手用力均匀匀速转动转轮,左手持毛笔在刀口稍下端接隹切好的片子,并托住切下的蜡带,待蜡带形成一定长度后,右手停止转动,持另一枝毛笔轻轻将蜡带挑起,平放于42℃左右水浴展片锅中。切好的切片需展平后贴附于载玻片。捞片法具体流程:首先将连串的切片放入到42℃左右的温水浴展片锅中,待切片浮于水面,并由于表面张力的作用自然展平,用镊子将切片分开,然后用apes或多聚赖氨酸处理过的防脱玻片倾斜着插入水面去捞取切片,使切片贴附在载玻片的合适位置,贴服完成后于60℃烤箱烤片3个小时。
[0133]
(6)切片脱蜡:将石蜡切片依次放入二甲苯ⅰ(10min)-二甲苯ⅱ(10min)-无水乙醇
ⅰꢀ
(5min)-无水乙醇ⅱ(5min)-95%酒精(3min)-90%酒精(3min)-80%酒精(2min)-70%酒精(2min),然后蒸馏水浸洗2min。
[0134]
(7)he染色:harris氏苏木素染液染色5-7min,自来水洗浸洗返蓝。切片入1%的盐酸酒精分化2-5s,自来水洗浸洗返蓝。切片入1%水溶性伊红染液染色2min,自来水洗浸洗30s。切片入无水乙醇脱水,二甲苯透明,风干后中性树胶封片。
[0135]
(8)镜下拍照:染色完成后光学镜下观察如图9。
[0136]
酪蛋白水凝胶作为伤口敷料有助于创面的愈合,其愈合速度高于其他水凝胶以及空白对照,且对创伤组织无任何毒副作用,愈合状态良好。
[0137]
表6、不同凝胶材料处理后的皮肤伤口状态变化
[0138][0139]
根据表6的结果,酪蛋白水凝胶对皮肤伤口的愈合的速率显著高于明胶和商业水凝胶组,经过8天后愈合率达到87%,具有优异的愈合效果。
[0140]
对比例1-1、将实施例1中的酪蛋白溶液的浓度由7%改成5%,其余等同于实施例1。
[0141]
对比例1-2、将实施例1中的酪蛋白溶液的浓度由7%改成15%,其余等同于实施例1。
[0142]
对比例2-1、将实施例1中的氯化三(2,2'-联吡啶)钌(ii)六水合物(ru)浓度由0.3mmol/l 改成0.5mmol/l,其余等同于实施例1。
[0143]
对比例2-2、将实施例1中的氯化三(2,2'-联吡啶)钌(ii)六水合物(ru浓度由0.3mmol/l 改成2mmol/l,其余等同于实施例1。
[0144]
对比例2-3、将实施例1中的氯化三(2,2'-联吡啶)钌(ii)六水合物(ru浓度由0.3mmol/l 改成0.2mmol/l,其余等同于实施例1。
[0145]
对比例3-1、将实施例1中的过硫酸钠终浓度由60mmol/l改成20mmol/l,其余等同于实施例1。
[0146]
对比例3-2、将实施例1中的过硫酸钠终浓度由60mmol/l改成30mmol/l,其余等同于实施例1。
[0147]
对比例3-3、将实施例1中的过硫酸钠终浓度由60mmol/l改成80mmol/l,其余等同于实施例1。
[0148]
对比例4-1、将实施例1步骤1)的碱性溶液改成水,体积用量保持不变;其余等同于实施例1。
[0149]
对比例4-2、将实施例1步骤1)的碱性溶液改成高碱性溶液,即ph约为14的氢氧化钠溶液(浓度约为1mol/l)。
[0150]
将上述所有对比例所得的水凝胶按照上文的实施例1中力学试验方法和对比例1中流变学试验方法进行检测,所得结果与本发明实施例1的对比,如下表7所示:
[0151]
表7
[0152][0153]
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1