一种基于亚甲基蓝的近红外荧光探针及其合成方法和应用
1.本发明涉及基于亚甲基蓝的近红外荧光探针,具体属于一种基于亚甲基蓝的近红外荧光探针及其合成方法,以及该探针在区分检测硫醇和代谢中的应用。
背景技术:
2.新陈代谢是体内维持生命的一系列有序化学反应的总称。代谢也被称为细胞代谢。化学生物学需要发展新的技术和方法来研究以化学小分子为探针的生命系统信号转导过程中的重要分子事件。随着有机合成技术的改进,制备了基于有机分子的高性能多功能荧光探针,不仅可有效作为生活系统信号通路的视觉荧光追踪,还可作为有效干预生理和病理过程的药物。
3.生命系统中有一类重要的含硫活性物质,主要是三种生物硫醇,包括同型半胱氨酸(hcy)、半胱氨酸(cys)、谷胱甘肽(gsh)、二氧化硫(so2)和硫化氢(h2s)。它们在生物体中形成了一个相互交织的网络:cys参与了各种蛋白质的合成,以及主要的抗氧化剂gsh也是细胞中硫代谢的中心物质。近年来,研究表明,活性含硫分子的浓度和代谢异常与各种疾病密切相关。生物硫醇和硫化氢与心血管疾病密切相关。内源性二氧化硫浓度与癌症的发生和发展密切相关。研究其代谢途径有利于有效的干预,以预防相关主要疾病的发生和发展。
4.近年来,我们研究小组一直专注于基于有机分子荧光探针的含硫活性物质的化学精确测量和生物成像。特别是,在将多位点反应和多色发射应用于信号通路方面已经取得了一些进展。
5.在本发明中,我们同时构建了反应位点来进一步区分靶点或检测其代谢物,从而实现多种代谢途径的同时可视化示踪。实现了对三种生物硫醇的区分检测和追踪gsh代谢so2的检测。
技术实现要素:
6.本发明的目的在于提供一种基于亚甲基蓝的近红外荧光探针及其合成方法,以及该探针在区分检测硫醇和代谢中的应用,所述检测应操作简便、灵敏度高,生物相容性好,检出限较低。
7.本发明提供一种基于亚甲基蓝的近红外荧光探针,化合物的名称为4-((7-(二乙氨基)-3-甲酰基-2-氧代-2h-铬-4-基)氧基)苄基3,7-双(二甲氨基)-10h-吩噻嗪-10-羧酸盐4-((7-(diethylamino)-3-formyl-2-oxo-2h-chromen-4-yl)oxy)benzyl 3,7-bis(dimethylamino)-10h-phenothiazine-10-carboxylate。命名为mb-c,结构式如下:
10-羰基氯、碳酸钠和4-二甲氨基吡啶的摩尔比1.2:1:3:1。
16.上述近红外荧光探针mb-c可用于cys,hcy,gsh的区分检测以及gsh代谢so2的检测。其检测原理:
17.该探针以连接基团对羟基苯甲醇的羟基上的氧作为三种硫醇的反应位点,一部分通过电荷转移释放出亚甲基蓝荧光团,另一部分连接硫醇巯基的香豆素部分,hcy和cys通过分子内重排发出蓝色荧光,而gsh由于其空间位阻较大无法发生分子内重排,从而与醛基发生结合而发出绿色荧光。随后以c=n双键作为亚硫酸根的反应位点使荧光发生淬灭。其反应式如下:
[0018][0019]
本发明提供的一种区分检测cys/hcy和gsh的方法,步骤为:
[0020]
(1)配制体积比为1:1的ph7.4的磷酸缓冲溶液和二甲基亚砜为反应体系,将mb-c溶于dmso配制成2mm的制备液,分别配制20mm的谷胱甘肽(gsh),半胱氨酸(cys),同型半胱氨酸(hcy)溶液;
[0021]
(2)紫外光谱:取1960μl的反应体系溶液、10μlmb-c、30μl的gsh溶液,加到比色皿中,进行紫外扫描,时间间隔为90s。cys/hcy进行同样操作;
[0022]
(3)荧光光谱:取1960μl的反应体系溶液、10μlmb-c、30μl的gsh溶液,加到比色皿中,进行荧光扫描,时间间隔为25s;cys/hcy进行同样操作;每种硫醇都分别用不同激发380nm,445nm,630nm测定三次;
[0023]
(4)工作曲线:在7个2ml的ep管中,分别加入体系溶液1990μl;10μlmb-c;然后加入不同量的gsh溶液,使gsh在体系中的浓度分别为0μm,10μm,12μm,14μm,16μm,18μm,20μm;摇匀放置10分钟后,以445nm作为激发进行荧光扫描,得样品在529nm处的荧光强度;以gsh浓度为横坐标,以529nm处荧光强度为纵坐标绘制图,得gsh与mb-c的工作曲线;线性回归方程为:y=114.07x+802.10,r2=0.98966;x的单位为μm;cys/hcy进行同样操作,以380nm作为激发进行荧光扫描,得到cys/hcy在472nm处的荧光强度与mb-c的工作曲线。
[0024]
本发明提供的一种追踪gsh代谢so2代谢过程的方法,步骤为:
[0025]
(1)配制体积比为1:1的ph7.4的磷酸缓冲溶液和二甲基亚砜为反应体系,将mb-c溶于二甲基亚砜配制成2mm的制备液,配制20mm的谷胱甘肽(gsh),半胱氨酸(cys),同型半胱氨酸(hcy)和亚硫酸钠(na2so3)溶液;配制ph7.4的磷酸缓冲溶液,2mm的n-乙基马来酰亚胺(nem)溶液;
[0026]
(2)代谢光谱:取1960μl的反应体系溶液、10μlmb-c,30μl的gsh溶液,加到比色皿中,摇匀放置10分钟后;再取30μl的na2so3溶液,分别在380nm,445nm,630nm作为激发的条件下,对上述体系进行荧光扫描,时间间隔为30s;cys和hcy也同样操作;
[0027]
(3)细胞应用:10μl mb-c加入到2ml的pbs溶液中,使得其浓度为10μm;在37℃下用上述溶液孵育hela 10分钟,用pbs洗涤细胞(2ml
×
3),用于共聚焦成像;第二组用500μm nem处理细胞10分钟,pbs洗涤后再用10μmmb-c孵育10分钟,用于共聚焦成像。第三组细胞先用500μm nem处理细胞10分钟,pbs洗涤后用500μm cys+10μmmb-c孵育10分钟,pbs洗涤后成像。第四组细胞先用500μm nem处理细胞10分钟,pbs洗涤后用500μm gsh+10μmmb-c孵育10分钟,pbs洗涤后成像;
[0028]
(4)用2ml的500μm nem的pbs溶液孵育hela 10分钟,pbs洗涤后用500μm gsh+10μmmb-c孵育10分钟,pbs洗涤细胞,加入200μm na2so3实时监测细胞信号随时间的变化。对照组则不添加na2so3,检测细胞荧光信号的变化。cys的操作与gsh组相同。
[0029]
与现有技术相比,本发明具有如下有益效果:
[0030]
1、本发明的探针不仅可区分检测三种生物硫醇,还可进行生物代谢检测;
[0031]
2、本发明技术操作较为简单,检测简便,仅需紫外分光光度计和荧光检测器;
[0032]
3、本发明检测信号明显,反应溶液颜色变化肉眼可见,反应时间迅速。
附图说明
[0033]
图1实施例1制备荧光探针mb-c氢谱图
[0034]
图2实施例1制备荧光探针mb-c碳谱图
[0035]
图3实施例1制备荧光探针mb-c质谱图
[0036]
图4实施例2mb-c与gsh反应的紫外光谱图
[0037]
图5实施例2mb-c与cys反应的紫外光谱图
[0038]
图6实施例2mb-c与hcy反应的紫外光谱图
[0039]
图7,8,9实施例3mb-c与gsh分别在380nm、445nm、630nm作为激发条件下的荧光光谱图
[0040]
图10,11,12实施例3mb-c与cys分别在380nm、445nm、630nm作为激发条件下的荧光光谱图
[0041]
图13,14,15实施例3mb-c与hcy在分别在380nm、445nm、630nm作为激发条件下的荧光光谱图
[0042]
图16实施例4mb-c与gsh在529nm处荧光强度的线性关系
[0043]
图17实施例4mb-c与cys在472nm处荧光强度的线性关系
[0044]
图18实施例4mb-c与hcy在472nm处荧光强度的线性关系
[0045]
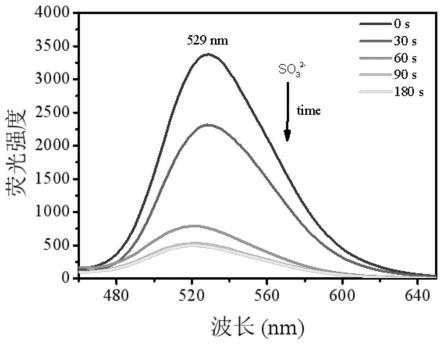
图19,20实施例5mb-c与gsh反应后的体系加入na2so3后分别445nm、630nm作为激发条件下的荧光光谱图
[0046]
图21,22实施例5mb-c与cys反应后的体系加入na2so3后分别380nm、630nm作为激发条件下的荧光光谱图
[0047]
图23,24实施例5mb-c与hcy反应后的体系加入na2so3后分别380nm、630nm作为激发条件下的荧光光谱图
[0048]
图25实施例6mb-c在不同条件下孵育的细胞成像图
[0049]
图26实施例7mb-c与gsh反应后是否添加na2so3的细胞荧光强度随时间变化图
[0050]
图27实施例7mb-c与cys反应后是否添加na2so3的细胞荧光强度随时间变化图。
具体实施方式
[0051]
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制。
[0052]
实施例1
[0053]
探针mb-c的合成和表征
[0054]
将丙二酸(11g,106mmol)和苯酚(19.95g,212mmol)混合物于0℃下缓慢加入三氯氧磷(11.5ml,123mmol),混合物在115℃加热到氯化氢气体的强释放停止(约1.5小时),将上层倒入150ml水中并用乙酸乙酯萃取三次,有机相用无水硫酸钠干燥,旋干溶剂,得到浅黄色油状物丙二酸二苯酯(20.6g)。
[0055]
将丙二酸二苯酯(12.8g,50mmol)溶于50ml的甲苯中,再加入3-二乙氨基酚(8.25g,50mmol),回流反应7小时,反应结束后,抽滤,用石油醚或者正己烷洗涤,产物真空干燥,得到浅黄色固体7-(二乙氨基)-4-羟基-2h-铬烯-2-酮(8.7g)。
[0056]
在冰水浴中,将n,n-二甲基甲酰胺(2.8ml)加入到三氯氧磷(2.8ml)中,搅拌半小时,得透明粘稠状物质,将溶于n,n-二甲基甲酰胺(13.2ml)的7-(二乙氨基)-4-羟基-2h-铬烯-2-酮(2.33g,10mmol)逐滴加入到上述溶液中,得狸红色溶液。在60℃下搅拌12小时,然后倒入100ml冰水中,加入氢氧化钠调节ph到5产生大量沉淀,抽滤并用水洗涤,之后用无水乙醇重结晶。得4-氯-7-(二乙氨基)-2-氧代-2h-铬烯-3-甲醛(1.2g)。
[0057]
将4-氯-7-(二乙氨基)-2-氧代-2h-铬烯-3-甲醛(1.2g,4.3mmol)溶于10ml二氯甲烷中,在冰水浴下搅拌5分钟,加入三乙胺(1.8ml,12.9mmol),继续搅拌10分钟,加入对羟基苯甲醇(0.533g,4.3mmol),搅拌反应8小时,除去溶剂并将粗产物进行硅胶柱色谱纯化。得到黄色产物7-(二乙氨基)-4-(4-(羟甲基)苯氧基)-2-氧代-2h-铬烯-3-甲醛(0.68g)。1h nmr(600mhz,dmso-d6)δ9.87(s,1h),7.36(d,j=8.9hz,1h),7.27(d,j=7.2hz,2h),7.06(d,j=7.0hz,2h),6.75(d,j=9.1hz,1h),6.64(s,1h),5.17(s,1h),4.44(s,2h),3.49(d,j=6.0hz,4h),1.13(s,6h).
[0058]
7-(二乙氨基)-4-(4-(羟甲基)苯氧基)-2-氧代-2h-铬烯-3-甲醛(0.68g,1.85mmol),3,7-双(二甲氨基)-10h-吩噻嗪-10-羰基氯(0.54g,1.54mmol),碳酸钠(0.59g,5.55mmol)和4-二甲氨基吡啶(0.19g,1.54mmol)溶于二氯甲烷中,在氮气保护,冰浴条件下搅拌反应8h;除去溶剂并将粗产物进行硅胶柱色谱纯化,得到黄色固体4-((7-(二乙氨基)-3-甲酰基-2-氧代-2h-铬-4-基)氧基)苄基3,7-双(二甲氨基)-10h-吩噻嗪-10-羧酸盐(0.04g,1.54mmol),命名为mb-c。1h nmr(600mhz,dmso-d6)δ9.87(s,1h),7.37(d,j=9.3hz,1h),7.31(dd,j=8.6,4.2hz,4h),7.10(d,j=8.6hz,2h),6.75(d,j=9.6hz,1h),6.68(d,j=2.5hz,2h),6.66(d,j=2.7hz,2h),6.64(d,j=2.6hz,1h),5.13(s,2h),3.50
–
3.48(m,4h),2.88(s,12h),1.14(d,j=6.9hz,6h).
[0059]
实施例2
[0060]
溶液配制:配制体积比为1:1的ph7.4的磷酸缓冲溶液和二甲基亚砜为反应体系,
将mb-c溶于二甲基亚砜配制成2mm的制备液,配制20mm的谷胱甘肽(gsh),半胱氨酸(cys),同型半胱氨酸(hcy)溶液和亚硫酸钠(na2so3);
[0061]
紫外光谱:取1960μl的反应体系溶液、10μlmb-c制备液、30μl的gsh溶液,加到比色皿中,进行紫外扫描,时间间隔为90s。cys/hcy进行同样操作得光谱性质显示:随着时间的增加,三种硫醇在666nm的吸收逐渐增加而后趋于稳定,但cys和hcy在380nm处出现一个新的吸收峰,而gsh在445nm处的吸收峰减弱,在385nm处会出现一个稍弱的吸收峰。结果如图4,5,6所示。
[0062]
实施例3
[0063]
溶液配制:同实施例2。
[0064]
荧光光谱:取1960μl的反应体系溶液、10μl mb-c制备液、30μl的gsh溶液,加到比色皿中,进行荧光扫描,时间间隔为25s。结果如图7,8,9所示。cys/hcy进行同样操作,光谱性质如10,11,12(13,14,15)。每种硫醇都分别用不同激发380nm,445nm,630nm测定三次。光谱显示:以380nm和630nm为激发,三种硫醇在472nm和704nm处的荧光强度随着时间的增加而增强。以445nm作为激发,cys和hcy在498nm的荧光强度急剧下降,而gsh在529nm的荧光强度急剧增加而后趋于稳定。
[0065]
实施例4
[0066]
溶液配制:同实施例2;
[0067]
工作曲线:在7个2ml的ep管中,分别加入体系溶液1990μl;10μlmb-c;然后加入不同量的gsh溶液,使gsh在体系中的浓度分别为0μm,10μm,12μm,14μm,16μm,18μm,20μm。摇匀放置10分钟后,以445nm作为激发进行荧光扫描,得样品在529nm处的荧光强度;以gsh浓度为横坐标,以529nm处荧光强度为纵坐标绘制图,得gsh与mb-c的工作曲线;线性回归方程为:y=114.07x+802.10,r2=0.98966。x的单位为μm;cys/hcy进行同样操作,以380nm作为激发进行荧光扫描,得498nm处得荧光强度,处理数据得cys/hcy与mb-c的工作曲线。线性关系如图16,17,18所示。
[0068]
实施例5
[0069]
代谢光谱:分别在380nm,445nm,630nm作为激发的条件下,将mb-c与gsh反应后的溶液中加入30μlna2so3进行荧光扫描,时间间隔为30s。cys/hcy进行同样操作。光谱性质显示:以630nm,380nm为激发,三种硫醇在704nm和472nm的荧光强度基本没有明显变化。以445nm为激发,gsh体系中529nm处的荧光强度随着时间急剧减弱。光谱图如图19-24所示。
[0070]
实施例6
[0071]
溶液配制:配制ph7.4的磷酸缓冲溶液,将mb-c溶于二甲基亚砜配制成2mm的制备液,配制20mm的谷胱甘肽(gsh),半胱氨酸(cys),同型半胱氨酸(hcy)溶液,亚硫酸钠(na2so3)和2mm的n-乙基马来酰亚胺(nem)溶液;
[0072]
细胞实验:10μl mb-c加入到2ml的pbs溶液中,使得其浓度为10μm;在37℃下用上述溶液孵育hela 10分钟,用pbs洗涤细胞(2ml
×
3),用于共聚焦成像,细胞在蓝色通道,绿色通道和红色通道都发出荧光;第二组用500μm nem处理细胞10分钟,pbs洗涤后再用10μmmb-c孵育10分钟,三个通道的荧光都减弱。第三组细胞先用500μm nem处理细胞10分钟,pbs洗涤后用500μm cys+10μmmb-c孵育10分钟,pbs洗涤后成像,红色通道和蓝色通道都发出较强的荧光信号,而绿色通道相对来说很弱。第四组细胞先用500μm nem处理细胞10分
钟,pbs洗涤后用500μm gsh+10μmmb-c孵育10分钟,pbs洗涤后成像,三个通道都发出较强的荧光信号。所有实验组结果如图25所示。
[0073]
实施例7
[0074]
溶液配制:同实施例6;
[0075]
用2ml的500μm nem的pbs溶液孵育hela 10分钟,pbs洗涤后用500μm gsh+10μmmb-c孵育10分钟,pbs洗涤细胞,加入200μm na2so3实时监测细胞信号随时间的变化。对照组则不添加na2so3,检测细胞荧光信号的变化。cys的操作与gsh组相同。gsh组实验结果如图26所示,孵育na2so3的细胞随着时间的增加,其绿色荧光信号随着时间的增加而减弱。红色通道基本无变化。对照组的荧光信号基本都无明显变化。cys实验组和对照组结果如图27。cys的实验组和对照组的蓝色通道和红色通道均无明显变化。这也证实了我们的光谱性质。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1