一种草本纤维提取用微生物菌剂及其制备方法和应用
1.本发明属于草本纤维原料的处理技术领域,更具体地,涉及一种草本纤维提取用微生物菌剂及其制备方法和应用。
背景技术:
2.草本纤维是世界上重要的天然纤维来源之一;草本纤维原料除含有大量纤维素纤维外,还包含有果胶、半纤维素和木质素等“杂质”成分。为了从草本纤维原料中获得纯净纤维,都必须经过“除杂”,除去韧皮纤维原料的非纤维素物质;因此,纤维提取是草本纤维原料加工过程中基础而关键的环节。
3.生物提取法因其具有“绿色、高效、节能”的优势而备受青睐。
4.草本纤维生物提取的核心是高效菌种;国内外报道一系列有关草本纤维生物提取的菌株,如:actinomycete sp.(br
ü
hlmann et al.,1994)、bacillus pumilus dks1(basu et al.,2009)、paenibacillus campinasensis bl11(ko et al.,2011)、bacillus tequilensis(chiliveri et al.,2016)、bacillus clausii(zhou et al.,2017)等,然而这些菌株还存在培养条件苛刻、生长周期长、除杂不彻底等缺陷,限制了其在工业化生产中的大规模应用。
5.本技术的发明人所在课题组前期选育到能用于草本纤维生物提取的广谱性高效菌种dce-01,能同时高效处理涉及苎麻、红麻、黄麻、亚麻、工业大麻、麦草和龙须草等多种草本纤维原料,尤其在6-10h能完成苎麻和红麻纤维的生物提取。截止2021年底,该课题组利用该菌种先后建成麻类生物脱胶示范工程10余个,累计生产麻类纤维15-20万吨,占全国麻类农产品工厂化脱胶能力的30%以上。
6.然而,dce-01菌种属于热敏性的革兰氏阴性菌,其菌种制备技术比较难,尤其是菌种易退化和变异的技术问题制约了其在麻类生物脱胶的进一步扩大应用。
7.鉴于此,特提出本发明。
技术实现要素:
8.为解决上述技术中存在的缺陷,本发明提供了一种草本纤维提取用微生物菌剂及其制备方法和应用。
9.为实现上述目的,本发明的技术方案如下:
10.一种草本纤维提取用微生物菌剂的制备方法,包括:
11.将活化后的dce-01菌种接种至改良发酵培养液中扩培发酵,随后将获得的成熟发酵液浓缩,最后添加保护剂,混匀后将得到的菌悬液干燥即可;
12.所述改良发酵培养液为含有甘露糖0.08-0.25wt%、海藻糖0.075-0.24wt%和葡萄糖0.2-0.55wt%的发酵培养液。
13.在上述技术方案中,所述保护剂为包含糖类、蛋白质和淀粉的复合保护剂。
14.优选地,在上述技术方案中,所述保护剂为由玉米淀粉、脱脂奶粉、海藻糖、乳糖、
糊精、甘露醇、谷氨酸钠和甘油组成的复合保护剂。
15.在本发明的优选实施方式中,在所述复合保护剂中,所述糊精、海藻糖、乳糖的质量比为10∶3-5∶2-1。
16.在本发明的优选实施方式中,在所述复合保护剂中,所述玉米淀粉和脱脂奶粉的质量比为1∶3-5。
17.进一步地,在上述技术方案中,所述保护剂的加入质量为浓缩后的成熟发酵液的质量的0.4-0.5倍。
18.再进一步地,在上述技术方案中,所述改良发酵培养液的配方为:
19.甘露糖0.1-0.2wt%+海藻糖0.1-0.2wt%+葡萄糖0.3-0.5wt%+牛肉膏0.5wt%+蛋白胨0.5wt%+nacl 0.5wt%,余量为水。
20.具体地,在上述技术方案中,所述草本纤维提取用微生物菌剂的制备方法还包括:
21.在将活化后的dce-01菌种接种至改良发酵培养液中扩培发酵之前,通过加入nh3·
h2o将所述改良发酵培养液的ph调节为7.0-7.5,随后在115℃下灭菌18-25min。
22.又进一步地,在上述技术方案中,所述扩培发酵具体包括:
23.将活化后的dce-01菌种的种子液与改良发酵培养液按体积比为1∶30-50的比例置于密封的发酵罐中,并控制发酵罐的灌装量为其容积的0.5-0.6倍,同时通过添加nh3·
h2o控制ph值为6.7-7.0,在32-35℃、180-200rpm和对应于每升种子液的通气量为0.5-0.7m3/h的条件下,发酵培养8-10h直至其ph值恒定或上升。
24.优选地,在上述技术方案中,扩培发酵所获得的成熟发酵液中,所述dce-01菌的浓度大于2
×
108cfu/ml。
25.优选地,在上述技术方案中,所述浓缩为采用孔径为0.2μm的超滤膜包对所获得的成熟发酵液浓缩7.5-15倍。
26.还进一步地,在上述技术方案中,所述活化具体为:
27.将混有dce-01菌苔的营养肉汤培养液接种至30-50倍体积的营养肉汤培养液中并混匀,在33-35℃和150-180rpm条件下培养5-6h得一级种子液,随后再将一级种子液与200-350倍体积的营养肉汤培养液混匀,在33-35℃和150-180rpm条件下培养5-6h得二级种子液。
28.优选地,在上述技术方案中,所述营养肉汤培养液的配方为:
29.葡萄糖1wt%+牛肉膏0.5wt%+蛋白胨0.5wt%+nacl 0.5wt%,并用naoh调ph值为7.0-7.5。
30.具体地,在上述技术方案中,所述dce-01菌苔的制备方法为:
31.将冷驯化的dce-01菌种接种至营养肉汤培养液中并混匀,在33-35℃下培养5-6h,稀释后涂布于yq营养琼脂平板中,在33-35℃下培养18-20h后分离单菌落,挑选典型菌落划线于新鲜斜面上,在33-35℃下培养18-20h后真空包装,常温保存,半年内有效。
32.在本发明的一个具体实施方式中,所述菌悬液的干燥具体采用冷冻喷雾干燥法。
33.本发明另一方面还提供了上述制备方法制备得到的草本纤维提取用微生物菌剂。
34.本发明又一方面还提供了上述制备方法或上述微生物菌剂在草本纤维提取中的应用。
35.本发明与现有技术相比,具有以下优点:
36.(1)本发明所提供的纤维提取用微生物菌剂的制备方法,通过调整改良发酵培养液的配方,采用甘露糖和海藻糖替代部分葡萄糖制备改良发酵培养液,菌体吸入甘露糖和海藻糖后细胞内大分子的稳定性增强,提高了菌株的抗冷冻能力;
37.(2)本发明所提供的纤维提取用微生物菌剂的制备方法,通过选用糖类和蛋白有机组合的复合保护剂,其菌体吸附容量大,保护效果好,实际应用效果优异;
38.(3)本发明所提供的纤维提取用微生物菌剂的制备方法,针对热敏性革兰氏阴性菌dce-01菌种,通过冷驯化提高其抗冻能力,再采用冷冻喷雾干燥方法,既提高了冷冻环境下的干燥效率,又最大限度保护了dce-01菌种免受伤害;
39.(4)本发明所提供的纤维提取用微生物菌剂的制备方法,方法简单、成本低廉、易于推广应用,实际应用前景广阔,理论和实际意义重大。
附图说明
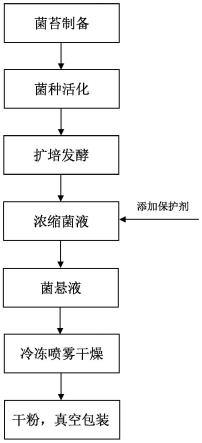
40.图1为本发明实施例所提供纤维提取用微生物菌剂的制备方法的工艺流程图。
具体实施方式
41.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
42.应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
43.实施例中,如无特别说明,所用手段均为本领域常规的手段。
44.本文中所用的术语“包含”、“包括”或其任何其它变形,意在覆盖非排它性的包括。例如,包含所列要素的组合物、步骤、方法、制品或装置不必仅限于那些要素,而是可以包括未明确列出的其它要素或此种组合物、步骤、方法、制品或装置所固有的要素。
45.此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
46.实施例1一种纤维提取用微生物菌剂的制备方法
47.从中国农业科学院麻类研究所保存的斜面原种菌苔挑取一环冷驯化的dce-01菌种接种至5ml改良肉汤培养液(营养肉汤培养液),充分悬匀,35℃培养6h;稀释后涂布于yq营养琼脂平板,35℃培养20h,分离单菌落;挑选典型菌落划线于新鲜斜面,35℃培养20h,真空包装,常温保存;把1ml的灭菌的改良肉汤培养液(营养肉汤培养液)倒入1支上述斜面菌种,用接种环轻轻刮表面菌苔,保证菌苔全部混入培养液。
48.具体地,上述营养肉汤培养液的质量比配方为:葡萄糖1%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,并用naoh调ph值为7.0-7.5。
49.将混有菌苔的液体接种至盛有40ml改良肉汤培养液(营养肉汤培养液)的250ml三角瓶中,充分混匀,35℃,180r/min水浴摇床培养5h,即为一级种子液;再将一级种子液接种至盛有1000ml改良肉汤培养液(营养肉汤培养液)的3500ml三角瓶中,充分混匀,35℃,180r/min水浴摇床培养6h,即为二级种子液。
50.将二级种子液(1l)直接接种至盛有30l改良发酵培养液的50l发酵罐(瑞士比欧,德国)中,不断自动补加nh3·
h2o,使ph维持至6.7,通气量0.7m3/h,34℃,180r/min培养10h,即培养至ph略有上升,终止发酵,收获成熟发酵液。
51.具体地,上述改良发酵培养液的质量比配方为:甘露糖0.18%+海藻糖0.15%+葡萄糖0.44%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,余量为水。
52.参照标准《进出口食品中乳酸菌检验方法》(sn/t 1941.1-2017),用梯度稀释法对成熟发酵液中的dce-01活菌进行分离与计数,活菌数达2.2
×
108cfu/ml。
53.取35℃预热的自来水按2%添加dce-01成熟发酵液配成菌悬液,称取苎麻20g,用200ml菌悬液(苎麻与菌悬液按浴比1∶10)在35℃条件下浸泡10min后,倒掉多余的菌液,35℃静置脱胶,培养6h开始苎麻开始变蓝,7.5h全部变蓝,并且纤维软化,分散性好,验证了dce-01菌种活力高。
54.采用超滤法浓缩菌液,超滤膜包孔径选择0.2μm,浓缩10倍。取膜包透过液做镜片检测,用结晶紫染色,在油镜(40
×
100倍)下观察菌体数量,每个视野菌体数量为3-5个菌体,分离效果良好。
55.称取浓缩菌液3kg(约3l),添加1.35kg复合保护剂(由玉米淀粉、脱脂奶粉、海藻糖、乳糖、糊精、甘露醇、谷氨酸钠和甘油按质量比为10∶30∶5∶2∶10∶2∶2∶2的比例混合而成),充分混匀后,用冷冻干燥机过夜冻干,真空包装,即为成品固态菌剂。
56.用水分测定仪检测成品固态菌剂的水分含量约为7.2wt%,梯度稀释法测得dce-01活菌计数为7.8
×
10
10
cfu/g。
57.经过核算,通过实施例1的方法制备得到的固态菌粉中,dce-01活菌的回收率为42.5%。
58.实施例2一种纤维提取用微生物菌剂的制备方法
59.从中国农业科学院麻类研究所保存的斜面原种菌苔挑取一环冷驯化的dce-01菌种接种至5ml改良肉汤培养液(营养肉汤培养液),充分悬匀,35℃培养6h;稀释后涂布于yq营养琼脂平板,35℃培养20h,分离单菌落;挑选典型菌落划线于新鲜斜面,35℃培养20h,真空包装,常温保存;把1ml的灭菌的改良肉汤培养液(营养肉汤培养液)倒入1支上述斜面菌种,用接种环轻轻刮表面菌苔,保证菌苔全部混入培养液。
60.具体地,上述营养肉汤培养液的质量比配方为:葡萄糖1%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,并用naoh调ph值为7.0-7.5。
61.将混有菌苔的液体接种至盛有40ml改良肉汤培养液(营养肉汤培养液)的250ml三角瓶中,充分混匀,35℃,180r/min水浴摇床培养5h,即为一级种子液;再将一级种子液接种至盛有1000ml改良肉汤培养液(营养肉汤培养液)的3500ml三角瓶中,充分混匀,35℃,180r/min水浴摇床培养6h,即为二级种子液。
62.将二级种子液(1l)直接接种至盛有30l改良发酵培养液的50l发酵罐(瑞士比欧,德国)中,不断自动补加nh3·
h2o,使ph维持至6.7,通气量0.7m3/h,34℃,180r/min培养10h,即培养至ph略有上升,终止发酵,收获成熟发酵液。
63.具体地,上述改良发酵培养液的质量比配方为:甘露糖0.12%+海藻糖0.20%+葡萄糖0.45%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,余量为水。
64.参照标准《进出口食品中乳酸菌检验方法》(sn/t 1941.1-2017),用梯度稀释法对成熟发酵液中的dce-01活菌进行分离与计数,活菌数达2.12
×
108cfu/ml。
65.取35℃预热的自来水按2%添加dce-01成熟发酵液配成菌悬液,称取苎麻20g,用200ml菌悬液(苎麻与菌悬液按浴比1∶10)在35℃条件下浸泡10min后,倒掉多余的菌液,35
℃静置脱胶,培养6h开始苎麻开始变蓝,7.5h全部变蓝,并且纤维软化,分散性好,验证了dce-01菌种活力高。
66.采用超滤法浓缩菌液,超滤膜包孔径选择0.2μm,浓缩10倍。取膜包透过液做镜片检测,用结晶紫染色,在油镜(40
×
100倍)下观察菌体数量,每个视野菌体数量为3-5个菌体,分离效果良好。
67.称取浓缩菌液3kg(约3l),添加1.35kg重量的保护剂(脱脂奶粉),充分混匀后,用冷冻干燥机过夜冻干,真空包装,即为成品固态菌剂。
68.用水分测定仪检测成品固态菌剂水分含量约为5wt%,梯度稀释法测得dce-01活菌计数为5.51
×
10
10
cfu/g。
69.经过核算,通过实施例2的方法制备得到的固态菌粉中,dce-01活菌的回收率为30%。
70.实施例3一种纤维提取用微生物菌剂的制备方法
71.从中国农业科学院麻类研究所保存的斜面原种菌苔挑取一环冷驯化的dce-01菌种接种至5ml改良肉汤培养液(营养肉汤培养液),充分悬匀,35℃培养6h;稀释后涂布于yq营养琼脂平板,35℃培养20h,分离单菌落;挑选典型菌落划线于新鲜斜面,35℃培养20h,真空包装,常温保存;把1ml的灭菌的改良肉汤培养液(营养肉汤培养液)倒入1支上述斜面菌种,用接种环轻轻刮表面菌苔,保证菌苔全部混入培养液。
72.具体地,上述营养肉汤培养液的质量比配方为:葡萄糖1%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,并用naoh调ph值为7.0-7.5。
73.将混有菌苔的液体接种至盛有40ml改良肉汤培养液(营养肉汤培养液)的250ml三角瓶中,充分混匀,35℃,180r/min水浴摇床培养5h,即为一级种子液;再将一级种子液接种至盛有1000ml改良肉汤培养液(营养肉汤培养液)的3500ml三角瓶中,充分混匀,35℃,180r/min水浴摇床培养6h,即为二级种子液。
74.将二级种子液(1l)直接接种至盛有30l改良发酵培养液的50l发酵罐(瑞士比欧,德国)中,不断自动补加nh3·
h2o,使ph维持至6.7,通气量0.7m3/h,34℃,180r/min培养10h,即培养至ph略有上升,终止发酵,收获成熟发酵液。
75.具体地,上述改良发酵培养液的质量比配方为:甘露糖0.20%+海藻糖0.10%+葡萄糖0.47%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,余量为水。
76.参照标准《进出口食品中乳酸菌检验方法》(sn/t 1941.1-2017),用梯度稀释法对成熟发酵液中的dce-01活菌进行分离与计数,活菌数达2.18
×
108cfu/ml。
77.取35℃预热的自来水按2%添加dce-01成熟发酵液配成菌悬液,称取苎麻20g,用200ml菌悬液(苎麻与菌悬液按浴比1∶10)在35℃条件下浸泡10min后,倒掉多余的菌液,35℃静置脱胶,培养6h开始苎麻开始变蓝,7.5h全部变蓝,并且纤维软化,分散性好,验证了dce-01菌种活力高。
78.采用超滤法浓缩菌液,超滤膜包孔径选择0.2μm,浓缩10倍。取膜包透过液做镜片检测,用结晶紫染色,在油镜(40
×
100倍)下观察菌体数量,每个视野菌体数量为3-5个菌体,分离效果良好。
79.称取浓缩菌液3kg(约3l),添加1.35kg重量的保护剂(由玉米淀粉、脱脂奶粉、海藻糖、乳糖、糊精、甘露醇、谷氨酸钠和甘油按质量比为10∶30∶2∶5∶10∶2∶1∶3的比例混合而
成),充分混匀后,用冷冻干燥机过夜冻干,真空包装,即为成品固态菌剂。
80.用水分测定仪检测成品固态菌剂水分含量约为6.8wt%,梯度稀释法测得dce-01活菌计数为6.98
×
10
10
cfu/g。
81.经过核算,通过实施例2的方法制备得到的固态菌粉中,dce-01活菌的回收率为34%。
82.对比例1一种纤维提取用微生物菌剂的制备方法
83.从中国农业科学院麻类研究所保存的斜面原种菌苔挑取一环未经冷驯化的dce-01原种接种至5ml改良肉汤培养液(营养肉汤培养液),充分悬匀,35℃培养6h;稀释后涂布于yq营养琼脂平板,35℃培养20h,分离单菌落;挑选典型菌落划线于新鲜斜面,35℃培养20h,真空包装,常温保存;把1ml的灭菌的改良肉汤培养液(营养肉汤培养液)倒入1支上述斜面菌种,用接种环轻轻刮表面菌苔,保证菌苔全部混入培养液。
84.具体地,上述营养肉汤培养液的质量比配方为:葡萄糖1%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,并用naoh调ph值为7.0-7.5。
85.将混有菌苔的液体接种至盛有40ml改良肉汤培养液(营养肉汤培养液)的250ml三角瓶中,充分混匀,35℃,180r/min水浴摇床培养5h,即为一级种子液;再将一级种子液接种至盛有1000ml改良肉汤培养液(营养肉汤培养液)的3500ml三角瓶中,充分混匀,35℃,180r/min水浴摇床培养6h,即为二级种子液。
86.将二级种子液(1l)直接接种至盛有30l改良发酵培养液的50l发酵罐(瑞士比欧,德国)中,不断自动补加nh3·
h2o,使ph维持至6.7,通气量0.7m3/h,34℃,180r/min培养10h,即培养至ph略有上升,终止发酵,收获成熟发酵液。
87.具体地,上述改良发酵培养液的质量比配方为:甘露糖0.18%+海藻糖0.15%+葡萄糖0.44%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,余量为水。
88.参照标准《进出口食品中乳酸菌检验方法》(sn/t 1941.1-2017),用梯度稀释法对成熟发酵液中的dce-01活菌进行分离与计数,活菌数达2.25
×
108cfu/ml。
89.取35℃预热的自来水按2%添加dce-01成熟发酵液配成菌悬液,称取苎麻20g,用200ml菌悬液(苎麻与菌悬液按浴比1∶10)在35℃条件下浸泡10min后,倒掉多余的菌液,35℃静置脱胶,培养6h开始苎麻开始变蓝,7.5h全部变蓝,并且纤维软化,分散性好,验证了dce-01菌种活力高。
90.采用超滤法浓缩菌液,超滤膜包孔径选择0.2μm,浓缩10倍。取膜包透过液做镜片检测,用结晶紫染色,在油镜(40
×
100倍)下观察菌体数量,每个视野菌体数量为3-5个菌体,分离效果良好。
91.称取浓缩菌液3kg(约3l),添加1.35kg复合保护剂(由玉米淀粉、脱脂奶粉、海藻糖、乳糖、糊精、甘露醇、谷氨酸钠和甘油按质量比为10∶30∶5∶2∶10∶2∶2∶2的比例混合而成),充分混匀后,用冷冻干燥机过夜冻干,真空包装,即为成品固态菌剂。
92.用水分测定仪检测成品固态菌剂水分含量约为6.4%,梯度稀释法测得dce-01活菌计数为1.1
×
108cfu/g。
93.经过核算,通过对比例1的方法制备得到的固态菌粉中,dce-01活菌的回收率为0.59%。
94.与本发明实施例1相比,采用未经驯化的dce-01菌种活化与扩培,其制备的菌粉中
所含的活菌浓度和总回收率均大幅度下降。
95.对比例2一种纤维提取用微生物菌剂的制备方法
96.本对比例2所提供的纤维提取用微生物菌剂的制备方法与实施例1类似,区别仅在于,对二级种子液进行扩培发酵时,所采用的培养液为普通营养肉汤发酵培养液(葡萄糖1%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,余量为水),其余步骤和工艺参数均与实施例1相同。
97.参照标准《进出口食品中乳酸菌检验方法》(sn/t 1941.1-2017),用梯度稀释法对成熟发酵液中的dce-01活菌进行分离与计数,活菌数达5.31
×
108cfu/ml。
98.取35℃预热的自来水按2%添加dce-01成熟发酵液配成菌悬液,称取苎麻20g,用200ml菌悬液(苎麻与菌悬液按浴比1∶10)在35℃条件下浸泡10min后,倒掉多余的菌液,35℃静置脱胶,培养6h开始苎麻开始变蓝,7.5h全部变蓝,并且纤维软化,分散性好,验证了dce-01菌种活力高。
99.用水分测定仪检测成品固态菌剂水分含量约为6.8%,梯度稀释法测得dce-01活菌计数为3.4
×
109cfu/g。
100.经过核算,通过对比例2的方法制备得到的固态菌粉中,dce-01活菌的回收率为5.8%。
101.分析结果可以看出,以不含甘露糖和海藻糖的普通营养肉汤发酵培养液进行扩培发酵时,虽然发酵液的活菌数有所增加,但在喷雾冷冻干燥过程中,由于没有甘露糖和海藻糖的保护,固态菌粉的活菌密度和总回收率反而大幅度下降。
102.对比例3一种纤维提取用微生物菌剂的制备方法
103.本对比例3所提供的纤维提取用微生物菌剂的制备方法与实施例1类似,区别仅在于,对二级种子液进行扩培发酵时,所采用改良发酵培养液的质量比配方为:甘露糖0.33%+葡萄糖0.45%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,余量为水,其余步骤和工艺参数均与实施例1相同。
104.参照标准《进出口食品中乳酸菌检验方法》(sn/t 1941.1-2017),用梯度稀释法对成熟发酵液中的dce-01活菌进行分离与计数,活菌数达3.01
×
108cfu/ml。
105.取35℃预热的自来水按2%添加dce-01成熟发酵液配成菌悬液,称取苎麻20g,用200ml菌悬液(苎麻与菌悬液按浴比1∶10)在35℃条件下浸泡10min后,倒掉多余的菌液,35℃静置脱胶,培养6h开始苎麻开始变蓝,7.5h全部变蓝,并且纤维软化,分散性好,验证了dce-01菌种活力高。
106.用水分测定仪检测成品固态菌剂水分含量约为7.18%,梯度稀释法测得dce-01活菌计数为1.02
×
109cfu/g。
107.经过核算,通过对比例3的方法制备得到的固态菌粉中,dce-01活菌的回收率为1.37%。
108.对比例4一种纤维提取用微生物菌剂的制备方法
109.本对比例4所提供的纤维提取用微生物菌剂的制备方法与实施例1类似,区别仅在于,对二级种子液进行扩培发酵时,所采用改良发酵培养液的质量比配方为:海藻糖0.22%+葡萄糖0.58%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,余量为水,其余步骤和工艺参数均与实施例1相同。
110.参照标准《进出口食品中乳酸菌检验方法》(sn/t 1941.1-2017),用梯度稀释法对成熟发酵液中的dce-01活菌进行分离与计数,活菌数达3.98
×
108cfu/ml。
111.取35℃预热的自来水按2%添加dce-01成熟发酵液配成菌悬液,称取苎麻20g,用200ml菌悬液(苎麻与菌悬液按浴比1∶10)在35℃条件下浸泡10min后,倒掉多余的菌液,35℃静置脱胶,培养6h开始苎麻开始变蓝,7.5h全部变蓝,并且纤维软化,分散性好,验证了dce-01菌种活力高。
112.用水分测定仪检测成品固态菌剂水分含量约为6.88%,梯度稀释法测得dce-01活菌计数为1.03
×
109cfu/g。
113.经过核算,通过对比例4的方法制备得到的固态菌粉中,dce-01活菌的回收率为2.3%。
114.对比例5一种纤维提取用微生物菌剂的制备方法
115.本对比例5所提供的纤维提取用微生物菌剂的制备方法与实施例1类似,区别仅在于,对二级种子液进行扩培发酵时,所采用改良发酵培养液的质量比配方为:甘露糖0.28%+海藻糖0.04%+葡萄糖0.44%+牛肉膏0.5%+蛋白胨0.5%+nacl 0.5%,余量为水,其余步骤和工艺参数均与实施例1相同。
116.参照标准《进出口食品中乳酸菌检验方法》(sn/t 1941.1-2017),用梯度稀释法对成熟发酵液中的dce-01活菌进行分离与计数,活菌数达3.34
×
108cfu/ml。
117.取35℃预热的自来水按2%添加dce-01成熟发酵液配成菌悬液,称取苎麻20g,用200ml菌悬液(苎麻与菌悬液按浴比1∶10)在35℃条件下浸泡10min后,倒掉多余的菌液,35℃静置脱胶,培养6h开始苎麻开始变蓝,7.5h全部变蓝,并且纤维软化,分散性好,验证了dce-01菌种活力高。
118.用水分测定仪检测成品固态菌剂水分含量约为7.06%,梯度稀释法测得dce-01活菌计数为5.78
×
109cfu/g。
119.经过核算,通过对比例5的方法制备得到的固态菌粉中,dce-01活菌的回收率为7.1%。
120.对比例6一种纤维提取用微生物菌剂的制备方法
121.本对比例6所提供的纤维提取用微生物菌剂的制备方法与实施例1类似,区别仅在于,所添加的1.35kg复合保护剂由玉米淀粉、脱脂奶粉、乳糖、糊精、甘露醇、谷氨酸钠和甘油按质量比为10∶30∶7∶10∶2∶2∶2的比例混合而成,其余步骤和工艺参数均与实施例1相同。
122.参照标准《进出口食品中乳酸菌检验方法》(sn/t 1941.1-2017),用梯度稀释法对成熟发酵液中的dce-01活菌进行分离与计数,活菌数达2.2
×
108cfu/ml。
123.取35℃预热的自来水按2%添加dce-01成熟发酵液配成菌悬液,称取苎麻20g,用200ml菌悬液(苎麻与菌悬液按浴比1∶10)在35℃条件下浸泡10min后,倒掉多余的菌液,35℃静置脱胶,培养6h开始苎麻开始变蓝,7.5h全部变蓝,并且纤维软化,分散性好,验证了dce-01菌种活力高。
124.用水分测定仪检测成品固态菌剂水分含量约为7.15%,梯度稀释法测得dce-01活菌计数为1.04
×
109cfu/g。
125.经过核算,通过对比例6的方法制备得到的固态菌粉中,dce-01活菌的回收率为0.98%。
126.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。
127.应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1