抗肿瘤干细胞的紫草素及阿卡宁肟衍生物
1.本发明属于医药领域,涉及一种抗肿瘤干细胞的紫草素及阿卡宁肟衍生物,具体涉及一种紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物及其医药用途。
背景技术:
2.肿瘤是严重危害人类健康的一种疾病,近年来其发病率逐年上升,发病情况也呈现明显的年轻化趋势(s.gupta,et al.international trends in the incidence ofcancer among adolescents and young adults,j.natl.cancer inst.,2020,112(11), 1105-1117)。全球癌症观察站(globocan)近期发布的统计报告表明,2020年全球新增癌症病例约1929万,当年死亡病例995万(h.sung,et al.global cancer statistics 2020: globocan estimates of incidence and mortality worldwide for 36 cancers in 185countries.ca:a cancer journal for clinicians,2021,71(3),209-249)。当年新发病例中,女性乳腺癌的发病率最高,占到全球新增癌症病例的11.7%;其次为肺癌 (11.4%)和结肠直肠癌(10.0%)。随着新诊疗方法的出现,近年来癌症患者总体生存率显著提高,但在治疗中出现的肿瘤的迁移、复发及耐药现象,是疾病难以治愈的关键原因。
3.肿瘤是由异质性细胞群体构成,这些细胞群具有不同的表观形态、功能、表面抗原类型及基因的表达水平。其中的一小部分细胞(0.2-3%)具有与干细胞相似的自我更新能力并可以产生肿瘤内所有异质性细胞,这部分细胞被称为肿瘤干细胞(e.batlle,et al.cancer stem cells revisited,nat.med.,2017,23,1124-1134.)。肿瘤干细胞具有自我更新及无限增殖的特性,可以产生构成实体瘤内所有异质性的癌细胞群。肿瘤干细胞的存在首次于1997年发表的关于急性髓性白血病(aml) 的研究中得到证实(d.bonnet,et al.human acute myeloid leukemia is organized asa hierarchy that originates from a primitive hematopoietic cell.nat.med.,1997,3, 730-737)。少量的原代aml细胞在转移到非肥胖型糖尿病/严重联合免疫缺陷 (nod/scid)小鼠时可以重现白血病并维持白血病生长。2003年,al-hajj等人首先证实了乳腺癌中肿瘤干细胞的存在,该类细胞的表面抗原类型为 cd
44+
cd
24-/low
。乳腺癌患者的cd
44+
cd
24-/low
肿瘤细胞在nod/scid小鼠中比相应的 cd
44+
cd
24+
细胞具有更高的致瘤性。此外,由cd
44+
cd
24-/low
乳腺癌细胞所形成的肿瘤可以连续传代,这表明该细胞具有自我更新能力,且可以连续复制并产生具有细胞异质性的肿瘤。
4.肿瘤干细胞具有高度的耐药性,对临床常用的化疗药物及放射性疗法均不敏感(c.t.jordan,et al.cancer stem cells,new engl.j.med.,2006,355,1253-1261)。在化疗及放疗过程中,处于快速有丝分裂期的普通癌细胞被杀伤,而具有耐药性的癌症干细胞在特定条件下持续分裂并维持肿瘤的生长,导致肿瘤复发。由肿瘤干细胞分化的癌细胞也会获得干细胞的特性,增加化疗耐药性。此外,研究表明乳腺癌中的肿瘤干细胞也与肿瘤的侵袭性相关。因此,寻找选择性杀伤肿瘤干细胞的药物,对于解决目前肿瘤治疗中出现的迁移、复发及耐药现象,具有非常重要的意义。
5.目前临床使用的抗肿瘤药物可以分为细胞毒类药物、激素类药物、生物反应调节剂、单克隆抗体药物等(孙燕。关于抗肿瘤药物分类的共识建议。循证医学, 2004,3,190-191)。细胞毒类药物主要通过抑制肿瘤细胞的复制或生长来发挥作用,分为作用于dna化学结构的药物、影响核酸合成的药物、作用于核酸转录的药物、作用于dna复制的拓扑异构酶ⅰ抑制剂、主要作用于有丝分裂m期干扰微管蛋白合成的药物等。激素类药物通过特异性与激素受体结合而发挥作用,形成激素受体复合物,被活化并进入细胞体内,调节dna的复制与细胞分裂。激素类药物分为抗雌激素、芳香化酶抑制剂、孕激素、性激素、抗雄激素、rh-lh 激动剂/拮抗剂等。生物反应调节剂为通过免疫系统增强机体抗肿瘤效应并对肿瘤有治疗效果的药剂,分为干扰素、白细胞介素2、胸腺肽类等。单克隆抗体主要通过抗体作用于细胞膜表面的特定抗原,调节细胞的生长,提高肿瘤细胞的对于化疗药物的敏感性。上述临床抗肿瘤药物作用于快速生长的细胞,由于肿瘤干细胞一般处于静止期,因此上述靶向快速分裂细胞的临床药物,对肿瘤干细胞不敏感。治疗乳腺癌的一线临床抗肿瘤药物紫杉醇,对于三阴性乳腺癌细胞系 mda-mb-231具有非常强的生长抑制活性,其ic
50
值仅为8nm;而对于具有肿瘤干细胞性质的三阴性乳腺癌细胞系mda-mb-231
pac10
,紫杉醇的ic
50
大于1 μm,ic
50
值的差异大于100倍(liu,p.,et al.disulfiram targets cancer stem-like cellsand reverses resistance and cross-resistance in acquired paclitaxel-resistanttriple-negative breast cancer cells.br.j.cancer,2013,109,1876
–
1885)。对于分选所得的cd
44+
/cd
24-/low
mcf-7乳腺癌干细胞,紫杉醇的ic
50
大于100μm(j.cui, etal.,natural products targeting cancer stem cells:a revisit,curr.med.chem.,2021, 28,6773-6804)。因此,不能简单的根据药物具有抗肿瘤活性的特点,即推测其具有抗肿瘤干细胞活性。
6.从天然产物中寻找预防和治疗恶性肿瘤的药物始终是药学领域的研究热点之一。目前临床中使用的抗肿瘤药物紫杉醇、多西紫杉醇、博来霉素、阿霉素、多柔比星、喜树碱、羟基喜树碱等均源于天然产物。作为传统化疗药物,这些抗肿瘤药对体内快速生长的细胞均有较强的生长抑制活性,但对于肿瘤干细胞几乎无影响。同时,这些抗肿瘤药物缺乏选择性,即在杀伤肿瘤细胞的同时,也对正常细胞及免疫细胞表现出极大的杀伤作用。天然萘醌类化合物紫草素有广谱抗肿瘤活性,其萘醌结构产生活性氧及侧链的生物还原烷基化作用是该化合物具有抗肿瘤活性的分子机制(x.zhang,et al.advance in anti-tumor mechanisms ofshikonin,alkannin and their derivatives.mini-rev.med.chem.,2018,18(2), 164-172)。近期研究报道表明,该化合物对于肿瘤干细胞具有生长抑制作用(r. thakur,et al.inhibition of stat3,fak and src mediated signaling reduces cancerstem cell load,tumorigenic potential and metastasis in breast cancer.sci.rep.,2015, 5(1),1-16),然而紫草素的广泛细胞毒性,限制了该化合物作为抗肿瘤干细胞药物的临床应用。
技术实现要素:
7.本发明的目的在于克服现有技术的不足,提供一种抗肿瘤干细胞的紫草素及阿卡宁肟衍生物。具体而言,本发明以(s)-2-(1-羟基-4-甲基-3-戊烯基)-1,4,5,8
‑ꢀ
四甲氧基萘(附图1,
ⅹ‑
s)及其对映体(r)-2-(1-羟基-4-甲基-3-戊烯基)-1,4,5,8
‑ꢀ
四甲氧基萘(附
图1,
ⅹ‑
r)为原料,在侧链羟基上引入烷基链或者末端具有含氮杂环的烷基链,再通过氧化脱甲基化羰基肟化方法,制备了一种具有抗肿瘤干细胞活性的紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物。药理结果显示,本发明所述紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物具有很强的抗肿瘤干细胞活性,抗肿瘤干细胞作用的机理为靶向肿瘤干细胞的黏附分子通路,杀伤肿瘤干细胞,这一抗肿瘤干细胞的机理完全不同于现有技术(z l201310044877.6)中所公开化合物的抗肿瘤作用机理。本专利所公开的化合物其抗肿瘤干细胞作用机理新颖,药效显著高于阿霉素、紫杉醇、氟尿嘧啶等临床常用抗肿瘤药物,而且于正常细胞几乎无毒性,有良好的开发前景。
8.本发明的目的是通过以下技术方案实现的:
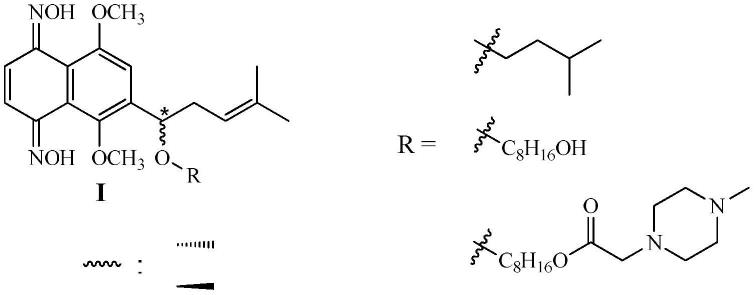
9.第一方面,本发明涉及一种抗肿瘤干细胞的紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物,所述衍生物的结构式如式(ⅰ)所示:
[0010][0011]
其中,r代表含3,3-二甲基正丙基、8-羟基正辛基、8-(1-甲基-4-哌嗪乙酰氧基)正辛基;手性碳(*)的构型为r型或s型。
[0012]
第二方面,本发明涉及一种所述紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物在制备抗肿瘤干细胞药物中的用途。
[0013]
所述抗肿瘤干细胞药物中所述衍生物为主要活性成分。
[0014]
优选的,所述肿瘤干细胞为细胞表面抗原类型为cd
44+
cd
24-/low
的乳腺癌干细胞。
[0015]
第三方面,本发明涉及一种所述紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物与其它抗肿瘤药物联用在制备用于恶性肿瘤的治疗的药物中的用途。
[0016]
优选的,所述药物可制成下列之一的剂型:
①
注射剂;
②
片剂;
③
胶囊剂;
④
颗粒剂。
[0017]
与现有技术相比,本发明具有如下的有益效果:
[0018]
1)本发明所述紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物结构明确,制备方法简便,收率较高且原料易得。
[0019]
2)体外抗肿瘤活性实验研究表明,该类化合物抗肿瘤干细胞活性较强,显著优于临床常用的抗肿瘤药如阿霉素、紫杉醇及氟尿嘧啶。
[0020]
3)本发明所公开的紫草素及阿卡宁萘茜母核羟基甲基化羰基肟衍生物抗肿瘤干细胞作用的机理新颖,完全不同于现有技术(zl201310044877.6)中所公开化合物的抗肿瘤作用机理。
[0021]
4)体外细胞生长抑制活性实验研究表明,本发明所述化合物对人体正常细胞几乎无生长抑制活性,表现出良好的选择性。
附图说明
[0022]
通过阅读以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
[0023]
图1为紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物的制备方法示意图。
[0024]
图2为分选前后乳腺癌干细胞mcf-7 cd
44+
cd
24-/low
在细胞群落中的比例变化。
[0025]
图3为分选所得乳腺癌干细胞mcf-7 cd
44+
cd
24-/low
的成瘤性实验结果。
[0026]
图4为化合物
ⅱ‑
2对mcf-7 cd
44+
cd
24-/low
乳腺癌干细胞球形态的影响实验结果。
[0027]
图5为化合物
ⅱ‑
2对mcf-7 cd
44+
cd
24-/low
乳腺癌干细胞的细胞周期阻滞效果。
[0028]
图6为化合物
ⅱ‑
2诱导mcf-7 cd
44+
cd
24-/low
乳腺癌干细胞凋亡。
[0029]
图7为化合物
ⅱ‑
2的体内抗肿瘤干细胞活性测试结果。
具体实施方式
[0030]
下面结合附图和具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
[0031]
实施例1
[0032][0033]
本实施例涉及一种具有结构式(
ⅱ‑
1)的(s)-2-(1-异戊氧基-4-甲基-3-戊烯基)
ꢀ‑
1,4,5,8-四甲氧基萘的制备方法,如图1所示,包括以下步骤:
[0034]
采用文献(liming zhao et al,letters in organic chemistry,2008,5,234
‑ꢀ
236;徐彦等,紫草素与阿卡宁的不对称全合成。沈阳药科大学学报,2014,3 1(6),440-443,482)报道的方法,以1,4,5,8-四甲氧基-2-萘甲醛为原料,制备(s)
ꢀ‑
2-(1-羟基-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘(
ⅹ‑
s)。取(s)-2-(1-羟基-4-甲基
ꢀ‑
3-戊烯基)-1,4,5,8-四甲氧基萘(
ⅹ‑
s,1.7g,5.0mmol)溶于无水dmf(30.0 ml),冰浴以及氮气保护条件下加入60%nah(1.0g,25.0mmol),30min 后,将碘代异戊烷(5.0g,25.0mmol)缓慢滴加到反应液中,20min后升温至60℃搅拌过夜,反应完毕加入二氯甲烷和水稀释反应液,萃取,无水na2s o4干燥,减压浓缩,粗产品用硅胶柱层析得到无色油状物(1.90g,91.3%)。1h nmr(400mhz,cdcl3):δ6.96(s,1h),6.81(s,2h),5.25
–
5.21(m, 1h),4.88
–
4.84(m,1h),3.94
–
3.90(m,9h),3.72(s,3h),3.34
–
3.28 (m,2h),2.48
–
2.44(m,2h),1.68(s,3h),1.52(s,3h),1.44
–
1.40(m,1 h),1.27
–
1.23(m,2h),0.85(s,3h),0.80(s,3h)。
[0035]
实施例2
[0036][0037]
本实施例涉及一种具有结构式(
ⅱ‑
2)的(s)-6-(1
’‑
异戊氧基-4
’‑
甲基-3
’‑
戊烯基)-5,8-二甲氧基-1,4-萘二酮二肟的制备方法,如图1所示,包括以下步骤:
[0038]
将(s)-2-(1-异戊氧基-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘(
ⅱ‑
1,1.25g,3. 0mmol)溶于二氯甲烷-乙腈混合溶剂(3:1,v/v,45ml)中,冰浴下加入硝酸铈铵(4.24g,7.7mmol)的水溶液(4.5ml),反应完成后用二氯甲烷萃取,有机层经无水na2so4干燥,减压浓缩,粗产品用硅胶柱层析得到黄色油状物(0. 31g)。将该黄色溶于无水乙醇(24.0ml)和吡啶(5.50ml),氮气保护下加入盐酸羟胺(0.39g,5.6mmol),53℃搅拌过夜,减压蒸除溶剂,加水抽滤,滤饼干燥后用无水乙醇重结晶得化合物
ⅱ‑
2,呈淡黄色固体(0.25g,收率75.1 %)。1h nmr(400mhz,cdcl3):δ=11.9(s,2h,=n-oh),7.68(d,2h, h
quin
),7.23(s,1h,h
ar
),5.24(t,1h,-ch=),4.75(t,1h,-choh(ch2)), 3.98(s,9h,aroch3),3.78(s,3h,aroch3),3.37(t,2h,-ch
2-o-),2.4 2(m,2h,-ch
2-ch=),1.67(s,3h,ch3)1.54(s,3h,ch3),1.47(m,1h), 1.24(m,2h),0.88(2s,3h,ch3),0.84(2s,3h,ch3)。
[0039]
实施例3
[0040][0041]
本实施例涉及一种具有结构式(
ⅱ‑
2)的(r)-6-(1
’‑
异戊氧基-4
’‑
甲基-3
’‑
戊烯基)-5,8-二甲氧基-1,4-萘二酮二肟的制备方法,如图1所示,包括以下步骤:
[0042]
采用文献(liming zhao et al,letters in organic chemistry,2008,5,234
‑ꢀ
236;徐彦等,紫草素与阿卡宁的不对称全合成。沈阳药科大学学报,2014,31(6), 440-443,482)报道的方法,以1,4,5,8-四甲氧基-2-萘甲醛为原料,制备(r)-2-(1
‑ꢀ
羟基-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘(
ⅹ‑
r)。后以(r)-2-(1-羟基-4-甲基-3
‑ꢀ
戊烯基)-1,4,5,8-四甲氧基萘(
ⅹ‑
r)为原料,采用与实施例1及实施例2相同的实验步骤,制备化合物
ⅱ‑
3。化合物呈淡黄色粉末,收率63.6%。1h nmr(400 mhz,dmso-d6)δ12.02(s,2h),7.42
–
7.28(m,2h),7.05(s,1h),5.23
–ꢀ
5.13(m,1h),4.68
–
4.55(m,1h),3.74(s,3h),3.55(s,3h),3.30
–
3.19 (m,2h),2.32
–
2.26(m,2h),1.74
–
1.65(m,1h),1.60(s,3h),1.47(s,3 h),1.40
–
1.28(m,2h),0.88
–
0.65(m,6h)
[0043]
实施例4
[0044][0045]
本实施例涉及一种具有结构式(
ⅲ‑
1)的(s)-2-(1-(8-羟基辛氧基)-4-甲基-3
‑ꢀ
戊烯基)-1,4,5,8-四甲氧基萘的制备方法,如图1所示,包括以下步骤:
[0046]
将(s)-2-(1-羟基-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘(0.5g,1.4mmol)溶于无水dmf(15ml)中,n2保护,冰浴条件下加入的氢化钠(0.45g,60%, 11.2mmol),继续搅拌30min。然后滴加2-(8-溴辛氧基)四氢-2h-吡喃(2.8m mol)和碘化钾(46mg,0.28mmol),60℃反应过夜。反应完毕后,用乙酸乙酯萃取,合并有机层;有机相减压浓缩,柱层析分离得淡黄色油状物。将该黄色油状物溶于甲醇(10ml)中,室温下滴加浓盐酸(1ml),继续搅拌30mi n。待反应完毕后,向反应液中加入ch2cl2(10ml)稀释,用饱和碳酸氢钠溶液中和盐酸,分出有机相;有机相用饱和nacl洗,无水硫酸钠干燥,减压浓缩,柱层析分离,得(s)-2-(1-(8-羟基辛氧基)-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘(
ⅲꢀ‑
1),呈淡黄色油状液体(收率94.7%)。1h nmr(400mhz,cdcl3):δ6.89 (s,1h),6.72
–
6.66(m,2h),5.21
–
5.15(m,1h),4.82
–
4.74(m,1h),3.82 (s,3h),3.79(s,3h),3.75(s,3h),3.63(s,3h),3.46
–
3.40(m,2h),3.25
ꢀ–
3.16(m,2h),2.80
–
2.71(m,1h),2.44
–
2.35(m,2h),1.55(s,3h),1.43 (s,3h),1.40
–
1.34(m,2h),1.31
–
1.08(m,10h)。
[0047]
实施例5
[0048][0049]
本实施例涉及一种具有结构式(
ⅲ‑
2)的(s)-6-(1-(8-羟基辛氧基)-4-甲基戊
‑ꢀ
3-烯-1-基)-5,8-二甲氧基-1,4-萘二酮二肟的制备方法,如图1所示,包括以下步骤:
[0050]
将(s)-2-(1-(8-羟基辛氧基)-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘(1.42g,3. 0mmol)溶于二氯甲烷-乙腈混合溶剂(3:1,v/v,45ml)中,冰浴下加入硝酸铈铵(4.24g,7.7mmol)的水溶液(4.5ml),反应完成后用二氯甲烷萃取,有机层经无水na2so4干燥,减压浓缩,粗产品用硅胶柱层析得到黄色油状物(0. 31g)。将该黄色溶于无水乙醇(24.0ml)和吡啶(5.50ml),氮气保护下加入盐酸羟胺(0.39g,5.6mmol),53℃搅拌过夜,减压蒸除溶剂,加水抽滤,滤饼干燥后用无水乙醇重结晶得目标化合物,呈淡黄色固体(0.45g,31.6%)。
1 h nmr(400mhz,dmso-d6)δ11.98(s,2h),7.38
–
7.32(m,2h),7.04(s, 1h),5.18(t,j=6.3hz,1h),4.60(t,j=6.3hz,1h),4.24
–
4.16(m,1 h),3.74(s,3h),3.55(s,3h),3.34
–
3.28(m,2h),3.25
–
3.18(m,2h),2.3 2
–
2.24(m,2h),1.59(s,3h),1.46(s,3h),1.48
–
1.38(m,12h)。
[0051]
实施例6
[0052][0053]
本实施例涉及一种具有结构式(
ⅲ‑
3)的(r)-2-(1-(8-羟基辛氧基)-4-甲基-3
‑ꢀ
戊烯基)-1,4,5,8-四甲氧基萘的制备方法,如图1所示,包括以下步骤:
[0054]
以(r)-2-(1-羟基-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘为原料,采用与实施例 4及实施例5相同的实验步骤,制备化合物
ⅲ‑
3。化合物呈淡黄色粉末,收率31. 2%。1h nmr(400mhz,dmso-d6):δ11.98(s,2h),7.38
–
7.32(m,2h),7. 04(s,1h),5.18(t,j=6.3hz,1h),4.61(t,j=6.3hz,1h),4.24
–
4.16 (m,1h),3.74(s,3h),3.55(s,3h),3.34
–
3.28(m,2h),3.25
–
3.18(m,2 h),2.32
–
2.24(m,2h),1.60(s,3h),1.47(s,3h),1.46
–
1.38(m,12h)。
[0055]
实施例7
[0056][0057]
本实施例涉及一种具有结构式(iv-1)的(s)-2-(1-(8-(1-甲基-4-哌嗪乙酰氧) 辛氧基)-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘的制备方法,如图1所示,包括以下步骤:
[0058]
将(s)-2-(1-(8-羟基辛氧基)-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘(
ⅲ‑
1,1.42 g,3.0mmol)溶于无水二氯甲烷中,加入催化量的对二甲氨基吡啶及1.5倍当量的缩合剂n,n
’‑
二环己基碳二亚胺。反应液室温搅拌10min后,加入1.5倍当量的4-甲基-1-哌嗪乙酸。反应液室温搅拌24小时后,用二氯甲烷稀释并抽滤。滤液经水、饱和食盐水清洗,减压浓缩至干后得目标化合物iv-1,呈淡黄色油状物(1.72g,产率93.4%)。1h nmr(400mhz,cdcl3)δ6.91(s,1h),6.76 (d,j=2.2hz,2h),5.19(t,j=6.7hz,1h),4.81(t,j=6.9hz,1h),4.02 (t,j=6.7hz,2h),3.85(s,9h),3.67(s,3h),3.30
–
3.18(m,2h),3.14(s, 2h),2.69
–
2.48(m,8h),2.43
–
2.39(m,2h),2.25(s,3h),1.61(s,3h), 1.55
–
1.51(m,2h),1.47(s,3h),1.35
–
1.10(m,10h)。
[0059]
实施例8
[0060][0061]
本实施例涉及一种具有结构式(iv-2)的(s)-(1e,4e)-6-(1-(8-(1-甲基-4-哌嗪乙酰氧)辛氧基)-4-甲基戊-3-烯-1-基)-5,8-二甲氧基萘-1,4-二酮二肟的制备方法,如图
1所示,包括以下步骤:
[0062]
将(s)-2-(1-(8-(1-甲基-4-哌嗪乙酰氧)辛氧基)-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘(1.84g,3.0mmol)溶于二氯甲烷-乙腈混合溶剂(3:1,v/v,45ml) 中,冰浴下加入硝酸铈铵(4.24g,7.7mmol)的水溶液(4.5ml),反应完成后用二氯甲烷萃取,有机层经无水na2so4干燥,减压浓缩,粗产品用硅胶柱层析得到黄色油状物(0.31g)。将该黄色溶于无水乙醇(24.0ml)和吡啶(5.50 ml),氮气保护下加入盐酸羟胺(0.39g,5.6mmol),53℃搅拌过夜,减压蒸除溶剂,加水抽滤,滤饼干燥后用无水乙醇重结晶得化合物iv-2,呈淡黄色固体 (0.36g,产率19.7%)。1h nmr(400mhz,dmso-d6)δ11.99(s,2h),7.3 5(d,j=2.6hz,2h),7.05(s,1h),5.18(t,j=6.7hz,1h),4.62(t,j=6. 6hz,1h),3.99(d,j=7.1hz,2h),3.75(s,3h),3.56(s,3h),3.25
–
3.21 (m,4h),2.82
–
2.73(s,4h),2.64(s,3h),2.48
–
2.44(m,4h),2.31(s,2h), 1.61(s,3h),1.53
–
1.50(m,2h),1.48(s,3h),1.35
–
1.10(m,10h)。
[0063]
实施例9
[0064][0065]
本实施例涉及一种具有结构式(iv-3)的(r)-(1e,4e)-6-(1-(8-(1-甲基-4-哌嗪乙酰氧)辛氧基)-4-甲基戊-3-烯-1-基)-5,8-二甲氧基萘-1,4-二酮二肟的制备方法,如图1所示,包括以下步骤:
[0066]
以(r)-2-(1-羟基-4-甲基-3-戊烯基)-1,4,5,8-四甲氧基萘为原料,采用与实施例 4、实施例7及实施例8相同的实验步骤,制备化合物iv-3。化合物呈淡黄色粉末,总收率16.2%。1h nmr(400mhz,dmso-d6)δ12.03(s,1h),10.59(s, 1h),7.41
–
7.36(m,2h),7.08(s,1h),5.22(t,j=7.1hz,1h),4.65(t,j =6.4hz,1h),4.06(t,j=6.6hz,2h),3.78(s,3h),3.59(s,3h),3.44(d, j=11.8hz,2h),3.28(q,j=6.4,6.0hz,2h),3.17(s,6h),2.93(s,2h), 2.77(s,3h),2.35(s,2h),1.64(s,3h),1.60
–
1.53(m,2h),1.51(s,5h),1. 25(s,8h)。
[0067]
实施例10
[0068]
本实施例涉及乳腺癌干细胞mcf-7 cd
44+
cd
24-/low
的分选及表征方法,包括以下步骤:
[0069]
参考文献(muhammad al-hajj et al,pnas,100(2003),3983-3988)所报道的方法,我们采用荧光标记抗体cd44-apc及cd24-pe,通过流式细胞术分选了乳腺癌mcf-7 cd
44+
cd
24-/low
细胞亚群(乳腺癌干细胞)。将贴壁的mcf-7细胞用预冷的pbs清洗后,用稀释的胰蛋白酶-乙二胺四乙酸(edta)溶液处理以使细胞从培养皿表面脱离。为了尽量减少对细胞的损害,用相差显微镜监测脱离。目视确认脱离后,加入5ml含有血清的培养基终止消化。将细胞悬液离心后,用5mlpbs洗涤mcf-7细胞。离心5分钟后,将离心管底部的细胞用500μl 的pbs重悬,根据制造商的说明,使用荧光标记抗体cd44-apc及cd24-pe(bdpharmingen,san diego,ca)将细胞染色。细胞染色结束后,在室温下将细胞用pbs冲洗3次,然后转移到5ml流式细胞管。bd facs calibur(becton& dickinson biosciences,san jose,ca)上对细胞进
行分选,分选后的细胞于 mammocult无血清培养基中进行悬浮培养。悬浮培养的细胞2周使用荧光标记抗体cd44-apc及cd24-pe重新分析细胞表面抗原(cd
44
及cd
24
)的表达,乳腺癌干细胞mcf-7 cd
44+
cd
24-/low
在所培养的细胞中,比例达到75%。分选前的 mcf-7贴壁细胞,分化抗原(cd)类型为cd
44+
cd
24-/low
的细胞亚群(乳腺癌干细胞)比例仅为1.89%(附图2)。
[0070]
实施例11
[0071]
本实施例涉及分选所得的乳腺癌干细胞mcf-7 cd
44+
cd
24-/low
的体内成瘤性实验,包括以下步骤:
[0072]
将免疫缺陷小鼠nod/scid饲养于spf级实验动物中心,温度、湿度和光照分别控制在21
±
2℃,50
±
10%和12h光照/12h黑暗循环。所有动物实验的操作均参照动物实验伦理委员会指导手册要求执行。将分选所得的乳腺癌干细胞 mcf-7 cd
44+
cd
24-/low
及分选前的mcf-7细胞正常传代,培养至所需数目。细胞经胰酶消化后,用pbs清洗并制备两种细胞的细胞悬液,调整细胞悬液中的细胞数至所需浓度。将该细胞悬液与基质胶(bd matrigel
tm
)等体积混合后,接种于nod/scid小鼠皮下。接种2周后,将小鼠实施安乐死并取出肿瘤。结果如附图3所示,接种105个、2*104个及104个mcf-7 cd
44+
cd
24-/low
乳腺癌干细胞的小鼠,皮下均有移植瘤生成。而接种107个mcf-7细胞的小鼠,无移植瘤产生。实验结果表明,分选所得的mcf-7 cd
44+
cd
24-/low
乳腺癌干细胞的具有很强的成瘤性,与文献(muhammad al-hajj et al,pnas,100(2003),3983-3988)所报道的乳腺癌干细胞的成瘤性一致。
[0073]
实施例12
[0074]
本实施例涉及紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物对乳腺癌干细胞mcf-7 cd
44+
cd
24-/low
的生长抑制活性测试,包括以下步骤:
[0075]
取对数生长期的mcf-7 cd
44+
cd
24-/low
肿瘤干细胞,用0.25%胰蛋白酶消化后,用磷酸盐缓冲液稀释后离心,加入mammocult无血清培养基混悬,并调整细胞悬液至合适的浓度,在96孔板中每孔加入100μl细胞悬液,使得每孔中的细胞数为5000个。将96孔板静置于37℃,5%co2恒温培养箱中培养12h,待细胞贴壁后每孔加入用完全培养基稀释的化合物100μl,各组均设三个复孔。每块96孔板上需设置调零孔(只加化合物与培养基,不含细胞)与空白对照孔 (只含有细胞与培养基,不加化合物)。继续培养48h后,加入之前配好的mts 溶液20μl/孔,避光继续培养4h,在多功能酶标仪上490nm波长处检测各孔的吸光度(od值)。测试中选用临床常用抗肿瘤药阿霉素、紫杉醇及氟尿嘧啶为阳性对照药物。
[0076]
细胞生长抑制率的计算公式:
[0077]
生长抑制率(%)=(1
–
给药组od值/对照组od值)
×
100
[0078]
根据计算得到的不同给药浓度下的细胞生长抑制率,采用prism软件中的 dose-response-inhibition里面的log(inhibitor)vs.normalized response程序拟合曲线,计算ic
50
值。
[0079]
表1目标化合物抑制乳腺癌干细胞mcf-7 cd
44+
cd
24-/low
的ic
50
值
[0080]
化合物ic
50
(μm)
ⅱ‑
20.77
ⅱ‑
31.08
ⅲ‑
20.96
ⅲ‑
31.76
iv-21.21iv-32.09阿霉素38.6紫杉醇》100氟尿嘧啶》250 在上述肿瘤干细胞生长抑制活性测试中,所采用的阳性对照药物阿霉素、紫杉醇及氟尿嘧啶均是临床常用的抗肿瘤药物,文献(sun w h.synthesis andcytotoxicity evaluation of oleanolic acid derivatives.bioorganic&medicinal ch emistry letters,2013;)研究表明,这三种药物对于乳腺癌mcf-7细胞有非常强的生长抑制活性(阿霉素ic
50
=1.65μm;),然而几种化合物对于相应的乳腺癌肿瘤干细胞均不敏感,不能根据化合物具有抗肿瘤活性推测出其具有抗肿瘤干细胞活性。现有技术(zl 201310044877.6)报道了化合物
ⅱ‑
2的抗肿瘤活性,其抑制乳腺癌mcf-7细胞的ic
50
值为17.6μm,具有中等活性的抗肿瘤活性;而在本发明中,该化合物抗乳腺癌肿瘤干细胞的ic
50
值仅为0.77μm,具有极强的抗肿瘤干细胞活性,不能根据其具有中等活性的抗肿瘤活性,来推测其具有强抗肿瘤干细胞的活性。
[0082]
实施例13
[0083]
乳腺细胞球形成分析法(mammosphere formation assay)是检验乳腺干细胞、乳腺癌癌干细胞活性及自我更新能力的一种公认的方法(eguiara a,et al.ma mmosphere formation in breast carcinoma cell lines depends upon expressio n of e-cadherin.plos one,2013,8(10),e77281)。本实施例涉及高光学纯度阿卡宁萘茜母核羟基甲基化羰基肟衍生物对乳腺癌干细胞乳腺细胞球形成能力的测试,包括以下步骤:
[0084]
参考文献(gupta p,et al.identification of selective inhibitors of cancer stemcells by high-throughput screening.cell,2009,138(4),645-659.)的方法,取对数生长期的mcf-7 cd
44+
cd
24-/low
肿瘤干细胞,用胰酶分离细胞。调整细胞悬液的浓度为10,000个细胞/ml,并将细胞接种在6孔超低附着板中,使用mammocult 无血清培养基培养。培养72h后,给药组用化合物
ⅱ‑
2(2μm in dmso)处理,对照组用相同体积的dmso处理。分别于8h及24小时观察肿瘤干细胞球的数量及形态。结果如附图4所示,经化合物
ⅱ‑
2处理后的乳腺癌干细胞,细胞球的数量随药物处理时间的增加显著下降,同时单细胞数量显著增加。实验结果说明化合物
ⅱ‑
2可显著降低肿瘤干细胞的自我更新能力及细胞活性。
[0085]
实施例14
[0086]
本实施例涉及高光学纯度阿卡宁萘茜母核羟基甲基化羰基肟衍生物对mcf-7 cd
44+
cd
24-/low
肿瘤干细胞的生长周期抑制实验。
[0087]
参考文献(chefetz i.,et al.inhibition of aurora-a kinase induces cell cyclearrest in epithelial ovarian cancer stem cells by affecting nfκb pathway.cell cycle. 2011 jul 1;10(13):2206
–
2214)方法进行细胞周期抑制实验。将5
×
106个mcf-7 cd
44+
cd
24-/low
肿瘤干细胞接种至6孔板内,培养24小时后,给药不同浓度的化合物
ⅱ‑
2(给药浓度依次为0,1.0,2.0μm),给药后继续孵育24小时。用胰酶消化细胞,加入完全培养基终止消化后,收集所有细胞至离心管内,1000g 离心5min,弃上清,用预冷的pbs重悬细胞沉淀,以漂洗离心管内剩余的培养基。1000g离心5min后弃上清,pbs重悬沉淀后计
数,调节细胞悬液浓度为2
ꢀ×
106cells/ml,转移细胞至10ml离心管内,再次离心沉淀细胞,小心吸除上清。后加入1ml预冷的70%乙醇,轻轻吹打混匀细胞沉淀,静置4℃固定12h。 4℃,1000g离心5min,沉淀细胞,小心吸除上清,加入预冷的pbs重悬细胞,再次离心沉淀细胞,小心吸除上清。每管样品内加入0.5ml已配制好的pi染色液,缓慢并充分重悬细胞沉淀,37℃避光温育30min,避光置于冰上待用。用流式细胞仪在激发波长488nm处检测红色荧光,同时检测光散射情况。染色完成后的样品宜在24h内使用流式细胞仪进行检测。用flowjo7.0软件分析数据, dean-jett-fox模型周期。
[0088]
荧光染料碘化吡啶能在嵌入双链dna后显示红色荧光,根据细胞周期内各阶段dna含量的不同,能在直方图上直观地将细胞分为三类,如附图5所示, g0期和g1期细胞还未开始dna的复制,都含有相同的二倍体dna,在图中归为一个峰;而g2期与m期的细胞已完成dna的复制但还未或正在分裂为两个细胞,因均含有四倍体dna而显示为一个峰;分布在两个峰之间的则为正在进行dna复制的s期细胞。从上图5中我们可以看到,当浓度达到1μm时能发现 s期细胞比例由对照组的15.97%明显减少为13.63%,而g0/g1期细胞从70.72%增加到75.92%,g2/m期细胞也由13.31%下降至10.45%。当化合物ⅱ浓度升高至2μm时,处理组g0/g1期细胞明显增加,比例增加至83.23%;s期细胞显著减少,比例下降至6.70%。即在该浓度下细胞周期开始明显阻滞在g0/g1期,进入s期的细胞数目降低。这说明肿瘤干细胞的dna细胞调控因素的影响下,可能受到损伤,不能通过g1期的dna损伤检测点,细胞周期被阻断不能进入s期,细胞在试图修复dna不成功后可能启动凋亡程序。
[0089]
表2目标化合物ⅱ抑制乳腺癌干细胞mcf-7 cd
44+
cd
24-/low
的细胞周期
[0090][0091]
实施例15
[0092]
本实施例涉及高光学纯度阿卡宁萘茜母核羟基甲基化羰基肟衍生物诱导 mcf-7 cd
44+
cd
24-/low
肿瘤干细胞凋亡的实验。给药不同浓度的化合物ⅱ后,采用annexv-fitc/pi染色法,对细胞凋亡情况进行定量分析。
[0093]
在正常细胞中,磷脂酰丝氨酸分布在细胞膜脂质双层的内侧,当细胞处于凋亡早期时,在细胞皱缩、染色质浓缩、细胞膜通透性增加等凋亡现象还未开始出现时,磷脂酰丝氨酸从膜的内侧翻向外侧。annexinv与磷脂酰丝氨酸有高度的亲和力,能在凋亡早期与暴露在细胞外侧的磷脂酰丝氨酸相结合,标记了fitc 的annexinv能做为荧光探针用于检测早期凋亡的细胞。前面已经提到,pi是一种不能透过完整细胞膜的核酸染料,但当细胞处于凋亡的中晚期或坏死时,细胞膜的通透性增加,pi即能透过细胞膜而使细胞核染色。因此,根据annexinv和 pi对细胞染色情况能将处于不同凋亡时期的细胞区分开来。
[0094]
如图附图6所示,左下象限为正常细胞(annexin v-/pi-),右下象限为凋亡早期细胞(annexin v+/pi-),右上象限内的则为凋亡晚期或坏死细胞(annexinv+/pi+)。当用化
cd138),均为肿瘤干细胞的标志物,与肿瘤干细胞的自我更新、细胞粘附及增殖、肿瘤耐药密切相关(dana,h.,et al.cd166 as a stem cell marker?a potentialtarget for therapy colorectal cancer?j stem cell res ther.2016,1(6),226-229; shimada,et al.syndecan-1(cd138)contributes to prostate cancer progression bystabilizing tumour-initiating cells.j pathol,2013,231,495-504;onyeisi,j.et al. syndecan-4 as a pathogenesis factor and therapeutic target in cancer.biomolecules, 2021,11(4),503.)。化合物
ⅱ‑
2处理后,上述标志物的表达量下调,肿瘤干细胞的粘附性降低,同时细胞的增殖及其恶性程度降低,即化合物
ⅱ‑
2靶向肿瘤干细胞的标记物,产生抗肿瘤干细胞的活性。
[0105]
结论:化合物
ⅱ‑
2处理后,肿瘤干细胞粘附分子通路上的蛋白表达发生变化,蛋白表达下调后影响肿瘤干细胞的生长。
[0106]
实施例17
[0107]
本实施例涉及紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物抗mcf-7 cd
44+
cd
24-/low
乳腺癌干细胞瘤的体内活性研究。参考文献(celikoglu f, et al.intratumoral administration of cisplatin through a bronchoscope followed byirradiation for treatment of inoperable non-small cell obstructive lung cancer.lungcancer,2006,51(2),225-236)方法,采用瘤内注射的方式进行化合物
ⅱ‑
2抗 mcf-7 cd
44+
cd
24-/low
干细胞瘤的体内药效实验。
[0108]
实验方法:
[0109]
nod-scid小鼠(雌性)饲养在spf级实验动物中心,温度、湿和光照分别控制21
±
2℃,50
±
10%及12h光照/12h黑暗循环。所有动物实验的操作均参照所在实验动物中心的动物实验伦理委员会指导手册。
[0110]
称取所需重量的化合物
ⅱ‑
2,将其溶于聚氧乙烯蓖麻油与无水乙醇1:1的混合液中,制备浓度为6毫克/毫升的储备液,置于玻璃瓶中待用,给药前用生理盐水稀释6倍至1毫克/毫升浓度,一次性过滤器过滤后即可给药。
[0111]
mcf-7 cd
44+
cd
24-/low
乳腺癌干细胞正常传代培养至所需数目,细胞用胰酶消化;离心收取细胞后,使用培养基与基质胶(bd matrigel
tm
)等体积混合液稀释,调整细胞浓度至(2
×
10^6个/ml)后接种于小鼠右前肢腋窝皮下(0.2ml/ 只)。接种后,待移植瘤瘤体积大于50mm3时,将小鼠按5只/组随机分组,分为给药组(化合物
ⅱ‑
2)及空白对照组(control),并称重记录。给药组用已配好的化合物
ⅱ‑
2溶液对小鼠进行瘤内注射(0.2ml/只),空白对照组用相应的空白制剂进行瘤内注射,隔天给药,共给药10次。开始实验后每天记录肿瘤的体积,给药结束后再记录瘤重2天。
[0112]
肿瘤体积计算公式:
[0113]
体积(mm3)=长径(mm)
×
短径(mm)
×
短径(mm)/2
[0114]
肿瘤体积变化率计算公式:
[0115]
肿瘤体积变化率(%)=肿瘤体积/初次给药时肿瘤体积
×
100
[0116]
实验结果:
[0117]
实验结果如附图7所示,随化合物
ⅱ‑
2的瘤内注射,给药组的肿瘤体积变化不大,在第20天,给药组的平均肿瘤体积变化率仅为初始值的135%;空白对照组的平均肿瘤体积
变化率已达到初始值的270%。这一结果提示,在所采用的给药方式下,化合物
ⅱ‑
2可显著抑制mcf-7 cd
44+
cd
24-/low
乳腺癌干细胞瘤的生长。
[0118]
实施例18
[0119]
本实施例涉及紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟衍生物对人皮肤成纤细胞hsf(人正常细胞)的生长抑制活性测试,包括以下步骤:
[0120]
取对数生长期的hsf,用0.25%胰蛋白酶消化后,用磷酸盐缓冲液稀释后离心,加入无血清培养基混悬,并调整细胞悬液至合适的浓度,在96孔板中每孔加入100μl细胞悬液,使得每孔中的细胞数为5000个。将96孔板静置于37℃, 5%co2恒温培养箱中培养12h,待细胞贴壁后每孔加入用完全培养基稀释的化合物100μl,各组均设三个复孔。每块96孔板上需设置调零孔与空白对照孔。继续培养48h后,加入之前配好的mtt溶液20μl/孔,避光继续培养4h。后将上清液吸出,每孔加100微升dmso,并于多功能酶标仪上570nm波长处检测各孔的吸光度(od值)。测试中选用紫草素为阳性对照药物。细胞生长抑制率及半数抑制浓度(ic
50
)计算方法同实施例12。
[0121]
表2目标化合物抑制人正常细胞hsf的ic
50
值
[0122]
化合物ic
50
(μm)
ⅱ‑
2》50
ⅱ‑
3》50
ⅲ‑
2》50
ⅲ‑
3》50iv-2》50iv-3》50紫草素1.3
[0123]
综上所述,本发明化合物的制备方法简便,收率较高且原料易得。体外抗肿瘤活性实验研究表明,所制备紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟化衍生物对乳腺癌干细胞有非常强的生长抑制作用,其去除肿瘤干细胞的药效显著高于临床应用的紫杉醇、多西紫杉醇及阿霉素。与紫草素相比,紫草素及其对映体阿卡宁萘茜母核羟基甲基化羰基肟化衍生物对于正常细胞hsf-1毒性显著降低。该类化合物可选择性抗肿瘤干细胞的特性,为后续抗肿瘤药物筛选提供了先导化合物,具有重大开发前景。
[0124]
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1