一种适宜儿童使用的组织工程神经及其制备方法
1.本发明涉及神经损伤的治疗领域,具体地说是一种适宜儿童使用的组织工程神经及其制备方法。
背景技术:
2.外周神经损伤的原因有很多,在成人,多以外伤、肿瘤侵犯、感染所致。而在儿童,除去上述原因以外,新生儿臂丛神经损伤也就是产瘫,也是导致儿童外周神经损伤的主要原因。
3.对于神经损伤的治疗,缺损较小的可以直接缝合,缺损大于3cm的,一般采用自体神经移植,更大的缺损则再用自体血管、肌肉肌腱、人造神经导管植入等方法进行替代。同样,对于新生儿臂丛神经损伤的手术治疗,神经移植也是金标准。但是,作为金标准的自体神经移植术也存在其局限性,移植区域神经尺寸不匹配,供区创伤、供区功能丧失是其无法规避的缺点。甚至,即使克服了以上不足,可供移植的神经材料有时仍然无法满足临床的需要,所以需要一种尺寸多样,能够避免供区手术,能够与正常神经微环境类似而且材料充足的神经替代品。
4.这就是组织工程神经被提出的基础,他能够满足上述的临床要求。目前也已经存在了众多关于组织工程神经的研究。对于支架的研究,目前有生物来源胶原蛋白人工合成的支架,有经化学方法洗涤制作的脱细胞支架还有经过脱细胞后再经过静电纺丝等方法再构成的支架。但是这些支架也都存在一些不足,比如人工合成的支架的微环境与正常组织不同,脱细胞支架存在洗涤剂的细胞毒性而静电纺丝构成的支架则强度不够。
5.对于种子细胞而言,施万细胞被诸多实验证实因为其再外周神经损伤时能够分泌多种促神经生长的因子,所以是最理想的种子细胞。但作为成熟细胞,施万细胞的生长慢,细胞少,难以获取。所以现在对于种子细胞的研究都集中在间充质干细胞上,最多见的就是骨髓和脂肪,但无论在怎么容易获得,这些干细胞均会对病人上次二次创伤。
技术实现要素:
6.本发明的目的在于提出一种适宜儿童使用的组织工程神经及其制备方法,以解决上述背景技术中提出的问题。
7.为实现上述目的,本发明提供以下技术方案:
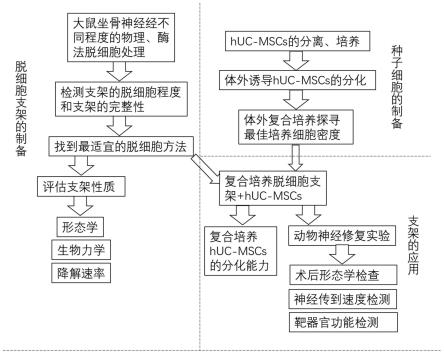
8.一种适宜儿童使用的组织工程神经,其特征在于,包括冻干脱细胞支架和人脐带间充质干细胞,所述冻干脱细胞支架和所述人脐带间充质干细胞进行复合培养,得到支架-细胞复合物。
9.一种适宜儿童使用的组织工程神经的制备方法,其特征在于,包括以下具体步骤:
10.s1、冻干脱细胞神经支架的制备;
11.s2、人脐带间充质干细胞的培养和诱导;
12.s3、支架-细胞复合物的构建;
13.s4、动物实验。
14.所述步骤s1具体包括以下内容:
15.s1-1、准备
16.①
标本的获取:新西兰兔,坐骨神经,分八组,每组四个;
17.②
清除软组织后,在-80℃冰箱速冻保存;
18.③
γ射线消毒
19.s1-2、冻干
20.①
将冻干仪容器预冷至-56℃;
21.②
将-80℃的神经转移至冻干仪容器;
22.③
持续冻干48小时;
23.④
复温冲洗
24.所述步骤s1-2需要进行一到两个周期后,再执行步骤s1-3,;
25.s1-3、脱细胞
26.接受不同时间的(丝氨酸蛋白酶抑制剂)pmsf和(脱氧核糖核酸酶)d nase的消化得到脱细胞程度不同的8种支架;
27.s1-4、制备方法的评估
28.①
he染色和dapi染色:观察细胞核成分和细胞外基质的排列;
29.②
lfb染色:评估神经内髓鞘的去除程度;
30.③
dna定量:评估脱细胞程度;
31.④
胶原蛋白定量:与脱细胞前胶原蛋白含量比较,观察脱细胞对胶原蛋白的影响;
32.s1-5、制备方法的选择
33.选取损伤最小并且脱细胞和髓鞘最完全的试验组进行下一步试验;
34.s1-6、脱细胞支架质量的验证
35.①
形态学验证:扫描电镜检查;
36.②
生物力学验证:正常神经vs脱细胞支架。
37.所述步骤s2具体包括以下内容:
38.s2-1、分离和培养
39.①
取新生儿脐带;
40.②
分离脐带华通氏胶;
41.③
胶原蛋白酶处理18h;
42.④
0.25%胰蛋白酶消化处理5min;
43.⑤
加入mscs无血清专用培养液;
44.⑥
传代;
45.s2-2、细胞的鉴定
46.①
分别与抗cd29,cd44,cd34,cd45,cdl05,cdl06,hla-dr单克隆抗体(phar mingen)室温反应30min;
47.②
pbs洗涤两次后与fitc标记的二抗避光反应15min;
48.③
用epics—altra流式细胞仪检测细胞表面抗原的表达;
49.s2-3、向scs的诱导
50.①
预诱导液(dmem培养基、1mmol/l b.巯基乙醇)培养24h;
51.②
预诱导液(dmem培养基、10%fbs,35/ml全反式视黄酸)培养72h;
52.③
诱导液(dmem培养基、10%fbs、5ng mol/l forskolin、10ng/ml bfgf、5ng/ml pdgf、200ng/ml heregulin)培养14d;
53.s2-4、分化鉴定
54.①
应用小鼠抗人神经元特异性烯醇化酶(nse)和神经丝蛋白(nf)单抗;
55.②
分别滴加羊抗小鼠的ig-fitc和tritc的二抗工作液;
56.③
置于荧光显微镜下观察。计算nse和nf-m阳性细胞占总细胞的比例。
57.所述步骤s3具体包括以下内容:
58.s3-1、细胞密度的探究
59.①
将密度为103,104,105,106,的huc-smcs以沉淀法的方式与支架复合培养;
60.②
培养1周后,将10μl mtt溶液分别加入各个培养皿内,在37℃下培养4小时;
61.③
中和mtt溶液,加入100μl dmso,室温下震荡10分钟;
62.④
用分光光度计测量,读取λ=540nm时的吸收比值;
63.⑤
细胞增殖最佳的为最适合的细胞密度;
64.s3-2、支架向scs的分化能力评估
65.①
以最适细胞密度以沉浸法与脱细胞支架复合培养1周;
66.②
应用小鼠抗人神经元特异性烯醇化酶(nse)和神经丝蛋白(nf)单抗工作液;
67.③
分别滴加羊抗小鼠的ig-fitc和tritc的二抗工作液,置于荧光显微镜下观察;
68.④
计算nse和nf-m阳性细胞占总细胞的比例。
69.所述步骤s4具体包括以下内容:
70.s4-1、植入物的准备
71.①
支架-细胞复合物的准备:术前3天应用上述方法制备适宜密度的支架-细胞复合物;
72.②
脱细胞支架的准备:脱细胞支架均在pbs液中进行保存;
73.s4-2、动物模型的准备
74.①
新西兰兔18只,分成三组,每组6只;
75.②
取左坐骨神经作为实验对象,切除坐骨神经干15mm;
76.所有的脱细胞支架均在-4℃温度下,加入双抗的pbs液中进行保存。支架-细胞复合物的制作则是在手术的前三天;总共准备新西兰兔18只,随机分为3组;均取左侧坐骨神经为实验组,右坐骨神经为对照组;尖刀切除15mm的神经干组织;分别进行翻转神经干的神经外膜吻合术、支架修复术和复合物修复术。
77.③
术后八周,对修复效果评估;
78.评估兔子的腓肠肌电生理、移植物的组织学和靶器官的功能三项指标;与对照组进行比较,分析支架和复合物对神经修复的疗效。
79.与现有技术相比,本发明有益效果如下:
80.本发明中冻干脱细胞技术利用冻干复温过程在保持细胞外基质完整的同时破坏细胞壁结构,避免使用去污剂等有细胞毒性的试剂进行脱细胞的操作,保持细胞外基质的生物特性,本发明运用的种子细胞是人脐带间充质干细胞,这种细胞已经被证明有施万细
胞的分化能力,对于儿童多见的产瘫病人而言,这种细胞较病人其他部位的细胞更容易获取,而且无创,且方便进行动物实验。
附图说明
81.图1为本发明制备方法的整体流程图;
82.图2为本发明人脐带间充质干细胞的培养和诱导流程图;
83.图3为本发明多种神经修复术效果示意图。
具体实施方式
84.为阐明技术问题、技术方案、实施过程及性能展示,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释。本发明,并不用于限定本发明。以下将参考附图详细说明本公开的各种示例性实施例、特征和方面。附图中相同的附图标记表示功能相同或相似的元件。尽管在附图中示出了实施例的各种方面,但是除非特别指出,不必按比例绘制附图。
85.在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
86.另外,为了更好的说明本公开,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本公开同样可以实施。在一些实例中,对于本领域技术人员熟知的方法、手段、元件和电路未作详细描述,以便于凸显本公开的主旨。
87.实施例1
88.一种适宜儿童使用的组织工程神经,其特征在于,包括冻干脱细胞支架和人脐带间充质干细胞,所述冻干脱细胞支架和所述人脐带间充质干细胞进行复合培养,得到支架-细胞复合物。
89.一种适宜儿童使用的组织工程神经的制备方法,其特征在于,包括以下具体步骤:
90.s1、冻干脱细胞神经支架的制备;
91.s2、人脐带间充质干细胞的培养和诱导;
92.s3、支架-细胞复合物的构建;
93.s4、动物实验。
94.所述步骤s1具体包括以下内容:
95.s1-1、准备
96.①
标本的获取:新西兰兔,坐骨神经,分八组,每组四个;
97.②
清除软组织后,在-80℃冰箱速冻保存;
98.③
γ射线消毒
99.s1-2、冻干
100.①
将冻干仪容器预冷至-56℃;
101.②
将-80℃的神经转移至冻干仪容器;
102.③
持续冻干48小时;
103.④
复温冲洗
104.所述步骤s1-2需要进行一到两个周期后,再执行步骤s1-3,;
105.s1-3、脱细胞
106.接受不同时间的(丝氨酸蛋白酶抑制剂)pmsf和(脱氧核糖核酸酶)d nase的消化得到脱细胞程度不同的8种支架;
107.s1-4、制备方法的评估
108.①
he染色和dapi染色:观察细胞核成分和细胞外基质的排列;
109.②
lfb染色:评估神经内髓鞘的去除程度;
110.③
dna定量:评估脱细胞程度;
111.④
胶原蛋白定量:与脱细胞前胶原蛋白含量比较,观察脱细胞对胶原蛋白的影响;
112.s1-5、制备方法的选择
113.选取损伤最小并且脱细胞和髓鞘最完全的试验组进行下一步试验;
114.s1-6、脱细胞支架质量的验证
115.①
形态学验证:扫描电镜检查;
116.②
生物力学验证:正常神经vs脱细胞支架。
117.所述步骤s2具体包括以下内容:
118.s2-1、分离和培养
119.①
取新生儿脐带;
120.②
分离脐带华通氏胶;
121.③
胶原蛋白酶处理18h;
122.④
0.25%胰蛋白酶消化处理5min;
123.⑤
加入mscs无血清专用培养液;
124.⑥
传代;
125.s2-2、细胞的鉴定
126.①
分别与抗cd29,cd44,cd34,cd45,cdl05,cdl06,hla-dr单克隆抗体(phar mingen)室温反应30min;
127.②
pbs洗涤两次后与fitc标记的二抗避光反应15min;
128.③
用epics—altra流式细胞仪检测细胞表面抗原的表达;
129.s2-3、向scs的诱导
130.①
预诱导液(dmem培养基、1mmol/l b.巯基乙醇)培养24h;
131.②
预诱导液(dmem培养基、10%fbs,35/ml全反式视黄酸)培养72h;
132.③
诱导液(dmem培养基、10%fbs、5ng mol/l forskolin、10ng/ml bfgf、5ng/ml pdgf、200ng/ml heregulin)培养14d;
133.s2-4、分化鉴定
134.①
应用小鼠抗人神经元特异性烯醇化酶(nse)和神经丝蛋白(nf)单抗;
135.②
分别滴加羊抗小鼠的ig-fitc和tritc的二抗工作液;
136.③
置于荧光显微镜下观察。计算nse和nf-m阳性细胞占总细胞的比例。
137.所述步骤s3具体包括以下内容:
138.s3-1、细胞密度的探究
139.①
将密度为103,104,105,106,的huc-smcs以沉淀法的方式与支架复合培养;
140.②
培养1周后,将10μl mtt溶液分别加入各个培养皿内,在37℃下培养4小时;
141.③
中和mtt溶液,加入100μl dmso,室温下震荡10分钟;
142.④
用分光光度计测量,读取λ=540nm时的吸收比值;
143.⑤
细胞增殖最佳的为最适合的细胞密度;
144.s3-2、支架向scs的分化能力评估
145.①
以最适细胞密度以沉浸法与脱细胞支架复合培养1周;
146.②
应用小鼠抗人神经元特异性烯醇化酶(nse)和神经丝蛋白(nf)单抗工作液;
147.③
分别滴加羊抗小鼠的ig-fitc和tritc的二抗工作液,置于荧光显微镜下观察;
148.④
计算nse和nf-m阳性细胞占总细胞的比例。
149.所述步骤s4具体包括以下内容:
150.s4-1、植入物的准备
151.①
支架-细胞复合物的准备:术前3天应用上述方法制备适宜密度的支架-细胞复合物;
152.②
脱细胞支架的准备:脱细胞支架均在pbs液中进行保存;
153.s4-2、动物模型的准备
154.①
新西兰兔18只,分成三组,每组6只;
155.②
取左坐骨神经作为实验对象,切除坐骨神经干15mm;
156.所有的脱细胞支架均在-4℃温度下,加入双抗的pbs液中进行保存。支架-细胞复合物的制作则是在手术的前三天;总共准备新西兰兔18只,随机分为3组;均取左侧坐骨神经为实验组,右坐骨神经为对照组;尖刀切除15mm的神经干组织;分别进行翻转神经干的神经外膜吻合术、支架修复术和复合物修复术。
157.③
术后八周,对修复效果评估;
158.评估兔子的腓肠肌电生理、移植物的组织学和靶器官的功能三项指标;与对照组进行比较,分析支架和复合物对神经修复的疗效。
159.以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的仅为本发明的优选例,并不用来限制本发明,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1