一种苯并[c]菲啶类天然产物及其衍生物的制备方法
本发明属于医药,具体涉及一种苯并[c]菲啶类天然产物及其衍生物的制备方法。
背景技术:
1、苯并[c]菲啶类天然产物是一类分布于罂粟科和芸香科植物中的异喹啉类生物碱,具有广泛的生物活性,包括抗癌,杀菌,消炎等,寻找简洁高效的合成方法以满足其生物活性评价需求,一直是有机化学关注的焦点,其母核结构如下:
2、
3、分子中一般有a、b、c、d四个环,根据b环与c环的构建方式,目前报道的该苯并[c]菲啶类天然产物及其衍生物的合成策略主要包括:
4、1.bischler-napieralski环合法,例如:
5、bischler-napieralski反应是合成异喹啉类生物碱的常用方法,tsutomuishikawa课题组以1-四氢萘醌为关键反应前体,在ticl4催化下与甲胺反应得到亚胺,nabh4还原亚胺得到仲胺中间体,再经n-甲酰化与后续的芳构化后,制备出bischler-napieralski反应的关键底物,在pocl3条件下发生环合,完成该骨架的构建。(j.org.chem.2000,65,9143.)
6、该bischler-napieralski环合法对应的反应路线为:
7、
8、2.分子内电环化策略,例如:
9、2014年,satoshi hibino课题组利用微波辅助电环化反应对c环进行了构建,该路线以取代的邻溴苯甲醛和频哪醇硼酸酯为原料,发生suzuki-miyaura偶联并与o-甲基羟胺反应得到肟醚中间体,该关键中间体发生分子内6-π电环化得到具有苯并[c]菲啶骨架的产物,再经后续的氧化还原反应,可合成目标天然产物。(heterocycles 2014,88,297.)
10、该分子内电环化策略对应的反应路线为:
11、
12、3.小檗碱的重排反应策略,例如:
13、1990年,miyoji hanaoka课题组通过对小檗碱的hofmann重排反应,将其转化为异喹啉类化合物,并通过后续c-c键的构筑,完成了该类化合物的合成。(chem.pharm.bull.1990,38,3335.)
14、该小檗碱的重排反应策略对应的反应路线为:
15、
16、4.金催化串联环合策略,例如:
17、2009年,yoshiji takemoto课题组以炔烃类化合物为底物,经6-endo-dig与6-endo-trig环合,完成了苯并[c]菲啶骨架的构筑,再经后续修饰,完成了天然产物nitidine的合成。(j.org.chem.2009,74,9158.)
18、该金催化串联环合策略对应的反应路线为:
19、
20、另外,也有使用分子内自由基偶联,(tetrahedron lett.2008,49,5262;j.org.chem.1998,63,4235.)钯催化两组分串联环合反应,(j.org.chem.2006,71,9818.)分子内稀酰胺-醛环化,(chem.pharm.bull.1999,47,900;tetrahedron:asymmetry 1999,10,1947;bioorg.med.chem.lett.2001,11,2643.)分子内f-c反应(j.enzymeinhib.med.chem.2004,19,481.)等策略对b/c环进行构筑。
21、尽管对于苯并[c]菲啶类天然产物的全合成策略很丰富,但其中许多策略存在路线长,收率低,使用的试剂较危险且不够环保等问题,因此,发展具有高效合成策略和符合绿色化学理念的苯并[c]菲啶类天然产物制备路线仍是当务之急。
技术实现思路
1、本发明的目的是提供一种苯并[c]菲啶类天然产物及其衍生物的制备方法,该制备方法是一种过渡金属催化的,符合“pot-economy”的合成策略,该策略可用于集群式全合成一系列苯并[c]菲啶类生物碱。其路线较短,收率高且操作简单,产品纯度高,反应原子经济性好,符合“绿色化学”标准。
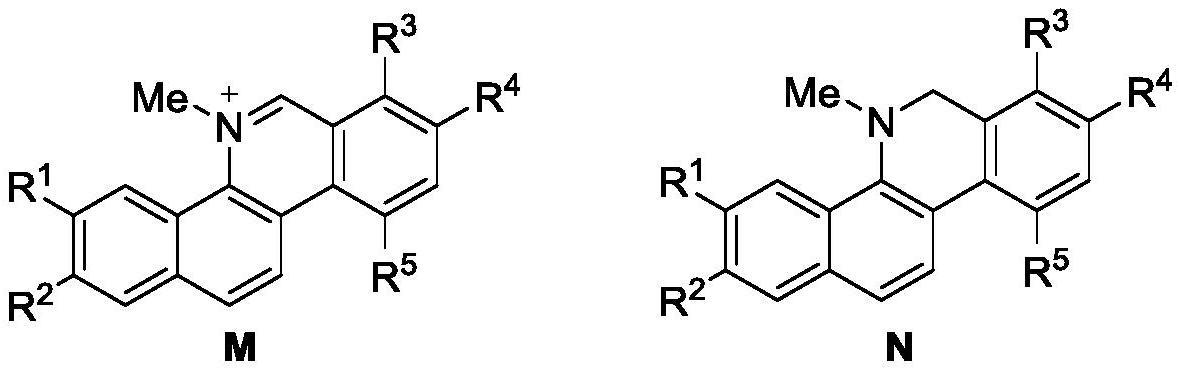
2、本发明提供如下的结构通式(m)和结构通式(n)的苯并[c]菲啶类天然产物、或其衍生物:
3、
4、其中,
5、r1,r2形成亚甲二氧基,或独立表示为甲氧基;
6、r3,r4形成亚甲二氧基,或独立表示为甲氧基;
7、r5为甲氧基,异丙氧基,苄氧基。
8、更优选地,苯并[c]菲啶类天然产物、或其衍生物,具体为以下结构中的一种:
9、化合物1
10、
11、化合物2
12、
13、化合物3
14、
15、化合物4
16、
17、化合物5
18、
19、化合物6
20、
21、化合物7
22、
23、化合物8
24、
25、化合物9
26、
27、化合物10
28、
29、化合物11
30、
31、化合物12
32、
33、上述苯并[c]菲啶类天然产物、或其衍生物的制备方法,包括以下合成路线:
34、
35、其中,r1、r2、r3、r4、r5如前文所述。
36、对应上述合成路线中,具体的一种苯并[c]菲啶类天然产物、或其衍生物,具体包括以下步骤:
37、s1:系列化合物b的制备
38、以6-溴胡椒醛或6-溴藜芦醛(系列化合物a)为起始原料,以双三苯基磷二氯化钯,碘化亚铜作为催化剂,以无氧且干燥的四氢呋喃作为溶剂,氮气保护,室温搅拌成均匀体系,再加入三甲基乙炔基硅和干燥三乙胺,室温搅拌至6-溴胡椒醛或6-溴藜芦醛消失,反应结束后浓缩反应液并柱层析,得到系列化合物b;
39、其中,所述的s1中,按摩尔比,6-溴胡椒醛:双三苯基磷二氯化钯:碘化亚铜:三甲基乙炔基硅:三乙胺=(20~22):(1.0~1.5):(2.5-3.0):(65-70):(0.1-0.15);
40、s2:系列化合物c的制备
41、将系列化合物b用甲醇溶解,加入碳酸钾,室温搅拌反应,反应结束后,加入饱和氯化铵溶液淬灭,二氯甲烷萃取,萃取液进行水洗,硫酸钠干燥,浓缩得系列化合物c;
42、其中,所述的s2中,室温搅拌反应时间优选为0.4~1小时。
43、所述的s2中,按摩尔比,系列化合物b:碳酸钾=(20-25):(2.0-2.5)。
44、s3:系列化合物e的制备
45、将系列化合物d,双三苯基膦二氯化钯,碘化亚铜加入到反应瓶中,用无氧且干燥的四氢呋喃溶解,在氮气保护的条件下,加入系列化合物c的四氢呋喃溶液和干燥三乙胺,并继续搅拌直至末端炔烃完全被消耗,待反应结束后,将反应液浓缩并柱层析,得系列化合物e;
46、其中,所述的s3中,按摩尔比,系列化合物d:双三苯基膦二氯化钯:碘化亚铜:系列化合物c:三乙胺=(1.5-1.6):(0.03-0.04):(0.05-0.07):(0.6-0.7):(3.0-3.5)。
47、s4:系列化合物f的制备
48、用干燥四氢呋喃溶剂溶解三苯基甲基溴化磷,得到溶液,在-70℃~-80℃条件下滴加双(三甲基硅基)氨化钠(nahmds),滴加完毕,室温搅拌20-40分钟,在-70℃~-80℃条件下滴加系列化合物e的四氢呋喃溶液,滴加完毕室温搅拌3-8小时,反应结束后,饱和氯化铵溶液淬灭,乙酸乙酯萃取,水洗,干燥,减压浓缩溶剂柱层析,得到系列化合物f;
49、其中,所述的s4中,滴加双(三甲基硅基)氨化钠的滴加速率为0.1~3ml/s。
50、所述的s4中,按摩尔比,三苯基甲基溴化磷:双(三甲基硅基)氨化钠:系列化合物e=(2.0-2.1):(2.0-2.1):(1.0-1.1)。
51、s5:系列化合物g的制备
52、将ipraucl和agsbf6加入到干燥反应瓶中,用干燥二氯甲烷溶解,氮气保护,常温搅拌5-10分钟,加入系列化合物f的二氯甲烷溶液,再加入n-碘代丁二酰亚胺(nis)的二氯甲烷溶液,继续搅拌5-10分钟,待反应结束后,浓缩反应液,柱层析,得化合物g;
53、其中,所述的s5中,ipraucl:agsbf6:系列化合物f:n-碘代丁二酰亚胺=0.05:0.05:1:(1.5-2.0)。
54、s6:系列化合物h的制备
55、在封管内加入系列化合物g,铜粉,乙醇,甲胺水溶液,加热至100-120℃搅拌3-12小时,反应完成后,加入硫酸钠干燥,用微孔滤膜过滤,得到系列化合物h;
56、其中,所述的s6中,按摩尔比,系列化合物g:铜粉:甲胺水溶液=(0.5-0.7):(0.02-0.04):(3.2-3.5)。
57、s7:系列化合物m的制备(苯并[c]菲啶类天然产物、或其衍生物的制备)
58、在封管内加入系列化合物h,多聚甲醛,硫酸镁,乙醇,三氟乙酸,氧气保护,加热至60-70℃搅拌2.5-4.0小时,反应完成后,加入水淬灭,二氯甲烷萃取,无水硫酸钠干燥,减压浓缩溶剂柱层析,得到系列化合物m,即为苯并[c]菲啶类天然产物及其衍生物;
59、其中,按摩尔比,系列化合物h:多聚甲醛:硫酸镁:三氟乙酸=10:3:3:10。
60、s8:系列化合物n的制备(苯并[c]菲啶类天然产物、或其衍生物的制备)
61、在封管内加入系列化合物h,多聚甲醛,硫酸镁,乙醇,三氟乙酸,氮气保护,加热至60-70℃搅拌2.5-4.0小时,反应完成后,加入水淬灭,二氯甲烷萃取,无水硫酸钠干燥,减压浓缩溶剂柱层析,得到系列化合物n(苯并[c]菲啶类天然产物及其衍生物)。
62、其中,按摩尔比,系列化合物h:多聚甲醛:硫酸镁:三氟乙酸=10:3:3:10。
63、以上制备方法中,添加的各个原料,按官能团反应的摩尔比确定。
64、本发明的苯并[c]菲啶类天然产物及其衍生物的制备方法,得到的苯并[c]菲啶类天然产物及其衍生物,收率25-34%,质量纯度≥99%。
65、本发明的一种苯并[c]菲啶类天然产物及其衍生物的制备方法,以6-溴胡椒醛或6-溴藜芦醛作为起始原料,通过连续的过渡金属催化反应,经sonogashira偶联(s1和s3),脱除硅烷基保护(s2),wittig反应(s4),金催化条件下的环合反应制备萘环并在α位引入碘(s5),以及“一锅法”的ullmann偶联反应(s6),mannich反应(s7,s8),快速高效地构筑苯并[c]菲啶类天然产物与衍生物。本发明目前在苯并[c]菲啶类天然产物以及衍生物的制备方法中属路线最短,收率较高且操作简单,产品纯度高,反应原子经济性好,符合“绿色化学”标准。
- 还没有人留言评论。精彩留言会获得点赞!