MUC1-PDL1-IgG1Fc肿瘤疫苗及其制备方法和应用
muc1-pdl1-igg1 fc肿瘤疫苗及其制备方法和应用
技术领域
1.本发明属于医药技术领域,更具体地,本发明涉及一种muc1-pdl1-igg1 fc重组蛋白、由所述muc1-pdl1-igg1 fc重组蛋白制备而得的肿瘤疫苗及其制备方法和应用。
背景技术:
2.恶性肿瘤在世界范围内具有较高的发病率和死亡率,对人类健康构成了相当大的威胁。恶性肿瘤的传统治疗手段有手术、放疗、化疗和靶向治疗,这几种治疗方法各有利弊。手术不能总是完全去除肿瘤细胞,近期研究表明,术后伤口愈合反应可能导致转移性肿瘤的生长。放化疗容易引起肿瘤细胞耐受和复发,导致预后不良。而靶向治疗有特异性的优势。早期在多种肿瘤类型的临床试验表明,单分子靶向治疗比其他治疗有更高的反应率和生存率。
3.治疗性肿瘤疫苗也是靶向治疗的一种,其原理与一般的预防疫苗不同,肿瘤疫苗是给恶性肿瘤患者接种,并辅以适当的佐剂,以激活患者的自身免疫反应并杀死肿瘤细胞。肿瘤细胞的突变改变了蛋白质的氨基酸序列,然后这些蛋白质被翻译并加工成短肽,称为肿瘤新抗原。作为非自身抗原,新抗原被dc细胞吞噬、加工和呈递,激活t细胞和其他免疫细胞,随后触发机体的特异性抗肿瘤免疫反应,因此肿瘤疫苗一直是开发治疗性癌症疫苗的焦点。
4.肿瘤疫苗的使用已经得到广泛研究,其制备的方法包括分离或在体外生成和扩增自体dcs,然后在体外操作并再输注到患者体内。目前肿瘤疫苗仅有一种被fda批准,即sipuleucel-t(provenge;dendreon),该疫苗是由负载着前列腺酸性磷酸酶(pap)和gm-csf组成的重组融合蛋白抗原的自体血液apcs组成的,用于治疗无症状或无症状的去势抵抗性前列腺癌,能延长患者生存期。
5.肿瘤抗原的来源、类型和种类在肿瘤疫苗的抗肿瘤免疫效力中起了关键的作用。如sipuleucel-t使用的前列腺酸性磷酸酶(pap),pap在前列腺癌中表达具有特异性和局限性,因此被认为是开发前列腺癌治疗性疫苗的候选分子。随着肿瘤免疫治疗的发展,越来越多的靶点被引入肿瘤治疗技术中,包括黏蛋白(muc1)、乳腺癌的表皮生长因子受体2(her2)、间皮素(msln)和表皮生长因子受体iii型突变体(egfrviii)等,这些靶点的发现及引入实验为免疫细胞疗法的发展及实体瘤的治疗奠定了基础。
6.黏蛋白muc1是一种高度糖基化的跨膜蛋白,它由一个胞内c-末端片段、一个单程跨膜区和一个胞外n-末端结构域(muc1-n),muc1-n是由数目可变的20个氨基酸组成的串联重复序列(vntr,hgvtsapdtrpapgstappa),可以重复20-120次。正常情况下它表达于大多数分泌腺上皮的顶端和基底外侧表面,但被间充质细胞和皮肤上皮封闭。据研究,人类癌症从正常表型向恶性表型的转变与细胞表面糖基化异常有关。muc1在肿瘤细胞中过度表达,并发生异常糖基化,这种肿瘤细胞表达的muc1称为ta-muc1或低糖基化粘蛋白-1(umuc1)。它与正常细胞表达的muc1的抗原位点有些不同,正常细胞muc1经过糖基化修饰,因此vntr区域的免疫原性表位被覆盖,而ta-muc1的异常低糖基化使这些免疫原性表位暴露在免疫系
统中。因此,肿瘤细胞中产生了新的糖肽抗原。ta-muc1通常导致细胞不可逆的凋亡、t细胞抑制以及不良预后。ta-muc1在许多肿瘤中都高表达,包括96.7%的侵袭性肺癌,90%的胰腺、前列腺、上皮性卵巢癌和铂耐药肿瘤,77%的原发肺癌和70%的乳腺癌等。ta-muc1在肿瘤细胞上的广泛分布,使muc1成为许多诊断和免疫治疗方法中广泛探索的靶点。基于某些标准,如治疗功能、免疫原性和癌细胞特异性,muc1被美国国家癌症研究所转译研究工作组列为75种肿瘤相关抗原名单中第二个最有希望的癌症研究目标。
7.基于muc1的癌症疫苗包括亚单位疫苗、dna疫苗、病毒疫苗、树突状细胞(dc)疫苗和糖肽疫苗等。至今已有许多学者研究了针对muc1的dc疫苗在抗肿瘤中的作用,如在胰腺癌中,用于手术后辅助治疗的靶向muc1的肿瘤疫苗发挥了显着的抗肿瘤作用,且显示了良好的安全性和耐受性,在为期四年的临床试验中,33%的患者实现了无复发生存。另一项载有muc1甘露聚糖肽的自体肿瘤疫苗的ii期临床试验表明,15%的进行性上皮性卵巢癌患者获得了持久的反应,类似的还有teramoto等人设计的以muc1为靶点的肿瘤疫苗,成功地诱导了muc1特异性抗肿瘤免疫反应,从而延长了难治性非小细胞肺癌患者的生存期。由此可见基于muc1的肿瘤疫苗具有巨大的抗肿瘤应用潜力。
8.但尽管靶向muc1的肿瘤疫苗在一些恶性肿瘤的临床试验中显示出相当大的潜力,但由于临床效果不稳定,部分患者对靶向muc1的肿瘤疫苗无应答或者效果微弱,因此这些疫苗仍未进入第三阶段试验,因而现在迫切需要提高muc1的免疫原性,提高负载muc1免疫原的肿瘤疫苗抗肿瘤免疫效力,实现更强的抗肿瘤免疫的激活。
9.程序性死亡配体1(pd-l1,b7-h1)高表达于许多肿瘤细胞的表面,其与其受体pd-1,是抑制抗肿瘤t细胞反应的一对主要免疫检查点,肿瘤细胞上表达的pd-l1与t细胞表面的pd-1受体结合导,可致效应性t细胞耗尽,从而导致肿瘤细胞免疫逃逸,预后不良。许多研究表明,特异性靶向pd-l1或其受体pd-1的单克隆抗体(mab),可阻断pd-1/pd-l1途径对t细胞的抑制作用,从而增强机体细胞免疫功能,并且许多特异性的单抗已在许多不同类型的恶性肿瘤中产生了显著的临床效果。但也有研究表明,机体免疫有一种抗癌机制就是通过pd-l1特异性的效应t细胞求偶作用的,pd-l1特异性t细胞可以通过直接靶向杀伤或者释放细胞因子间接杀伤肿瘤细胞。且pd-l1特异性t细胞杀伤肿瘤细胞后能通过释放因子或者裂解的肿瘤细胞释放相关的肿瘤抗原从而直接和间接增强其他t细胞反应,从而有效地增强免疫反应的效应期,或直接调节肿瘤疫苗的免疫原性,从而有效地增强免疫反应的强度。
10.dc细胞摄取抗原的方式主要分为三种,吞噬作用、胞饮作用和受体介导的内吞作用。传统的肿瘤疫苗负载抗原的方法是在体外培养dc时用肿瘤相关抗原(taa)多肽脉冲的dc细胞,dc细胞通过液相胞吞或者吞噬作用摄取负载的taa,再将负载了抗原片段的dc细胞回输小鼠体内诱导抗原特异性免疫反应。然而,多肽脉冲的dc细胞在体内的效果是有限的,因为脉冲方式的taa被dc胞饮后仅短暂地与mhc分子结合。而受体介导的内吞作用是指dc细胞表面表达免疫球蛋白fc段的受体fcgrs,fcgrs能与蛋白的fc端结合,从而触发dc细胞活化,促进抗原递呈过程中的表面分子及细胞因子上调。这种通过受体介导的内吞途径,可以使抗原-igg复合物(免疫复合物,ics)被dc有效地捕获、加工并呈递给mhc-ii,从而有力地诱导th细胞和ctl细胞。激活的th细胞可以产生的高水平细胞因子,从而直接控制病毒感染和肿瘤生长。此外,fcgr介导ics内化可以直接将抗原呈递给mhc-i(交叉启动),从而激活ctl,这种受体介导的内吞方式比胞饮作用效率高1000-10000倍。因此,许多学者利用这种
受体介导的内吞摄取抗原的方式,研发了新的疫苗,如you等人开发了一种表达融合igg fc的乙型肝炎病毒e抗原的dna疫苗,疫苗接种后被细胞摄取,然后产生和分泌ics,诱导b细胞的同时通过受体介导途径被dc摄取并加工,结果显示这种dna疫苗策略可以广泛增强抗原特异性cd4
+
th和cd8
+
ctl和b细胞的反应;近年chen等人设计了一款负载了igg fc和pd-l1融合肽段的肿瘤疫苗,结果发现负载pdl1-igg fc的肿瘤疫苗在诱导抗pd-l1免疫应答和抑制肿瘤生长方面比单纯负载pd-l1蛋白的dc更有效。但单靶点的肿瘤疫苗已经在许多临床试验中进行了抗肿瘤测试,总体来说临床疗效不尽如人意,可能是归因于抗原的免疫原性不够强或dc交叉呈递抗原的能力不足。
技术实现要素:
11.基于此,本发明的目的之一在于提供一种muc1-pdl1-igg1 fc重组蛋白,所述重组蛋白中muc1与pd-l1联合作为肿瘤疫苗抗肿瘤的靶点蛋白,提高了抗原免疫原性和抗肿瘤疗效。
12.实现上述发明目的的具体技术方案包括如下:
13.一种muc1-pdl1-igg1 fc重组蛋白,所述重组蛋白的氨基酸序列如seq id no.1所示。
14.一种muc1-pdl1-igg1 fc重组蛋白,所述重组蛋白由seq id no.2所示的核苷酸序列所编码。
15.本发明还提供了上述muc1-pdl1-igg1 fc重组蛋白的制备方法,所述方法包括以下步骤:
16.(1)、合成包含了人muc1、th刺激表位、pdl1、连接子和igg1fc的基因序列的融合基因片段;所述融合基因片段的核苷酸序列如seq id no.2所示;
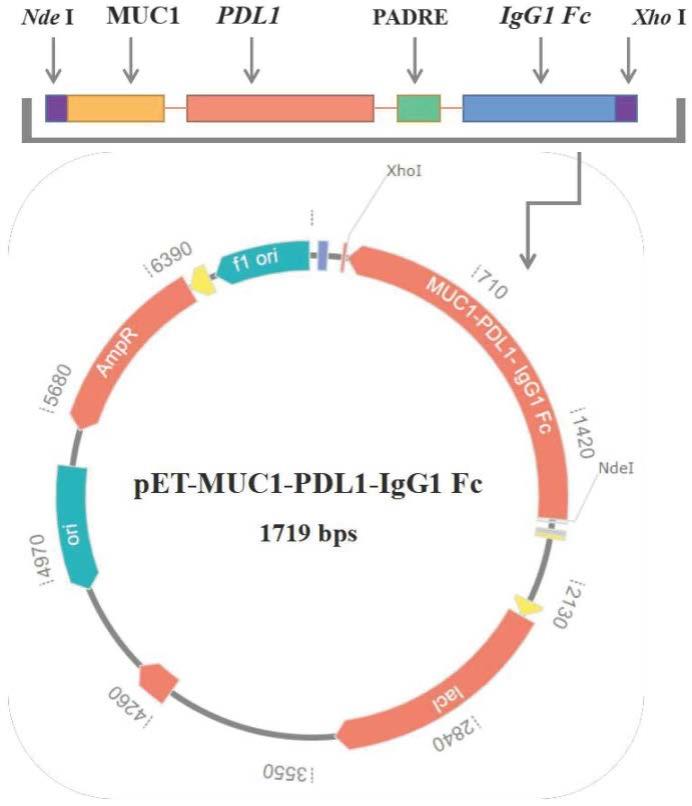
17.(2)、对步骤(1)的融合基因片段和pet-21a质粒载体进行ndei和xhoi双酶切,切胶纯化试剂盒回收,连接,得到表达质粒pet-21a/muc1-pdl1-igg1 fc;
18.(3)、将表达质粒pet-21a/muc1-pdl1-igg1 fc转入bl21(de3)表达菌株中,经iptg诱导,获得目的蛋白,经纯化、透析,即得muc1-pdl1-igg1 fc重组蛋白。
19.本发明还提供了上述muc1-pdl1-igg1 fc重组蛋白在制备肿瘤疫苗中的应用。
20.一种肿瘤疫苗,所述肿瘤疫苗的活性成分为muc1-pdl1-igg1 fc重组蛋白。
21.在其中一些实施例中,所述肿瘤疫苗的免疫浓度为1*105个dc细胞~3*105个dc细胞。
22.在其中一些实施例中,所述肿瘤疫苗的免疫浓度为1.5*105个dc细胞~2.5*105个dc细胞。
23.本发明还提供了上述肿瘤疫苗的制备方法。
24.一种肿瘤疫苗的制备方法,所述方法包括以下步骤:
25.(1)、在培养有树突状细胞的培养基中,加入80μg/ml~120μg/ml的muc1-pdl1-igg1 fc重组蛋白培养过夜;
26.(2)、再用45μg/ml~55μg/ml muc1-pdl1-igg1 fc重组蛋白对树突状细胞进行脉冲处理1h~3h,即得。
27.在其中一些实施例中,所述步骤(1)中的培养基为含有20ng/ml gm-csf和20ng/ml
重组小鼠il-4的rpmi-1640培养基。
28.本发明还提供了上述肿瘤疫苗在制备治疗实体瘤的药物中的应用。
29.在其中一些实施例中,所述实体瘤为侵袭性肺癌、胰腺癌、前列腺癌、上皮性卵巢癌、原发肺癌或乳腺癌。
30.在其中一些实施例中,所述实体瘤为胰腺癌。
31.与现有技术相比,本发明具有以下有益效果:
32.1、在本发明中,设计并成功表达了muc1-pdl1-igg1 fc重组蛋白,负载该重组蛋白的肿瘤疫苗,以肿瘤相关抗原muc1为靶点(muc1的肽段选择的是胞外全长,能尽可能囊括更多的抗原位点,比仅用某一抗原位点序列更能激起更广泛的t细胞反应),融合免疫检查点pd-l1片段(提高肿瘤疫苗的免疫原性,靶向肿瘤微环境,激活特异性靶向pd-l1的肿瘤特异性细胞毒性t细胞,诱导有效的淋巴细胞ctls反应),igg1 fc作为佐剂(使抗原肽通过fc与dc表面表达的受体fcr结合,介导抗原-igg复合物ics的内化,促进主要组织相容性复合物mhcⅱ类限制性抗原的高效呈递,更有效地激活th和ctl,从而杀伤肿瘤),利用dc细胞能吞噬、加工和呈递癌症抗原给t细胞和其他免疫细胞的功能,启动一种强大的癌症特异性免疫反应,从而克服了单个检查点抑制剂(muc1单靶点或pdl1单靶点)治疗无效的缺点,提高了抗肿瘤免疫效力,实现更强的抗肿瘤免疫激活,为其他高度表达muc1或pd-l1的肿瘤(96.7%的侵袭性肺癌、90%的胰腺、前列腺、上皮性卵巢癌、77%的原发肺癌和70%的乳腺癌)等实体瘤免疫治疗提供了一种新的有效策略,具有良好的安全性和可观的前景,同时也促进以muc1为靶点的药物开发,这些无疑为癌症的治疗带来了新的希望。
33.2、本发明的muc1-pdl1-igg1 fc重组蛋白是利用pet-21a/his原核系统制备而得的,相比于真核系统的方法,用时短,成本低,且获得的蛋白量大。
附图说明
34.图1为本发明实施例1构建的pet-21a/muc1-pdl1-igg1 fc表达质粒的结构示意图。
35.图2为本发明实施例2中muc1-pdl1-igg1 fc重组蛋白的sds-page图谱;其中,泳道m为预染的蛋白质分子量标记物,泳道con p为无iptg诱导的细菌裂解沉淀,泳道iptg s为1mm iptg诱导后的细菌裂解上清液,泳道iptg p为无1mm iptg诱导的细菌裂解后不溶性蛋白部分,泳道p为iptg诱导的细菌裂解后不溶性蛋白部分,箭头指示条带为重组蛋白muc1-pdl1-igg1 fc。
36.图3为本发明实施例3中muc1-pdl1-igg1 fc重组蛋白纯化过程中,溶解液、穿流液和纯化后的muc1-pdl1-igg1 fc重组蛋白的sds-page图谱;其中,泳道m为预染的蛋白质分子量标记物,泳道cl为8m尿素溶解不溶性蛋白后的上清液,泳道fl为纯化后的蛋白穿流液,泳道w为洗脱的杂蛋白片段,泳道e为纯化后的muc1-pdl1-igg1 fc重组蛋白。
37.图4是图3中muc1-pdl1-igg1 fc重组蛋白在sds-page凝胶上电泳后,用金斯瑞eblot l1快速湿转仪转膜,然后裁开膜后分别用his和抗人muc1一抗孵育,进行westernblot分析结果;其中,泳道m为预染的蛋白质分子量标记物,泳道e为纯化后的muc1-pdl1-igg1 fc重组蛋白。
38.图5为本发明实施例3中,透析处理后的muc1-pdl1-igg1 fc重组蛋白的sds-page
图谱;其中,泳道m为预染的蛋白质分子量标记物,泳道d为透析后的重组蛋白。
39.图6为本发明实施例4中使用muc1-pdl1-igg1 fc重组蛋白负载的肿瘤疫苗对小鼠进行免疫的实验流程。
40.图7为本发明实施例4中用流式细胞仪检测dc特异性标记物cd11c和cd80的表达情况。
41.图8为本发明实施例4中通过细胞内染色和流式细胞仪检测小鼠cd4
+
t细胞的比例。
42.图9为本发明实施例4中通过细胞内染色和流式细胞仪检测小鼠cd8
+
t细胞的比例。
43.图10为本发明实施例4中通过细胞内染色和流式细胞仪检测cd4
+
t细胞中产生il-2的频率。
44.图11为本发明实施例4中通过细胞内染色和流式细胞仪检测cd4
+
t细胞中产生ifn-γ的频率。
45.图12为本发明实施例4中通过细胞内染色和流式细胞仪检测cd8
+
t细胞中产生ifn-γ的频率。
46.图13为本发明实施例4中通过细胞内染色和流式细胞仪检测cd8
+
t细胞中产生perforin的频率。
47.图14为本发明实施例4中小鼠接种胰腺癌panc02的肿瘤生长曲线图(n=4)。
48.图15为本发明实施例4中肿瘤疫苗接种后荷胰腺癌panc02肿瘤细胞的小鼠的存活曲线(n=4)。
49.图16为本发明实施例4中免疫小鼠肝、肾切片的h&e染色分析。
具体实施方式
50.为了便于理解本发明,下面将对本发明进行更全面的描述。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明公开内容的理解更加透彻全面。
51.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
52.除非另外指明,本发明的实施例中所使用的实验方法,均为常规实验方法,实施例中所用到的各种试剂耗材,均为市售产品。
53.本发明的第一方面,提供了一种muc1-pdl1-igg1 fc重组蛋白,所述重组蛋白的融合片段包括黏蛋白muc1、程序性死亡配体1(pd-l1)和igg1 fc,所述重组蛋白的氨基酸序列如seq id no.1所示,其由如seq id no.2所示的核苷酸序列所编码。
54.氨基酸序列(seq id no.1)
55.mnalstgvsffflsfhisnlqfnssledpstdyyqelqrdisemflqiykqggflglsnikfrpgsvvvqltlafregtinvhdvetqfnqykteaasrynltisdvsvsdvpfpfsaqsftvtvpkdlyvveygsnmtieckfpvekqldlaalivywemedkniiqfvhgeedlkvqhssyrqrarllkdqlslgnaalqitdvklqdagvyrcmisygga
dykritvkvnapynkinqrilvvdpvtseheltcqaegypkaeviwtssdhqvlsgkttttnskreeklfnvtstlrintttneifyctfrrldpeenhakfvaawtlkaaagsngsgsgdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgklehhhhhh
56.核苷酸序列(seq id no.2)
57.catatgaacgcgctgagcaccggcgtgagcttctttttcctgagctttcacatcagcaacctgcaattcaacagcagcctggaggacccgagcaccgattactatcaggagctgcaacgtgatatcagcgaaatgtttctgcagatttacaagcaaggtggctttctgggcctgagcaacatcaaattccgtccgggtagcgtggttgtgcagctgaccctggcgtttcgtgagggtaccattaacgtgcacgacgttgaaacccagttcaaccaatacaagaccgaggcggcgagccgttataacctgaccattagcgacgtgagcgttagcgatgttccgtttccgttcagcgcgcaaagctttaccgtgaccgttccgaaagatctgtacgttgtggaatatggcagcaacatgaccatcgagtgcaagttcccggtggaaaaacaactggacctggcggcgctgattgtttactgggagatggaagataagaacatcattcagttcgtgcacggcgaggaagacctgaaagttcagcacagcagctatcgtcaacgtgcgcgtctgctgaaagaccagctgagcctgggtaacgcggcgctgcagatcaccgacgtgaaactgcaagatgcgggtgtttaccgttgcatgatcagctacggtggcgcggattataagcgtattaccgtgaaagttaacgcgccgtataacaagatcaaccagcgtattctggttgtggacccggtgaccagcgagcacgaactgacctgccaagcggagggttacccgaaggcggaagtgatttggaccagcagcgatcaccaggttctgagcggtaagaccaccaccaccaacagcaagcgtgaggaaaaactgtttaacgtgaccagcaccctgcgtatcaacaccaccaccaacgagatcttctactgcaccttccgtcgtctggatccggaggaaaaccacgcgaagttcgttgcggcgtggaccctgaaagcggcggcgggtccgaacggtagcggtagcggtgacaaaacccatacctgcccgccgtgcccggcgccggaactgctgggtggcccgagcgtttttctgttcccgccgaagccgaaagataccctgatgatcagccgtaccccggaagtgacctgcgttgtggttgacgttagccacgaggatccggaagtgaagttcaactggtacgtggacggtgtggaagttcacaacgcgaagaccaaaccgcgtgaggaacagtacaacagcacctatcgtgtggttagcgtgctgaccgttctgcaccaagactggctgaacggcaaagaatataagtgcaaagtgagcaacaaggcgctgccggcgccgatcgaaaaaaccattagcaaggcgaagggtcagccgcgtgagccgcaagtttacaccctgccgccgagccgtgaggaaatgaccaagaaccaagtgagcctgacctgcctggttaaaggcttttatccgagcgatatcgcggtggagtgggaaagcaacggtcagccggagaacaactacaaaaccaccccgccggtgctggacagcgatggcagctttttcctgtatagcaagctgaccgttgacaaaagccgttggcagcagggtaacgtgttcagctgcagcgttatgcacgaagcgctgcacaaccactacacccagaagagcctgagcctgagcccgggtaaactcgag
58.在本发明的第二个方面,提供了muc1-pdl1-igg1fc重组蛋白的制备方法,包括重组蛋白的表达、纯化、透析步骤。
59.在本发明的第三个方面,提供了利用muc1-pdl1-igg1fc重组蛋白在制备肿瘤疫苗中的应用。将muc1-pdl1-igg1fc重组蛋白与树突状细胞dc脉冲并免疫小鼠,发挥抗肿瘤免疫应答的作用。
60.在本发明的第四方面,提供了一种肿瘤疫苗,所述肿瘤疫苗的活性成分为muc1-pdl1-igg1fc重组蛋白。
61.在本发明的第五方面,提供了上述肿瘤疫苗在制备治疗实体瘤的药物中的应用。所述实体瘤为侵袭性肺癌、胰腺癌、前列腺癌、上皮性卵巢癌、铂耐药肿瘤、原发肺癌或乳腺癌。更优选为胰腺癌。
igg1fc重组蛋白(带有his标签),通过sds-page进一步分析裂解液、穿流液和洗脱液部分,如图3结果所示,泳道m为marker,泳道cl为包涵体用8m尿素溶解后的蛋白溶液样品,泳道ft为蛋白加入纯化柱后从柱子流出的穿流液样品,泳道w1和w3为含有菌体杂蛋白的洗涤液样品,泳道e1、2、4、6、8为洗脱的目的蛋白溶液样品。经过了ni柱的纯化,与裂解液cl和穿流液ft相比,洗脱液(e1、2、4、6、8)中的杂蛋白含量明显减少,达到了纯化的目的。
80.三、将纯化后的蛋白取一部分样品做westernblot分析,具体步骤如下:
81.(1)、以每个泳道50μg的量进行蛋白质电泳(12%sds-page),电泳后的蛋白用金斯瑞eblotl1快速湿转仪转膜转移到硝酸纤维膜上(pall corporation)。
82.(2)、膜用5%的脱脂奶粉室温封闭1小时然后用pbst洗3次。
83.(3)、用鼠抗his一抗和鼠抗人muc1一抗4℃振荡杂交过夜,次日用pbst洗膜5次后用辣根过氧化物酶(hrp)标记山羊抗鼠二抗(碧云天a0216)室温杂交1小时再用pbst洗膜5次。
84.(4)、用amersham imager 680曝光分析。
85.结果如图4所示,在预估的分子量附近(65.33kda),有一条能与两个抗体均结合的蛋白条带,由此可认为目的蛋白muc1-pdl1-igg1 fc已成功表达并纯化。
86.四、为了保持生理一致性,对步骤二纯化后的洗脱部分用透析袋进行进一步透析处理,将溶解蛋白的8m尿素溶液置换成pbs溶液。透析后的蛋白溶液用超滤管超滤浓缩。浓缩后的蛋白溶液用bca试剂盒(thermo;ih117217)进行定量分析,检测蛋白浓度。透析后的蛋白进行sds-page后考马斯亮蓝和westernblot分析,western blot一抗选用his一抗,如图5所示,透析处理后的muc1-pdl1-igg1fc重组蛋白的sds-page考马斯亮蓝染色结果及western blot his一抗结果都均有一条分子量相当的条带,蛋白制备成功。
87.采用本实施例的纯化方法,从800ml细菌培养液中获得约20mg高纯度muc1-pdl1-igg1 fc重组蛋白,用于进一步的功能鉴定。
88.实施例4 muc1-pdl1-igg1fc重组蛋白负载的肿瘤疫苗对胰腺癌的治疗作用
89.本实施例首先通过muc1-pdl1-igg1fc重组蛋白脉冲dc,获得了muc1-pdl1-igg1fc重组蛋白负载的dc(树突状细胞)疫苗、pbs负载的树突状细胞(作为对照)和pdl1-igg1fc重组蛋白(制备方法同muc1-pdl1-igg1fc重组蛋白)负载的dc(树突状细胞)疫苗(作为对照),再用于免疫小鼠,检测小鼠脾脏细胞il-2、ifn-γ和perforin的分泌,测量肿瘤的生长情况,并检测分析了抗肿瘤过程中肝肾损伤情况。
90.一、肿瘤疫苗的制备
91.方法如下:
92.1、分离c57bl/6小鼠双腿腿骨,用1ml注射器吸取pbs将小鼠骨髓从腿骨中冲出,将骨髓细胞悬液过70um细胞筛,用氯化铵裂解红细胞。用rpmi-1640大面积洗涤后,在添加10%fbs、mgm-csf(20ng/ml;peprotech)和重组小鼠il-4(10ng/ml;peprotech)的rpmi-1640中重悬骨髓细胞。每隔2天,用含有20ng/ml rmgm-csf和10ng/ml重组小鼠il-4的新鲜rpmi-1640培养基替换上清液。
93.2、所有培养物在37℃的5%湿化二氧化碳中培养。在培养的第7天于dc细胞培养基中加入纯化透析后的muc1-pdl1-igg1fc重组蛋白使其终浓度浓度为100ug/ml,使dc细胞负载重组蛋白,对照组是在dc细胞培养基中加入同等体积的pbs和同等浓度的pdl1-igg1fc蛋
白。4小时后加入细菌脂多糖使其浓度达1ug/ml(lps;sigma)继续培养1天,刺激dc成熟。
94.培养8天后,流式细胞仪(facs)测定dc特异性标记物(cd11c、cd80),结果如图7所示,从图7可知,加入pbs、pdl1-igg1fc和muc1-pdl1-igg1fc的dc细胞中cd11c、cd80的成熟度均超过60%。
95.二、肿瘤疫苗对胰腺癌的治疗作用
96.请参考图6,为使用本实施例中的制备的肿瘤疫苗免疫小鼠的流程图。
97.给6~8周的c57bl/6小鼠皮下接种稳定表达人muc1-pdl1的指数生长的小鼠胰腺癌细胞panc02(3
×
106细胞/只),一周后,将c57bl/6小鼠随机分为3组(每组8只),分别为:
98.1)、pbs-dcs对照组(即负载pbs的树突状细胞)
99.2)、pdl1-igg1fc-dcs对照组(即负载pdl1-igg1fc蛋白的树突状细胞)
100.3)、muc1-pdl1-igg1fc-dcs组(即负载muc1-pdl1-igg1fc重组蛋白的树突状细胞)
101.第0天和第7天通过尾静脉分别注射pbs-dcs(100μg/ml,2
×
105dc细胞/只)、pdl1-igg1fc-dcs(100μg/ml,2
×
105dc细胞/只)和muc1-pdl1-igg1fc-dcs(100μg/ml,2
×
105dc细胞/只)。
102.每组8只小鼠,其中4只用于检测机体细胞免疫反应,4只用于观察肿瘤曲线和生存期。
103.1、muc1-pdl1-igg1fc重组蛋白负载的肿瘤疫苗诱导小鼠脾脏细胞il-2和ifn-γ分泌
104.第二次接种6天后,分离免疫小鼠的脾脏,消化成单细胞悬浮液,然后在铺于24孔板中,然后加入pma50ng/ml,ion1ug/ml和bfa2ug/ml,培养5h后采用细胞内染色和流式细胞仪检测小鼠脾脏中的t细胞。
105.所用抗体来自bdbiosciences,包括fitc抗鼠、cd3、pe抗鼠cd4、pe抗鼠cd8a、pe-cy7抗鼠il-2、apc抗鼠ifn-γ、apc抗鼠perforin。固定活性染料是从thermofisher购买的。所有数据收集在bdfacs/verse(中国广东省广州市广州医科大学呼吸疾病国家重点实验室的bdfacs/verse流式细胞仪)上,并使用flowjo软件进行分析。
106.结果如图8和图9所示,与pbs-dcs对照组和pdl1-igg1fc-dcs对照组对比,muc1-pdl1-igg1fc-dcs免疫的小鼠脾细胞中cd4
+
和cd8
+
都有显著增加。cd4
+
t细胞分泌的ifn-γ和il-2及cd8
+
t细胞分泌的ifn-γ和perforin的频率均有显著增加(图10~图11和图12~图13)。
107.这些结果清楚地表明,muc1-pdl1-igg1fc负载的肿瘤疫苗可促进ifn-γ、il-2和perforin的产生,并产生良好的ctl诱导能力。
108.2、muc1-pdl1-igg1fc重组蛋白负载的肿瘤疫苗可显著抑制肿瘤生长
109.为了验证muc1-pdl1-igg1fc重组蛋白负载的肿瘤疫苗的效力,进行了如下实验:
110.第二次接种6天后,肿瘤细胞接种建立,每隔6天用卡尺测量一次肿瘤大小,监测肿瘤生长,并计算生长曲线。
111.肿瘤体积计算如下:0.5*(最长直径)
×
(最短直径)2112.结果如图14和图15所示,与pbs-dcs对照组和pdl1-igg1fc-dcs对照组相比,接种muc1-pdl1-igg1fc-dcs组能更有效地延缓肿瘤生长(图14)且提高了荷瘤小鼠的存活率,延长了小鼠的生存期(图15)。
113.这些数据表明,与传统的dc靶向蛋白疫苗相比,本发明的muc1-pdl1-igg1fc重组蛋白肿瘤疫苗可能是一种更有效的治疗性疫苗,muc1提高了t细胞靶向杀伤肿瘤的作用,且pdl1和igg1fc辅助增强了肿瘤疫苗的作用。
114.3、muc1-pdl1-igg1fc重组蛋白负载的肿瘤疫苗抗肿瘤过程中肝肾损伤检测分析
115.为了进一步验证muc1-pdl1-igg1fc重组蛋白负载的肿瘤疫苗的抗肿瘤作用是否能损伤小鼠的肝、肾组织细胞,从muc1-pdl1-igg1fc-dcs、pdl1-igg1fc-dcs和pbs-dcs免疫后的小鼠分离出肝脏和肾脏,放入异戊烷中,用液氮快速冷冻。组织切片按照标准方案进行。
116.简单地说,冷冻组织在-20℃下被切割(5μm厚),然后立即转移到保存在干冰上并在-80℃下储存的微型滑盒中。这些滑片被风干,用福尔马林固定,然后用石蜡包埋。h&e染色在广州医科大学的病理中心完成。
117.结果显示,切片分析的h&e染色未在肝脏和肾脏的细胞质中检测到阳性标记(如图16所示),说明本发明的muc1-pdl1-igg1fc重组蛋白负载的肿瘤疫苗诱导有效抗肿瘤ctl反应,不会攻击邻近免疫组织,在抗肿瘤过程中未对肝肾造成损伤。
118.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
119.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1