CynanbungeigeninC的衍生物CBC-1及其制备方法和应用
cynanbungeigenin c的衍生物cbc-1及其制备方法和应用
技术领域
1.本发明属于药物技术领域,具体涉及到cynanbungeigenin c的衍生物cbc-1的制备方法,以及该衍生物及其药物组合物在制备hegdehog信号通路gli抑制剂和在制备治疗结直肠癌药物中的应用。
背景技术:
2.hedgehog信号通路主要由shh配体蛋白、12次跨膜蛋白patched(ptch)、跨膜信号转导蛋白smoothened(smo)以及核转录因子glioma-associated oncogene(gli)等组成。当hedgehog配体与ptch1结合,ptch1解除对smo蛋白的抑制,smo蛋白被磷酸化激活并转运至初级纤毛,gli释放促使glia入核,从而激活靶基因的转录和表达;反之,在没有hedgehog配体存在时,ptch抑制smo蛋白的纤毛转移,促使gli被磷酸化后变成阻遏子glir,进入核内从而阻断靶基因的转录。由此可见,hedgehog信号通路小分子抑制剂的发现为治疗hedgehog信号通路异常激活相关疾病提供一条切实可行的策略。
3.hh信号通路在结直肠癌的发生和发展中起着重要作用,并参与结肠上皮细胞的发展和修复。此前的研究表明,hh信号通路在结直肠癌中被激活,hh信号通路的mrna和蛋白在结直肠癌细胞株中高表达。大多数研究认为,结直肠癌中hh-smo-gli的高表达促进肿瘤细胞存活和转移,hh信号可被结直肠癌中的经典信号(通过smo)激活。它也可以被非经典信号激活(通过ras/raf通路)。然而,经典和非经典hh信号通路均与gli表达密切相关。gli基因介导hh信号转导应答的转录调节,这些基因也被致癌信号通路激活。在gli水平上,hh信号通路的失活导致广泛的细胞死亡,而不同类型的结直肠癌细胞系中hh信号通路的激活高度不一致,这表明hh信号通路的功能可能在不同的结直肠癌类型中存在差异。据报道,与hedgehog信号通路相关的成分shh、ptch1、smo和gli在结肠增生性息肉、腺瘤和腺癌中过表达。由此可见,靶向抑制hh信号通路可为结直肠癌的治疗提供一种新的方法和思路。
4.目前hh通路抑制剂的研究主要靶向该信号通路的两个重要分子:一个为靶向hh通路上游的smo,另一个是其下游的gli。其中smo抑制剂进展较为顺利,已有三个药物vismodegib(gdc-0449,2012年)、sonidegib(lde225,2015年)和glasdegib(2018年)被fda批准上市,前两者用于治疗基底细胞癌,后者用于治疗急性髓系白血病。但是,临床已发现多例由于smo突变(d473h,w535l)引起构象重排、药物和蛋白结合位点破坏介导的获得性耐药病例。究其原因,其一、smo抑制剂是作用于hh信号通路smo蛋白从而抑制整条通路,属于经典hh信号通路,对其下游其他分子如sufu、gsk3β、gli等突变引起的激活并不能达到理想的抑制效果;其二、通常在一种特定的癌症类型中经典和非经典hh信号激活共存,不依赖smo的非经典激活的肿瘤对smo抑制剂不敏感。另外,基于hh信号通路在多种肿瘤中都存在过度激活,为拓展hh通路抑制剂的更多适应症,已上市smo抑制剂药物在以胰腺癌、小细胞肺癌、转移性结直肠癌、前列腺癌、黑色素瘤为适应症的临床研究也在广泛开展中,但尚无确切结果。
5.gli是hh通路最下游的分子,在许多人类肿瘤主要表现为glil高表达,因此被认为
是肿瘤治疗的靶分子。现已有多个gli抑制剂处于临床前或临床研究阶段,如gant-58、gant-61和ato等。这些gli抑制剂对smo抑制剂耐药的smo突变肿瘤株仍具有较好的抑制作用。然而,gant61在生理条件下不稳定,可以迅速水解成无hh信号通路抑制活性的醛类物质(gant61-a)。另一个gli抑制剂ato可在体外抑制表达特异性smo突变体的细胞,还可通过阻止纤毛积累和降低gli的稳定性从而抑制hh通路。目前认为ato通过直接作用于gli锌指结构域来抑制gli转录,降低下游靶基因的表达,从而对基底细胞癌、恶性胸膜间皮瘤和横纹肌肉瘤等各种肿瘤发挥抑制作用,但是由于毒性限制了ato在临床上的使用。因此,发现新的活性更强、安全性更强的gli抑制剂可能会收获更好的临床治疗效果。
6.化合物cynanbungeigenin c是本发明人之前的研究中从泰山白首乌中分离得到的具有hedgehog信号通路抑制活性和抗肿瘤作用的化合物。迄今,现有的技术中没有这种化合物衍生物的报道,没有这种化合物的衍生物及其组合物作为hedgehog信号通路gli抑制剂的报道,也没有这种化合物衍生物及其组合物作为治疗结直肠癌药物的报道。
技术实现要素:
7.本发明的目的在于提供一类新的具有药用价值的cynanbungeigenin c的衍生物cbc-1及其药物组合物,其制备方法,以及该衍生物cbc-1及其药物组合物在制备hegdehog信号通路gli抑制剂和在制备治疗结直肠癌的药物中的应用。
8.为了实现本发明的上述目的,本发明提供了以下的技术方案:
9.结构式(i)所示的cynanbungeigenin c衍生物cbc-1,
[0010][0011]
cynanbungeigenin c衍生物cbc-1在制备hedgehog信号通路gli抑制剂中的应用。
[0012]
cynanbungeigenin c衍生物cbc-1在制备抗结直肠癌药物中的应用。一种药物组合物,其包括cynanbungeigenin c衍生物cbc-1和药学上可接受的载体或赋型剂。
[0013]
所述药物组合物在制备hedgehog信号通路gli抑制剂中的应用。
[0014]
所述药物组合物在制备抗结直肠癌药物中的应用。
[0015]
制备结构式(i)所示cynanbungeigenin c衍生物cbc-1的方法,以化合物cynanbungeigenin c为反应原料,合成cbc-1。
[0016]
所述的cynanbungeigenin c的衍生物cbc-1的制备方法,包括以下步骤:
[0017]
cynanbungeigenin c、4-甲基-1-哌嗪乙酸、n,n-二异丙基乙胺、2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯、二氯甲烷,44~52℃下搅拌反应,反应结束后分离,得到cynanbungeigenin c的衍生物cbc-1。
[0018]
所述的cynanbungeigenin c、4-甲基-1-哌嗪乙酸、n,n-二异丙基乙胺、2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯的摩尔比为0.05~0.3:0.05~0.3:0.1~0.6:0.05~0.36;最优选为0.1mmol:0.11mmol:0.3mmol):0.11mmol。
[0019]
最优选地,根据所述的制备方法,其中cbc-1的合成方法为:cynanbungeigenin c(0.1mmol),4-甲基-1-哌嗪乙酸(0.11mmol),n,n-二异丙基乙胺(0.3mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.11mmol),10ml二氯甲烷,48℃下搅拌反应至tlc检测不到原料,反应结束后冷至室温,减压回收溶剂,经制备型高效液相色谱仪分离纯化,得到衍生物cbc-1。
[0020]
本发明的化合物cbc-1用作药物时,可用于作为hedgehog信号通路gli抑制剂,用于制备治疗结直肠癌的药物。本发明还可以以该化合物cbc-1为有效成分与药学上可接受的载体或者/其他抗结直肠癌活性成分形成药物组合物;该药物组合物在制备治疗抗结直肠癌的药物中的应用。
[0021]
本发明的化合物cbc-1和抗结直肠癌活性成分联合在制备治疗结直肠癌的药物组合物中的应用,所述的抗结直肠癌活性成分为奥利沙铂、5-氟尿嘧啶、伊利替康中的一种或两种以上。
[0022]
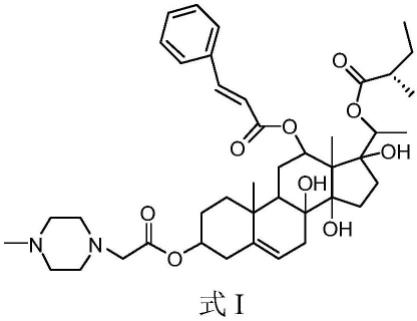
本发明所述的治疗结直肠癌的药物组合物,由该化合物与药学上可接受的载体制备的药物剂型包括片剂、胶囊剂、口服液、针剂、注射用冻干剂或粉针剂等。
[0023]
本发明化合物cbc-1用作药物时,可以直接使用,或者以药物组合物的形式使用。该药物组合物含有0.1-99.9%,优选为0.5-90%的本发明化合物,其余为药物学上可接受的,对人和动物无毒和惰性的可药用载体和/或赋形剂。
[0024]
与现有技术相比,本发明具有如下优点:
[0025]
本发明采用结构新颖的小分子化合物cynanbungeigenin c的衍生物cbc-1作为hedgehog信号通路gli抑制剂,可用于制备治疗结直肠癌的药物,能显著抑制hedgehog通路的激活,具有优异的抗结直肠癌活性,并且与其他抗结直肠癌活性成分联合,能够更好地治疗结直肠癌,具有广阔的应用前景。
附图说明
[0026]
图1为cbc-1结构式;
[0027]
图2为cbc-1和vismodegib对hedgehog信号通路抑制作用;
[0028]
图3不同浓度的cbc-1(5、10、20、40μm)和gant 61 20μm在ht29细胞上作用24h或48h后细胞内ptch,smo,gli,shh mrna水平的表达(*p《0.05,**p《0.01,***p《0.001.n=3);
[0029]
图4用不同浓度的cbc-1(5、10、20和40μm)和gant61 20μm刺激ht-29细胞24h或48h,采用western blotting检测shh、smo和gli1蛋白表达水平;
[0030]
图5cbc-1对ht29细胞来源的异种移植肿瘤生长的抑制作用。(a)图像显示了cbc-1治疗组和对照组第16天的肿瘤。(b)图像显示了cbc-1治疗组和对照组之间肿瘤体积的差异。(c)cbc-1治疗组与对照组第16天肿瘤重量差异有统计学意义(与对照组比较,*p《0.05,**p《0.01,***p《0.001);
[0031]
图6免疫组化显示不同组肿瘤组织中shh、smo、gli1、ptch水平,显示具有代表性的免疫组化图像。
具体实施方式
[0032]
以下结合实例进一步对本发明实质内容进行说明,但本发明的内容并不局限于此。
[0033]
实施例1:化合物cbc-1的制备和结构表征
[0034]
cbc-1的制备方法:cynanbungeigenin c(0.1mmol),4-甲基-1-哌嗪乙酸(0.11mmol),n,n-二异丙基乙胺(0.3mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.11mmol),10ml二氯甲烷,48℃下搅拌反应至tlc检测不到原料,反应结束后冷至室温,减压回收溶剂,经制备型高效液相色谱仪分离纯化,得到衍生物cbc-1(67.1mg,得率92%);
[0035]
cbc-1的结构数据:淡黄色粉末,熔点135.9-137.9℃。hresi-ms(positive)m/z:737.4398[c
42h60
n2o9+h]
+
,计算值:737.4377。
[0036]
13
c nmr(c5d5n,125mhz),δ:38.9(c-1),28.0(c-2),75.2(c-3),38.8(c-4),138.5(c-5),121.0(c-6),35.3(c-7),74.7(c-8),46.5(c-9),37.5(c-10),25.7(c-11),74.7(c-12),57.3(c-13),88.0(c-14),34.7(c-15),34.3(c-16),89.2(c-17),11.7(c-18),18.4(c-19),74.6(c-20),15.8(c-21),170.5(c-1
′
),60.2(c-2
′
),55.8(c-4
′
,8
′
),53.4(c-5
′
,7
′
),49.3(c-9
′
),167.6(c-1
″
),121.0(c-2
″
),144.5(c-3
″
),136.3(c-4
″
),129.0(c-5
″
,9
″
),129.8(c-6
″
,8
″
),131.0(c-7
″
),175.5(c-1
″′
),44.4(c-2
″′
),26.3(c-3
″′
),12.3(c-4
″′
),16.8(c-5
″′
).
[0037]1hnmr(c5d5n,500mhz),δ:4.92(1h,m,h-3),5.37(1h,m,h-6),5.35(1h,m,h-12),2.10(3h,s,h-18),1.39(3h,s,h-19),5.17(1h,brs,h-20),1.38(3h,brs,h-21),3.38(2h,s,h-2
′
),2.52(4h,m,h-4
′
,8
′
),2.46(4h,m,h-5
′
,7
′
),2.17(3h,s,h-9
′
),6.89(1h,d,j=15.0hz,h-2
″
),8.12(1h,d,j=15.5hz,h-3
″
),7.78(2h,d,j=7.5hz,h-5
″
,9
″
),7.43(2h,d,j=7.5hz,h-6
″
,8
″
),7.40(1h,d,j=7.0hz,h-7
″
),0.90(3h,t,j=7.0hz,h-4
″′
),1.14(3h,d,j=7.0hz,h-5
″′
).
[0038]
上述的表征数据证明,化合物cbc-1的结构可鉴定为3-o-(2-(4-甲基哌嗪-1-基)乙酰基)cynanbungeigenin c,如图1所示。
[0039]
实施例2:
[0040]
按实施例1的方法制得化合物cbc-1,按常规方法制成注射液。
[0041]
实施例3:
[0042]
按实施例1的方法制得化合物cbc-1,按常规方法制得粉针剂。
[0043]
实施例4:
[0044]
按实施例1的方法制得化合物cbc-1,与赋形剂按一定比例混合,制成粉剂。
[0045]
实施例5:
[0046]
按实施例1的方法制得化合物cbc-1,与赋形剂按一定比例混合,制粒压片。
[0047]
实施例6:
[0048]
按实施例1的方法制得化合物cbc-1,按常规口服液制法制成口服液。
[0049]
实施例7:
[0050]
按实施例1的方法制得化合物cbc-1,按其与赋形剂按一定比例混合,制成胶囊或颗粒剂或冲剂。
[0051]
为了更好地理解本发明的优异性,以下将用本发明的化合物cbc-1的药理作用结果即试验例子来说明,但并不以此来限定本发明。
[0052]
实施例8:化合物cbc-1抗人结直肠癌增殖的活性研究
[0053]
8.1实验方法
[0054]
培养人结直肠ht-29、hct116、sw480细胞至对数生长期,96孔板中每孔接入8
×
103个细胞,100μl/孔。在37℃,5%co2培养箱中孵育24h后,培养至细胞有80%融合,control组加入rpmi 1640培养基,给药组每孔加入不同浓度的cbc衍生物(100μl/孔,dmso溶解,rpmi 1640稀释),孵育24h。吸除每孔液体,并加入新鲜的100μl rpmi 1640培养基以及10μl cck-8工作液,在37℃、5%co2条件下培养细胞2h,用酶标仪在450nm处测量od值。按公式1计算抑制率(%),以ndst软件,bliss法求出ic
50
。
[0055]
公式1:抑制率(%)=(1-(test-blank)/(ctrl-blank))
×
100%
[0056]
8.2实验结果
[0057]
cbc-1对ht29,hct116,sw480细胞的ic
50
分别为7.13
±
0.79μm,23.33
±
1.67μm,和15.31
±
1.37μm。
[0058]
实施例9:化合物cbc-1hh信号通路活性的测定
[0059]
9.1实验方法
[0060]
9.1.1 shh-lightⅱ细胞复苏、培养与传代
[0061]
将shh-lightⅱ细胞从液氮中取出,放入37℃水浴至完全溶解,转移至15ml离心管,加入9ml cm加盖混合均匀(不用移液枪吹打),1000rpm持续离心5min,弃上清,加入1ml cm,轻轻吹打均匀,加入25cm2细胞培养瓶(含5ml cm),放入二氧化碳培养箱。
[0062]
9.1.2shh-lightⅱ细胞的培养与传代,接板
[0063]
换液:复苏24h后更换一次cm,之后每过48h更换一次cm;传代:倒掉原培养基并用移液枪吸除残留液体,加入含edta的0.25%胰酶1ml,37℃消化2min44 s,加入5ml cm终止消化;吹打均匀后转移至15ml离心管内,1000rpm持续离心5min;倒掉上清液后加入1ml cm吹打均匀,接入75cm2细胞培养瓶中扩大培养。
[0064]
9.1.3shh-lightⅱ细胞传代与接板
[0065]
倒掉原培养基并用移液枪吸除残留液体,加入含edta的0.25%胰酶2ml,37℃消化3min,用移液枪吹打底部未消化完全细胞团,加入8ml cm终止消化;吹打均匀后转移至15ml离心管内,1000rpm持续离心5min;倒掉上清液后加入2ml cm吹打均匀,计数,调整细胞密度为5
×
103个/ml,接入96孔板,每孔加入200μl,待进行活性测试,剩下细胞接回原细胞培养瓶,继续培养。
[0066]
9.1.4药物加样
[0067]
待细胞培养至细胞融合80%,分为三组:blank组、sag组(即control组)、cbc-1组、阳性药vismodegib组。用少量dmso配置所有药物母液,用dmem培养基稀释cbc-1浓度为0.156μm,0.625μm,2.5μm,10μm,sag浓度为500nm,vismodegib浓度为200nm。吸除96孔中原有液体,按照以下加样方式加样:
[0068]
①
blank组:200μl dmem培养基
[0069]
②
sag组:100μl dmem培养基+100μl sag
[0070]
③
cbc-1组:100μl dmem培养基+50μl sag+50μl cbc-1
[0071]
④
vismodegib组:100μl dmem培养基+50μl sag+50μl vismodegib处理后的细胞继续放入37℃,5%co2培养箱培养。
[0072]
9.1.5双荧光素酶测定
[0073]
细胞培养48h后,弃除每孔培养基,96孔板中加细胞裂解液80μl/孔,室温下裂解15min,用移液枪吹打使细胞充分裂解,然后转移至白色底透的96孔酶标板。然后按照dual-reporter assay system(promege,e1910)的说明测定双酶活性:
①
luciferase assay reagent ii(lar ii)的配制:测定底物(冻干粉)加入缓冲液ii 10ml;
②
stop&glo reagent配制(临用前配制):stop&glo substrate以50倍稀释。然后取出96孔细胞板,吸除培养液,每个孔加细胞裂解液20μl,37℃裂解15min,使细胞充分裂解,通过synergy-2slfpa全波长多功能酶标仪测量化学发光值,首先测量每孔的基底吸收值,再加入溶液
①
100μl/孔,测定萤火虫光吸收值;最后加入溶液
②
100μl/孔,测量海肾荧光吸收值。保存数据。
[0074]
按公式1计算抑制率(%),以ndst软件,bliss法求出ic
50
。
[0075]
公式1:抑制率(%)=(1-(test-blank)/(ctrl-blank))
×
100%
[0076]
9.2结果
[0077]
利用含有双荧光素酶的gli报告基因的shh-light ii细胞,双荧光素酶实验测定出cbc-1对hh信号通路的抑制作用。如图2所示,结果表明cbc-1对hh信号通路具有很好的抑制作用且调控依赖浓度梯度,ic
50
=1.3μm。
[0078]
实施例10:cbc-1对结直肠癌细胞hh通路mrna水平的调控
[0079]
10.1实验方法
[0080]
10.1.1ht29细胞接板与加药
[0081]
ht29细胞培养至对数生长期,进行传代,调整细胞浓度为5
×
104个/ml,每孔0.5ml的细胞混悬液接入24孔板。培养至细胞融合至80%左右,吸除24孔板中原有培养基,用rpmi 1640培养基配置如下药物浓度,分为五组进行处理:
①
control组;
②
cbc-1 5μm;
③
cbc-1 10μm;
④
cbc-1 20μm;
⑤
cbc-1 40μm;
⑥
gant 61 20μm,处理后的细胞继续放在37℃,5%co2培养箱中培养。
[0082]
10.1.2提取rna
[0083]
24h后每孔吸除原液,加冰pbs 0.5ml/孔洗2次,每孔吸除残留的pbs后,每孔加入0.5ml trizol,吹打几次,上下为复孔合并转移1.5ml ep管内,室温下放置15min,使核酸蛋白复合物完全分离;之后每管加200μl氯仿,盖好盖子,上下剧烈摇晃5s,涡旋混匀15s,室温下放置5min,再13400g 4℃离心15min,分成三相:粉色有机相,中间层和上层无色水层,吸取上清液约400μl至新预冷的1.5ml ep管;每管加入等体积1:1异丙醇,约400μl,上下摇晃,充分混匀,室温下放置5min,再13400rpm 4℃离心10min,倒出每管上清液,倒置在面巾纸上蘸干残留液体(管侧或管底形成胶状沉淀);每管加入1ml 75%无水乙醇(用depc水配置)洗涤沉淀,轻轻颠倒混合,室温下放置5min,再13400rpm 4℃离心5min,倒掉每管上清液(注意不要倒出沉淀),倒置在面巾纸上蘸干残留液体,剩下的再次13400rpm 4℃速离1min,用移液枪吸除残留液体,敞开盖子在超净台晾干5min;每管加入20μl depc水,指弹,速离,放入60℃水浴10min,充分溶解,取出后速离,转移至200μl的小离心管内保存,放-20℃冰箱保存,提前取出3μl进行rna浓度测定。rna浓度的测定:以depc水为空白对照,测量样品组的
rna浓度。
[0084]
10.1.3去基因组dna实验
[0085]
将模板rna冰上解冻,5
×
gdna eraser buffer,fq-rt primer mix,10
×
king rt buffer,rnase free h2o室温下解冻,解冻后放冰上。使用前将配成预混液,涡旋振荡混匀,速离一下。全称冰上操作。配置预混液:rnase free h2o加上total rna样品总体积为8μl混匀后加入2μl 5
×
gdna buffer。混合均匀后速离,42℃,孵育3min,之后放4℃冰浴。
[0086]
10.1.4反转录
[0087]
配置反转录体系预混液,混合均匀,加至上述去除基因组dna的样品中,10μl/管,充分混匀,速离,42℃,孵育15min;95℃,孵育3min,之后放4℃冰浴,得到cdna。
[0088]
10.1.5 real-time pcr(rt-pcr)反应
[0089]
每孔加入预混液16.8μl、引物预混液1.2μl和cdna模板2μl。在abi 7500 fast real-time pcr仪器上设定反应体系20μl,95℃,15min预热;95℃,10s变性;60℃,32s退火/延伸,共40个循环。(共计2h。)结束后,数据存储并用abi 7500fast软件对实验结果进行处理。
[0090]
10.2实验结果
[0091]
使用不同浓度的cbc-1(5、10、20、40μm)和gant 61 20μm作用24h或者48h,结果如图3所示。结果表明,作用48h时,cbc-1明显下调人结直肠细胞ht29中hh信号通路中shh,smo,gli,ptch的mrna的表达水平,并呈现出剂量依赖性(*p《0.05,**p《0.01,***p《0.001.n=3)。与对照组相比,cbc-1 20μm作用48h时,shh,smo,gli,ptch基因的mrna下调水平降至50%以下(***p《0.001);cbc-1 20μm时对shh,smo,gli,ptch基因下调呈现出与gant 61 20μm类似的水平。除此之外,作用24h时,cbc-1对shh,smo基因的mrna水平的调控也体现出剂量依赖性,但是只有浓度到达20μm以上时,才下调gli,ptch基因的mrna水平。
[0092]
实施例11:cbc-1对结直肠癌细胞hh通路蛋白水平的调控
[0093]
11.1实验方法
[0094]
11.1.1 ht29细胞的接板与给药
[0095]
ht29细胞培养至对数生长期,进行传代,调整细胞浓度为5
×
105个/ml,每孔2ml的细胞混悬液接入6孔板。培养至细胞融合至80%左右,吸除6孔板中原有培养基,用rpmi 1640培养基配置如下药物浓度,分为五组进行处理:
①
control组;
②
cbc-1 5μm;
③
cbc-1 10μm;
④
cbc-1 20μm;
⑤
cbc-1 40μm;
⑥
gant 61 20μm,处理后的细胞继续放在37℃,5%co2培养箱中培养。
[0096]
11.1.2 western blot法研究蛋白表达
[0097]
(1)蛋白提取:
[0098]
以100
×
蛋白酶抑制剂:ripa强细胞裂解液=1:99的比例配置细胞裂解液,涡旋混匀,放于冰上;将6孔板从co2培养箱取出放冰上,倒掉cm,冷0.5ml pbs/孔洗2遍,用移液枪吸除每孔残留液体,加步骤a配好的裂解液100-200μl/孔,用细胞刮刀将每孔的细胞刮起,用移液枪转移至预冷的1.5ml离心管,放在冰上,摇床上振荡裂解60min;60min后,4℃,13000rpm,离心30min;将上清液转移至6个新1.5ml ep管内;-80℃存放。
[0099]
(2)bca法测定蛋白浓度和上样量计算:上述的蛋白样品溶液用pbs10倍稀释后,按照碧云天bca试剂盒说明书方法做出蛋白标准曲线并检测蛋白浓度。样品上样量为20μg/
孔,计算每孔上样体积。
[0100]
(3)蛋白样品变性:蛋白样品与5
×
loading buffer以4:1比例混合,混合均匀后,100℃煮沸5min。
[0101]
(4)制胶(胶厚度为1.5mm)
[0102]
(5)sds-page(聚丙烯酰胺)凝胶电泳:恒压80v,基线超过浓缩胶和分离胶的界限时调成110v,至接近底部1cm时结束电泳。
[0103]
(6)转膜:剪一张与胶略大一点的pvdf膜,大小约长
×
宽=8
×
5cm;在ar级甲醇中活化5min;将多张滤纸放入转膜液中浸润;海绵和转膜夹放入托盘,加适量转膜液浸泡,取冰待用。将转膜夹黑色板铺在底层,依次放上1个海绵、3层滤纸、胶、pvdf膜、3层滤纸、1个海绵,压住转膜夹白色板(每层添加时除去气泡),固定好白色夹子。转膜槽内加满转膜液后,转膜夹的白色夹子朝上,黑色板朝前,将转膜夹插入同样黑色板朝前的转膜装置里,冰盒放在黑色板前面,盖上盖子,将整个转膜槽放入冰浴中,恒流300ma,120min。
[0104]
(7)封闭:将pvdf膜用5%脱脂奶粉(1
×
tbst配)封闭,60rpm摇床室温孵育2h;
[0105]
(8)孵育一抗:弃封闭液,用1
×
tbst洗膜3次,10min/次,将膜沿50kda的marker线剪成2块:第1块膜,加入smo抗体(86kda),1:200稀释5%bsa稀释,4℃摇床过夜;第2块膜,加入gapdh抗体(1:1000稀释)4℃摇床过夜。
[0106]
(9)孵育二抗:回收一抗,洗膜,用tbst洗膜5次(10min/次),用hrp标记的山羊抗小鼠igg(h+l)二抗(1:1000用5%脱脂奶粉稀释)60rpm的摇床上室温孵育2h;
[0107]
(10)洗膜:废弃二抗,用tbst洗膜3次(10min/次)
[0108]
(11)显影:配制显影液,将碧云天显影液a:b=1:1混合均匀,室温下放置1min,用bio-rad chemidoc-xrs+化学发光成像系统显影并拍摄强光照片。
[0109]
11.2结果
[0110]
在证实cbc-1对ht29结直肠癌细胞抑制作用与hh信号通路密切相关以及调控hh信号通路关键基因的mrna水平之后,我们进行了western blot分析,研究相应蛋白的表达水平。图4用不同浓度的cbc-1(5、10、20和40μm)和gant61 20μm刺激ht-29细胞24h或48h,采用western blotting检测shh、smo和gli1蛋白表达水平。每个实验都进行了3次独立重复实验。数据以平均值
±
sd表示。与对照组相比,*p《0.05,**p《0.01,and***p《0.001。如图4所示,cbc-1以浓度依赖的方式显著抑制shh、smo和gli1蛋白的表达,48h的调控效果好于24h。
[0111]
实施例12:cbc-1对体内结直肠癌hh通路的调控
[0112]
12.1实验方法
[0113]
人结直肠癌细胞ht29培养至对数生长期,调整细胞密度为5
×
106个/ml,充分混匀后,皮下注射至裸鼠(n=20)腋下。游标卡尺每日测量肿瘤的长和宽,按照体积=(长
×
宽2)/2的公式计算肿瘤体积。当肿瘤体积达到约20mm3时,将裸鼠随机分为两组:对照组(给予生理盐水,n=9)和给药组(cbc-1,50mg/kg,n=9)。按照分组,每日腹腔注射生理盐水和cbc-1,连续操作16天,每天记录肿瘤的体积,绘制肿瘤曲线。末次给药24h后处死老鼠,无菌切除肿瘤组织,对所有的裸鼠进行解剖,对所有裸鼠的肿瘤的组织称量肿瘤重量和体积,记录并计算平均值。肿瘤固定在缓冲的4%多聚甲醛溶液中,并包埋在石蜡中。最后取石蜡切片,苏木精-伊红染色(h&e)。对标本进行免疫组化(ihc)分析。
[0114]
12.2实验结果
[0115]
12.2.1 cbc-1对ht29细胞来源的异位移植肿瘤的生长有抑制作用
[0116]
结果如图3-1所示,16天后取出裸鼠皮下的肿瘤组织,与每天腹腔注射的生理盐水的对照组组(n=9)相比,每天腹腔注射给药cbc-1 50mg/kg的实验组(n=9)的肿瘤更小,说明cbc-1 50mg/kg时可以显著性抑制ht29细胞来源的异位移植肿瘤的生长(p《0.001),抑制率为68%。如图5b所示,从肿瘤曲线图中可看出,对照组的肿瘤从第6天开始生长速度加快,而给药cbc-1 50mg/kg时可以明显抑制肿瘤体积(p《0.05),抑制率为58%。第8天,对照组肿瘤增长加速,给药组对肿瘤有显著抑制效果(p《0.01)。第10-16天,cbc-1 50mg/kg对肿瘤有更为明显的抑制效果(p《0.001)。第16天处理完裸鼠24h后,对所有的裸鼠进行解剖,称量对照组和cbc-1 50mg/kg组的肿瘤重量,如图5c所示,给药cbc-1 50mg/kg的组的肿瘤重量明显小于对照组(p《0.001),结果与肿瘤体积曲线和肿瘤块大小结果一致。综上所述,cbc-1对ht29细胞来源的异位移植肿瘤的生长有显著的抑制效果。
[0117]
12.2.2 cbc-1下调ht29细胞来源的异位移植肿瘤中的hh信号通路
[0118]
在本文先前的研究中发现,cbc-1在细胞水平上可以抑制三种人结直肠癌细胞株的生长以及调控人结直肠细胞株ht29细胞中的hh信号通路的mrna水平和蛋白水平。在本章研究中,我们将取出的肿瘤组织固定在缓冲的4%多聚甲醛溶液中,并包埋在石蜡中。最后取石蜡切片,苏木精-伊红染色(h&e)。对标本进行免疫组化(ihc)分析。图6免疫组化显示不同组肿瘤组织中shh、smo、gli1、ptch水平,显示具有代表性的免疫组化图像。数据以平均值
±
sd表示。与对照组比较,*p《0.05,**p《0.01,and***p《0.001。如图6a和e所示,cbc-1 50mg/kg作用于ht29细胞来源的异位移植肿瘤时,显著性下调体内shh蛋白的表达量(p《0.01),下调了54.26%。如图6b,c和e所示,cbc-1 50mg/kg作用下,异位移植肿瘤中的smo和gli蛋白的表达量也显著性下调(p《0.05),其下调率分别为33.88%和28.09%。图6d和e显示cbc-1 50mg/kg作用下,异位移植肿瘤中ptch蛋白的表达量也也显著性下调(p《0.01)。综上所述,cbc-1在ht29细胞来源的异位移植肿瘤模型即体内水平也下调hh信号通路。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1