一种多粘芽孢杆菌及其微生物固体菌剂的制备方法与应用
1.本发明涉及生物防治技术领域,具体来说,涉及一种多粘芽孢杆菌及其微生物固体菌剂的制备方法与应用。
背景技术:
2.人参在东北地区,尤其是以吉林为代表的主产区,作为道地药材常占据着药材交易的主流地位。然而,人参的产量和品质受病害流行和生长季节气候的影响较大。近几十年来,药用植物特别是人参的种植中,土传病原真菌引起的疾病问题日益严重并已经影响人参的产量和质量,造成了难以估量的经济损失。影响人参的土壤传播疾病主要包括锈腐病、灰霉病和根腐病等。其中毁灭柱抱菌是引起人参锈腐病的病原菌。它是一种毒性病原体,可以感染许多植物物种,导致严重减产,并通过受污染的植物残基、种子和土壤传播。毁灭柱孢菌还会产生对人类和动物有害的真菌毒素。因此,研究控制该病原菌的方法至关重要。
3.在食品、医药和园艺作物中过度使用化学农药会导致土壤中有害的化学残留物并成为环境污染源。因此,识别和开发适用于可持续生产系统的环保替代疾病控制方法一直是相当多研究的重点。由于其有效性、对动物和人类的相对安全性以及适用于生态农业方法,生物控制是管理土壤传播疾病最具前景的替代策略之一。在这方面,细菌属芽孢杆菌已被证明是一种有效的生物防治剂,因为它能够轻松定植植物,生长迅速,并表现出高度的抗病性。由于上述因素,芽孢杆菌种类一直是生物防治研究的重点。近年来,以芽孢杆菌为主的微生物菌剂因其环境友好、促进植物生长且抗病能力强等特点已成为当前国内外防治植物土传病害的研究热点,具有较为广阔的应用前景。
4.经过查阅文献梳理发现,现有微生物菌剂的制备工艺存在一定的缺陷,具体如下:
5.专利号cn113816801a中涉及到的一种抑制土传病害土壤改良剂的制备方法,该方法将有机基质进行粉碎处理,得到粉碎基质后,将所述粉碎基质按照比例混合,得到混合基质;将所述混合基质与助剂混合,并调节含水率为50~70%,得到发酵底物;在所述发酵底物内接种由解淀粉芽孢杆菌、多粘芽孢杆菌、巨大芽孢杆菌、哈茨木霉和淡紫拟青霉混合而成的复合微生物固体菌剂,在室温条件下发酵腐熟,得到腐熟物料,将所述腐熟物料与营养元素混合均匀,得到抑制抑制土传病害土壤改良菌剂。但是该方法存在成本较大且操作复杂的缺点。
6.专利号cn113439759a中涉及到一种络铜柠铜多粘芽孢杆菌根部杀菌组合物及其制备方法,该方法向封闭式反应釜中加入氨水,在搅拌下依次加入络氨铜、柠檬酸、硫酸铜、水杨和edta,待液体清澈透明且温度降低至25℃以下后,继续向封闭式反应釜中加入多粘芽孢杆菌,再搅拌30分钟后得到杀菌组合物成品。但是该方法存在费时费工、工作环境危险的缺点。
7.专利号cn111302860a中涉及到一种预防柑橘溃疡病的特种肥的制备方法,该方法将一水硫酸镁、五水硼砂、解淀粉芽孢杆菌菌粉、ltpp03菌粉等在搅拌机中混匀后得混合物;又将硫酸铵、氮钾肥等辅料在搅拌机中搅拌,期间向其中加入腐植酸原粉、混合物和加
入水溶性防结粉,混匀后得到半成品,将半成品包装后得到特种肥。但是该方法存在抑菌种类少且环境易污染的缺点。
8.专利号cn110540461a中涉及到一种防治草莓炭疽病的复合有益微生物菌发酵液的制备方法,该方法将解淀粉芽孢杆菌、枯草芽孢杆菌、固氮芽孢杆菌、多粘芽孢杆菌进行三级培养发酵后按1:1:1:1的比例等体积混合制成复合成有益微生物菌发酵液,又将复合有益微生物菌发酵液和糖蜜搅拌混匀,向其中加入腐植酸,直至其完全溶解,然后依次加入磷酸二氢钾、磷酸氢二钾、聚磷酸铵等辅料直至全部物料完全溶解即得到液体肥。但是该方法存在加工成本高、活菌衰减快的缺点。
9.针对相关技术中的问题,目前尚未提出有效的解决方案。
技术实现要素:
10.针对相关技术中的问题,本发明提出一种多粘芽孢杆菌及其微生物固体菌剂的制备方法与应用,以克服现有相关技术所存在的上述技术问题。
11.本发明的构思如下:从连续种植4年的健康人参根际土壤中,分离筛选并纯化对多种人参致病真菌具有拮抗活性的多粘芽孢杆菌yn-59(l),经发酵培养、喷雾干燥制成微生物固体菌剂,具备防治人参病害和促进人参根系生长的作用。
12.具体的,本发明采用的具体技术方案如下:
13.根据本发明的一个方面,提供了一种多粘芽孢杆菌yn-59(l),该多粘芽孢杆菌为从健康的人参根际土壤中分离、纯化、筛选出的一株有效拮抗人参病原真菌的生防细菌,具体的,本发明首先挖取重茬老参地中依旧茁壮生长的健康人参10株,将其根际土壤抖落后统一收集,然后分离筛选并纯化共145株,最后通过平行对峙实验及牛津杯实验法筛选有效拮抗人参病原真菌的生防细菌。
14.进一步的,所述多粘芽孢杆菌yn-59(l)属于芽孢杆菌属(bacillus cohn),所述生防细菌为多粘芽孢杆菌bacilluspolymyxae。
15.根据本发明的另一个方面,提供了一种多粘芽孢杆菌yn-59(l)在拮抗人参病原真菌中的应用,所述病原真菌为人参尖孢镰刀菌、毁灭柱孢菌、腐皮镰孢菌,且所述多粘芽孢杆菌yn-59(l)对该病原真菌的抑菌率大于等于89%。
16.作为可选的,所述病原真菌为人参立枯丝核菌、灰葡萄孢菌、链格孢菌、恶疫霉菌,且所述多粘芽孢杆菌yn-59(l)对该病原真菌的抑菌率大于等于78%。
17.作为可选的,所述病原真菌为核盘菌和强壮土赤壳,且所述多粘芽孢杆菌yn-59(l)对该病原真菌的抑菌率大于等于72%。
18.作为可选的,所述多粘芽孢杆菌yn-59(l)在含100mg/l色氨酸的king培养液中分泌吲哚乙酸的浓度为32.28mg/l。
19.根据本发明的又一个方面,提供了一种多粘芽孢杆菌yn-59(l)制备的微生物固体菌剂,所述微生物固体菌剂包括以下重量百分比的原料:
20.多粘芽孢杆菌yn-59(l)微生物菌液80~90%和蛭石10~20%。
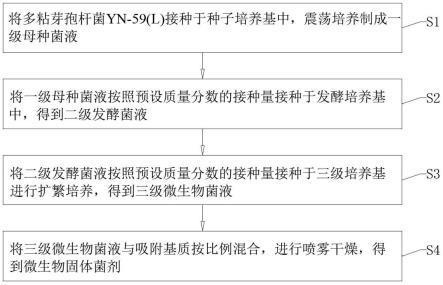
21.根据本发明的再一个方面,提供了一种多粘芽孢杆菌yn-59(l)制备的微生物固体菌剂的制备方法,该微生物固体菌剂采用三级制种加喷雾干燥技术制备得到,包括以下步骤:
22.s1、将多粘芽孢杆菌yn-59(l)接种于种子培养基中,振荡培养制成一级母种菌液;
23.s2、将一级母种菌液按照预设质量分数的接种量接种于发酵培养基中,得到二级发酵菌液;
24.s3、将二级发酵菌液按照预设质量分数的接种量接种于三级培养基进行扩繁培养,得到三级微生物液体菌剂;
25.s4、将三级微生物液体菌剂与吸附基质按比例混合,进行喷雾干燥,得到微生物固体菌剂。
26.进一步的,所述种子培养基包括以下重量分数的原料:酵母膏5.0g、蛋白胨10.0g、氯化钠10.0g及水1l;
27.所述发酵培养基包括以下重量分数的原料:葡萄糖5.0g、牛肉膏10.0g、蛋白胨10.0g、磷酸氢二钾1.0g、氯化钠3.0g、果胶10.0g及水1l;
28.所述二级培养基包括以下重量分数的原料:牛肉膏10.0g、蛋白胨5.0g、磷酸氢二钾1.0g、果胶5.0g、氯化钠3.0g及水1l。
29.进一步的,所述种子培养基的ph为7.0~7.2,所述发酵培养基的ph为7.0~7.2,所述二级培养基的ph为7.2~7.5。
30.进一步的,所述一级母种菌液的接种量采用质量分数为5%的接种量接种,所述二级发酵菌液接种量采用质量分数为60%的接种量接种。
31.进一步的,所述振荡培养的温度为30℃~35℃,所述发酵培养的温度为26℃~30℃,所述扩繁培养的温度为30℃~35℃;
32.所述喷雾干燥中进风口温度为220℃,出风口温度为80℃;
33.所述振荡培养的时间为1~4h,所述发酵培养的时间为12h~30h,所述扩繁培养的时间为1.5h~2h。
34.进一步的,所述通气量为0.2~0.8l/dm2/min。
35.进一步的,所述多粘芽孢杆菌yn-59(l)的一级母种活菌数不少于1
×
105cfu/ml,所述多粘芽孢杆菌yn-59(l)的二级原种活菌数不少于1
×
109cfu/ml,所述多粘芽孢杆菌yn-59(l)的三级生产种活菌数不少于1
×
10
10
cfu/ml,所述多粘芽孢杆菌yn-59(l)的微生物固体菌剂活菌数为50
×
108cfu/g。
36.进一步的,所述吸附基质为蛭石。
37.进一步的,所述多粘芽孢杆菌yn-59(l)的微生物固体菌剂的水含量为4%(w/w)。
38.进一步的,所述喷雾干燥为离心喷雾干燥。
39.本发明的有益效果为:
40.1)本发明提供的多粘芽孢杆菌yn-59(l),具备有效的拮抗人参病原真菌和促生长能力,对人参尖孢镰刀菌、毁灭柱孢菌、腐皮镰孢菌、立枯丝核菌、灰葡萄孢菌、链格孢菌、恶疫霉菌、核盘菌和强壮土赤壳等病原真菌有拮抗作用;此外,以其为原料制备的微生物固体菌剂,能够预防病原真菌,绿色安全,加强抗逆性,增加人参产质量。
41.2)本发明提供了一种多粘芽孢杆菌yn-59(l),对人参多种病原真菌的防治效果十分明显,其中对人参尖孢镰刀菌、毁灭柱孢菌、腐皮镰孢菌的抑菌率大于等于89%,对人参立枯丝核菌、灰葡萄孢菌、链格孢菌、恶疫霉菌抑菌率大于等于78%,对核盘菌和强壮土赤壳抑菌率大于等于72%。
42.3)本发明接种多粘芽孢杆菌yn-59(l)的三级微生物菌液处理组的人参根盘上仅有少量甚至无菌丝生长。在盆栽药效试验中,与对照组相比,在种植人参前使用一种以多粘芽孢杆菌yn-59(l)为原料的微生物固体菌剂进行拌土处理后,使人参的鲜重提高大于等于46.3%,湿重提高大于等于39.82%,还使人参的须根数增多大于等于97.14%,主根增长大于等于44.96%,根茎加粗大于等于1.7%,具有显著的促生长特点。
43.4)本发明在种植人参后使用由多粘芽孢杆菌yn-59(l)为原料制备的微生物固体菌剂后,人参锈腐病发病率仅低至12.9%,对人参锈腐病的防治效果高达79.33%。
附图说明
44.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
45.图1是根据本发明实施例的一种多粘芽孢杆菌yn-59(l)制备的微生物固体菌剂的制备方法的流程示意图;
46.图2是根据本发明实施例的一种多粘芽孢杆菌yn-59(l)制备的微生物固体菌剂的制备方法的原理示意图;
47.图3是根据本发明实施例中多粘芽孢杆菌yn-59(l)的形态学情况示意图;
48.图4是根据本发明实施例中多粘芽孢杆菌yn-59(l)的16s rdna序列系统发育树。
49.图中:
50.a、多粘芽孢杆菌yn-59(l)的革兰染色情况;b、多粘芽孢杆菌yn-59(l)的扫描电镜情况。
具体实施方式
51.为进一步说明各实施例,本发明提供有附图,这些附图为本发明揭露内容的一部分,其主要用以说明实施例,并可配合说明书的相关描述来解释实施例的运作原理,配合参考这些内容,本领域普通技术人员应能理解其他可能的实施方式以及本发明的优点,图中的组件并未按比例绘制,而类似的组件符号通常用来表示类似的组件。
52.根据本发明的实施例,提供了一种多粘芽孢杆菌及其微生物固体菌剂的制备方法与应用。
53.现结合附图和具体实施方式对本发明进一步说明,根据本发明的一个实施例,提供了一种多粘芽孢杆菌yn-59(l),该多粘芽孢杆菌为从健康的人参根际土壤中分离、筛选、纯化出的一株高效拮抗人参病原真菌的生防细菌,所述生防细菌为多粘芽孢杆菌bacilluspolymyxae。
54.根据本发明的另一个实施例,提供了一种多粘芽孢杆菌yn-59(l)在拮抗人参病原真菌中的应用,所述病原真菌为对人参尖孢镰刀菌、毁灭柱孢菌,腐皮镰孢菌的抑菌率大于等于89%。
55.可选的,所述病原真菌为人参立枯丝核菌、灰葡萄孢菌、链格孢菌、恶疫霉菌,且所述多粘芽孢杆菌yn-59(l)对该病原真菌的抑菌率大于等于78%。所述病原真菌为核盘菌和
强壮土赤壳,且所述多粘芽孢杆菌yn-59(l)对该病原真菌的抑菌率大于等于72%。所述多粘芽孢杆菌yn-59(l)在含100mg/l色氨酸的king培养液中分泌吲哚乙酸的浓度为32.28mg/l。
56.根据本发明的又一个实施例,提供了一种多粘芽孢杆菌yn-59(l)制备的微生物固体菌剂,所述微生物固体菌剂包括以下重量百分比的原料:
57.多粘芽孢杆菌yn-59(l)微生物菌液80~90%和蛭石10~20%;
58.优选的,多粘芽孢杆菌yn-59(l)微生物菌液86%和蛭石14%。
59.根据本发明的再一个实施例,如图1-2所示,提供了一种多粘芽孢杆菌yn-59(l)制备的微生物固体菌剂的制备方法,该微生物固体菌剂采用三级制种加喷雾干燥技术制备得到,包括以下步骤:
60.s1、将多粘芽孢杆菌yn-59(l)接种于种子培养基中,震荡培养制成一级种子菌液;
61.其中,所述种子培养基包括以下重量分数的原料:酵母膏5.0g、蛋白胨10.0g、氯化钠10.0g及水1l;所述种子培养基的ph为7.0~7.2;所述振荡培养的温度为30℃~35℃;所述振荡培养的时间1~4h;所述多粘芽孢杆菌yn-59(l)的一级种子菌液活菌数不少于1
×
105cfu/ml;
62.s2、将一级母种菌液按照预设质量分数的接种量接种于发酵培养基中,得到二级发酵菌液;
63.其中,所述发酵培养基包括以下重量分数的原料:葡萄糖5.0g、牛肉膏10.0g、蛋白胨10.0g、磷酸氢二钾1.0g、氯化钠3.0g、果胶10.0g及水1l;所述二级发酵培养基的ph为7.0~7.2;所述一级母种菌液的接种量采用质量分数为5%的接种量接种;所述发酵培养的温度为26℃~30℃;所述发酵培养的时间为12h~30h;所述多粘芽孢杆菌yn-59(l)的二级发酵菌液活菌数不少于1
×
109cfu/ml;
64.s3、将二级发酵菌液按照预设质量分数的接种量接种于三级培养基进行扩繁培养,得到三级微生物菌液;
65.其中,所述三级培养基包括以下重量分数的原料:牛肉膏10.0g、蛋白胨5.0g、磷酸氢二钾1.0g、果胶5.0g、氯化钠3.0g及水1l;所述三级培养基的ph为7.2~7.5;所述二级发酵菌液接种量采用质量分数为60%的接种量接种;所述扩繁培养的温度为30℃~35℃;所述扩繁培养的时间为1.5h~2h;所述通气量为0.2~0.8l/dm2/min;所述多粘芽孢杆菌yn-59(l)的三级微生物菌液活菌数不少于1
×
10
10
cfu/ml;
66.s4、将三级微生物菌液与吸附基质按比例混合,进行喷雾干燥,得到微生物固体菌剂;
67.其中,所述吸附基质为蛭石;所述喷雾干燥为离心喷雾干燥。
68.为了方便理解本发明的上述技术方案,以下就本发明在实际过程中的具体实施例进行详细说明。
69.实施例1:
70.人参连作土壤拮抗细菌菌株的分离和筛选
71.(1)拮抗细菌菌株的分离
72.于2019年6月采自吉林省左家镇的的人参种植园中采集4年生健康人参10株,收集人参根际土壤于无菌塑料袋中,处理前置于4℃冰箱保存。称取根际土壤与无菌水以1:9的
比例混合后于30℃,180r/min的条件下充分振荡培养40min,制成土壤悬浮液备用。用无菌水依次稀释浓度至10-5
。采用无菌接种环划线涂布于(5.0g酵母粉,10.0g蛋白胨,10.0g氯化钠,15.0g琼脂,1l蒸馏水,ph值7.2)的牛肉膏平板培养基上,30℃于恒温培养箱中培养12h。挑取具有代表性且形态不一致的单个菌落,纯化并保存备用。
73.(2)生防细菌菌株的活性筛选
74.采用平板对峙法进行抑菌率测定。在无菌操作台内用直径为5mm的打孔器在培养3d的病原真菌菌落边缘打取菌饼,用无菌接种针将菌饼接种于距pda平板中央1.25cm处,同时在距pda平板中央1.25cm的另一侧用接种环接种拮抗细菌菌饼。对照组只接种病原真菌。每个处理重复3次。28℃培养7d,测量对照组及处理组平板菌丝的生长直径,按下式计算抑菌率:
75.抑菌率(%)=(d
c-d
t
)/dc×
100%
76.其中,dc代表对照组平板菌丝的生长直径,d
t
代表处理组平板菌丝的生长直径。
77.分别以人参尖孢镰刀菌、毁灭柱孢菌,腐皮镰孢菌、立枯丝核菌、灰葡萄孢菌、链格孢菌、恶疫霉菌、核盘菌和强壮土赤壳为供试病原菌,采用平板对峙法进行抑菌率的测定。结果见表1。从145株细菌中共筛选出有拮抗活性的细菌12株,其中生防细菌yn-59(l)对以上人参的病原真菌均有明显且高效的拮抗作用,其中,对人参尖孢镰刀菌、毁灭柱孢菌、腐皮镰孢菌的抑菌率大于等于89%。对人参立枯丝核菌、灰葡萄孢菌、链格孢菌、恶疫霉菌抑菌率大于等于78%,对核盘菌和强壮土赤壳抑菌率大于等于72%。
78.表1生防细菌yn-59(l)对9种人参病原真菌的拮抗作用
[0079][0080]
实施例2:
[0081]
生防细菌yn-59(l)的鉴定
[0082]
(1)生防细菌yn-59(l)的菌落形态特征和生理生化特性
[0083]
将生防细菌yn-59(l)在lb培养基上25℃培养3d。选取分离的纯菌,按照《实验微生物学》第三版的要求,观察并记录菌株的生长情况、形态和颜色等特征形态指标,根据《常见细菌系统鉴定方法手册》和《伯杰测定细菌学手册》,对该菌株进行生理生化检测测定。
[0084]
结果见表2与图3。革兰氏染色结果显示生防细菌yn-59(l)这株生防细菌均为革兰
氏阳性菌,在平板上观察到生防细菌yn-59(l)在lb培养基上菌落为白色,形状呈圆形,不透明且褶皱凸出显微镜下观察到yn-59(l)呈蓝色短杆状;结合表3生理生化特性测试结果,初步判断生防细菌yn-59(l)为芽孢杆菌属。
[0085]
表2lb琼脂平板上yn-59(l)的菌落形态
[0086][0087][0088]
表3生防细菌yn-59(l)的生理生化特征
[0089][0090]
+代表反应为阳性,-代表反应为阴性。
[0091]
(2)分子鉴定
[0092]
生防细菌yn-59(l)的系统发育分析
[0093]
通过对细菌菌株16s rdna保守序列(its)测序进行分子鉴定。使用天根生化科技有限公司的细菌基因组提取试剂盒提取所选菌株的总基因组dna。采用通用引物27f(5
’‑
agagtttgatcmtggctcag-3’)和1492r(5
’‑
tacggytaccttgttacgactt-3’)对16s rdna基因进行pcr扩增。在以下条件下进行放大:在96℃初始变性5分钟,然后在96℃变性20秒,在62℃退火0.5分钟,在72℃延伸0.5分钟,在72℃延伸10分钟。3μl pcr产物进行1%的琼脂糖凝胶检测,观察条带性状。使用pcr产物磁珠法纯化试剂盒来纯化pcr产物。将纯化后的pcr产物进行上机检测。最后对测序结果进行ncbi-blast比对。采用mega 6.0版本进行系统发育和分子进化分析利用1000个重复的bootstrap分析,采用nj法重建系统发育树,明确生防菌株的系统发育地位。
[0094]
将生防细菌yn-59(l)的16s rdna分子测序结果经过mega6.0软件对相近序列构建
系统发育树后发现,发现生防细菌yn-59(l)菌株与providencia sp.菌株smkrbt-ts9的相似性为100%,因此确定yn-59(l)为多粘芽孢杆菌(bacilluspolymyxae)。
[0095]
多粘芽孢杆菌yn-59(l)的16s rdna序列系统发育树如图4所示。
[0096]
实施例3:
[0097]
多粘芽孢杆菌yn-59(l)拮抗毁灭柱孢菌的根盘实验
[0098]
将多粘芽孢杆菌yn-59(l)菌饼接种于lb液体培养基中,35℃,转速为200r/min的条件下培养2h,调整多粘芽孢杆菌yn-59(l)菌悬液的od
600
在0.1~0.2之间。将毁灭柱孢菌在pda固体培养基上培养7d,用无菌水冲洗孢子,将收集到的孢子悬液调整为100孢子/ml。吸取毁灭柱孢菌分生孢子悬浮液10ul均匀涂布于人参根盘上,在超净台上风干15分钟后接种多粘芽孢杆菌yn-59(l)菌悬液10ul。将处理过的人参根盘置于水浸过的滤纸上,25℃培养至腐烂。所有试验设3个重复,以只接种尖孢镰刀菌分生孢子悬浮液的人参根盘为对照组,观察菌丝生长和腐烂情况。
[0099]
实施例4:
[0100]
多粘芽孢杆菌yn-59(l)拮抗毁灭柱孢菌的根盘实验
[0101]
将多粘芽孢杆菌yn-59(l)菌饼接种于lb液体培养基中,35℃,转速为200r/min的条件下培养2h,调整多粘芽孢杆菌yn-59(l)菌悬液的od
600
在0.2~0.3之间。将毁灭柱孢菌在pda固体培养基上培养7d,用无菌蒸馏水冲洗孢子,将收集到的孢子悬液调整为500孢子/ml。吸取毁灭柱孢菌分生孢子悬浮液10ul均匀涂布于人参根盘上,在超净台上风干15分钟后接种多粘芽孢杆菌yn-59(l)菌悬液10ul。将处理过的人参根盘置于水浸过的滤纸上,25℃培养至腐烂。所有试验设3个重复,以只接种毁灭柱孢菌分生孢子悬浮液的人参根盘为对照组,观察菌丝生长和腐烂情况。
[0102]
实施例5:
[0103]
多粘芽孢杆菌yn-59(l)拮抗毁灭柱孢菌的根盘实验
[0104]
将多粘芽孢杆菌yn-59(l)菌饼接种于lb液体培养基中,35℃,转速为200r/min的条件下培养2h,调整多粘芽孢杆菌yn-59(l)菌悬液的od
600
在0.3~0.4之间。将毁灭柱孢菌在pda固体培养基上培养7d,用无菌蒸馏水冲洗孢子,将收集到的孢子悬液调整为1000孢子/ml。吸取毁灭柱孢菌分生孢子悬浮液10ul均匀涂布于人参根盘上,在超净台上风干15分钟后接种多粘芽孢杆菌yn-59(l)菌悬液10ul。将处理过的人参根盘置于水浸过的滤纸上,25℃培养至腐烂。所有试验设3个重复,以只接种毁灭柱孢菌分生孢子悬浮液的人参根盘为对照组,观察菌丝生长和腐烂情况。
[0105]
实施例6:
[0106]
多粘芽孢杆菌yn-59(l)拮抗毁灭柱孢菌的根盘实验
[0107]
将多粘芽孢杆菌yn-59(l)菌饼接种于lb液体培养基中,35℃,转速为200r/min的条件下培养2h,调整多粘芽孢杆菌yn-59(l)菌悬液的od
600
在0.4~0.5之间。将毁灭柱孢菌在pda固体培养基上培养7d,用无菌蒸馏水冲洗孢子,将收集到的孢子悬液调整为2000孢子/ml。吸取尖孢镰刀菌分生孢子悬浮液50ul均匀涂布于人参根盘上,在超净台上风干15分钟后接种多粘芽孢杆菌yn-59(l)菌悬液10ul。将处理过的人参根盘置于水浸过的滤纸上,25℃培养至腐烂。所有试验设3个重复,以只接种毁灭柱孢菌分生孢子悬浮液的人参根盘为对照组,观察菌丝生长和腐烂情况。
[0108]
表4根盘菌丝生长情况
[0109][0110]
实施例7:
[0111]
一种以多粘芽孢杆菌yn-59(l)为原料的三级微生物菌液的制备方法,步骤如下:
[0112]
将多粘芽孢杆菌yn-59(l)菌饼接种于ph为7.0的种子培养基中,30℃振荡培养1h,制成活菌数在1
×
105cfu/ml左右的一级种子菌液。将一级种子菌液用质量分数为5%的接种量接种于ph为7.0的发酵培养基中,30℃发酵培养12h,通气量为0.2l/dm2/min,制成活菌数在1
×
109cfu/ml左右的二级发酵菌液。将二级种子菌液用质量分数为50%的接种量接种于ph为7.0的三级培养基中,30℃扩繁培养1.5h,制成活菌数在1
×
109cfu/ml左右的三级微生物菌液。
[0113]
实施例8:
[0114]
一种以多粘芽孢杆菌yn-59(l)为原料的三级微生物菌液的制备方法,步骤如下:
[0115]
将多粘芽孢杆菌yn-59(l)菌饼接种于ph为7.0的种子培养基中,30℃振荡培养1h,制成活菌数在1
×
105cfu/ml左右的一级种子菌液。将一级种子菌液用质量分数为5%的接种量接种于ph为7.0的发酵培养基中,30℃发酵培养24h,通气量为0.4l/dm2/min,制成活菌数在1
×
10
10
cfu/ml左右的二级发酵菌液。将二级种子菌液用质量分数为55%的接种量接种于ph为7.0的三级培养基中,30℃扩繁培养1.5h,制成活菌数在1
×
10
10
cfu/ml左右的三级微生物菌液。
[0116]
实施例9:
[0117]
一种以多粘芽孢杆菌yn-59(l)为原料的三级微生物菌液的制备方法,步骤如下:
[0118]
将多粘芽孢杆菌yn-59(l)菌饼接种于ph为7.0的种子培养基中,30℃振荡培养1h,制成活菌数在1
×
105cfu/ml左右的一级种子菌液。将一级种子菌液用质量分数为6%的接种量接种于ph为7.0的发酵培养基中,30℃发酵培养30h,通气量为0.8l/dm2/min,制成活菌数在2
×
10
10
cfu/ml左右的二级发酵菌液。将二级种子菌液用质量分数为60%的接种量接种于ph为7.5的三级培养基中,35℃扩繁培养2h,制成活菌数在2
×
10
10
cfu/ml左右的三级微生物菌液。
[0119]
实施例10:
[0120]
一种以多粘芽孢杆菌yn-59(l)为原料的三级微生物菌液的制备方法,步骤如下:
[0121]
将多粘芽孢杆菌yn-59(l)菌饼接种于ph为7.0的种子培养基中,30℃振荡培养2h,制成活菌数在1
×
108cfu/ml左右的一级种子菌液。将一级种子菌液用质量分数为5%的接种量接种于ph为7.0的发酵培养基中,30℃发酵培养12h,通气量为0.2l/dm2/min,制成活菌数在1
×
109cfu/ml左右的二级发酵菌液。将二级种子菌液用质量分数为60%的接种量接种
于ph为7.5的三级培养基中,35℃扩繁培养2h,制成活菌数在2
×
10
10
cfu/ml左右的三级微生物菌液。
[0122]
实施例11:
[0123]
一种以多粘芽孢杆菌yn-59(l)为原料的三级微生物菌液的制备方法,步骤如下:
[0124]
将多粘芽孢杆菌yn-59(l)菌饼接种于ph为7.0的种子培养基中,30℃振荡培养2h,制成活菌数在1
×
108cfu/ml左右的一级种子菌液。将一级种子菌液用质量分数为5%的接种量接种于ph为7.0的发酵培养基中,30℃发酵培养24h,通气量为0.4l/dm2/min,制成活菌数在1
×
10
10
cfu/ml左右的二级发酵菌液。将二级种子菌液用质量分数为50%的接种量接种于ph为7.0的三级培养基中,30℃扩繁培养1.5h,制成活菌数在1
×
109cfu/ml左右的三级微生物菌液。
[0125]
实施例12:
[0126]
一种以多粘芽孢杆菌yn-59(l)为原料的三级微生物菌液的制备方法,步骤如下:
[0127]
将多粘芽孢杆菌yn-59(l)菌饼接种于ph为7.0的种子培养基中,30℃振荡培养2h,制成活菌数在1
×
108cfu/ml左右的一级种子菌液。将一级种子菌液用质量分数为6%的接种量接种于ph为7.0的发酵培养基中,30℃发酵培养30h,通气量为0.8l/dm2/min,制成活菌数在2
×
10
10
cfu/ml左右的二级发酵菌液。将二级种子菌液用质量分数为55%的接种量接种于ph为7.0的三级培养基中,30℃扩繁培养1.5h,制成活菌数在1
×
10
10
cfu/ml左右的三级微生物菌液。
[0128]
实施例13:
[0129]
一种以多粘芽孢杆菌yn-59(l)为原料的三级微生物菌液的制备方法,步骤如下:
[0130]
将多粘芽孢杆菌yn-59(l)菌饼接种于ph为7.0的种子培养基中,30℃振荡培养4h,制成活菌数在1
×
109cfu/ml左右的一级种子菌液。将一级种子菌液用质量分数为5%的接种量接种于ph为7.0的发酵培养基中,30℃发酵培养12h,通气量为0.2l/dm2/min,制成活菌数在1
×
109cfu/ml左右的二级发酵菌液。将二级种子菌液用质量分数为55%的接种量接种于ph为7.0的三级培养基中,30℃扩繁培养1.5h,制成活菌数在1
×
10
10
cfu/ml左右的三级微生物菌液。
[0131]
实施例14:
[0132]
一种以多粘芽孢杆菌yn-59(l)为原料的三级微生物菌液的制备方法,步骤如下:
[0133]
将多粘芽孢杆菌yn-59(l)菌饼接种于ph为7.0的种子培养基中,30℃振荡培养4h,制成活菌数在1
×
109cfu/ml左右的一级种子菌液。将一级种子菌液用质量分数为5%的接种量接种于ph为7.0的发酵培养基中,30℃发酵培养24h,通气量为0.4l/dm2/min,制成活菌数在1
×
10
10
cfu/ml左右的二级发酵菌液。将二级种子菌液用质量分数为60%的接种量接种于ph为7.5的三级培养基中,35℃扩繁培养2h,制成活菌数在2
×
10
10
cfu/ml左右的三级微生物菌液。
[0134]
实施例15:
[0135]
一种以多粘芽孢杆菌yn-59(l)为原料的三级微生物菌液的制备方法,步骤如下:
[0136]
将多粘芽孢杆菌yn-59(l)菌饼接种于ph为7.0的种子培养基中,30℃振荡培养4h,制成活菌数在1
×
109cfu/ml左右的一级种子菌液。将一级种子菌液用质量分数为6%的接种量接种于ph为7.0的发酵培养基中,30℃发酵培养30h,通气量为0.8l/dm2/min,制成活菌
数在2
×
10
10
cfu/ml左右的二级发酵菌液。将二级种子菌液用质量分数为50%的接种量接种于ph为7.0的三级培养基中,30℃扩繁培养1.5h,制成活菌数在1
×
109cfu/ml左右的三级微生物菌液。
[0137]
表5三级微生物菌液对人参毁灭柱孢菌的抑菌效果
[0138][0139]
实施例16:
[0140]
制备含多粘芽孢杆菌yn-59(l)的微生物固体菌剂
[0141]
向实施例8制得的三级微生物菌液(活菌含量为1
×
10
10
cfu/ml)中加入蛭石,三级微生物菌液与蛭石的重量比为4:1。将该液固混合物搅拌45分钟后静置30分钟,利用输料泵将料液输入离心式喷雾塔中干燥后,得到的微生物固态菌剂。
[0142]
实施例17:
[0143]
制备含多粘芽孢杆菌yn-59(l)的微生物固体菌剂
[0144]
向实施例8制得的三级微生物菌液(活菌含量为1
×
10
10
cfu/ml)中加入草炭,三级微生物菌液与草炭的重量比为4:1。将该液固混合物搅拌45分钟后静置30分钟,利用输料泵将料液输入离心式喷雾塔中干燥后,得到的微生物固态菌剂。
[0145]
实施例18:
[0146]
制备含多粘芽孢杆菌yn-59(l)的微生物固体菌剂
[0147]
向实施例8制得的三级微生物菌液(活菌含量为1
×
10
10
cfu/ml)中加入麸皮,三级微生物菌液与麸皮的重量比为4:1。将该液固混合物搅拌45分钟后静置30分钟,利用输料泵将料液输入离心式喷雾塔中干燥后,得到的微生物固态菌剂。
[0148]
实施例19:
[0149]
制备含多粘芽孢杆菌yn-59(l)的微生物固体菌剂
[0150]
向实施例8制得的三级微生物菌液(活菌含量为1
×
10
10
cfu/ml)中加入轻质碳酸钙,三级微生物菌液与轻质碳酸钙的重量比为4:1。将该液固混合物搅拌45分钟后静置30分钟,利用输料泵将料液输入离心式喷雾塔中干燥后,得到的微生物固态菌剂。
[0151]
实施例20:
[0152]
制备含多粘芽孢杆菌yn-59(l)的微生物固体菌剂
[0153]
向实施例8制得的三级微生物菌液(活菌含量为1
×
10
10
cfu/ml)中加入沸石粉,三
级微生物菌液与沸石粉的重量比为4:1。将该液固混合物搅拌45分钟后静置30分钟,利用输料泵将料液输入离心式喷雾塔中干燥后,得到的微生物固态菌剂。
[0154]
实施例21:
[0155]
采用上述实施例16~20制备得到的微生物固体菌剂防治人参锈腐病的盆栽药效试验
[0156]
人参毁灭柱抱菌菌悬液的制备:在无菌操作台内用φ=5mm打孔器从培养5d后的人参毁灭柱抱菌菌落边缘取5块菌饼,放入装有pda液体培养基的500ml三角瓶中,在35℃,160r/min条件下培养2h后备用,将od值调节至0.2左右。
[0157]
将上述实施例16~20制备得到的微生物固体菌剂分别进行拌土处理。将4年生人参种植在大小已拌好微生物固体菌剂的花盆中,在每株人参根部周围均匀灌入10ml人参毁灭柱孢菌菌悬液。以未拌微生物固体菌剂的新林土人参为对照。每个处理设4次重复,每个重复5株人参。于采收期取样1次。
[0158]
人参植株病情分级标准:0级表示根部没有可见病斑,1级表示根部病斑直径0.9mm,2级表示根部病斑1.0~4.0mm,3级表示根部病斑4.1~7.0mm,4级表示根部病斑大于7.0mm,5级表示病斑侵染整个根部。计算公式如下:
[0159]
发病率(%)=发病植株数/总株数
×
100%
[0160][0161][0162]
表6微生物固体菌剂对人参根腐病盆栽防效结果
[0163][0164]
微生物固体菌剂对人参根腐病防治效果见表6。采收期取样发现,对照组人参锈腐病发病率高达62.4%,病情指数为68.95。而实施例16的人参锈腐病发病率仅为12.9%,防治效果为79.33%;而实施例17的人参锈腐病发病率为30.6%,防治效果为50.96%;实施例18的人参锈腐病发病率为25.8%,防治效果为58.65%;实施例19的人参根腐病发病率为28.6%,防治效果为54.17%;实施例20的人参锈腐病发病率为27.8%,防治效果为55.45%。
[0165]
对比防治效果,结果表明接种一种以多粘芽孢杆菌yn-59(l)为原料的微生物固体
菌剂对人参锈腐病的防治效果十分明显,各处理对人参锈腐病的防治效果在50.96%以上,其中以实施例16的防治效果最好,达到79.33%。
[0166]
结果证明:与对照组相比,在种植人参前使用一种以多粘芽孢杆菌yn-59(l)为原料的微生物固体菌剂进行拌土处理后,可以使人参的鲜重提高大于等于46.3%,湿重提高大于等于39.82%,还使人参的须根数增多大于等于97.14%,主根增长大于等于44.96%,根茎加粗大于等于1.7%,具有显著的促生长特点。
[0167]
通过上述实例证明,以蛭石为吸附基质的微生物固体菌剂能够有效拮抗人参多种病原真菌,使人参的发病率显著降低,生长状况得到显著改善,可在种植人参前,大面积进行预防使用。
[0168]
上述实施例均于吉林省长春市长春中医药大学药用植物资源圃进行,真实性可查。
[0169]
综上所述,借助于本发明的上述技术方案,提供了一种多粘芽孢杆菌yn-59(l)对人参多种病原真菌的防治效果十分明显,其中对人参尖孢镰刀菌、毁灭柱孢菌,腐皮镰孢菌的抑菌率大于等于89%,对人参立枯丝核菌、灰葡萄孢菌、链格孢菌、恶疫霉菌抑菌率大于等于78%,对核盘菌和强壮土赤壳抑菌率大于等于72%。而从人参根盘实验的效果可以看出,接种锈腐病致病真菌毁灭柱抱菌3d后的对照组人参根盘已长满菌丝,而接种多粘芽孢杆菌yn-59(l)菌悬液的处理组人参根盘上仅有少量甚至无菌丝生长。与对照组相比,在种植人参前使用一种以多粘芽孢杆菌yn-59(l)为原料的微生物固体菌剂进行拌土处理后,使人参的鲜重提高大于等于46.3%,湿重提高大于等于39.82%,还使人参的须根数增多大于等于97.14%,主根增长大于等于44.96%,根茎加粗大于等于1.7%,具有显著的促生长特点。除此之外,在种植人参后使用由多粘芽孢杆菌yn-59(l)为原料制备的微生物固体菌剂后,人参锈腐病发病率仅低至12.9%,对人参锈腐病的防治效果高达79.33%。
[0170]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1