靶向人血清白蛋白(HSA)的纳米抗体及其应用的制作方法
靶向人血清白蛋白(hsa)的纳米抗体及其应用
1.优先权信息
2.本技术请求2021年6月3日向中国国家知识产权局提交的、专利申请号为202110616699.4的专利申请的优先权和权益,并且通过参照将其全文并入此处。
技术领域
3.本发明属于抗体工程领域,具体涉及一种用于诊断或治疗肿瘤的治疗性单域抗体,特别是涉及一种靶向人血清白蛋白(hsa)的纳米抗体、其衍生蛋白以及用于制备药物的用途,特别是在将药物负载于白蛋白、延长药物半衰期中的用途。
背景技术:
4.单域抗体(single domain antibody,sdab)是一类特殊的,只包含一条抗体重链的抗体。和传统双链抗体类似,它可以选择性的与特定抗原结合。单域抗体最早在骆驼科动物中被发现,之后在护士鲨等软骨鱼纲动物中也被发现。单域抗体单个重链抗体可变区(vhh)是能完整结合抗原的单个功能域,只有12-15kda。vhh结构简单,在与抗原结合时具有高特异性、高亲和力、免疫原性低、渗透性好以及在进行肿瘤治疗时具有接触到不能被常规抗体接触的较为隐蔽靶点的能力等优点。此外,因为单域抗体只有一条链,所以不会产生双链抗体融合时的错配问题。基于这些优点,利用单域抗体作为双特异性抗体的抗原结合序列具有很大的优势,逐渐成为研发热点(serge muyldermans(2013),annu.rev.biochem.82:775-797)。
5.人血清白蛋白(human serum albumin,hsa)是人体血浆中含量最丰富的蛋白质,含量约占血清蛋白的一半,在肝脏中产生,可溶于水,以单体形式存在。血清白蛋白由585个氨基酸组成,包含1个游离cys和17对二硫键,分子量约为66.5kd。与其他蛋白多肽不同,hsa进入细胞内后在细胞内酸性环境下可以与新生儿受体(fcrn)特异性结合,从而使其免于进入溶酶体降解,并随fcrn返回至细胞表面,因此其血清半衰期可达约21天。hsa是理想的药物载体(elsadek,b.,&kratz,f.(2012).impact of albumin on drug delivery
‑‑
new applications on the horizon.j control release,157(1),4-28),将目的蛋白与hsa融合表达或以非共价连接形式与hsa结合可有效延长目的蛋白半衰期。
技术实现要素:
6.现有技术中的scfv、fab或全igg类抗hsa抗体分子,结构复杂、分子较大,虽然能将活性分子连接到hsa上,但影响活性分子的功能、方法复杂、负载效率也较低;纳米抗体分子较小、易于操作,但人源化程度低、亲和力不高,延长半衰期的性能有待进一步提高。
7.针对上述现有技术的不足,本发明提供了一种靶向人血清白蛋白(hsa)的单域抗体、及其衍生物、和制备药物的用途。
8.单可变域抗体是目前最小的抗体分子,其分子量是普通抗体的1/10,最初由比利时科学家hamers,r在骆驼血液中发现,它是工程化抗体产品中备受关注的一类。单可变域
抗体除具备单克隆抗体的抗原反应性外,还拥有一些独特的功能特性,如分子质量小,稳定性强、可溶性好、易表达、靶向性强、人源化简单等,尤其是适合进行双/多特异治疗性抗体的开发和car-t/m/nk等疗法的开发。目前单可变域抗体和/或基于单可变域抗体的双/多特异性抗体开发已成为研发热点。
9.研究表明,hsa结合蛋白或结合肽在体内也具有较长的半衰期,因此抗hsa抗体可被用于延长蛋白或多肽类药物的半衰期。获得抗hsa抗体可以通过抗原免疫小鼠制备杂交瘤或免疫库进行筛选,并进一步进行人源化改造而获得;也可以通过抗体库技术直接筛选人源抗hsa抗体;上述技术获得的抗体可以是vh+vl组成的scfv、fab或全抗体igg。通过免疫羊驼/骆驼,并制备免疫库,或者通过天然纳米抗体库,利用hsa抗原进行筛选获得抗hsa纳米抗体。ablynx公司利用hsa的纳米抗体,开发了三特异性抗体ozoralizumab(atn-103)。ozoralizumab含有3个纳米抗体结构域,其中2个靶向tnfα,1个与hsa结合延长药物半衰期(fleischmann1,r.m.(2019).a novel individualised treatment approach in open-label extension study of ozoralizumab.pd.ablynx)。目前正在进行临床三期的研究(nct04077567)。
10.发明人以同组人hsa免疫骆驼构建噬菌体表面展示vhh抗体库,采以人血清白蛋白和食蟹猴血清白蛋白包被酶联板,固相筛选法获得对hsa和食蟹猴血清白蛋白(cynomolgus serum albumin,cyno sa)具有结合能力的vhh抗体克隆。制备相应的嵌合抗体检测抗原亲和力,选择两株vhh抗体2h4和2mg6进行人源化及序列优化。利用对鼠血清白蛋白(msa)具有交叉反应的人源化vhh抗体hz2mg6进行小鼠体内活性测定,结果表明将药物与本发明所述抗hsa单域抗体结合能够能有效延长药物的半衰期。
11.具体而言,一方面,本发明提供了一种具有白蛋白结合功能的分子。根据本发明的实施例,该具有白蛋白结合功能的分子包括至少一个白蛋白结合结构域,所述白蛋白结合域包括互补决定区(cdrs)1、2和3,所述cdrs 1、2和3具有所选vhh或其突变体的cdrs1、2和3所示的氨基酸序列,其中,所述突变体是在所述所选vhh的cdrs1、2和3的基础上进行一个或几个氨基酸突变获得的,优选所述一个或几个氨基酸突变为一个、两个、三个、四个或五个氨基酸的替换突变,
12.其中,所述所选vhh的cdrs1、2和3的氨基酸序列为下列之一:
13.(1)所述所选vhh的cdrs1、2和3的氨基酸序列分别如seq id no.43、44和45所示;
14.(2)所述所选vhh的cdrs1、2和3的氨基酸序列分别如seq id no.46、47和48所示;
15.(3)所述所选vhh的cdrs1、2和3的氨基酸序列分别如seq id no.43、49和50所示;
16.(4)所述所选vhh的cdrs1、2和3的氨基酸序列分别如seq id no.51、52和53所示。
17.根据本发明的实施例,所述所选vhh的所述突变体的cdrs1、2和3的氨基酸序列为下列之一:
18.(1)所述所选vhh的所述突变体的cdr1的氨基酸序列如seq id no.51所示,cdr2的氨基酸序列如giytvggstfytdx
10
vkg所示,cdr3的氨基酸序列如gx1tdtax2lx3x4px5sfgy所示;
19.(2)所述所选vhh的所述突变体的cdr1的氨基酸序列如seq id no.71所示,cdr2的氨基酸序列如aiytx6sglsgttyyadx7vkg所示,cdr3的氨基酸序列如dwkyx8strcgleveydx9所示,
20.其中,
21.x1为r、e或a;
22.x2为k、e或a;
23.x3为r、e或a;
24.x4为d或e;
25.x5为r、e或a;
26.x6为d或s;
27.x7为s或t;
28.x8为d或e;
29.x9为s或a;
30.x
10
为s或t。
31.根据本发明的实施例,所述所选vhh或其所述突变体包括重链可变区,其中,
32.(1)所述重链可变区包含seq id no:1所示的序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列;
33.(2)所述重链可变区包含seq id no:3所示的序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列;
34.(3)重链可变区包含seq id no:5所示的序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列;
35.(4)重链可变区包含seq id no:7所示的序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
36.根据本发明的实施例,所述突变体的所述重链可变区的氨基酸序列是在seq id no:5所示vhh的基础上进行选自以下任一组合的突变:
37.v27f+s28t,
38.d54s+s66t,
39.d54e+s66a。
40.根据本发明的实施例,所述突变体的所述重链可变区的氨基酸序列如seq id no:36、38、39或40所示。
41.根据本发明的实施例,所述突变体的所述重链可变区的氨基酸序列是在seq id no:7所示vhh的基础上进行选自以下任一组合的突变:
42.a14p,
43.a14p+s27f,
44.a14p+s26t,
45.a14p+s27f+s62t,
46.a14p+s27f+s62t+r99e,
47.a14p+s27f+s62t+r99a,
48.a14p+s27f+s62t+k104e,
49.a14p+s27f+s62t+k104a,
50.a14p+s27f+s62t+r106e,
51.a14p+s27f+s62t+r106a,
52.a14p+s27f+s62t+r109e,
53.a14p+s27f+s62t+r109a,
54.a14p+s27f+s62t+r106a+r99e,
55.a14p+s27f+s62t+r106a+r99a,
56.a14p+s27f+s62t+k104e+r99e,
57.a14p+s27f+s62t+k104e+r99a,
58.a14p+s27f+s62t+d107e,
59.a14p+s27f+s62t+r109e+r99e,
60.a14p+s27f+s62t+r109e+k104a,
61.a14p+s27f+s62t+r109e+r106a,
62.a14p+s27f+s62t+r109e+r99a。
63.根据本发明的实施例,所述突变体的所述重链可变区的氨基酸序列如seq id no:13、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34或35所示。
64.根据本发明的实施例,所述白蛋白结合结构域能够特异性结合人血清白蛋白(hsa)和食蟹猴血清白蛋白(cyno sa),而对牛血清白蛋白(bsa)无特异性结合;且所述白蛋白结合结构域是以白蛋白为饵蛋白筛选纳米抗体库获得的纳米抗体或其功能衍生物。
65.根据本发明的实施例,所述白蛋白结合结构域还能够特异性结合鼠血清白蛋白(msa)。
66.根据本发明的实施例,该具有白蛋白结合功能的分子包括两个或多个白蛋白结合结构域,所述两个或多个白蛋白结合结构域具有相同或不同的氨基酸序列。
67.根据本发明的实施例,该具有白蛋白结合功能的分子还包括至少一种具有生物活性的功能域或功能片段,所述具有生物活性的功能域或功能片段包括载体蛋白、活性肽、标签肽、伴侣蛋白等组件,其与白蛋白结合结构域通过共价键、非共价键或连接子连接;
68.其中优选的,所述载体蛋白包括bsa、ova、hsa、klh、fc等;所述活性肽包括线性肽或环形肽,具有酶活性、细胞毒活性、抗原结合活性等;所述标签肽包括纯化标签肽、示踪标签肽等;所述伴侣蛋白包括hsp60、hsp70、hsp90等。
69.根据本发明的实施例,所述具有生物活性的功能域或功能片段包括多肽类、合成小分子、天然活性分子,并且所述白蛋白结合功能的分子以单体、同源多聚体、异源多聚体的形式存在。
70.根据本发明的实施例,该具有白蛋白结合功能的分子为纳米抗体、重链抗体、vhh-fc融合蛋白、单价抗体、双价抗体、多价抗体、单特异性抗体、双特异性抗体、多特异性抗体、嵌合抗体、免疫偶联物。
71.进一步地,本发明还提供一种具有白蛋白结合功能的分子。根据本发明的实施例,该分子包括至少一个白蛋白结合结构域,所述白蛋白结合结构域能够特异性结合人血清白蛋白(hsa)和食蟹猴血清白蛋白(cyno sa),而对牛血清白蛋白(bovine serum albumin,bsa)无特异性结合;所述白蛋白结合结构域是以白蛋白为饵蛋白筛选纳米抗体库获得的纳米抗体或其功能衍生物。
72.进一步,根据本发明的实施例,所述白蛋白结合结构域还能够特异性结合鼠血清白蛋白(msa)。
73.进一步,根据本发明的实施例,所述白蛋白结合域包括:
74.(1)cdrs区,其具有seq id no:1、3、5、7中任一项所示vhh的cdrs区序列;
75.或,
76.(2)cdrs区,其是在seq id no:1、3、5、7中任一项所示vhh的cdrs区基础上进行一个或几个氨基酸突变获得的序列,优选所述一个或几个突变为一个、两个、三个、四个或五个氨基酸的替换突变。
77.更进一步,根据本发明的实施例,所述在seq id no:1、3、5、7中任一项所示vhh的cdrs区基础上进行一个或几个氨基酸突变的位点选自:第14、27、28、54、62、66、99、104、106、107、109位氨基酸。
78.进一步,根据本发明的实施例,所述白蛋白结合域包括:
79.(1)选自seq id no:1、3、5、7中任一项所示的vhh;
80.(2)seq id no:1、3、5、7中任一项所示的vhh基础上进行cdrs移植获得的人源化vhh;
81.或,
82.(3)seq id no:1、3、5、7中任一项所示的vhh基础上进行cdrs移植获得的人源化vhh,再经序列优化获得的vhh。
83.更进一步,根据本发明的实施例,所述白蛋白结合域包括选自seq id no:1、3、5、7、13、15-36、38-40中任一项所示的氨基酸序列。
84.进一步,根据本发明的实施例,该具有白蛋白结合功能的分子包括两个或多个白蛋白结合结构域,所述两个或多个白蛋白结合结构域具有相同或不同的氨基酸序列。
85.进一步,根据本发明的实施例,该具有白蛋白结合功能的分子还包括至少一种具有生物活性的功能域或功能片段,所述具有生物活性的功能域或功能片段包括载体蛋白、活性肽、标签肽、伴侣蛋白等组件,其与白蛋白结合结构域通过共价键、非共价键或连接子连接;
86.其中优选的,所述载体蛋白包括bsa、ova、hsa、klh、fc等;所述活性肽包括线性肽或环形肽,具有酶活性、细胞毒活性、抗原结合活性等;所述标签肽包括纯化标签肽、示踪标签肽等;所述伴侣蛋白包括hsp60、hsp70、hsp90等。
87.进一步,根据本发明的实施例,所述具有生物活性的功能域或功能片段包括多肽类、合成小分子、天然活性分子,并且所述白蛋白结合功能的分子以单体、同源多聚体、异源多聚体的形式存在。
88.进一步,根据本发明的实施例,该具有白蛋白结合功能的分子为纳米抗体、重链抗体、vhh-fc融合蛋白、单价抗体、双价抗体、多价抗体、单特异性抗体、双特异性抗体、多特异性抗体、嵌合抗体、免疫偶联物。
89.第三方面,本发明提供一种白蛋白结合结构域的制备方法。根据本发明的实施例,该方法包括:
90.(1)利用hsa免疫能产生天然重链抗体的动物;
91.(2)分离pbmc扩增重链可变区编码核酸,构建噬菌体重链抗体库;
92.(3)利用hsa包被固相载体进行亲和淘选,去除未结合的噬菌体;
93.(4)从固相上将结合的噬菌体洗脱、扩增;
94.(5)重复步骤(3)-(4)二至四次;
95.(6)对特异性结合的噬菌体进行噬菌粒救援,进行噬菌体elisa鉴定;
96.(7)对噬菌体elisa鉴定阳性的噬菌体克隆进行测序获得白蛋白结合结构域的编码核酸。
97.进一步,根据本发明的实施例,所述方法还包括:
98.(8)对白蛋白结合结构域进行人源化改造;
99.(9)对人源化改造的白蛋白结合结构域进行序列优化。
100.第四方面,本发明提供一种组合物。根据本发明的实施例,该组合物包含前述任一项所述的具有白蛋白结合功能的分子,以及可选的药学上可接受的辅料。
101.第五方面,本发明提供一种多核苷酸。根据本发明的实施例,其编码前述任一项所述的具有白蛋白结合功能的分子或其中的蛋白部分。
102.第六方面,本发明提供一种核酸构建体。根据本发明的实施例,该构建体包含前述的多核苷酸。
103.第七方面,本发明提供一种宿主细胞。根据本发明的实施例,该宿主细胞包含前述的多核苷酸或前述的核酸构建体。
104.第八方面,本发明提供一种制备具有白蛋白结合功能的分子的方法。根据本发明的实施例,该方法包括:
105.(1)在适合表达重组外源蛋白的条件下培养权利要求18所述的宿主细胞,
106.(2)可选的,从细胞培养物中分离纯化具有白蛋白结合功能的分子。
107.第九方面,本发明提供了前述任一项所述的具有白蛋白结合功能的分子中的白蛋白结合域。
108.第十方面,本发明提供了前述白蛋白结合域在制备药物和/或延长药物半衰期中的应用。
109.进一步,根据本发明的实施例,该应用包括将具有预防或治疗作用的活性分子通过共价键、非公价键、或接头分子与所述白蛋白结合域结合。
110.为更好理解本发明,首先定义一些术语。其他定义则贯穿具体实施方式部分而列出。
111.除非另外指出,无论在本文中用于指代重链抗体或指代常规4-链抗体,术语“免疫球蛋白序列”均用作通用术语,包括全尺寸抗体,其单独的链,以及其所有部分、结构域或片段(分别包括但不限于抗原结合结构域或片段如vhh结构域或vh/vl结构域)。此外,如在本文中所使用的术语“序列”(例如在如“免疫球蛋白序列”、“抗体序列”、“可变结构域序列”、“vhh序列”或“蛋白质序列”的术语中)通常应被理解为包括相关氨基酸序列以及编码其的核酸或核苷酸序列二者,除非上下文需要更有限制性的解释。
112.可以使用免疫球蛋白单可变结构域作为用于制备含有可以充当结合单元(即,针对相同靶标的相同或不同表位和/或针对一个或多个不同靶标)的一个或多个另外的免疫球蛋白单可变结构域的多肽的“结合单元”、“结合结构域”或“构建单元”(这些术语可互换使用)。
113.可与“单可变结构域”(“svd”)互换使用的术语“免疫球蛋白单可变结构域”(“isvd”)定义了其中抗原结合位点存在于单一免疫球蛋白结构域上并且由单一免疫球蛋
白结构域形成的分子。这使得免疫球蛋白单可变结构域与“常规”免疫球蛋白或它们的片段不同,其中两个免疫球蛋白结构域可变结构域,尤其是两个可变结构域,相互作用以形成抗原结合位点。通常,在常规免疫球蛋白中,重链可变结构域(vh)和轻链可变结构域(vl)相互作用以形成抗原结合位点。在这种情况中,vh和vl二者的互补决定区(cdr)将会有利于抗原结合位点,即在抗原结合位点形成中将会涉及总计6个cdr。相比之下,免疫球蛋白单可变结构域的结合位点由单一vh或vl结构域形成。因此,免疫球蛋白单可变结构域的抗原结合位点由不多于三个cdr形成。
114.术语“免疫球蛋白单可变结构域”和“单可变结构域”因此不包括需要至少两个可变结构域相互作用以形成抗原结合位点的常规免疫球蛋白或它们的片段。然而,这些术语包括其中通过单可变结构域形成抗原结合位点的常规免疫球蛋白的片段。
115.通常,单可变结构域将会是基本上由4个构架区(分别为fr1至fr4)和3个互补决定区(分别为cdr1至cdr3)组成的氨基酸序列。这样的单可变结构域和片段是最优选的,从而它们包含免疫球蛋白折叠或者能够在适合条件下形成免疫球蛋白折叠。因此,单可变结构域可以例如包含轻链可变结构域序列(例如,vl序列)或其适合的片段;或重链可变结构域序列(例如,vh序列或vhh序列)或其适合的片段;只要其能够形成单一抗原结合单元(即,基本上由单可变结构域组成的功能性抗原结合单元,以使得单一抗原结合单元不需要与另一个可变结构域相互作用以形成功能性抗原结合单元,例如对于在例如常规抗体和scfv片段中存在的、需要例如通过vh/vl相互作用而与另一个可变结构域相互作用以形成功能性抗原结合结构域的可变结构域来说是这样的情况)。
116.在本发明的一个实施方案中,免疫球蛋白单可变结构域是轻链可变结构域序列(例如,vl序列)或重链可变结构域序列(例如,vh序列);更具体地,免疫球蛋白单可变结构域可以是来源于常规四链抗体的重链可变结构域序列或来源于重链抗体的重链可变结构域序列。
117.例如,单可变结构域或免疫球蛋白单可变结构域(或适合用作免疫球蛋白单可变结构域的氨基酸)可以是(单)结构域抗体(或适合用作(单)结构域抗体的氨基酸)、“dab”或dab(或适合用作dab的氨基酸)或纳米抗体(如在本文中定义的,并且包括但不限于vhh);其他单可变结构域,或它们中任一种的任何适合的片段。
118.对于(单)结构域抗体的概括描述,还参考在本文中引用的现有技术以及参考ep0368684。用于术语“dab”,例如参考ward等人,1989(nature341:544-546),参考holt等人,2003(trends biotechnol.21:484-490);以及参考例如wo 04/068820、wo 06/030220、wo06/003388、wo 06/059108、wo 07/049017、wo 07/085815和domantis ltd.的其他公布的专利申请。还应当指出,尽管因为它们不是哺乳动物来源的而在本发明上下文中较不优选,单可变结构域可以来源于鲨鱼的某些种(例如,所谓的“ignar结构域”,参见例如wo 05/18629)。
119.尤其是,免疫球蛋白单可变结构域可以是(如在本文中定义的)或其适合的片段。[注释:是埃博灵克斯股份有限公司(ablynx n.v.)的注册商标]对于纳米抗体的概括描述参考以下的进一步描述,以及参考在本文中引用的现有技术,如,例如,在wo 08/020079(第16页)中描述的。
[0120]
对于vhh和纳米抗体的进一步描述,参考muyldermans 2001(分子生物技术中的综
述(reviews in molecular biotechnology)74:277-302)的综述文章,以及参考作为一般背景技术提及的以下专利申请:vrijeuniversiteit brussel的wo 94/04678、wo 95/04079和wo 96/34103;unilever的wo 94/25591、wo 99/37681、wo 00/40968、wo 00/43507、wo00/65057、wo 01/40310、wo 01/44301、ep 1134231和wo 02/48193;vlaams instituutvoor biotechnologie(vib)的wo 97/49805、wo 01/21817、wo 03/035694、wo 03/054016和wo03/055527;algonomics n.v.和埃博灵克斯股份有限公司的wo 03/050531;加拿大国立研究委员会(national research council of canada)的wo 01/90190;抗体研究所(institute of antibodies)的wo 03/025020;以及埃博灵克斯股份有限公司的wo 04/041867、wo 04/041862、wo 04/041865、wo 04/041863、wo 04/062551、wo 05/044858、wo06/40153、wo 06/079372、wo 06/122786、wo 06/122787和wo 06/122825和埃博灵克斯股份有限公司的另外的公布的专利申请。还参考在这些申请中提及的另外的现有技术,并且尤其参考在国际申请wo 06/040153的第41-43页提及的参考文献清单,该清单和参考文献通过引用结合在本文中。如在这些参考文献中描述的,纳米抗体(尤其是vhh序列和部分人源化的纳米抗体)的特征可以尤其在于在一个或多个构架序列中存在一个或多个“标志残基”。可以例如在wo 08/101985和wo 08/142164中找到纳米抗体的进一步描述,包括纳米抗体的人源化和/或骆驼源化,以及其他修饰、部分或片段、衍生物或“纳米抗体融合体”、多价构建体(包括接头序列的一些非限制性实例)和增加纳米抗体半衰期的不同修饰和它们的制备。
[0121]
因此,在本发明的意义中,术语“免疫球蛋白单可变结构域”或“单可变结构域”包括来源于非人来源、优选骆驼科动物、优选骆驼科动物重链抗体的多肽。如之前描述的,它们可以是人源化的。此外,该术语包括来源于非骆驼科动物来源例如小鼠或人的已经“骆驼源化”的多肽,例如在davies和riechmann 1994(febs 339:285-290)、1995(biotechnol.13:475-479)、1996(prot.eng.9:531-537)和riechmann和muyldermans1999(j.immunol.methods 231:25-38)中描述的。
[0122]
术语“免疫球蛋白单可变结构域”包括不同来源的免疫球蛋白序列,包括小鼠、大鼠、兔、驴、人和骆驼科动物免疫球蛋白序列。其还包括完全人的、人源化的或嵌合的免疫球蛋白序列。例如,它包括骆驼科动物免疫球蛋白序列和人源化骆驼科动物免疫球蛋白序列,或骆驼源化免疫球蛋白单可变结构域,例如由ward等人,1989描述的骆驼源化dab(参见例如wo 94/04678以及davies和riechmann 1994、1995和1996)和骆驼源化vh。
[0123]
同样地,这样的免疫球蛋白单可变结构域可以以任何适合的方式来源于任何适合的来源,并且例如可以是自然存在的vhh序列(即,来自适合的骆驼科动物物种)或合成或半合成氨基酸序列,包括但不限于部分或完全“人源化”的vhh、“骆驼源化”的免疫球蛋白序列(并且尤其是骆驼源化vh),以及通过以下技术获得的纳米抗体和/或vhh:如亲和力成熟(例如,从合成的、随机的或自然存在的免疫球蛋白序列如vhh序列开始)、cdr移植、镶盖术(veneering)、组合来源于不同免疫球蛋白序列的片段、使用重叠引物的pcr装配、和技术人员公知的用于改造免疫球蛋白序列的类似技术;或前述中任一项的任何适合的组合。
[0124]
免疫球蛋白单可变结构域的氨基酸序列和结构可以被认为——然而不限于——由四个构架区或“fr”组成,其在本领域中和在本文中分别被称为“构架区1”或“fr1”;“构架区2”或“fr2”;“构架区3”或“fr3”;以及“构架区4”或“fr4”;所述构架区被三个互补决定区或“cdr”隔开,其在本领域中分别被称为“互补决定区1”或“cdr1”;“互补决定区2”或“cdr2”;以及“互补决定区3”或“cdr3”。
[0125]
在免疫球蛋白单可变结构域中的氨基酸残基的总数量可以在110-120的范围内,优选为112-115,并且最优选113。
[0126]
如在wo 08/020079(通过引用结合在本文中)的第58和59页的q)段中进一步描述的,根据由kabat等人给出的针对vh结构域的通用编号(“kabat编号”)(“免疫学目标蛋白序列(sequence of proteins ofimmunological interest)”,美国公众健康服务中心(uspublic healthservices),nih bethesda,md,公布号91)对免疫球蛋白单可变结构域的氨基酸残基进行编号,如在riechmann和muyldermans 2000(j.immunol.methods 240:185-195;参见例如该出版物的图2)的文章中应用于骆驼科动物的vhh结构域的,并且相应地,免疫球蛋白单可变结构域的fr1包含在1-30位的氨基酸残基,免疫球蛋白单可变结构域的cdr1包含在31-35位的氨基酸残基,免疫球蛋白单可变结构域的fr2包含在36-49位的氨基酸,免疫球蛋白单可变结构域的cdr2包含在50-65位的氨基酸残基,免疫球蛋白单可变结构域的fr3包含在66-94位的氨基酸残基,免疫球蛋白单可变结构域的cdr3包含在95-102位的氨基酸残基,并且免疫球蛋白单可变结构域的fr4包含在103-113位的氨基酸残基。
[0127]
基于在本文中以及在wo 08/020079中、在wo 06/040153中和在另外的关于免疫球蛋白单可变结构域的在其中引用的参考文献中给出的免疫球蛋白单可变结构域序列的实例,将会清楚的是,氨基酸残基的精确数量还将会取决于在免疫球蛋白单可变结构域中存在的特定cdr的长度。就cdr而言,如在本领域中公知的,存在多种定义并且描述vh或vhh片段的cdr的习惯,如kabat定义(其基于序列可变性并且是最常用的)和chothia定义(其基于结构环区域的位置)。例如,参考网站http://www.bioinf.org.uk/abs/。对于本说明书和权利要求的目的来说,即使也可以提及根据kabat的cdr,最优选基于abm定义(其基于oxfordmolecular的abm抗体建模软件)来定义cdr,因为认为这是在kabat和chothia定义之间的最佳折衷。再次参考网站http://www.bioinf.org.uk/abs/)。
[0128]
在一个实施方案中,fr4包含c端氨基酸序列vtvss,即109、110、111、112和113位中的每一个。本发明还包括在109、110、111或112位终止的isvd。在本发明的一个方面中,fr4以c端氨基酸序列vtvs(109-112位)终止,fr4以c端氨基酸序列vtv(109-111位)终止,fr4以c端氨基酸序列vt(109-110位)终止,或者fr4以c端氨基酸v(109位)终止。c端延伸可以存在于最后一个(位于最c端)的isvd的fr4的最后一个氨基酸残基例如v109、t110、v111、s112或s113的c端,其中本发明的半胱氨酸部分优选存在于或者位于c端延伸的c末端。在一个实施方案中,fr4包含c端氨基酸序列vtvss并且c端延伸是半胱氨酸(例如,本发明的多肽以vtvssc终止)。在一个实施方案中,fr4包含c端氨基酸序列vtvs并且c端延伸是半胱氨酸(例如,本发明的多肽以vtvsc终止)。在一个实施方案中,fr4包含c端氨基酸序列vtv并且c端延伸是半胱氨酸(例如,本发明的多肽以vtvc终止)。在一个实施方案中,fr4包含c端氨基酸序列vt并且c端延伸是半胱氨酸(例如,本发明的多肽以vtc终止)。在一个实施方案中,fr4包含c端氨基酸v并且c端延伸是半胱氨酸(例如,本发明的多肽以vc终止)。
[0129]
在一个实施方案中,本发明涉及如在本文中所描述的二聚体,其中所述isvd选自由下列各项组成的组:单一结构域抗体、结构域抗体、适合用作单一结构域抗体的氨基酸序列、适合用作结构域抗体的氨基酸序列、dab、适合用作dab的氨基酸序列、纳米抗体、vhh、人源化vhh、和骆驼源化vh。优选地,isvd包含100至140个之间的氨基酸,如110-130个之间的
氨基酸。
[0130]
术语“噬菌体展示文库”是指外源性肽或蛋白质在其表面上表达的噬菌体的“文库”。外来肽或多肽被展示在噬菌体衣壳外表面上。外来肽可展示为作为噬菌体外壳蛋白的一部分并入的重组融合蛋白;通常不是噬菌体外壳蛋白,但能够变得并入衣壳外表面中的重组融合蛋白;或变得共价或非共价连接于所述蛋白质的蛋白质或肽。这是通过将外源性核酸序列插入可被包装至噬菌体粒子中的核酸中来达成。所述外源性核酸序列可例如被插入噬菌体外壳蛋白基因的编码序列中。如果外来序列是框内克隆,那么它编码的蛋白质将表达为外壳蛋白的一部分。因此,核酸序列的文库,如由编码一个或多个个体的整个b细胞谱系的基因区段制得的抗体谱系的文库,可被如此插入噬菌体中以产生“噬菌体文库”。当代表由核酸文库编码的肽和蛋白质的那些肽和蛋白质由噬菌体展示时,产生“肽展示文库”。尽管多种噬菌体用于所述文库构建中,但通常使用丝状噬菌体(dunn(1996)curr.opin.biotechnol.7:547-553)。参见例如以下对噬菌体展示文库的描述。
[0131]
术语“嵌合抗体”是指其中免疫球蛋白分子的氨基酸序列源于两个或更多个物种的抗体。通常,轻链与重链两者的可变区均对应于抗体的源于一个哺乳动物物种(例如小鼠、大鼠、兔等)的具有所需特异性、亲和力和能力的可变区,而恒定区与抗体中源于另一物种(通常是人)的序列同源以避免在那个物种中引发免疫应答。
[0132]
术语“嵌合抗体”是指重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而链的剩余部分与衍生自另一物种或属于另一抗体类别或亚类的抗体中的相应序列相同或同源,以及此类抗体的片段,只要它们展现出期望的生物学活性(美国专利no.4,816,567;morrison sl等,proc.natl.acad.sci.usa,81:6851-6855,1984)。例如,术语“嵌合抗体”可包括这样的抗体(例如人鼠嵌合抗体),其中抗体的重链和轻链可变区来自第一抗体(例如鼠源抗体),而抗体的重链和轻链恒定区来自第二抗体(例如人抗体)。
[0133]
术语“多特异性抗体”,本发明的抗体可以是单特异性、双特异性或多特异性的。多特异性抗体可对目标多肽的不同表位具特异性或可以含有对超过一种目标多肽具特异性的抗原结合域。参见例如tutt等人,1991,《免疫学杂志》147:60-69;kufer等人,2004,《生物技术趋势(trendsbiotechnol.)》22:238-244。本发明的抗体可以键联到另一功能分子(例如另一肽或蛋白质)或与其共同表达。举例来说,抗体或其片段可以功能上键联(例如通过化学偶合、基因融合、非共价缔合或以其它方式)到一个或多个其它分子实体,如另一抗体或抗体片段,以制备具有第二结合特异性的双特异性或多特异性抗体。举例来说,本发明包括双特异性抗体,其中免疫球蛋白的一条臂对溶血素a的n端区或其片段具特异性,而免疫球蛋白的另一条臂对溶血素a的c端区或第二治疗剂靶标具特异性,或结合于治疗剂部分。可以用于本发明的背景中的示例性双特异性抗体格式涉及使用第一免疫球蛋白(ig)ch3结构域和第二ig ch3结构域,其中第一和第二ig ch3结构域因至少一个氨基酸而彼此不同,且其中至少一个氨基酸差异使双特异性抗体与蛋白质a的结合与缺乏所述氨基酸差异的双特异性抗体相比有所减少。在一个实施例中,第一ig ch3结构域结合蛋白质a且第二ig ch3结构域含有减少或消除蛋白质a结合的突变,如h95r修饰(根据imgt外显子编号;根据eu编号是h435r)。第二ch3可以进一步包含y96f修饰(根据imgt;根据eu是y436f)。第二ch3内可发现的其它修饰包括:在igg1抗体的情况下,d16e、l18m、n44s、k52n、v57m和v82i(根据
imgt;根据eu是d356e、l358m、n384s、k392n、v397m和v422i);在igg2抗体的情况下,n44s、k52n和v82i(imgt;根据eu是n384s、k392n和v422i);和在igg4抗体的情况下,q15r、n44s、k52n、v57m、r69k、e79q和v82i(根据imgt;根据eu是q355r、n384s、k392n、v397m、r409k、e419q和v422i)。关于上文所描述的双特异性抗体格式的变化涵盖于本发明范围内。可以用于本发明的背景中的其它示例性双特异性格式包括但不限于例如基于scfv或双功能抗体双特异性格式、igg-scfv融合物、双重可变域(dvd)-ig、四体杂交瘤(quadroma)、杵入臼结构、常见轻链(例如具有杵入臼结构的常见轻链等)、crossmab、crossfab、(seed)体、白氨酸拉链、duobody、igg1/igg2、双重作用fab(daf)-igg和mab2双特异性格式(关于前述格式的综述参见例如klein等人2012,mabs 4:6,1-11和其中所引用的参考文献)。双特异性抗体也可以使用肽/核酸结合来构筑,例如其中具有正交化学反应性的非天然氨基酸用于产生位点特异性抗体-寡核苷酸结合物,其然后自组装成具有所规定的组成、价数和几何形状的多聚复合物。(参见例如kazane等人,《美国化学学会杂志(j.am.chem.soc.)》[电子出版:2012年12月4日)。
[0134]
术语“单域抗体”用基因工程方法获得,主要有3类,第一类是从骆驼科动物hcab获得的重链可变区,为单一的折叠单元,保留了完整的抗原结合活性,是最小的天然抗体片段。第二类是从鲨鱼等软骨鱼ignar获得的重链可变区,用vnar表示。第三类是从人源或鼠源单抗获得的重链或轻链可变区,保留了抗原结合活性,但亲和性和可溶性大为下降。
[0135]
术语“fc区”或“fc”是指免疫球蛋白重链的c端区,其含有铰链区的至少一部分、ch2结构域和ch3结构域,其介导免疫球蛋白与宿主组织或因子的结合,包括与位于免疫系统的各种细胞(例如,效应细胞)上的fc受体结合或与经典补体系统的第一组分(例如c1q)结合,包括天然序列fc区和变异fc区。通常,人igg重链fc区为自其cys226或pro230位置的氨基酸残基至羧基末端的区段,但其边界可能有变化。fc区的c-末端赖氨酸(残基447,依照eu编号系统)可以存在或可以不存在。fc还可以指隔离的这一区域,或在包含fc的蛋白多肽的情况下,例如“包含fc区的结合蛋白”,还称为“fc融合蛋白”(例如,抗体或免疫粘合素)。本发明的抗体中天然序列fc区包括人igg1,igg2(igg2a,igg2b),igg3和igg4。在igg、iga和igd抗体同种型中,fc区包含抗体的两条重链的每一条的ch2和ch3恒定结构域;igm和igefc区包含在每条多肽链中的三个重链恒定结构域(ch结构域2-4)。
[0136]
术语“特异性结合”是指,两分子间的非随机的结合反应,如抗体和其所针对的抗原之间的反应。术语“免疫结合”是指发生在抗体分子和抗原(对于该抗原而言抗体为特异性的)之间的特异性结合反应。免疫结合相互作用的强度或亲和力可以相互作用的平衡解离常数(kd)表示,其中kd值越小,表示亲和力越高。两分子间的的免疫结合性质可使用本领域中公知的方法定量。一种方法涉及测量抗原结合位点/抗原复合物形成和解离的速度。指特定抗体-抗原相互作用的“结合速率常数”(ka或kon)和“解离速率常数”(kd或koff)两者都可通过浓度及缔合和解离的实际速率而计算得出,参见malmqvist m,1993,nature,361:186-187。kd/ka的比率等于解离常数kd,参见davies dr等,1990,annual rev biochem.,59:439-473。可用任何有效的方法测量kd、ka和kd值。在优选的实施方案中,用生物发光干涉测量法来测量解离常数。在其它优选的实施方案中,可用表面等离子共振技术(例如biacore)或kinexa来测量解离常数。
[0137]
术语“抗体药物偶联物”、“免疫偶联物”,由抗体、连接子和药物组成,所述连接子
是可断裂连接子组合或不可断裂连接子。抗体是球状蛋白,含有一系列氨基酸位点可用于偶联药物-连接子。由于其三级和四级结构,只有溶剂可及的氨基酸可供偶联。事实上,高收率的偶联通常发生在赖氨酸残基的ε-氨基基团或半胱氨酸残基的巯基基团上。抗体蛋白表面的大量赖氨酸侧链导致大量的位点可供药物偶联,从而导致生成的抗体药物偶联物是混合物,含有不同的药物偶联数量(药物/抗体比值,dar)和偶联位点。本发明提供的偶联产品,尽管仍然是混合物,但与传统方式偶联得到的抗体药物偶联物相比,其dar分布范围很窄。其平均dar值接近4,接近最佳抗体药物偶联物平均dar值(2-4)范围。此外,偶联产品极少不含有裸抗(dar=0),这一组分对细胞毒杀不起作用。同时,偶联产品也不含有重度偶联产品(dar=8),这一组分在体内的清除速度很快,相对于低dar的组分而言。因此,本发明提供的抗体药物偶联物产品非均一性得到很大的改善。
[0138]
本发明中组成抗体药物偶联物的抗体最好保持其原有野生状态时的抗原结合能力。因此,本发明中的抗体能够,最好专一性地,与抗原结合。为了开发可用于癌症诊断与治疗的有效的细胞水平目标物,研究人员力图找寻跨膜或其他肿瘤相关多肽。这些目标物能够特异性地表达在一种或多种癌症细胞表面,而在一种或多种非癌细胞表面表达很少或不表达。通常,相对于非癌细胞表面而言,这样的肿瘤相关多肽在癌细胞表面更加过度表达。确认这样的肿瘤相关因子,可大大提高基于抗体治疗癌症的专一靶向特性。
[0139]
术语“缀合”、“连接”、“偶联”是指两个或更多个分子的缔合。连接也可以是遗传的(即重组融合)。在具体上下文中,所述术语包括提及连接配体(例如抗体部分)与效应分子。所述连接这种连接可以使用多种本领域公认的技术来实现,例如可通过化学或重组的方式。“化学方式”是指所述抗体部分与效应分子之间的反应,使所述两个分子之间形成共价键以形成一个分子。
[0140]
术语“细胞毒剂”用于本文时指抑制或防止细胞的功能和/或引起细胞破坏的物质。该术语意图包括放射性同位素(例如i131、i125、y90、re186)、化学治疗剂、和毒素(诸如细菌、真菌、植物或动物起源的酶活毒素),或其片段。
[0141]
术语“载体”、“核酸构建体”是指能够运输与其连接的另一种核酸的核酸分子。一种类型的载体是“质粒”,其是指其中可以连接另外的dna区段的环状双链dna环。另一种类型的载体是病毒载体,其中额外的dna区段可以连接到病毒基因组中。某些载体能够在它们被导入的宿主细胞中自主复制(例如,具有细菌复制起点和游离型哺乳动物载体的细菌载体)。其他载体(例如非附加型哺乳动物载体)可以在导入宿主细胞后整合到宿主细胞的基因组中,并由此与宿主基因组一起复制。此外,某些载体能够指导它们有效连接的基因的表达。这种载体在本文中被称为“重组表达载体”(或简称为“表达载体”)。通常,在重组dna技术中有用的表达载体通常以质粒的形式存在。然而,也包括其他形式的表达载体,如病毒载体(例如,复制缺陷型逆转录病毒,腺病毒和腺伴随病毒),其起到等同的功能。
[0142]
术语“核酸分子”旨在包括dna分子和rna分子。核酸分子可以是单链或双链的,并且可以是cdna。
[0143]
术语“多肽”是指包含至少两个连续连接的氨基酸残基的链,对链的长度没有上限。蛋白质中的一个或多个氨基酸残基可含有修饰,例如但不限于糖基化,磷酸化或二硫键。“蛋白质”可以包含一种或多种多肽。
[0144]
术语“宿主细胞”在其中载体可以增殖并且其dna可以表达的细胞,所述细胞可以
是原核细胞或者真核细胞。该术语还包括受试宿主细胞的任何后代。应理解,并不是所有的后代都与亲本细胞相同,因为在复制过程中可能会发生突变,这类后代被包括在内。
[0145]
本发明取得了以下有益的技术效果:
[0146]
第一、在骆驼vhh噬菌体表面展示文库技术的基础上,制备获得了经过人源化的抗hsa纳米抗体,其能够结合hsa、cyno sa,表面本发明人源化的抗hsa纳米抗体不仅保持了骆驼vhh抗体的可溶性,而且显著降低了对人体的异源免疫反应。
[0147]
第二、本发明对人源化的vhh进行了序列优化,获得了亲和力高、线性良好的人源化纳米抗体。采用免疫噬菌体库筛选骆驼vhh,对其相应的人源化抗体进行序列优化,产物纳米抗体经历了骆驼体内亲和力成熟、人源化后体外序列优化等过程,确保了产物纳米抗体的适当亲和力和结构及性质稳定。结果表明,其对hsa、cyno sa的结合能力与阳性对照相当或更优,将其融合于抗cd73mfab抗体上能够显著改善抗cd73mfab抗体在体内的药物动力学、增强其半衰期。
[0148]
第三、本发明的抗hsa纳米抗体具有通用性,由于其分子量小、序列结构清楚,因此对于非肠道施用途径的药物均可采用共价键(二硫键、肽键、酰胺键等)、连接子(具有双功能基团)、或非共价键(氢键、离子键、疏水作用力等)的方式连接至本发明的抗hsa纳米抗体,并进而负载到hsa上,具有广阔的应用场景。
[0149]
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
[0150]
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
[0151]
图1:elisa检测噬菌体上清与hsa和cyno sa抗原的结合
[0152]
横坐标为克隆号,纵坐标为od值
[0153]
图2:elisa检测抗hsa嵌合抗体与hsa的结合
[0154]
图3:elisa检测抗hsa嵌合抗体与cyno sa的结合
[0155]
图4:elisa检测抗hsa嵌合抗体与msa的结合
[0156]
图5:elisa检测抗hsa人源化抗体与hsa的结合
[0157]
图6:elisa检测抗hsa人源化抗体与cyno sa的结合
[0158]
图7:elisa检测抗hsa人源化抗体与msa的结合
[0159]
图8:具有hsa结合结构域的受试重组蛋白在balb/c小鼠体内代谢血药浓度的变化曲线
具体实施方式
[0160]
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
[0161]
需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以
明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
[0162]
下面参考具体实施例,对本发明进行说明,需要说明的是,这些实施例仅仅是说明性的,而不能理解为对本发明的限制。
[0163]
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件(例如参考j.萨姆布鲁克等著,黄培堂等译的《分子克隆实验指南》,第三版,科学出版社)或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品,例如可以采购自sigma公司。
[0164]
实施例1:骆驼纳米抗体免疫噬菌体库构建
[0165]
利用hsa抗原免疫骆驼,分离外周血单核细胞(pbmc)并提取总rna进行反转录,以反转录产物为模板扩增纳米抗体重链可变区(variable domain of the heavy-chain of heavy chain antibody,vhh)并连入噬菌体展示载体,电转入大肠杆菌tg1感受态细胞,构建骆驼免疫库。
[0166]
具体地,骆驼免疫两周一次,共4次。每次注射0.8mg hsa胞外区重组蛋白(购于华兰生物工程股份有限公司,产品批号:201405030),佐以弗氏完全/不完全佐剂(sigma,f5881,f5506),采取皮下多点注射的方式。每次免疫后2周采集1ml血分离血清,用免疫原作为测定抗原,通过elisa法分别测定血清中全抗体(igg)和重链抗体(heavy chain antibody,hcab)的滴度。当血清滴度达到建库要求后,采集100ml骆驼外周血并用分离试剂盒(天津灏洋,cat:tbd2011cm)分离pbmc,提取pbmc的总rna反转获得cdna,作为后续扩增vhh片段的模板。根据相关文献和数据库中检索到驼源vhh抗体的基因,设计并合成vhh抗体库构建引物,pcr扩增出抗体可变区基因序列。随后利用核酸内切酶对载体和扩增的抗体片段进行酶切。采用t4连接酶的连接方式构建连接产物,利用电转染技术将连接产物转入到tg1菌种之中。最终构建了一个1.8
×
108骆驼抗人hsa vhh抗体免疫库,用于特异性抗人hsa纳米抗体的筛选。为检测文库的正确率,随机选取50个克隆进行菌落pcr,结果显示插入率达到100%。
[0167]
实施例2:抗hsa特异性纳米抗体筛选
[0168]
通过固相筛选的方法对所构建的骆驼免疫库进行筛选,获得特异性噬菌体展示纳米抗体。
[0169]
(1)原始库呈现。骆驼免疫库转接至含有氨苄青霉素和四环素的2yt培养基,培养至对数生长期,加入m13辅助噬菌体,然后加入卡那霉素,在较低温度条件下呈现过夜。第二天收取培养上清,peg沉淀对噬菌体进行浓缩,获得高滴度的抗体库呈现产物用于后续筛选。
[0170]
(2)筛选。采用固相法进行特异性抗体的筛选。将特异性抗原hsa包被在免疫管表面,用封闭剂分别封闭免疫管和抗体库后,将抗体库加至免疫管中孵育,然后进行反复洗涤,最后用ph2.2的酸进行洗脱,洗脱物中和至中性后与对数生长期的xl-blue混合孵育进行感染,进一步进行噬菌体展示,回收特异性噬菌体颗粒。筛选2-3轮后进行单克隆鉴定。
[0171]
(3)鉴定。感染回收特异性噬菌体颗粒的xl-blue涂布平板,长出克隆后进行单克隆鉴定。将单克隆挑取后进行培养,培养至对数增长期,加入m13辅助噬菌体感染,然后入卡
那霉素,在30℃培养过夜。第二天取上清,分别用包被了hsa、cyno sa和bsa的酶联板进行elisa反应,结果如图1所示。将对has、cyno sa反应呈阳性,对bsa反应呈阴性的噬菌体克隆提取噬粒(含有抗体基因的噬菌体展示载体)进行测序,确定vhh抗体基因序列。通过筛选获得了4株可同时结合hsa及cyno sa重组蛋白的噬菌体展示的纳米抗体:2h1,2h2,2h4,2mg6,其测序结果如下:
[0172]
克隆2h1可变区氨基酸序列如seq id no:1所示,可变区核苷酸序列如seq id no:2所示;
[0173]
克隆2h2可变区氨基酸序列如seq id no:3所示,可变区核苷酸序列如seq id no:4所示;
[0174]
克隆2h4可变区氨基酸序列如seq id no:5所示,可变区核苷酸序列如seq id no:6所示;
[0175]
克隆2mg6可变区氨基酸序列如seq id no:7所示,可变区核苷酸序列如seq id no:8所示。
[0176]
实施例3:抗人hsa纳米抗体及对照抗体的制备
[0177]
将同靶点对照纳米抗体alb8的进行vhh基因全合成,并克隆至入含有人fc(hfc)编码基因的真核瞬时表达载体中,并在hek293细胞中重组表达。细胞转染5-6天后,取培养上清,利用proa亲和层析柱对表达上清进行纯化,获得alb8重组蛋白。其中,对照抗体alb8氨基酸序列来源于us 2014/0228546 a1,可变区氨基酸序列如seq id no:9所示,可变区核苷酸序列如seq id no:10所示。hfc氨基酸序列如seq id no:11所示,核苷酸序列如seq id no:12所示。
[0178]
将测序正确的2h1,2h2,2h4,2mg6 vhh基因,克隆至含有人fc(hfc)编码基因的真核表达载体上。获得序列正确的表达质粒后,转染293f细胞进行瞬时表达,细胞转染后5-6天,取培养上清,利用proa亲和层析柱对表达上清进行纯化,获得嵌合抗体ch2h1,ch2h2,ch2h4,ch2mg6。
[0179]
实施例4:嵌合抗体亲和力分析
[0180]
利用fortebio公司的octet qke system仪器,采用抗人抗体fc段的捕获抗体(ahc)生物探针捕获抗体fc段的方法测定抗体亲和力。测定时将ch2h1,ch2h2,ch2h4,ch2mg6嵌合抗体及对照抗体alb8,用pbs缓冲液稀释至4μg/ml,流经ahc探针(cat:18-0015,pall)表面,时间为120s。hsa重组蛋白(购于华兰生物工程股份有限公司,产品批号:201405030)(60nm)作为流动相,结合时间为300s,解离时间为300s。实验完毕,扣除空白对照响应值,用软件进行1:1langmuir结合模式拟合,计算抗原抗体结合的动力学常数,如表1所示。
[0181]
表1.嵌合抗体与hsa重组蛋白的亲和力测定结果
[0182]
样本kd(m)ch2h12.79e-08ch2h21.62e-08ch2h47.79e-09ch2mg65.79e-10alb86.76e-09
[0183]
表1的结果表明所有嵌合抗体均能够正确装配,均具有与hsa重组蛋白特异性结合的能力。
[0184]
实施例5:elisa检测抗hsa嵌合抗体的种属特异性分析
[0185]
将hsa重组蛋白(购于华兰生物工程股份有限公司,产品批号:201405030)、食蟹猴sa重组蛋白(cat:#csa-c52h4,lot.#3445-9c5f1-qd,acro)、小鼠sa重组蛋白(cat:#msa-m52h8,lot.#3441a-9cbf1-qf,acro),4℃包被过夜,包被浓度1μg/ml;pbs洗板3次后,加入5%bsa pbs,37℃封闭60min,pbst洗板3次;加入不同稀释倍数的ch2h1,ch2h2,ch2h4,ch2mg6,以及对照抗体alb8(起始浓度为1μg/ml,3倍梯度依次稀释12个浓度),37℃孵育60min,pbst洗板4次;加入1:5000稀释的hrp-anti-human fc(cat:109-035-098,jackson immuno research),37℃孵育45min,pbst洗板4次;加入tmb底物显色,37℃孵育10min后,加入2m hcl终止反应;以630nm为参比波长,读取并记录波长450nm下孔板的吸光度a450nm-630nm,计算ec50值。结果如图2-4所示。
[0186]
图2-3表明ch2h1,ch2h2,ch2h4,ch2mg6及对照抗体均可以特异性的与人、食蟹猴sa重组蛋白结合,其对应的半数有效结合浓度ec50值如表2所示。表2、图4表明ch2h1、ch2mg6和对照抗体alb8还可与小鼠sa重组蛋白结合。
[0187]
表2.elisa检测抗hsa嵌合抗体对不同种属血清白蛋白结合的ec50
[0188][0189][0190]
实施例6:抗hsa纳米抗体的人源化及重组表达分析
[0191]
6.1驼源纳米抗体2mg6的人源化
[0192]
1、cdr移植
[0193]
对驼源抗体2mg6的vhh序列进行综合分析,确定抗体与抗原结合的抗原互补决定簇(cdr)区域及支撑抗体保守三维构象的框架区(framework)。随后根据同源性比对结果,选择最近似人源抗体template vh3(3-07)为基础模板,结合全序列blast结果,进行cdr移植,实现了2mg6可变区(vhh)在framework区的人源化。2mg6抗体cdr移植(cdr grafted)的人源化后氨基酸序列seq id no:13所示;核苷酸序列如seq id no:14所示。
[0194]
2、突变体设计
[0195]
对hz2mg6序列进行突变设计,突变位点如表3所示。
[0196]
表3.hz2mg6突变序列设计信息
[0197][0198][0199]
注:a14p表示将seq id no:13所示hz2mg6的第14位氨基酸a突变为p,依次类推。
[0200]
3、人源化抗体hz2mg6的重组表达及亲和力检测
[0201]
将人源化设计的hz2mg6抗体可变区序列进行全合成,克隆至含有人fc(hfc)编码基因的真核表达载体上。获得序列正确的表达质粒后,并根据突变设计,在表达质粒上进行定点突变,转入大肠杆菌扩增,获得hz2mg6突变表达质粒;转入hek293细胞中重组表达,细胞转染5-6天后,取培养上清,利用proa亲和层析柱对表达上清进行纯化,获得的人源化抗体.及其突变体重组蛋白。
[0202]
利用fortebio公司的octet qke system仪器,采用抗人抗体fc段的捕获抗体(ahc)生物探针捕获抗体fc段的方法测定抗体亲和力。测定时将hz2mg6抗体及嵌合抗体用pbs缓冲液稀释至4ug/ml,流经ahc探针(cat:18-0015,pall)表面,时间为300s。hsa重组蛋白(购于华兰生物工程股份有限公司,产品批号:201405030)作为流动相,hsa重组蛋白浓度为60nm。结合时间为300s,解离时间为300s。实验完毕,扣除空白对照响应值,用软件进行1:1langmuir结合模式拟合,计算抗原抗体结合的动力学常数。
[0203]
通过fortebio测定hz2mg6及其突变体与hsa重组蛋白的亲和力,kd结果如表4所示,人源化后的2mg亲和力从10-8
m至10-10
m,不同亲和力的突变体可为与不同重组蛋白组成融合蛋白提供更多选择,从而更有针对性调节融合蛋白的代谢特征。
[0204]
表4.hz2mg6突变体亲和力测定结果
[0205]
名称kd值(m)名称kd值(m)hz2mg61.72e-09hz2mg6m117.36e-10hz2mg6m11.56e-09hz2mg6m126.83e-10hz2mg6m22.41e-10hz2mg6m135.13e-08hz2mg6m31.64e-09hz2mg6m142.54e-08hz2mg6m42.49e-10hz2mg6m156.63e-08hz2mg6m54.51e-09hz2mg6m163.61e-08hz2mg6m62.91e-09hz2mg6m174.40e-10hz2mg6m75.12e-07hz2mg6m185.72e-09hz2mg6m85.76e-09hz2mg6m199.85e-09hz2mg6m94.71e-07hz2mg6m207.10e-09hz2mg6m105.63e-09hz2mg6m213.42e-09
[0206]
6.2驼源纳米抗体2h4的人源化
[0207]
1、cdr移植
[0208]
首先对驼源抗体2h4的vhh序列进行综合分析,确定抗体与抗原结合的抗原互补决定簇(cdr)区域及支撑抗体保守三维构象的框架区(framework)。随后根据同源性比对结果,选择最相似人源抗体template vh3(3-07)为基础模板,结合全序列blast结果,进行cdr移植,实现了2h4可变区(vhh)在framework区的人源化。重新名为hzh4;hzh4抗体cdr移植(cdr grafted)的人源化可变区氨基酸序列如seq id no:36所示;人源化可变区核苷酸序列如seq id no:37所示。
[0209]
2、突变体设计
[0210]
对hzh4序列进行突变设计,突变位点如表5所示。
[0211]
表5.hzh4人源化突变序列设计
[0212][0213]
3、人源化抗体hzh4的重组表达及亲和力检测
[0214]
将人源化设计的hzh4抗体可变区序列进行全合成,克隆至含有人fc(hfc)编码基因的真核表达载体上。获得序列正确的表达质粒后,并根据突变设计,在表达质粒上进行定点突变,转入大肠杆菌扩增,获得hzh4突变表达质粒;转入hek293细胞中重组表达,细胞转染5-6天后,取培养上清,利用proa亲和层析柱对表达上清进行纯化,获得的人源化抗体及
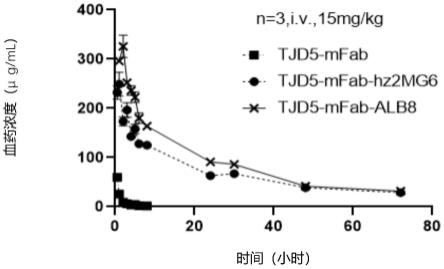
no.42)的重组表达载体,并在hek293细胞中进行瞬时表达,纯化制备重组蛋白样品。通过对上述3个重组蛋白在balb/c小鼠体内进行药代动力学检测,证实抗hsa纳米抗体可以延长重组蛋白在动物体内的半衰期。
[0227]
实验设计:雌性6周龄balb/c小鼠(维通利华)尾静脉给予250ug/只的受试样品,6只小鼠分为两个亚组,3只/亚组,交叉采血,于0.5h、1h、2h、3h、4h、5h、6h、8h、24h、30h、48h、72h断尾采血,收集血清并于-20℃保存。
[0228]
采血全部完成后,包被human cd73-his(序列号:np_002517.1)于96孔酶联板,0.5ug/ml,100ul/孔,4℃过夜,pbs洗板3次后,加入5%bsa pbs,37℃封闭60min,pbst洗板3次;加入待检测血清样本(10000,20000倍稀释),设置tjd5-fab和标准曲线孔(起始浓度为0.05μg/ml,2倍连续稀释,12个梯度),37℃孵育60min,pbst洗板4次;加入1:5000稀释的hrp-羊抗鼠fab(cat:a2304-1ml,lot#019m4758v,sigma),37℃孵育40min,pbst洗板4次;加入tmb底物(cat:me142,北京泰天河生物技术有限公司)显色,37℃孵育10min后,加入2m hcl终止反应;以630nm为参比波长,读取并记录波长450nm下孔板的吸光度a450nm-630nm。以标准抗体的浓度为y轴,od值为x轴,绘制时间——抗体浓度曲线图,进行线性拟合,并根据公式t
1/2
=|0.693/k|,计算药物半衰期t
1/2
。各蛋白代谢曲线图如图8所示,拟合半衰期结果如表8所示。结果显示,当前条件下,融合了hsa纳米抗体的tjd5-mfab相比于未融合纳米抗体的tjd5-mfab同时间点的血药浓度更高,代谢t
1/2
明显延长,表明抗hsa纳米抗体具有延长与之融合或偶联的分子半衰期的作用。
[0229]
表8.受试重组蛋白在balb/c小鼠体内代谢的半衰期
[0230]
组别半衰期(hrs)tjd5-mfab(n=3)t1/2=1.5tjd5-mfab-hz2mg6(n=3)t1/2=23.6tjd5-mfab-alb8(n=3)t1/2=15.8
[0231]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
[0232]
尽管已经示出和描述了本发明的实施例,本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1