一种诊断血吸虫病的试剂盒
1.本发明涉及寄生虫学分子检测技术领域,具体地,涉及一种诊断血吸虫病的试剂盒。
背景技术:
2.血吸虫病(schistosomiasis)是由裂体吸虫(schistosome)感染引起的一种寄生虫病,对人类健康和经济发展造成不利影响。《中华人民共和国传染病防治法 (修订)》将血吸虫病列为乙类法定报告传染病。随着现代医学的进步,曾经广泛传播、严重威胁我国人民健康的日本血吸虫病得到了有效的控制。
3.血吸虫感染可导致肝损伤、脾肿大、发热、腹泻等症状,其中肝损伤包括肉芽肿和肝纤维化,是血吸虫感染诱导的最严重健康损害,后期可发展为晚期血吸虫病,严重影响病人的生活满意度。早发现、诊断、早治疗是目前控制血吸虫病的重要方法。因此,开发对血吸虫感染诱导的肝损伤程度的快速、准确的检测方法,是遏制血吸虫病及其进展的有效途径之一。
4.对目前,检测血吸虫病的主要方法包括流行病学诊断、临床诊断和实验室诊断三大类。实验室诊断主要包括免疫学检测和分子生物学检测。免疫学诊断方法主要有包括抗原检测如免疫层析法和抗体检测如酶联免疫吸附试验、化学发光免疫测定和免疫层析测定等。虽然这些方法也被广泛应用于临床诊断和流行病学调查,但同时也暴露出不少问题。病原学诊断方法易漏检,且常需重复多次。免疫学诊断并非直接检测病原体,敏感性较低且特异性不足。分子生物学技术主要以核酸扩增技术为基础,为疾病的诊断提供了快速、灵敏、特异及稳定的检测方法。常用于检测血吸虫病的有血清学等侵入性的分子生物学检测方法及无侵入性方法如b超和ct等。但是缺乏、方便、准确、灵敏和特异性高的无侵入性的检测方法。
5.肠道菌群被誉为人类的“第二基因组”,对宿主的健康起到重要作用。近年来,高通量测序的快速发展,我们对肠道菌群的认识越来深刻。有文章报道日本血吸虫不同感染程度对小鼠肠道菌群的影响(宋秋月,张亦舒,张蓓蓓,刘嘉华,宋兰桂,孙希,吴忠道.日本血吸虫不同感染程度对小鼠肠道菌群的影响[j].热带医学杂志,2020,20(03):303-308+428.),但其提出的肠道菌群灵敏度和特异性较低,不利于准确、灵敏地判断血吸虫病肝损伤,对此依然需要更加准确、灵敏和特异性高的判断血吸虫病肝损伤的方法。
技术实现要素:
[0006]
本发明的目的是克服现有技术的上述不足,提供一种诊断血吸虫病的试剂盒。
[0007]
本发明的第一个目的是提供检测bacteroides、blautia和/或enterococcus菌群的试剂在制备诊断血吸虫病的试剂盒中的应用。
[0008]
本发明的第二个目的是提供一种诊断血吸虫病的试剂盒。
[0009]
为了实现上述目的,本发明是通过以下方案予以实现的:
[0010]
检测bacteroides、blautia和/或enterococcus菌群的试剂在制备诊断血吸虫病的试剂盒中的应用。
[0011]
优选地,所述试剂用于鉴别bacteroides、blautia和/或enterococcus菌群的种类。
[0012]
更优选地,所述试剂还用于检测bacteroides、blautia和/或enterococcus菌群的丰度。
[0013]
更优选地,试剂为检测肠道中的bacteroides、blautia和/或enterococcus菌群。
[0014]
更优选地,所述血吸虫病为血吸虫入侵诱导的器官损伤。
[0015]
更优选地,所述器官损伤为肝损伤。
[0016]
更优选地,肝损伤为肝肉芽肿和/或肝纤维化。
[0017]
优选地,所述血吸虫为日本血吸虫。
[0018]
优选地,诊断人日本血吸虫病的试剂为检测肠道菌群中blautia和 enterococcus的丰度的试剂,诊断小鼠日本血吸虫病的试剂为检测肠道菌群中 bacteroides和blautia的丰度的试剂。
[0019]
一种诊断血吸虫病的试剂盒,所述试剂盒中含有所述试剂。
[0020]
优选地,所述血吸虫病为血吸虫入侵诱导的器官损伤。
[0021]
更优选地,所述器官损伤为肝损伤。
[0022]
更优选地,肝损伤为肝肉芽肿和/或肝纤维化。
[0023]
优选地,所述血吸虫为日本血吸虫、曼氏血吸虫、埃及血吸虫、间插血吸虫和/或湄公血吸虫。
[0024]
更优选地,所述血吸虫为日本血吸虫。
[0025]
与现有技术相比,本发明具有以下有益效果:
[0026]
本发明公开了一种诊断血吸虫病的试剂盒,利用肠道菌群生物标志物bacteroides、blautia和enterococcus三菌的丰度变化,检测血吸虫入侵诱导的肝肉芽肿和肝纤维化。与传统的血清学指标等方法相比,具有灵敏度高、特异性强、无侵入性的优点,从而特异性地检测出肝损伤程度,实现对血吸虫诱导的肝损伤的精准检测;与传统ast、alt等血液检测方法相比,具备无侵入性,减少与血液制品的接触;与b超、ct等影像检查相比,具有便携性、更简便等优点;所需要设备简单,检测结果直观,对操作人员要求低,能够有效降低检测成本,适用于基层医疗机构和人群筛查现场,有良好的应用价值和推广前景。
附图说明
[0027]
图1为小鼠感染日本血吸虫后同一时间点(第8周)采样,肠道菌群α多样性(基于otus)差异,其中control为阴性对照组,sj为日本血吸虫感染组。
[0028]
图2为小鼠感染日本血吸虫后不同时间点(第7周和第8周)采样,肠道菌群α多样性(基于shannon)差异。
[0029]
图3为小鼠感染日本血吸虫后同一时间点(第8周)采样,肠道菌群β多样性(基于pls-da)差异。
[0030]
图4为小鼠感染日本血吸虫后不同时间点(第7周和第8周)采样,肠道菌群区分阴性对照组和日本血吸虫感染组的生物标志物(基于stamp),其中 control为阴性对照组,sj
为日本血吸虫感染组,具有统计学意义。
[0031]
图5为小鼠感染日本血吸虫后同一时间点(第8周)采样,肠道菌群区分阴性对照组和日本血吸虫感染组的标志物,其中control为阴性对照组,sj为日本血吸虫感染组,lda值≥3。
[0032]
图6为小鼠感染日本血吸虫后不同时间点(第7周和第8周)采样,肠道菌群β多样性(基于pls-da)差异。
[0033]
图7为小鼠感染日本血吸虫后不同时间点(第7周和第8周)采样,肠道菌群区分阴性对照组和日本血吸虫感染组的生物标志物(基于随机森林分析)。
[0034]
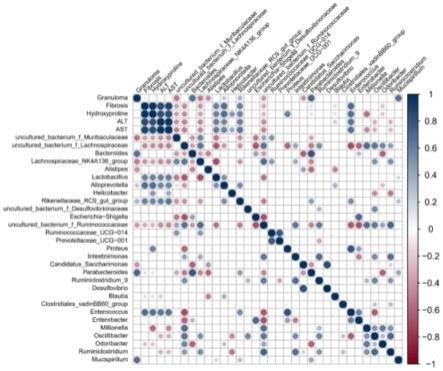
图8为基于spearman分析感染日本血吸虫后小鼠肠道菌群的相互作用及与血清学检测指标的相关性。可以看到肉芽肿面积(granuloma)、肝纤维化 (fibrosis)、羟脯氨酸水平(hydroxyproline)以及alt、ast等与多种细菌呈显著相关性。圆圈大小表示相关性大小,且表示有统计学意义;不同颜色表示相关性是正相关或负相关。
[0035]
图9为人感染日本血吸虫组与未感染日本血吸虫组,肠道菌群β多样性(基于pls-da)差异。
[0036]
图10为人的感染日本血吸虫组与未感染日本血吸虫组,基于肠道菌群丰度差异,获得不同组的生物标志物,如g_blautia(属水平)为感染了血吸虫的生物标志物,lda值≥3。
[0037]
图11为人感染日本血吸虫组与未感染日本血吸虫组,肠道菌群区分感染日本血吸虫组与未感染日本血吸虫组的生物标志物(基于stamp),具有统计学意义,其中control为阴性对照组(即未感染日本血吸虫组),sj为日本血吸虫感染组。
[0038]
图12为人感染日本血吸虫与未感染日本血吸虫组,肠道菌群肠道菌群区分感染日本血吸虫组与未感染日本血吸虫组的生物标志物(基于随机森林分析)。
[0039]
图13为肠道菌群生物标志物在人类和小鼠中对日本血吸虫诱导的肝损伤诊断效果。其中红色线为人类,蓝色线为小鼠。auc(area under curve)表示roc (receiver operating characteristic curve)曲线下与坐标轴围成的面积,值越接近 1表示检测方法真实性越高。p值小于0.05表示具有统计学意义。
[0040]
图14为肠道菌群生物标志物在小鼠中对日本血吸虫赶感染和对非寄生虫感染因素(本实验选取枯草芽孢杆菌感染)实验的对比,为前面的实验结果作进一步验证和补充。其中control为阴性对照组(即未感染日本血吸虫组);sj为日本血吸虫感染组;bs为枯草芽孢杆菌感染组,经口灌胃。
[0041]
图15表示通过pls-da分析比较三组中肠道菌群的β多样性差异,即肠道菌群结构的差异,发现三组互相分离;其中control为阴性对照组(即未感染日本血吸虫组);sj为日本血吸虫感染组;bs为枯草芽孢杆菌感染组,经口灌胃。
[0042]
图16为通过lefse分析,得到可以区分3组(即对照组、感染日本血吸虫组和感染枯草芽孢杆菌组)的肠道菌群的具体种类的生物标志物;其中control 为阴性对照组(即未感染日本血吸虫组);sj为日本血吸虫感染组;bs为枯草芽孢杆菌感染组,经口灌胃。
[0043]
图17为随机森林分析,得到可以区分2组(即感染日本血吸虫组和感染枯草芽孢杆菌组)的肠道菌群的具体种类的生物标志物,lda score的筛选值≥3;其中control为阴性对照组(即未感染日本血吸虫组);sj为日本血吸虫感染组; bs为枯草芽孢杆菌感染组,经
口灌胃。
[0044]
图18为通过lefse分析,得到可以区分2组(即感染日本血吸虫组和感染枯草芽孢杆菌组)的肠道菌群的具体种类的生物标志物,lda score的筛选值≥3。其中control为阴性对照组(即未感染日本血吸虫组);sj为日本血吸虫感染组; bs为枯草芽孢杆菌感染组,经口灌胃。
具体实施方式
[0045]
下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
[0046]
实施例1高通量测序分析肠道菌群的差异
[0047]
对从肠道菌群获得的总dna进行高通量16s rrna gene测序。
[0048]
1.待检样本dna的提取
[0049]
(1)小鼠购买于广东省动物中心,释放日本血吸虫尾蚴的钉螺购买于上海寄研所。
[0050]
通过贴皮法构建感染日本血吸虫小鼠模型,主要流程为先给小鼠肚皮剃毛,然后用水湿润剃毛部位,把血吸虫尾蚴(分别为5条/只小鼠、10条/只小鼠、15 条/只小鼠、20条/只小鼠或者60条/只小鼠)附在玻片上,贴在小鼠肚皮上,对小鼠进行血吸虫感染实验,持续15min。感染后,分别在7周和8周时间点采集粪便样本。未感染血吸虫的小鼠为对照组。每个组6个重复。
[0051]
对获得的不同时间点(7周和8周时间点)的样本包括动物的肠道及其内容物总dna,或肠道菌群dna的提取和纯化,得到的含有样本中的待检测总dna 的溶液。后续进行高通量测序,找到小鼠感染日本血吸虫的肠道菌群生物标志物。
[0052]
(2)人群数据来源于ncbi(编号prjna625383),感染了血吸虫为感染组(sj);未感染人为对照组(control)。通过来自感染了日本血吸虫的病人和未感染的健康人类的粪便肠道菌群进行比对,找到人类感染日本血吸虫的肠道菌群生物标志物。
[0053]
2.总dna提取和纯化
[0054]
通过hipure stool dna kit试剂盒(购买于广州magen公司),采用dna 聚合酶扩增、琼脂糖凝胶电泳法对取样样本进行菌群dna提取和纯化。
[0055]
3.高通量测序
[0056]
采用16s rrna基因的扩增子测序,
[0057]
引物为:
[0058]
338f 5'-actcctacgggaggcagca-3';
[0059]
806r 5'-ggactachvgggtwtctaat-3'。
[0060]
所述扩增程序为:将配置好的扩增反应体系置于ep管中,95℃变性5min; 95℃30s,50℃30s,72℃40s,25个循环;72℃延伸5min。
[0061]
根据pcr扩增引物序列和barcode序列,获得其相关数据,在下机数据中从各样品原始数据raw data中拆分截去barcode和引物序列相关数据,使用 flash(v1.2.7)对每个样品的reads进行拼接,得到的拼接序列为原始tags数据(raw tags),经过滤处理得到高质
量的tags数据(clean tags)。具体参照 qiime(v1.7.0)的tags质量控制流程,进行如下操作:
[0062]
a.tags截取:将raw tags从连续低质量值(默认质量阈值为《=19)碱基数达到设定长度值为3的第一个低质量碱基位点截断。
[0063]
b.tags长度过滤:tags经过截取后得到的tags数据集,进一步过滤掉其中连续高质量碱基长度小于tags长度75%的tags。
[0064]
经过以上处理后得到的tags进行去除嵌合体序列的处理,tags序列通过 (uchime algorithm)与数据库(gold database)进行比对,检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据(effective tags)。
[0065]
利用uparse软件(uparse v7.0.1001)对所有样品的全部effective tags进行聚类,默认以97%的一致性后将序列聚类成为otus(operational taxonomicunits),同时会选取出现频数最高的序列作为otus的代表序列。对otus代表序列进行物种注释,用mothur方法与silva的ssurrna数据库进行物种注释分析(设定阈值为0.8~1),获得分类学信息并分别在各个分类水平:界 (kingdom)、门(phylum),纲(class)、目(order)、科(family)、属(genus) 和种(species),统计各样本的群落组成。使用muscle(version 3.8.31)软件进行快速多序列比对,得到所有otus代表序列的系统发生关系。最后对各样品的数据进行均一化处理,以样品中数据量最少的为标准进行均一化处理,后续的α多样性分析和β多样性分析都是基于均一化处理后的数据。
[0066]
使用qiime软件(version 1.7.0)基于otu来计算observed-species、chao1、 shannon、simpson、ace、goods coverage和pd whole tree指数,使用r软件 (version 2.25.3)绘制稀释曲线、rank abundance曲线和物种累积曲线,并使用 r软件进行α多样性指数组间差异分析;α多样性指数组间差异分析会分别进行有参数检验和非参数检验,如果只有两组,选用t-test和wilcox检验,如果多于两组,选用的是tukey检验和agricolae包的wilcox检验。
[0067]
用qiime软件(version 1.7.0)计算unifrac距离、构建upgma样品聚类树。使用r软件(version 2.25.3)绘制pca、pcoa和nmds图。pca分析使用r 软件的ade4包和ggplot2软件包,pcoa分析使用r软件的wgcna,stats和 ggplot2软件包,nmds分析使用r软件的vegan软件包。使用r软件进行β多样性指数组间差异分析,分别进行有参数检验和非参数检验,如果只有两组,选用t-test和wilcox检验,如果多于两组,选用的是tukey检验和agricolae包的 wilcox检验。
[0068]
使用lefse软件进行lefse分析,默认设置ldascore的筛选值为4。 metastats分析使用r软件在各分类水平(phylum、class、order、family、genus、 species)下,做组间的permutation test,得到p值,然后利用benjamini and hochbergfalse discovery rate方法对于p值进行修正,得到q值。spearman相关性、主坐标分析(principal co-ordinates analysis,pcoa)、statistical analysis of metagenomicprofiles(stamp)、随机森林(random forest)和受试者特征曲线(roc)通过r语言分析。组间差异显著的物种分析利用r软件做组间t-test检验并作图。
[0069]
实施例2感染日本血吸虫和未感染日本血吸虫小鼠的肠道菌群的差异
[0070]
一、实验方法
[0071]
通过r语言,用α多样性指数组间差异分析和β多样性指数组间差异分析法,分析实施例1的小鼠感染日本血吸虫和未感染日本血吸虫的肠道菌群的差异。
[0072]
二、实验结果
[0073]
α多样性用于分析样品内(within-community)的微生物群落多样性,可以反映样品内的微生物群落的丰富度和多样性。α多样性指数包括丰富度、多样性、均一性等。α多样性运用到肠道菌群分析中,是用来衡量个体内菌群的一个多样性如何,注意是单个个体,不涉及个体间的比较。
[0074]
β多样性的计算是为了表征个体间微生物组成相似性的一个指标,个体之间物种的有无和不一致性通常影响β多样性指数,当然α多样性指数也会影响β多样性指数。
[0075]
感染和未感染日本血吸虫的小鼠肠道菌群在α多样性和β多样性上存在显著差异。从图1和图2可知,感染和未感染日本血吸虫的小鼠肠道菌群out值有显著差异(p《0.05),表明感染和未感染日本血吸虫的小鼠肠道菌群多样性存在显著差异。从图3和图4可知,感染和未感染日本血吸虫的小鼠肠道菌群结构显著不同(permanova《0.05)。其中,pls-da指的是偏最小二乘回归分析法。
[0076]
实施例3感染日本血吸虫和未感染日本血吸虫小鼠的肠道菌群生物标志物 (biomarker)
[0077]
一、实验方法
[0078]
通过r语言,用linear discriminant analysis effect size(lefse)、statisticalanalysis of metagenomic profiles(stamp)和随机森林(random forest)分析实施例1的小鼠感染日本血吸虫与未感染日本血吸虫的肠道菌群在属水平上的变化。
[0079]
二、实验结果
[0080]
图5为lefse分析得到的小鼠感染日本血吸虫与未感染日本血吸虫的肠道菌群的具体种类;图6为stamp分析得到的小鼠感染日本血吸虫与未感染日本血吸虫的肠道菌群的具体种类,右侧为p值,p《0.05表示具有统计学意义;图7 为随机森林分析得到的小鼠感染日本血吸虫与未感染日本血吸虫的肠道菌群的具体种类。其中,“mean decrease accuracy”表示随机森林预测准确性的降低程度,该值越大表示该变量的重要性越大;圆圈不同颜色表示不同细菌,圆圈位置不同表示准确性值。以上结果表明,在属水平上,肠道菌群bacteroides、blautia 等可作为小鼠感染和未感染日本血吸虫的生物标志物。
[0081]
实施例4小鼠肠道菌群标志物与日本血吸虫感染诱导的肝纤维化和肉芽肿等肝损伤存在显著相关性
[0082]
一、实验方法
[0083]
通过r语言,用spearman相关性分析法,分析实施例1的感染日本血吸虫后小鼠肠道菌群的相互作用及与血清学检测指标(包括谷草转氨酶ast和谷丙转氨酶alt)的相关性,然后分析肠道菌群生物标志物bacteroides、blautia和 enterococcus与日本血吸虫感染诱导的肝纤维化和肉芽肿等肝损伤的程度存在显著相关性。
[0084]
二、实验结果
[0085]
spearman相关性分析结果见图8,圆圈大小表示相关性大小,且表示有统计学意义;不同颜色表示相关性是正相关或负相关。通过spearman相关性分析,找到与肉芽肿面积(granuloma)、肝纤维化(fibrosis)、羟脯氨酸水平 (hydroxyproline)、alt和ast存在显著
相关性的小鼠肠道肠道菌群种类。以上结果表明,衡量肝损伤可用肉芽肿面积(granuloma)、肝纤维化(fibrosis)、羟脯氨酸水平(hydroxyproline)以及谷丙转氨酶(alt)、谷草转氨酶(ast) 等指标,这些指标分别与多种感染日本血吸虫后小鼠的肠道菌群呈显著相关性。
[0086]
实施例5感染和未感染日本血吸虫的人类肠道菌群存在差异
[0087]
一、实验方法
[0088]
通过r语言,用主坐标分析法(principal co-ordinates analysis,pcoa)和 analysis of variance(anova)分析法,分析实施例1人感染日本血吸虫与未感染日本血吸虫的肠道菌群在属水平上的变化。
[0089]
二、实验结果
[0090]
anova分析发现,感染和未感染日本血吸虫的人类肠道菌群结构存在显著差异。图9表明,感染和未感染日本血吸虫的人肠道菌群结构差异,结果表明两者的肠道菌群在结构上具有统计学意义(anosim:p《0.05)。图10表明,感染和未感染日本血吸虫的人类肠道菌群中bacteroides、blautia和enterococcus 等菌种丰度存在差异,不同柱状图表示细菌相对丰度大小。
[0091]
实施例6感染和未感染日本血吸虫的人类肠道菌群的生物标志物与小鼠的类似
[0092]
一、实验方法
[0093]
通过r语言,用statistical analysis of metagenomic profiles(stamp)和随机森林(random forest)分析法,分析实施例1人和小鼠感染日本血吸虫和未感染日本血吸虫的肠道菌群在属水平上的变化。
[0094]
二、实验结果
[0095]
人类和小鼠的对感染日本血吸虫前后的肠道菌群生物标志物相似,主要有 bacteroides、blautia和enterococcus。图11表明,stamp分析得到的人类感染日本血吸虫和未感染日本血吸虫的肠道菌群在门、纲、目、科、属水平上的差异,展示了主要的细菌种类,比如blautia菌为感染血吸虫后的生物标志物。图12表明,随机森林分析得到的人类鼠感染日本血吸虫与未感染日本血吸虫的肠道菌群的具体种类。
[0096]
实施例7生物标志物bacteroides、blautia和enterococcus的效能
[0097]
一、实验方法
[0098]
1.单独用bacteroides、blautia或enterococcus的效能
[0099]
通过r语言,用受试者特征曲线(roc)分析法,分析实施例1人和小鼠感染日本血吸虫染与未感染日本血吸虫的肠道菌群在属水平上的变化,得到单独用bacteroides、blautia或enterococcus,预测人类和小鼠的日本血吸虫诱导的肝损伤的灵敏度和特异性。
[0100]
2.bacteroides、blautia或enterococcus的组合效能
[0101]
对bacteroides、blautia或enterococcus进行分组,分为:bacteroides和blautia 组,bacteroides和enterococcus组,blautia和enterococcus组,bacteroides、blautia 和enterococcus组,在r语言上通过受试者特征曲线(roc)分析,分析人类和小鼠感染日本血吸虫染与未感染日本血吸虫的肠道菌群在属水平上的变化,分别用极值排除率为10%、0%和5%的方法计算auc值和统计学意义。
[0102]
二、实验方法
[0103]
1.单独用bacteroides、blautia或enterococcus的效能
[0104]
结果显示生物标志物bacteroides、blautia或enterococcus预测人类和小鼠的日本血吸虫诱导的肝损伤的灵敏度和特异性较高,auc值分别为:人类: 0.8385,0.8182,0.8438;小鼠:0.9639,0.8478,0.5354。除了enterococcus在小鼠的预测效能外,其他数值均有统计学意义(p《0.05)。具体见图13,其中红色线为人类,蓝色线为小鼠。auc(area under curve)表示roc(receiveroperating characteristic curve)曲线下与坐标轴围成的面积,值越接近1表示检测方法真实性越高。
[0105]
2.bacteroides、blautia或enterococcus的组合效能(极值排除率均为10%)
[0106]
结果显示生物标志物bacteroides、blautia和enterococcus之间组合: bacteroides和blautia,bacteroides和enterococcus,blautia和enterococcus, bacteroides、blautia和enterococcus,与人类和小鼠的日本血吸虫诱导的肝损伤的灵敏度和特异性较高,auc值分别为:人类:0.8308,0.8385,0.8701,0.8308;小鼠:0.965,0.9446,0.8596,0.9538。均有统计学意义(p《0.05),具体数值见表1。
[0107]
表1 roc曲线分析肠道菌群组合诊断日本血吸虫诱导的肝损伤的效能(极值排除率为10%)
[0108][0109]
注:a极值排除率均为10%,bp《0.05表示显著差异。
[0110]
3.bacteroides、blautia或enterococcus的组合效能(极值排除率均为0%)
[0111]
结果显示生物标志物bacteroides、blautia和enterococcus之间组合: bacteroides和blautia,bacteroides和enterococcus,blautia和enterococcus, bacteroides、blautia和enterococcus,与人类的日本血吸虫诱导的肝损伤的灵敏度和特异性有差别,与小鼠的日本血吸虫诱导的肝损伤的灵敏度和特异性较高, auc值分别为:人类:0.6727,0.6788,0.8182,0.6667,blautia和enterococcus 组合有统计学意义(p《0.05);小鼠:0.939,0.902,0.719,0.09107,均有统计学意义(p《0.05),具体数据见表2。
[0112]
表2 roc曲线分析肠道菌群组合诊断日本血吸虫诱导的肝损伤的效能(极值排除率为0%)
[0113]
[0114][0115]c极值排除率均为0%,dp《0.05表示显著差异。
[0116]
4.bacteroides、blautia或enterococcus的组合效能(极值排除率均为5%)
[0117]
结果显示生物标志物bacteroides、blautia和enterococcus之间组合: bacteroides和blautia,bacteroides和enterococcus,blautia和enterococcus, bacteroides、blautia和enterococcus,与人类和小鼠赶人日本血吸虫诱导的肝损伤的灵敏度和特异性均较高,auc值分别为:人类:0.7552,0.8385,0.8701, 0.7552;小鼠:0.965,0.9371,0.8287,0.9457。均有统计学意义(p《0.05),具体数据见表3。
[0118]
表3 roc曲线分析肠道菌群组合诊断日本血吸虫诱导的肝损伤的效能
[0119][0120]
注:e极值排除率均为5%,fp《0.05表示显著差异。
[0121]
实施例8感染枯草芽孢杆菌和感染日本血吸虫小鼠的肠道菌群差异
[0122]
一、实验方法
[0123]
使小鼠感染日本血吸虫的方法见实施例1,
[0124]
枯草芽孢杆菌(cmcc(b)63501)购买于索莱宝生物公司,与感染日本血吸虫小鼠同一天对小鼠感染枯草芽孢杆菌,通过lb培养基(每1l水中加胰蛋白胨10g,酵母提取物5g,nacl 10g)扩大培养,途径通过经口灌胃,初始浓度为 3
×
109,每只小鼠每次灌胃0.3ml,第一次感染后隔天灌胃感染,持续到杀小鼠 (感染日本血吸虫后第7周和第8周)的前1周后停止灌胃感染枯草芽孢杆菌。小鼠感染了血吸虫为感染组(sj);感染了枯草芽孢杆菌为其他对照组(bs);未感染组为阴性对照组(control)。
[0125]
对获得的不同时间点(7周和8周时间点)的样本的小鼠肠道及其内容物总 dna,或肠道菌群dna的提取和纯化,得到的含有样本中的待检测总dna的溶液。每个组至少6个重复。
[0126]
通过r语言,用shannon指数、pls-da分析、linear discriminant analysiseffect size(lefse)和随机森林(random forest)分析小鼠感染日本血吸虫、感染枯草芽孢杆菌以及未感染组小鼠的肠道菌群的差异。
[0127]
二、实验结果
[0128]
感染日本血吸虫、感染枯草芽孢杆菌和未感染组的小鼠肠道菌群在α多样性存在差异,其中感染日本血吸虫和感染枯草芽孢杆菌组的小鼠肠道菌群在α多样性存在显著差异。从图14可知,感染日本血吸虫、感染枯草芽孢杆菌和未感染组的小鼠肠道菌群在shannon值有显著差异;且感染日本血吸虫和感染枯草芽孢杆菌组的小鼠肠道菌群在shannon值有显著差异(p《0.05),表明感染日本血吸虫和感染枯草芽孢杆菌组的小鼠肠道菌群多样性存在显著差异。感染日本血吸虫、感染枯草芽孢杆菌和未感染组的小鼠肠道菌群在β多样性多样性上存在差异。从图15可知,感染日本血吸虫、感染枯草芽孢杆菌和未感染组的小鼠肠道菌群结构存在差异,互相分离,其中pls-da指的是偏最小二乘回归分析法。
[0129]
图16为lefse分析得到的感染日本血吸虫、感染枯草芽孢杆菌和未感染组的小鼠肠道菌群的具体种类,默认设置lda score的筛选值≥3;图17为随机森林分析得到的小鼠感染日本血吸虫与感染枯草芽孢杆菌的肠道菌群的具体种类。“mean decrease accuracy”表示随机森林预测准确性的降低程度,该值越大表示该变量的重要性越大;圆圈不同颜色表示不同细菌,圆圈位置不同表示准确性值。图18为lefse分析得到的小鼠感染日本血吸虫与感染枯草芽孢杆菌后的肠道菌群的具体种类,默认设置lda score的筛选值≥3。以上结果表明,在属水平上,肠道菌群bacteroides、blautia等是感染日本血吸虫、感染枯草芽孢杆菌和未感染组的小鼠的生物标志物。
[0130]
对比例1其他生物标志物如lachnospiraceae_nk4a136_group、desulfovibrio、 alistipes和lactobacillus的灵敏度和特异性测定
[0131]
一、实验方法
[0132]
通过r语言,用受试者特征曲线(roc)分析法,分析人类和小鼠感染日本血吸虫染与未感染日本血吸虫的肠道菌群在属水平上的变化。
[0133]
二、实验结果
[0134]
结果显示生物标志物lachnospiraceae_nk4a136_group、desulfovibrio、 alistipes和lactobacillus预测小鼠的日本血吸虫诱导的肝损伤的灵敏度和特异性较高,auc值分别为小鼠:0.7560、0.7756、0.7102和0.6710,而人类只有相对丰度较高的alistipes作为生物标志物,auc值为0.6303,没有显著性。总的来说,基于auc值和显著性比较,虽然这几种肠道微生物作为预测是否感染日本血吸虫的生物标志物具有一定的灵敏度和特异性,但是均没有bacteroides、 blautia和enterococcus作为生物标志物的效果好。具体数值见表4,因人群部分细菌的相对丰度较小,为减少误差而被排除分析。
[0135]
表4其他生物标志物:lachnospiraceae_nk4a136_group、desulfovibrio、alistipes 和lactobacillus的灵敏度和特异性
[0136]
[0137]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1