一种碳硼烷类手性化合物、其制备方法及其光学纯度的分析检测方法和应用
1.本发明涉及一种碳硼烷类手性化合物、其制备方法及其光学纯度的分析检测方法和应用,属于有机合成领域。
背景技术:
2.手性化合物是指分子量、分子结构相同,但左右排列相反,如实物与其镜中的映体。手性二醇化合物不仅仅广泛存在于生物界中,且在有机合成中也具有非常重要的作用。手性二醇化合物在有机催化中是一类应用非常广泛的手性配体,同时也是制备手性双胺、手性二膦等化合物的起始原料。
3.手性芳基邻二醇是具有光学特性的手性化合物,是合成许多光学纯药物的重要中间体。手性芳基邻二醇中不仅含有两个羟基,还含有药物分子中常见的芳环,可以通过官能团的转化,作为一些药物的先导化合物,是许多光学纯药物的重要中间体,同时在农药、信息素、香料原料、材料等精细化工领域也有广泛的应用价值。如(r)-苯乙二醇可以用于制备β-内酰胺类抗生素,治疗精神紊乱等各种代谢问题。除此之外,手性二醇还可作为不对称合成中的手性配体、手性助剂和手性合成砌块,具有较好的对映选择性和催化性能。但是,目前的手性二醇在作为不对称合成中的手性配体时,对映选择性和催化性能还有待提高。
技术实现要素:
4.本发明的目的在于提供一种碳硼烷类手性化合物,作为不对称合成中的手性配体时,具有较好的对映选择性和催化性能。
5.本发明的第二个目的在于提供一种碳硼烷类手性化合物的制备方法。
6.本发明的第三个目的在于提供一种碳硼烷类手性化合物的光学纯度的分析检测方法。
7.本发明的第四个目的在于提供一种碳硼烷类手性化合物在手性催化领域中的应用。
8.本发明的碳硼烷类手性化合物的技术方案为:
9.一种碳硼烷类手性化合物,所述碳硼烷类手性化合物具有式i、ii或iii所示的结构,
[0010][0011]
其中,r1~r5各自独立地选自氢、c
1-c
20
烷基、c
1-c
20
烷氧基、c
1-c
20
氟代烷基或卤代基。
[0012]
本发明的碳硼烷类手性化合物作为不对称合成中的手性配体时,具有较好的对映选择性和催化性能。
[0013]
优选地,所述c
1-c
20
烷基为c
1-c5烷基。
[0014]
优选地,所述c
1-c
20
烷氧基为c
1-c5烷氧基。
[0015]
优选地,所述c
1-c
20
氟代烷基为c
1-c5氟代烷基。
[0016]
优选地,所述r1~r5中有且只有一个为c
1-c5烷基、c
1-c5烷氧基、c
1-c5氟代烷基或卤代基,其余为氢。
[0017]
优选地,所述c
1-c5烷基为甲基或乙基。
[0018]
进一步优选地,所述c
1-c5烷基为甲基。
[0019]
所述卤代基为-f、-cl、-br、-i。优选地,所述卤代基为-cl或-f。
[0020]
优选地,所述r1和r5为氢;r2~r4各自独立地选自c
1-c5烷氧基。
[0021]
本发明的碳硼烷类手性化合物的制备方法的技术方案为:
[0022]
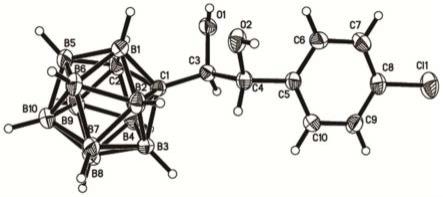
一种如上所述的碳硼烷类手性化合物的制备方法,包括以下步骤:将反应物m进行不对称双羟化反应,即得;所述反应物m具有式a、b或c所示的结构,
[0023][0024]
其中,r1~r5各自独立地选自氢、c
1-c
20
烷基、c
1-c
20
烷氧基、c
1-c
20
氟代烷基或卤代基。
[0025]
自1987年sharpless发现用金鸡纳碱衍生物可以催化烯烃不对称双羟基化反应,人们对手性二醇的合成进行了广泛的研究。本发明将反应物m进行不对称双羟化反应,得到上述碳硼烷类手性化合物,因此,本发明的碳硼烷类手性化合物的制备方法具有一般双羟化反应的操作简单,制备条件温和和制备时间较短的优点,是一种高效的、环境友好的制备方法。
[0026]
本发明的反应物m中烯烃为反式结构。
[0027]
优选地,所述c
1-c
20
烷基为c
1-c5烷基。
[0028]
优选地,所述c
1-c
20
烷氧基为c
1-c5烷氧基。
[0029]
优选地,所述c
1-c
20
氟代烷基为c
1-c5氟代烷基。
[0030]
优选地,所述r1~r5中有且只有一个为c
1-c5烷基、c
1-c5烷氧基、c
1-c5氟代烷基或卤代基,其余为氢。
[0031]
优选地,所述c
1-c5烷基为甲基或乙基。
[0032]
进一步优选地,所述c
1-c5烷基为甲基。
[0033]
所述卤代基为-f、-cl、-br、-i。优选地,所述卤代基为-cl或-f。
[0034]
优选地,所述r1和r5为氢;r2~r4各自独立地选自c
1-c5烷氧基。
[0035]
不对称双羟化反应是将反应物m中的烯属碳碳双键转化为二元醇,不对称双羟化反应的具体实施过程可以参考现有技术来完成。优选地,所述不对称双羟化反应包括以下步骤:将反应物m加入到包含催化体系的溶液中,进行不对称双羟化反应,反应完成后淬灭反应。
[0036]
优选地,所述催化体系包括催化剂、助氧化剂、配体、碱和水解促进剂。在催化剂和助氧化剂的作用下,烯基碳硼烷类反应物首先被氧化成酯,然后生成的酯在水解促进剂的作用下通过水解即得碳硼烷类手性化合物。
[0037]
为了不影响反应效率和产物的收率与ee值,优选地,所述反应物m、助氧化剂和水
解促进剂的摩尔比为1:(1~3):(1~3)。
[0038]
优选地,所述水解促进剂为甲磺酰胺。
[0039]
优选地,所述催化剂选自k2oso4和/或k2oso4水合物。
[0040]
优选地,所述助氧化剂选自k3[fe(cn)6]和/或4-甲基吗啡-n-氧化物。
[0041]
所述配体为金鸡纳碱衍生物。优选地,所述配体选自(dhq)2phal、(dhqd)2phal、dhq-ind和dhqd-ind中的一种或任意组合。(dhq)2phal为氢化奎宁1,4(2,3-二氮杂萘)二醚,(dhqd)2phal为氢化奎尼定1,4(2,3-二氮杂萘)二醚。
[0042]
优选地,所述碱选自碳酸钾、碳酸钠、碳酸铯、碳酸氢钾、碳酸氢钠、naoh、koh、lioh、nh4oh,tbuona、t-buok、t-buoli、碳酸铯、三乙胺、二异丙基乙基氨、dbu、吡啶和对二甲氨基吡啶中的一种或多种。
[0043]
进一步优选地,所述碱为碳酸钾。
[0044]
所述包含催化体系的溶液由催化体系和溶剂组成。为了使催化体系中的化合物充分溶解,优选地,所述溶液中溶剂由有机溶剂和水组成;所述有机溶剂和水的体积比为1:(1~3);所述有机溶剂选自叔丁醇、丙酮、二甲亚砜、乙腈中的一种或任意组合。
[0045]
优选地,所述不对称双羟化反应的时间为5~30h。
[0046]
进一步优选地,所述不对称双羟化反应的时间为8~12h。
[0047]
优选地,所述不对称双羟化反应的温度为0~25℃。
[0048]
优选地,所述淬灭反应包括以下步骤:将亚硫酸氢钠加入反应体系中,搅拌0.5h。
[0049]
优选地,所述不对称双羟化反应还包括以下步骤:淬灭反应后依次进行萃取、干燥处理。
[0050]
为了更好地萃取反应产物,优选地,所述萃取所用的有机溶剂选自二氯甲烷、乙酸乙酯、正丁醇中的一种或任意组合。
[0051]
本发明的碳硼烷类手性化合物的光学纯度的分析检测方法的技术方案为:
[0052]
一种碳硼烷类手性化合物的光学纯度的分析检测方法,包括以下步骤:将样品使用高效液相色谱法进行色谱分析检测;所述样品包含上述碳硼烷类手性化合物;所述色谱分析条件包括:色谱柱为手性oj-h或od-h柱,流动相为体积比为(80~95):(5~20)的正己烷和异丙醇,流速为0.8~1.0ml/min,柱温为20~30℃。
[0053]
进一步优选地,所述色谱分析条件包括:色谱柱为手性od-h柱,流动相为体积比为95:5的正己烷和异丙醇,流速为0.8ml/min,柱温为27℃。
[0054]
通常情况下,制备的手性化合物以r型异构体和s型异构体的形式出现,本发明的碳硼烷类手性化合物的光学纯度的分析检测方法可以实现上述碳硼烷类手性化合物r型异构体的光学纯度准确定量分析。
[0055]
优选地,所述高效液相色谱法通过配备有紫外检测器的高效液相色谱仪进行;所述检测波长为210nm。
[0056]
本发明的碳硼烷类手性化合物作为手性配体在手性催化领域中的应用的技术方案为:
[0057]
一种上述碳硼烷类手性化合物作为手性配体在手性催化领域中的应用。
[0058]
将上述碳硼烷类手性化合物作为手性配体应用于手性催化领域中,具有较好的对映选择性和催化性能。
附图说明
[0059]
图1为实施例12制得的碳硼烷类手性化合物(化合物2a)的核磁共振氢谱图;
[0060]
图2为实施例12制得的碳硼烷类手性化合物(化合物2a)的核磁共振碳谱图;
[0061]
图3为实施例12制得的碳硼烷类手性化合物(化合物2a)的核磁共振硼谱图;
[0062]
图4为实施例12制得的碳硼烷类手性化合物(化合物2a)的单晶衍射结构图;
[0063]
图5为实施例23测试所得的高效液相色谱图。
具体实施方式
[0064]
下面结合具体实施方式对本发明的技术方案进一步说明。
[0065]
一、本发明的碳硼烷类手性化合物的具体实施例如下:
[0066]
实施例1
[0067]
本实施例的碳硼烷类手性化合物(化合物2a)的结构式如下:
[0068][0069]
实施例2
[0070]
本实施例的碳硼烷类手性化合物(化合物2b)的结构式如下:
[0071][0072]
实施例3
[0073]
本实施例的碳硼烷类手性化合物(化合物2c)的结构式如下:
[0074][0075]
实施例4
[0076]
本实施例的碳硼烷类手性化合物(化合物2d)的结构式如下:
[0077][0078]
实施例5
[0079]
本实施例的碳硼烷类手性化合物(化合物2e)的结构式如下:
[0080][0081]
实施例6
[0082]
本实施例的碳硼烷类手性化合物(化合物2f)的结构式如下:
[0083][0084]
实施例7
[0085]
本实施例的碳硼烷类手性化合物(化合物2g)的结构式如下:
[0086][0087]
实施例8
[0088]
本实施例的碳硼烷类手性化合物(化合物2h)的结构式如下:
[0089][0090]
实施例9
[0091]
本实施例的碳硼烷类手性化合物(化合物2i)的结构式如下:
[0092][0093]
实施例10
[0094]
本实施例的碳硼烷类手性化合物(化合物2j)的结构式如下:
[0095][0096]
实施例11
[0097]
本实施例的碳硼烷类手性化合物(化合物2k)的结构式如下:
[0098][0099]
二、本发明的碳硼烷类手性化合物的制备方法的具体实施例如下:
[0100]
以下碳硼烷类手性化合物的制备方法的实施例(实施例12-22)中的收率均为不对称双羟化反应(步骤2)的收率。
[0101]
实施例12
[0102]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例1(化合物2a)的碳硼烷类手性化合物,包括以下步骤:
[0103]
(1)在n2保护下,向反应瓶中加入66mg打磨后的碎镁屑和25ml无水乙醚,将反应瓶置于35℃水浴中搅拌,然后缓慢滴加1-溴亚甲基邻碳硼烷(500mg,2.1mmol)和120ml无水乙醚形成的溶液,滴加完毕后,在室温下继续反应3h,待镁屑全部消失后,将反应体系降至0℃,继续搅拌20min,然后缓慢滴加4-氯苯甲醛(351mg,2.5mmol)和90ml无水乙醚形成的溶液,继续在0℃下反应3h,将反应产物进行减压蒸馏,得到固体产物,然后在n2保护下,将得到的固体产物、对甲苯磺酸(15mg,0.1mmol)和500ml甲苯加入单口瓶中,回流反应14h,反应结束后,将反应产物通过减压蒸馏和柱层析分离(以石油醚为展开剂)得到化合物1a。
[0104]
(2)在25℃下,将9.88g(0.03mol)铁氰化钾(k3[fe(cn)6])、2.76g(0.02mol)碳酸钾(k2co3)、0.05g(0.15mmol)二水锇酸钾(k2oso4·
2h2o)和0.039g(0.05mmol)氢化奎宁1,4(2,3-二氮杂萘)二醚((dhq)2·
phal)溶于25ml叔丁醇(t-buoh)和75ml水中,然后将形成的溶液置于反应器中,搅拌10min;再将5.63g(0.02mol)反应物1a溶解在叔丁醇中,然后将反应物1a的叔丁醇溶液和2.85g(0.03mol)甲磺酰胺(ch3so2nh2)加入到上述反应器中,继续搅拌12h;最后向反应器中加入5.0g亚硫酸氢钠,在25℃下进行搅拌30min,得到反应产物,然后将反应产物用200ml乙酸乙酯萃取3次,将萃取液用干燥剂(无水硫酸钠)干燥后,再经减压蒸馏,除去溶剂,得到5.81g白色固体状化合物2a,收率为92%,ee值为97.5%。
[0105]
本实施例的碳硼烷类手性化合物(化合物2a)的合成路线如下:
[0106][0107]
对化合物2a进行核磁分析,图1-3分别为化合物2a的氢谱、碳谱和硼谱图,所得化合物2a的表征数据如下:
[0108]
化合物2a,rf=0.17(己烷/乙酸乙酯=5:1.),熔点:165-167℃;1h nmr(300mhz,cdcl3)δ=7.41-7.26(m,4h),4.99(d,j=4.2hz,1h),4.16-4.03(m,2h),3.24(d,j=9.8hz,1h),2.36(d,j=4.7hz,1h);
13
c{1h}nmr(75mhz,cdcl3)δ=138.52,134.54,129.01,127.28,75.50,72.40,57.91;
11
b nmr(128mhz,cdcl3)δ=-3.28(t,j=157.9hz,3b),-7.19
‑‑
45.36(m,7b)。
[0109]
采用单晶衍射对化合物2a的结构进一步确认,由图4可知,单晶结构中,分子间氢键有序的排列,可能是因为碳硼烷和苯环的差异性,导致它们附近的羟基形成交错的氢键,并且碳硼烷特殊的电子效应也加强它们的氢键作用力,为进一步研究碳硼烷控制反应的立体过渡态诱导手性提供了初步的理论依据。
[0110]
实施例13
[0111]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例2(化合物2b)的碳硼烷类手性化合物,包括以下步骤:
[0112]
(1)在n2保护下,向反应瓶中加入38mg打磨过的碎镁屑和12ml无水乙醚,将反应瓶置于35℃油浴中搅拌,然后缓慢滴加1-溴亚甲基邻碳硼烷(295mg,1.2mmol)和90ml无水乙醚形成的溶液,滴加完毕后,在室温下反应2.5h,待镁屑全部消失后,将反应体系降至0℃,继续搅拌20min,然后缓慢滴加苯甲醛(148.6mg,1.4mmol)和45ml无水乙醚形成的溶液,继续在0℃下反应3h,将反应产物进行减压蒸馏,得到固体产物,然后在n2保护下,将得到的固体产物、对甲苯磺酸(12mg,0.08mmol)和90ml甲苯加入单口瓶中,回流反应12h,反应结束后,将反应产物通过减压蒸馏和柱层析分离(以石油醚为展开剂)得到化合物1b。
[0113]
(2)在0℃下,将6.58g(0.02mol)铁氰化钾(k3[fe(cn)6])、1.38g(0.01mol)碳酸钾(k2co3)、0.033g(0.1mmol)二水锇酸钾(k2oso4·
2h2o)和0.39g(0.5mmol)氢化奎尼定1,4(2,3-二氮杂萘)二醚((dhqd)2·
phal)溶于25ml丙酮(ch3coch3)和25ml水中,然后将形成的溶液置于反应器中,搅拌10min;再将2.46g(0.01mol)反应物1b溶解在25ml丙酮中,然后将反应物1b的丙酮溶液和0.95g(0.01mol)甲磺酰胺(ch3so2nh2)加入到上述反应器中,继续搅拌8h;最后向反应器中加入2.5g亚硫酸氢钠,在25℃下进行搅拌30min,得到反应产物,然后将反应产物用200ml二氯甲烷萃取3次,将萃取液用干燥剂(无水硫酸钠)干燥后,再经减压蒸馏,除去溶剂,得到2.49g白色固体化合物2b,收率为89%,ee值为97%。本实施例的碳硼烷类手性化合物(化合物2b)的合成路线如下:
[0114][0115]
对化合物2b进行核磁分析,所得化合物2b的表征数据如下:
[0116]
化合物2b,rf=0.23(己烷/乙酸乙酯=5/1),熔点:122-124℃;1h nmr(300mhz,
cdcl3)δ=7.45-7.30(m,5h),4.99(d,j=3.7hz,1h),4.17(d,j=9.5hz,1h),4.09(s,1h),3.28(d,j=9.6hz,1h),2.34(d,j=4.3hz,1h);
13
c{1h}nmr(75mhz,cdcl3)δ=140.17,128.87,128.69,125.84,77.54,75.55,73.03,58.08;
11
b nmr(128mhz,cdcl3)δ=-3.33(t,j=160.4hz),-11.31(dt,j=406.0,152.8hz,7b)。
[0117]
实施例14
[0118]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例3(化合物2c)的碳硼烷类手性化合物,包括以下步骤:
[0119]
(1)在n2保护下,向反应瓶中加入1.5g打磨过的镁屑和100ml无水乙醚,将反应瓶置于35℃油浴中搅拌,然后缓慢滴加1-溴亚甲基邻碳硼烷(10g,0.04mol)和300ml无水乙醚形成的溶液,滴加完毕后,在室温下反应4.5h,待镁屑全部消失后,将反应体系降至8℃,继续搅拌30min,然后缓慢滴加4-甲基苯甲醛(6g,0.05mol)和100ml无水乙醚形成的溶液,继续在8℃下反应3h,将反应产物进行减压蒸馏,得到固体产物,然后在n2保护下,将得到的固体产物、对甲苯磺酸(0.6g,3.5mmol)和500ml甲苯加入单口瓶中,回流反应14h,反应结束后,将反应产物通过减压蒸馏和柱层析分离(以石油醚为展开剂)得到化合物1c。
[0120]
(2)在25℃下,将13.17g(0.04mol)铁氰化钾(k3[fe(cn)6])、4.84g(0.035mol)碳酸钾(k2co3)、0.066g(0.2mmol)二水锇酸钾(k2oso4·
2h2o)和0.078g(0.1mmol)氢化奎宁1,4(2,3-二氮杂萘)二醚((dhq)2·
phal)溶于25ml叔丁醇(t-buoh)和75ml水中,然后将形成的溶液置于反应器中,搅拌10min;再将7.38g(0.03mol)反应物1c溶解在25ml叔丁醇中,然后将反应物1c的叔丁醇溶液和2.85g(0.03mol)甲磺酰胺加入到上述反应器中,继续搅拌12h;最后向反应器中加入5.0g亚硫酸氢钠,在25℃下进行搅拌30min,得到反应产物,然后将反应产物用200ml乙酸乙酯萃取3次,将萃取液用干燥剂(无水硫酸钠)干燥后,再经减压蒸馏,除去溶剂,得到7.59g白色固体状化合物2c,收率为91%,ee值为92%。本实施例的碳硼烷类手性化合物(化合物2c)的合成路线如下:
[0121]
[0122]
对化合物2c进行核磁分析,所得化合物2c的表征数据如下:
[0123]
化合物2c,rf=0.31(己烷/乙酸乙酯=5/1),熔点:131-133℃;1h nmr(300mhz,cdcl3)δ=7.20(s,4h),4.92(d,j=4.1hz,1h),4.14(d,j=9.2hz,1h),4.06(s,1h),3.31(d,j=9.3hz,1h),2.35(d,j=5.1hz,4h);
13
c{1h}nmr(75mhz,cdcl3)δ=138.64,137.15,129.52,125.79,77.63,75.53,72.92,58.06,21.12;
11
b nmr(128mhz,cdcl3)δ=-0.18
‑‑
5.63(m,3b),-7.20
‑‑
16.64(m,7b)。
[0124]
实施例15
[0125]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例4(化合物2d)的碳硼烷类手性化合物,包括以下步骤:
[0126]
(1)在n2保护下,向反应瓶中加入66mg打磨后的碎镁屑和25ml无水乙醚,将反应瓶置于35℃水浴中搅拌,然后缓慢滴加1-溴亚甲基邻碳硼烷(500mg,2.1mmol)和120ml无水乙醚形成的溶液,滴加完毕后,在室温下继续反应3h,待镁屑全部消失后,将反应体系降至0℃,继续搅拌20min,然后缓慢滴加3-甲基苯甲醛(300mg,2.5mmol)和90ml无水乙醚形成的溶液,继续在0℃下反应3h,将反应产物进行减压蒸馏,得到固体产物,然后在n2保护下,将得到的固体产物、对甲苯磺酸(15mg,0.1mmol)和500ml甲苯加入单口瓶中,回流反应14h,反应结束后,将反应产物通过减压蒸馏和柱层析分离(以石油醚为展开剂)得到化合物1d。
[0127]
(2)在25℃下,将9.88g(0.03mol)铁氰化钾(k3[fe(cn)6])、2.76g(0.02mol)碳酸钾(k2co3)、0.05g(0.15mmol)二水锇酸钾(k2oso4·
2h2o)和0.039g(0.05mmol)氢化奎宁1,4(2,3-二氮杂萘)二醚((dhq)2·
phal)溶于25ml乙腈(ch3cn)和50ml水中,然后将形成的溶液置于反应器中,搅拌10min;再将4.92g(0.02mol)反应物1d溶解在乙腈中,然后将1d的乙腈溶液和1.9g(0.02mol)甲磺酰胺(ch3so2nh2)加入到上述反应器中,继续搅拌12h;最后向反应器中加入5.0g亚硫酸氢钠,在25℃下进行搅拌30min,得到反应产物,然后将反应产物用200ml叔丁醇萃取3次,将萃取液用干燥剂(无水硫酸钠)干燥后,再经减压蒸馏,除去溶剂,得到4.67g白色固体状化合物2d,收率为84%,ee值为97%。本实施例的碳硼烷类手性化合物(化合物2d)的合成路线如下:
[0128][0129]
对化合物2d进行核磁分析,所得化合物2d的表征数据如下:
[0130]
化合物2d,rf=0.29(正己烷/乙酸乙酯=5:1),熔点:124-125℃;1h nmr(300mhz,cdcl3)δ=7.31-7.20(m,1h),7.12(q,j=7.7hz,3h),4.91(s,1h),4.13(d,j=9.1hz,1h),4.04(s,1h),3.28(d,j=9.3hz,1h),2.37(d,j=7.3hz,4h);
13
c{1h}nmr(75mhz,cdcl3)δ=140.10,138.70,129.43,128.77,126.45,122.83,77.66,75.51,73.02,58.05,21.44;
11
b nmr(128mhz,cdcl3)δ=-0.25
‑‑
6.27(m,3b),-11.29(dt,j=401.1,153.9hz,7b)。
[0131]
实施例16
[0132]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例5(化合物2e)的碳硼烷类手性化合物,本实施例与实施例12的区别在于,将2.5mmol 4-氯苯甲醛替换为2.5mmol对甲氧基苯甲醛,本实施例制备得到的化合物2e的收率为74%,ee值为96%,对化合物2e进行核磁分析,所得化合物2e的表征数据如下:
[0133]
化合物2e:rf=0.19(己烷/乙酸乙酯=3/1);1h nmr(300mhz,cdcl3)δ=7.33
–
7.17(m,2h),6.89(d,j=8.6hz,2h),4.89(s,1h),4.12(d,j=8.3hz,1h),4.06(s,1h),3.80(s,3h),3.36(d,j=9.0hz,1h),2.34(s,1h);
13
c{1h}nmr(75mhz,cdcl3)δ=159.82,132.23,127.30,114.21,77.65,75.48,72.74,58.08,55.34;
11
b nmr(128mhz,cdcl3)δ=-3.39(t,j=163.0hz,3b),-7.20
‑‑
16.89(m,7b)。
[0134]
实施例17
[0135]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例6(化合物2f)的碳硼烷类手性化合物,本实施例与实施例12的区别在于,将2.5mmol 4-氯苯甲醛替换为2.5mmol 3,4,5-三甲氧基苯甲醛,本实施例制备得到的化合物2f的收率为76%,ee值为99.5%,对化合物2f进行核磁分析,所得化合物2f的表征数据如下:
[0136]
化合物2f:rf=0.18(己烷/乙酸乙酯=1/1);1h nmr(300mhz,cdcl3)δ=6.42(s,2h),4.84(s,1h),4.18(d,j=7.9hz,1h),4.13(s,1h),3.80(s,6h),3.76(s,3h),2.84(s,1h),2.04(s,1h);
13
c{1h}nmr(75mhz,cdcl3)δ=153.08,137.06,136.64,102.56,77.73,
75.19,73.10,60.90,58.08,55.99;
11
b nmr(128mhz,cdcl3)δ=-2.75(d,j=154.0hz,3b),-7.36
‑‑
17.19(m,7b)。
[0137]
实施例18
[0138]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例7(化合物2g)的碳硼烷类手性化合物,本实施例与实施例12的区别在于,将2.5mmol 4-氯苯甲醛替换为2.5mmol 3-三氟甲基苯甲醛,本实施例制备得到的化合物2g的收率为87%,ee值为95%,对化合物2g进行核磁分析,所得化合物2g的表征数据如下:
[0139]
化合物2g:rf=0.24(己烷/乙酸乙酯=5/1);1h nmr(300mhz,cdcl3)δ=7.62(s,2h),7.52(dd,j=3.1,2.0hz,2h),5.08(d,j=3.0hz,1h),4.16(d,j=9.8hz,1h),4.08(s,1h),3.27(d,j=10.0hz,1h),2.54(d,j=4.1hz,1h);
13
c{1h}nmr(75mhz,cdcl3)δ=141.07,131.22(q,j=32.33hz),129.32,129.27,125.46(q,j=3.7hz),123.8(q,j=270.75hz),122.73(q,j=3.8hz),77.20,75.46,72.43,57.91;
11
b nmr(128mhz,cdcl3)δ=-0.87
‑‑
5.63(m,3b),-7.27
‑‑
16.48(m,7b);
19
f nmr(376mhz,cdcl3)δ=-62.6。
[0140]
实施例19
[0141]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例8(化合物2h)的碳硼烷类手性化合物,本实施例与实施例12的区别在于,将2.5mmol 4-氯苯甲醛替换为2.5mmol对叔丁基苯甲醛,本实施例制备得到的化合物2h的收率为88%,ee值为99%,对化合物2h进行核磁分析,所得化合物2h的表征数据如下:
[0142]
化合物2h:rf=0.29(己烷/乙酸乙酯=5/1);1h nmr(300mhz,cdcl3)δ=7.41(d,j=8.3hz,2h),7.29(s,2h),4.97(d,j=2.3hz,1h),4.17(d,j=9.4hz,1h),4.09(s,1h),3.31(d,j=9.5hz,1h),2.27(d,j=3.7hz,1h),1.31(s,9h);
13
c{1h}nmr(75mhz,cdcl3)δ=152.04,137.28,125.96,125.79,77.87,75.57,73.02,58.15,34.78,31.41;
11
b nmr(128mhz,cdcl3)δ=-1.12
‑‑
5.79(m,3b),-7.43
‑‑
16.48(m,7b)。
[0143]
实施例20
[0144]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例9(化合物2i)的碳硼烷类手性化合物,本实施例与实施例12的区别在于,将2.5mmol 4-氯苯甲醛替换为2.5mmol对三氟甲基苯甲醛,本实施例制备得到的化合物2i的收率为87%,ee值为95%,对化合物2i进行核磁分析,所得化合物2i的表征数据如下:
[0145]
化合物2i:rf=0.22(己烷/乙酸乙酯=5/1);1h nmr(300mhz,cdcl3)δ=7.65(d,j=8.2hz,2h),7.46(d,j=8.2hz,2h),5.08(d,j=2.5hz,1h),4.15(d,j=9.8hz,1h),4.08(s,1h),3.29(d,j=10.0hz,1h),2.60(d,j=4.5hz,1h);
13
c{1h}nmr(75mhz,cdcl3)δ=143.96(d,j=1.2hz),130.81(q,j=32.4hz).126.23,125.76(q,j=3.7hz).123.82(q,j=270.9hz),77.20,75.50,72.43,57.88;
11
b nmr(128mhz,cdcl3)δ=-3.20(t,j=160.6hz,3b),-11.84(dt,j=252.8,208.9hz,7b);
19
f nmr(376mhz,cdcl3)δ=-62.6。
[0146]
实施例21
[0147]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例10(化合物2j)的碳硼烷类手性化合物,本实施例与实施例12的区别在于,将2.5mmol 4-氯苯甲醛替换为2.5mmol对氟苯甲醛,本实施例制备得到的化合物2j的收率为89%,ee值为97%,对化合物2j进行核磁分析,所得化合物2j的表征数据如下:
[0148]
化合物2j:rf=0.26(己烷/乙酸乙酯=5/1.);1h nmr(300mhz,cdcl3)δ=7.34-7.29(m,2h),7.10-7.04(m,2h),4.97(s,1h),4.13(s,1h),4.07(s,1h),3.33(s,1h),2.46(s,1h);
13
c{1h}nmr(75mhz,cdcl3)δ=164.36,161.08,135.91(d,j=3.2hz),127.71(d,j=8.3hz),115.78(d,j=21.7hz),75.52,72.40,57.97;
11
b nmr(128mhz,cdcl3)δ=-1.03
‑‑
5.95(m,3b),-7.04
‑‑
16.34(m,7b);
19
f nmr(376mhz,cdcl3)δ=-112.9。
[0149]
实施例22
[0150]
本实施例的碳硼烷类手性化合物的制备方法得到的是实施例11(化合物2k)的碳硼烷类手性化合物,本实施例与实施例12的区别在于,将2.5mmol 4-氯苯甲醛替换为2.5mmol 2-甲基苯甲醛,本实施例制备得到的化合物2k的收率为87%,ee值为99.5%,对化合物2k进行核磁分析,所得化合物2k的表征数据如下:
[0151]
化合物2k:rf=0.26(己烷/乙酸乙酯=5/1);1h nmr(300mhz,cdcl3)δ=7.42-7.47(m,1h),7.34-7.08(m,3h),5.23(s,1h),4.10(d,j=8.2hz,1h),3.26(d,j=9.8hz,1h),2.33(s,3h),2.27(s,1h);
13
c{1h}nmr(75mhz,cdcl3)δ=138.01,133.92,130.90,128.45,126.45,125.52,77.43,73.75,69.44,57.99,19.28;
11
b nmr(128mhz,cdcl3)δ=-0.18
‑‑
5.95(m,3b),-7.43
‑‑
16.18(m,7b)。
[0152]
三、本发明的碳硼烷类手性化合物的光学纯度的分析检测方法的具体实施例如下:
[0153]
实施例23
[0154]
本实施例对实施例12制备的碳硼烷类手性化合物的光学纯度(ee值)进行分析检测,包括以下步骤:将实施例12制备的碳硼烷类手性化合物的甲醇溶液(浓度为0.1g/ml)注入配备有紫外检测器的高效液相色谱仪中,记录色谱图;其中,高效液相色谱仪的型号为lc-20a;色谱分析条件包括:色谱柱为手性od-h柱(4.6mm
×
250mm),流动相为体积比为95:5的正己烷和异丙醇,流速为0.8ml/min,柱温为27℃;紫外检测器的检测波长为210nm。通过计算得到光学纯度ee值,光学纯度ee值计算方法如下:
[0155][0156]
其中:a(s构型)代表产物中对映异构体s构型的色谱峰面积;a(r构型)代表产物中对映异构体r构型的色谱峰面积。
[0157]
测试所得的高效液相色谱图如图5所示,高效液相色谱图的分析结果如表1所示,计算可得,制备的化合物2a的光学纯度为97.5%。
[0158]
表1高效液相色谱图的分析结果
[0159]
化合物保留时间(min)峰宽(min)峰高(mau)峰面积(%)r构型7.8980.5170628.4313498.7762s构型10.4030.54957.373921.2238
[0160]
四、本发明的碳硼烷类手性化合物作为手性配体在手性催化领域中的应用的具体实施例如下:
[0161]
将实施例1、实施例2、实施例3、实施例4、实施例5、实施例6、实施例7、实施例8、实施例9、实施例10或实施例11的碳硼烷类手性化合物作为手性配体应用于手性催化领域中即可。
[0162]
实验例
[0163]
以芳香醛和二乙基锌的不对称加成反应作为模板反应来评价基于手性化合物(手性配体)的催化剂的催化性能。具体步骤如下:在氩气氛围下,将0.025mmol手性化合物溶于无水四氢呋喃中,再加入0.25mmol异丙醇钛,搅拌1h,得到基于手性化合物的催化剂,然后再加入2ml浓度为1mol/l的二乙基锌的正己烷溶液,室温下搅拌20min,最后加入0.25mmol芳香醛类反应物,在室温下搅拌反应24h,反应结束后,用1ml饱和氯化铵溶液淬灭反应,然后加入25ml水,再用25ml乙酸乙酯萃取三次,合并有机相,将有机相用无水硫酸钠干燥,然后经减压蒸馏,除去溶剂,得到产物手性芳香醇(r构型化合物),实验结果如表2所示。
[0164]
表2基于不同手性化合物(手性配体)的催化剂的催化性能
[0165][0166]
从表2可知,基于本发明的碳硼烷类手性化合物制得的催化剂对2-甲氧基-苯甲醛和邻氯苯甲醛与二乙基锌的不对称加成反应均有较好的催化作用,并且其催化效果优于其他手性二醇(如1,2-二对溴苯基乙二醇的r型异构体和1,2-二间溴苯基乙二醇的r型异构体)的催化效果;其中化合物2c的作用较强,对于2-甲氧基-苯甲醛的催化活性和对映选择性优于1,2-二对溴苯基乙二醇的r型异构体。说明本发明提供的碳硼烷类手性化合物具有良好的催化活性和对映选择性,在手性合成领域具有潜在用途。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1