弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物及其分离纯化方法和应用
1.本发明涉及氧杂蒽酮类化合物分离纯化技术领域。具体地说是弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物及其分离纯化方法和应用。
背景技术:
2.由于抗生素的滥用或者不合理使用,各种类型的耐药菌株相继出现,甚至出现了一些超级细菌,因此研究不抑制致病菌生长而抑制调控毒力因子表达的群感效应(quorum sensing,qs)系统就显得尤为重要。qs是控制生物膜(biofilm,bf)形成的重要机理,它是一种细胞间的信息交流过程,可以使得细菌之间相互传递关于外界环境和种群数量的信息,进而相应地调整基因表达,以确保自身能够最大程度地适应外界环境。由于大多数食源性感染和腐败是由qs介导的,抑制这一信号机制不失为一种在食品、临床和工业环境中减弱细菌病原体效力的策略。在抗qs策略中,细菌的生长并未受到限制,而是破坏细胞间的通信以抑制细菌生存所必需的某些表型的表达。天然产物包括植物提取物、膳食植物化学物质和植物精油等,因其潜在的qs抑制作用而得到多数研究工作者青睐,应用于延缓食物腐败、bf的形成及其扩散。药理研究表明,在一些天然中草药中含有的氧杂蒽酮类化合物具有广泛的药理活性,包括抗微生物、抗病毒、抗结核等活性,因此对氧杂蒽酮类化合物新结构、新活性进行研究具有较大前景。
3.金丝桃属植物为灌木或一年至多年生草本,包括贯叶连翘(hypericum perforatum)、糙枝金丝桃(h.scabrum)、元宝草(h.sampsonii)等,该属植物有广泛的药理作用,在国内外用于抗菌、消炎、镇痛、抗病毒、抗抑郁、治疗肝炎等。金丝桃属植物的化合物类型多样且具有丰富的药用成分,包括黄酮类、氧杂蒽酮类、二苯甲酮类、间苯三酚类、苯并吡喃类、类固醇类和萜类等,其中许多具有药用潜力。弯萼金丝桃(h.curvisepalum)为金丝桃属的多年生灌木,目前对其化学成分及生物活性研究较少,仅有时文盼和孙明霞对该种进行研究,主要为间苯三酚类、黄酮类、甾醇类和苯基聚酮类化合物。本发明研究人员通过前期对弯萼金丝桃提取物乙酸乙酯段紫外检测发现其中不乏氧杂蒽酮类成分的特征吸收。因此,可以考虑从弯萼金丝桃中寻找具有抑制群感效应活性的氧杂蒽酮类新化合物。
技术实现要素:
4.为此,本发明所要解决的技术问题在于提供弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物及其分离纯化方法和应用。
5.为解决上述技术问题,本发明提供如下技术方案:
6.弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物,均从弯萼金丝桃中分离纯化得到;
7.化合物1、化合物2和化合物4的化学结构通式如下:
[0008][0009]
化合物1中:r1为-och3,r2为-och3,r3为-oh,r4为-och3;
[0010]
化合物2中:r1为-och3,r2为-h,r3为-oh,r4为-h;
[0011]
化合物4中:r1为-h,r2为-oh,r3为-oac,r4为-h;
[0012]
化合物3的化学结构式如下:
[0013][0014]
弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物的分离纯化方法,包括如下步骤:
[0015]
(1)将干燥的弯萼金丝桃全草切碎后采取甲醇热回流法提取,减压回收溶剂,得甲醇提取物;
[0016]
(2)将甲醇提取物用甲醇充分溶解后与200-300目硅胶搅拌混匀后挥干溶剂,依次使用石油醚、乙酸乙酯和甲醇洗脱获得fr.a、fr.b和fr.c三种组分;
[0017]
(3)将fr.b组分进行硅胶柱层析,以石油醚-乙酸乙酯体系作为洗脱剂;洗脱时,洗脱剂中石油醚与乙酸乙酯的体积比依次为1:0、10:1、5:1、1:1和0:1;最后用甲醇进行卸柱洗脱,卸柱洗脱结束后依次得到fr.b1、fr.b2、fr.b3、fr.b4、fr.b5和fr.b6六种组分;
[0018]
(4)将fr.b4组分进行中压色谱柱层析,以体积分数分别为50%、70%和100%的甲醇水溶液作为洗脱剂,洗脱结束后依次得到fr.b4a、fr.b4b和fr.b4c三种组分;
[0019]
(5)将fr.b4b组分进行硅胶柱层析,以二氯甲烷-甲醇体系做为洗脱剂;洗脱时,洗脱剂中二氯甲烷与甲醇的体积比依次为100:1、50:1和20:1;洗脱结束后依次得到fr.b4b1、fr.b4b2和fr.b4b3三种组分;
[0020]
(6)对fr.b4b1组分依次进行凝胶柱层析和硅胶柱层析,并以薄层色谱法为指导合并得到氧杂蒽酮类组分;最后利用phplc对氧杂蒽酮类组分进一步分离,得到化合物1和化合物2;
[0021]
(7)对fr.b4b2组分进行凝胶柱层析,以薄层色谱法为指导合并得到氧杂蒽酮类组分,再利用phplc对氧杂蒽酮类组分进一步分离,得到化合物4;
[0022]
(8)对fr.b4b3组分进行凝胶柱层析,以薄层色谱法为指导合并得到氧杂蒽酮类组分,再利用phplc对氧杂蒽酮类组分进一步分离,得到化合物3;
c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为47%的乙腈水溶液,且1000ml流动相中含5ml甲酸,流动相流速为10ml/min,检测波长254nm;分离结束后,即可得到化合物4。
[0038]
上述弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物的分离纯化方法,步骤(8)的具体操作方法如下:
[0039]
(8-1):对fr.b4b3组分进行凝胶柱层析,以甲醇为洗脱剂进行洗脱,并以薄层色谱法指导合并得到fr.b4b3a、fr.b4b3b、fr.b4b3c和fr.b4b3d四种组分;
[0040]
(8-2):将fr.b4b3c组分利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为60%的甲醇水溶液,流动相流速为10ml/min,检测波长254nm;分离结束后,得到fr.b4b3c1、fr.b4b3c2、fr.b4b3c3、fr.b4b3c4和fr.b4b3c5五种组分;
[0041]
(8-3):将fr.b4b3c2组分利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为30%的乙腈水溶液,流动相流速为10ml/min,检测波长254nm;分离结束后,即可得到化合物3。
[0042]
上述弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物的分离纯化方法,包括如下步骤:
[0043]
(1)将干燥的弯萼金丝桃全草切碎后采取甲醇热回流法提取,减压回收溶剂,得甲醇提取物;
[0044]
(2)将甲醇提取物用甲醇充分溶解后与200-300目硅胶搅拌混匀后挥干溶剂,依次使用石油醚、乙酸乙酯和甲醇洗脱获得fr.a、fr.b和fr.c三种组分;
[0045]
(3)将fr.b组分进行硅胶柱层析,以石油醚-乙酸乙酯体系作为洗脱剂;洗脱时,洗脱剂中石油醚与乙酸乙酯的体积比依次为1:0、10:1、5:1、1:1和0:1;最后用甲醇进行卸柱洗脱,卸柱洗脱结束后依次得到fr.b1、fr.b2、fr.b3、fr.b4、fr.b5和fr.b6六种组分;
[0046]
(4)将fr.b4组分进行中压色谱柱层析,以体积分数分别为50%、70%和100%的甲醇水溶液作为洗脱剂,洗脱结束后依次得到fr.b4a、fr.b4b和fr.b4c三种组分;
[0047]
(5)将fr.b4b组分进行硅胶柱层析,以二氯甲烷-甲醇体系做为洗脱剂;洗脱时,洗脱剂中二氯甲烷与甲醇的体积比依次为100:1、50:1和20:1;洗脱结束后依次得到fr.b4b1、fr.b4b2和fr.b4b3三种组分;
[0048]
(6)对fr.b4b1组分进行凝胶柱层析,以二氯甲烷和甲醇按照体积比为1:1作为洗脱剂进行洗脱,并以薄层色谱法指导合并得到fr.b4b1a、fr.b4b1b和fr.b4b1c三种组分;
[0049]
将fr.b4b1b组分进行硅胶柱层析,以石油醚和乙酸乙酯按照体积比为5:1作为洗脱剂进行洗脱,最后用甲醇进行卸柱,以薄层色谱法指导合并得到fr.b4b1b1、fr.b4b1b2、fr.b4b1b3、fr.b4b1b4、fr.b4b1b5和fr.b4b1b6六种组分;
[0050]
将fr.b4b1b6组分利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为65%的甲醇水溶液,流动相流速为10ml/min,检测波长254nm;分离结束后,即可得到化合物1和化合物2;
[0051]
(7)对fr.b4b2组分进行凝胶柱层析,以甲醇为洗脱剂进行洗脱,并以薄层色谱法指导合并得到fr.b4b2a、fr.b4b2b、fr.b4b2c、fr.b4b2d和fr.b4b2e五种组分;
[0052]
经hplc分析后,将fr.b4b2b组分和fr.b4b2c组分合并,得到fr.b4b2(b+c)组分;将fr.b4b2(b+c)组分利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为60%的甲醇水溶液,流动相流速为10ml/min,检测波长254nm;分离结束后,得到fr.b4b2(b+c)1、fr.b4b2(b+c)2和fr.b4b2(b+c)3三种组分;
[0053]
将fr.b4b2(b+c)3组分利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为47%的乙腈水溶液,且1000ml流动相中含5ml甲酸,流动相流速为10ml/min,检测波长254nm;分离结束后,即可得到化合物4;
[0054]
(8)对fr.b4b3组分进行凝胶柱层析,以甲醇为洗脱剂进行洗脱,并以薄层色谱法指导合并得到fr.b4b3a、fr.b4b3b、fr.b4b3c和fr.b4b3d四种组分;
[0055]
将fr.b4b3c组分利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为60%的甲醇水溶液,流动相流速为10ml/min,检测波长254nm;分离结束后,得到fr.b4b3c1、fr.b4b3c2、fr.b4b3c3、fr.b4b3c4和fr.b4b3c5五种组分;
[0056]
将fr.b4b3c2组分利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为30%的乙腈水溶液,流动相流速为10ml/min,检测波长254nm;分离结束后,即可得到化合物3。
[0057]
上述弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物的分离纯化方法,步骤(1)中,弯萼金丝桃全草的质量与甲醇的体积之比为1:10;热回流法的提取过程保持沸腾状态,回流提取时间为3h;提取后将甲醇提取物中的甲醇充分烘干;
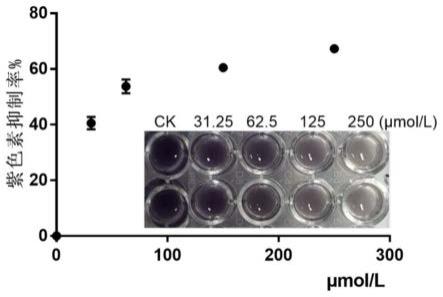
[0058]
步骤(2)中,甲醇提取物与拌样硅胶的质量之比为1:2;
[0059]
步骤(2)中,石油醚和乙酸乙酯的用量相等且均为4.9~5.1倍硅胶柱体积,甲醇的用量为2.1~2.2倍硅胶柱体积;
[0060]
步骤(3)中,石油醚与乙酸乙酯体积比为1:0的洗脱剂用量为11~12倍硅胶柱体积,石油醚与乙酸乙酯体积比为10:1的洗脱剂用量为9.2~9.3倍硅胶柱体积,石油醚与乙酸乙酯体积比为5:1的洗脱剂用量为10.3~10.5倍硅胶柱体积,石油醚与乙酸乙酯体积比为1:1的洗脱剂用量为9.5~9.7倍硅胶柱体积,石油醚与乙酸乙酯体积比为0:1的洗脱剂用量为9.8~10.0倍硅胶柱体积;
[0061]
步骤(4)中,体积分数为50%、70%和100%的甲醇水溶液的用量相等且均为4.9~5.0倍中压柱柱体积;
[0062]
步骤(5)中,二氯甲烷与甲醇体积比为100:1时的洗脱剂用量为4.16~4.20倍硅胶柱体积,二氯甲烷与甲醇体积比为50:1时的洗脱剂用量为4.22~4.25倍硅胶柱体积,二氯甲烷与甲醇体积比为20:1时的洗脱剂用量为4.60~4.70倍硅胶柱体积;
[0063]
薄层色谱法的检识条件:显色剂为5%硫酸乙醇溶液,在254nm和365nm紫外灯下观察荧光;硅胶柱层析为200-300目正相硅胶柱层析;凝胶柱层析所用凝胶柱为sephadex
tm
lh-20,且凝胶柱的径高比为1:60。
[0064]
弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物的应用,将上述弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物用于抑制细菌的群感效应。
[0065]
上述弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物的应用,用于抑制革兰氏阴性菌的群感效应。
[0066]
上述弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物的应用,革
兰氏阴性菌为紫色色杆菌c.violaceum atcc 12472。
[0067]
本发明的技术方案取得了如下有益的技术效果:
[0068]
本发明中所分离得到的4种化合物此前均未见相关报道,本发明将化合物1命名为6-methoxy-cadensin c,化合物2命名为8-hydroxy-kielcorin,化合物3命名为4'-hydroxy-toxyloxanthone b,化合物4命名为9'-o-acetyl-5'-demethoxycadensin g。这4种化合物均对紫色色杆菌c.violaceum atcc 12472紫色杆菌素具有一定的抑制作用,说明该类化合物具有抑制群感效应的生物活性,本发明为弯萼金丝桃天然产物的开发及研究奠定了实验基础。
附图说明
[0069]
图1-1本发明分离纯化的化合物1的ir图;
[0070]
图1-2本发明分离纯化的化合物1的hr-esi-ms图;
[0071]
图1-3本发明分离纯化的化合物1的1h nmr图;
[0072]
图1-4本发明分离纯化的化合物1的
13
c nmr图;
[0073]
图1-5本发明分离纯化的化合物1的hsqc图;
[0074]
图1-6本发明分离纯化的化合物1的hmbc图;
[0075]
图2-1本发明分离纯化的化合物2的ir图;
[0076]
图2-2本发明分离纯化的化合物2的hr-esi-ms图;
[0077]
图2-3本发明分离纯化的化合物2的1h nmr图;
[0078]
图2-4本发明分离纯化的化合物2的
13
c nmr图;
[0079]
图2-5本发明分离纯化的化合物2的hsqc图;
[0080]
图2-6本发明分离纯化的化合物2的hmbc图;
[0081]
图3-1本发明分离纯化的化合物3的ir图;
[0082]
图3-2本发明分离纯化的化合物3的hr-esi-ms图;
[0083]
图3-3本发明分离纯化的化合物3的1h nmr图;
[0084]
图3-4本发明分离纯化的化合物3的
13
c nmr图;
[0085]
图3-5本发明分离纯化的化合物3的hsqc图;
[0086]
图3-6本发明分离纯化的化合物3的hmbc图;
[0087]
图4-1本发明分离纯化的化合物4的ir图;
[0088]
图4-2本发明分离纯化的化合物4的hr-esi-ms图;
[0089]
图4-3本发明分离纯化的化合物4的1h nmr图;
[0090]
图4-4本发明分离纯化的化合物4的
13
c nmr图;
[0091]
图4-5本发明分离纯化的化合物4的hsqc图;
[0092]
图4-6本发明分离纯化的化合物4的hmbc图;
[0093]
图5本发明分离纯化的化合物1对c.violaceum atcc 12472抑制色素检测结果图;
[0094]
图6本发明分离纯化的化合物2对c.violaceum atcc 12472抑制色素检测结果图;
[0095]
图7本发明分离纯化的化合物3对c.violaceum atcc 12472抑制色素检测结果图;
[0096]
图8本发明分离纯化的化合物4对c.violaceum atcc 12472抑制色素检测结果图。
具体实施方式
[0097]
实施例1
[0098]
本实施例弯萼金丝桃中4种具有抑制群感效应活性的氧杂蒽酮类新化合物的分离纯化方法包括如下步骤:
[0099]
(1)将10kg干燥的弯萼金丝桃全草切碎后采取甲醇热回流法提取,减压回收溶剂,得甲醇提取物;弯萼金丝桃全草的质量与甲醇的体积之比为1:10;热回流法的提取过程中保持沸腾状态,回流提取时间为3h;提取后将甲醇提取物中的甲醇充分烘干;
[0100]
(2)将甲醇提取物(1699g)用甲醇充分溶解后与200-300目硅胶搅拌混匀后挥干溶剂,平均分成7份,依次使用石油醚、乙酸乙酯和甲醇洗脱,洗脱时,硅胶柱的柱体积为9.17l;石油醚、乙酸乙酯和甲醇的用量分别为45.9l、45.9l和20l;洗脱后分别得到fr.a、fr.b和fr.c三种组分;
[0101]
(3)将fr.b组分(421.95g)平均分成2份,进行200-300目正相硅胶柱层析,以石油醚-乙酸乙酯体系作为洗脱剂;洗脱时,洗脱时,硅胶柱的柱体积为1.66l,洗脱剂中石油醚与乙酸乙酯的体积比依次为1:0、10:1、5:1、1:1和0:1,用量依次为19l、15.4l、17.4l、16l和16.5l;最后用甲醇进行卸柱洗脱,卸柱洗脱结束后依次得到fr.b1、fr.b2、fr.b3、fr.b4、fr.b5和fr.b6六种组分;
[0102]
(4)将fr.b4组分(105.45g)进行ymc*gel ods-a-hg反相c18填料中压色谱柱层析,中压柱的柱体积为0.61l,以体积分数分别为50%、70%和100%的甲醇水溶液作为洗脱剂,洗脱时,不同体积分数的甲醇水溶液的用量均为3l,洗脱结束后依次得到fr.b4a、fr.b4b和fr.b4c三种组分;
[0103]
(5)将fr.b4b组分(16.16g)进行200-300目正相硅胶柱层析,以二氯甲烷-甲醇体系做为洗脱剂;洗脱时,所用的硅胶柱的柱体积为1.01l,洗脱剂中二氯甲烷与甲醇的体积比依次为100:1、50:1和20:1,用量依次为4.22l、4.28l和4.73l;洗脱结束后依次得到fr.b4b1、fr.b4b2和fr.b4b3三种组分;
[0104]
(6)对fr.b4b1组分依次进行凝胶柱层析和硅胶柱层析,并以薄层色谱法为指导合并得到氧杂蒽酮类组分;最后利用phplc对氧杂蒽酮类组分进一步分离,得到化合物1和化合物2;本步骤的具体操作方法如下:
[0105]
(6-1):对fr.b4b1组分(2.26g)进行凝胶柱层析,凝胶柱为sephadex
tm
lh-20凝胶柱(径高比为1:60);以二氯甲烷和甲醇按照体积比为1:1作为洗脱剂进行洗脱,并以薄层色谱法tlc指导合并得到fr.b4b1a、fr.b4b1b和fr.b4b1c三种组分;
[0106]
(6-2):将fr.b4b1b组分(1.41g)进行200-300目正相硅胶柱层析,以石油醚和乙酸乙酯按照体积比为5:1作为洗脱剂进行洗脱,最后用甲醇进行卸柱,以薄层色谱法tlc指导合并得到fr.b4b1b1、fr.b4b1b2、fr.b4b1b3、fr.b4b1b4、fr.b4b1b5和fr.b4b1b6六种组分;
[0107]
(6-3):将fr.b4b1b6组分(630mg)利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为65%的甲醇水溶液,流动相流速为10ml/min,检测波长254nm;分离结束后,即可得到化合物1(4.6mg)和化合物2(7.5mg);
[0108]
(7)对fr.b4b2组分进行凝胶柱层析,以薄层色谱法为指导合并得到氧杂蒽酮类组分,再利用phplc对氧杂蒽酮类组分进一步分离,得到化合物4;本步骤的具体操作方法如下:
[0109]
(7-1):对fr.b4b2组分(4.02g)进行凝胶柱层析,凝胶柱为sephadex
tm
lh-20凝胶柱(径高比为1:60);以甲醇为洗脱剂进行洗脱,并以薄层色谱法tlc指导合并得到fr.b4b2a、fr.b4b2b、fr.b4b2c、fr.b4b2d和fr.b4b2e五种组分;
[0110]
(7-2):经hplc分析后,将fr.b4b2b组分(307mg)和fr.b4b2c(663mg)组分合并,得到fr.b4b2(b+c)组分;将fr.b4b2(b+c)组分利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为60%的甲醇水溶液,流动相流速为10ml/min,检测波长254nm;分离结束后,得到fr.b4b2(b+c)1、fr.b4b2(b+c)2和fr.b4b2(b+c)3三种组分;
[0111]
(7-3):将fr.b4b2(b+c)3组分利用phplc进一步分离,phplc的色谱条件为:5色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为47%的乙腈水溶液,且1000ml流动相中含5ml甲酸,流动相流速为10ml/min,检测波长254nm;分离结束后,即可得到化合物4(16.5mg);
[0112]
(8)对fr.b4b3组分进行凝胶柱层析,以薄层色谱法tlc为指导合并得到氧杂蒽酮类组分,再利用phplc对氧杂蒽酮类组分进一步分离,得到化合物3;本步骤的具体操作方法如下:
[0113]
(8-1):对fr.b4b3组分(5.28g)进行凝胶柱层析,凝胶柱为sephadex
tm
lh-20凝胶柱(径高比为1:60);以甲醇为洗脱剂进行洗脱,并以薄层色谱法tlc指导合并得到fr.b4b3a、fr.b4b3b、fr.b4b3c和fr.b4b3d四种组分;
[0114]
(8-2):将fr.b4b3c组分(806mg)利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为60%的甲醇水溶液,流动相流速为10ml/min,检测波长254nm;分离结束后,得到fr.b4b3c1、fr.b4b3c2、fr.b4b3c3、fr.b4b3c4和fr.b4b3c5五种组分;
[0115]
(8-3):将fr.b4b3c2组分(105mg)利用phplc进一步分离,phplc的色谱条件为:岛津-c18色谱柱(20mm
×
250mm,5μm),流动相为体积分数为30%的乙腈水溶液,流动相流速为10ml/min,检测波长254nm;分离结束后,即可得到化合物3(13.2mg)。
[0116]
本实施例中,薄层色谱法tlc的检测条件:显色剂为5%硫酸乙醇溶液(配制方法为:取5ml质量分数为98wt%的浓硫酸于容量瓶中,定容至100ml):紫外灯(254nm,365nm)下观察荧光。
[0117]
对本实施例分离得到的化合物1、化合物2、化合物3和化合物4进行结构鉴定,采用现代波谱技术如1h nmr、
13
c nmr、hsqc、hmbc、高分辨质谱等对分离得到的单体化合物进行结构鉴定。
[0118]
化合物1呈浅黄色粉末状,高分辨质谱hr-esi-ms显示该化合物准分子离子峰为m/z 535.1209[m+na]
+
(计算值为535.1211),推测其分子式为c
26h24o11
,不饱和度为15。uv显示该化合物在波长257nm、318nm以及362nm处具有氧杂蒽酮类化合物母核的特征吸收;ir中存在羟基(3396cm-1
)、共轭羰基(1722cm-1
)和芳环(1588cm-1
、1502cm-1
、1481cm-1
)的特征吸收。1d nmr显示该化合物具有氧杂蒽酮母核结构以及苯丙烷单元。由1h nmr(400mhz,dmso-d6)可观察到1个缔合酚羟基信号δh13.03(1h,s);4种芳香族质子信号δh7.16(1h,s)、6.78(2h,s)、6.65(1h,d,j=2.2hz)、6.40(1h,d,j=2.2hz);连接苯环的叔氢信号δh5.08(1h,dd,j=10.8,6.4hz)以及与羟甲基基团相连的叔氢信号δh4.45(1h,m);3组甲氧基信号δh3.90(3h,
s)、3.87(3h,s)、3.77(6h,s)。化合物1的
13
c nmr(100mhz,dmso-d6)显示存在26个碳信号,包括δc179.2处的1个共轭羰基碳的特征信号以及δc95.9、140.0、141.1、92.5、97.4、102.7、112.4的2个带有含氧季碳的芳环证实该化合物具有氧杂蒽酮类母核;此外还有1组对称四元取代的苯环碳原子信号δc125.5、105.7、148.0、136.3;4种甲氧基碳信号δc55.8、56.2;2个叔碳信号δc78.7、77.7。此外,化合物1的1d nmr数据与calophyllumin a[iinuma m,tosa h,tanaka t,et al.occurrence of xanthonolignoids in guttifereous plants[j].heterocycles,1996,7(43):1521-1527]相似,结合hmbc谱图分析,发现差异主要体现在氧杂蒽酮骨架的取代基上,calophyllumin a 6号碳原子上的氢原子被羟基取代,而化合物1的6号碳原子上的氢原子被甲氧基所取代;hmbc谱图显示,化合物1的och
3-3'/5'(δh3.77)与c-3',5'(δc148.0)相关,och
3-2(δh3.87)和och
3-6(δh3.90)分别与c-2(δc146.0),c-6(δc166.0)相关;h-7'(δh5.07)与c-8'(δc78.7)、c-6'(δc105.7)、c-1'(δc77.7)相关,证明7'位碳原子与苯环相连,而8'位碳原子与羟甲基基团相连。根据以上数据推测出化合物1的结构如下:
[0119][0120]
将化合为1命名为6-methoxy-cadensinc;其核磁数据见表1。
[0121]
表1化合物1的1h nmr(400mhz)和
13
c nmr(100mhz)数据(in dmso-d6)
[0122][0123]
化合物2呈黄色粉末状;高分辨质谱hr-ei-ms显示分子离子峰为m/z 452.1102[m]
+
(计算值为452.2586),推测其分子式为c
24h20
o9,不饱和度为15。uv显示该化合物在波长254nm、318nm以及375nm处具有氧杂蒽酮类化合物母核的特征吸收;ir中显示存在羟基(3435cm-1
)、共轭羰基(1723cm-1
)和芳环(1603cm-1
、1507cm-1
、1463cm-1
)的特征吸收。由1h nmr(400mhz,dmso-d6)可观察到1个缔合酚羟基信号δh12.84(1h,s);7个芳香族质子信号δh7.18(1h,s)、7.14(1h,s)、7.70(1h,d,j=8.0hz)、6.82(1h,d,j=8.0hz)、6.83(2h,t,j=8.4hz)、6.90(1h,d,j=8.1hz);2个甲氧基氢原子信号δh3.78(3h,s)、3.77(3h,s);由
13
c nmr(100mhz,dmso-d6)可观察到24个碳信号,包括δc180.5处的1个共轭羰基碳信号以及δc95.8、140.5、141.5、107.2、110.1、107.9、112.5的2个带有含氧季碳的芳环证实该化合物具有氧杂蒽酮类母核;此外还有1,3,4位三取代的苯环碳原子信号δc123.6、112.1、147.7、147.5、115.1、120.9;2个甲氧基碳信号δc55.8。此外,化合物2的1dnmr数据与kielcorin[abou-shoer m,habib a a,chang c j,et al.seven xanthonolignoids from psorospermum febrifugum[j].phytochemistry,1989,9(28):2483-2487]相似,结合hmbc谱图发现,差异主要体现在氧杂蒽酮骨架上,kielcorin的8号碳原子上的氢原子未被其他基团取代,而化合物2的8号碳原子上与羟基相连;化合物2的och
3-2,3'(δh3.78)分别与c-2(δc146.1)和c-3'(δc147.7)相关;h-2'(δh6.83)与c-6'(δc120.9)和c-7'(δc76.6)相关;h-7'(δh5.10)与c-6'(δc120.9)和c-8'(δc77.8)相关;h-9'(δh3.39)与c-8'(δc77.8)相关,以上
hmbc数据证明7'位碳原子与苯环相连,且8'号碳原子还与羟甲基基团相连。因此,推测出化合物2的结构如下所示:
[0124][0125]
将化合物2命名为8-hydroxy-kielcorin,其核磁数据见表2。
[0126]
表2化合物2的1h nmr(400mhz)和
13
c nmr(100mhz)数据(in dmso-d6)
[0127][0128][0129]
化合物3为黑色不定形固体。高分辨质谱hr-esi-ms显示该化合物准分子离子峰为m/z 341.0661[m-h]-(计算值为341.0667),推测其分子式为c
18h14
o7,不饱和度为12。uv显示该化合物在波长261nm、331nm以及376nm处具有氧杂蒽酮类化合物母核的特征吸收;从ir可观察到羟基(3265cm-1
)和芳环(1650cm-1
、1576cm-1
、1503cm-1
、1453cm-1
)的特征吸收。由1h nmr(400mhz,dmso-d6)可观察到1个缔合酚羟基信号δh13.39(1h,s);3个芳香族质子信号δh6.78(1h,s)、6.27(1h,s)、6.11(1h,s);2个烯烃质子信号δh7.95(1h,d,j=10.4hz)和5.88(1h,d,j=10.4hz);由
13
c nmr(100mhz,dmso-d6)可观察到个18碳信号,包括δc181.4处的1个共轭羰基碳信号以及δc119.4、156.6、152.6、93.1、97.8、102.2、106.3的2个带有氧季碳的芳环证实该化合物具有氧杂蒽酮类母核;此外还有2个烯烃碳原子信号δc121.6、129.8以及一个季碳原子信号δc78.3。此外,化合物3的1d nmr数据与toxyloxanthone b[东鸿鑫,夏超,刘媛,等.元宝草化学成分研究[j].植物资源与环境学报,2015,24(01):110-112]相似,结合hmbc谱图分析,差异主要体现在氧杂蒽酮骨架上,toxyloxanthone b的3号碳原子上的氢原子未被其他基团取代,而化合物3的3号碳原子上与羟基相连,此外与化合物3的六元环取代基相连的甲基上还有一个羟基;化合物3的oh-8(δh12.84)与c-8(δc164.8)和c-8a(δc102.2)相关;h-4(δh6.78)与c-1(δc119.4)和c-9a(δc181.4)相关;h-1'(δh7.95)和h-2'(δh5.88)均与c-1(δc119.4)相关;h-5'(δh3.57,3.49)与c-3'(δc78.3)相关;以上数据证明有1个带氧的6元不饱和环与该化合物氧杂蒽酮骨架上的1号碳原子相连。因此,推测出化合物3的结构如下所示:
[0130][0131]
将化合物3命名为4'-hydroxy-toxyloxanthone b,其核磁数据见表3。
[0132]
表3化合物3的1h nmr(400mhz)和
13
c nmr(100mhz)数据(in dmso-d6)
[0133][0134]
化合物4为深绿色不定形固体。高分辨质谱hr-esi-ms显示该化合物准分子离子峰为m/z 479.0974[m-h]-(计算值为479.0984),推测其分子式为c
25h20o10
,不饱和度为16。uv显示该化合物在波长249nm、318nm处具有氧杂蒽酮类化合物母核的特征吸收;ir显示存在羟基(3403cm-1
)、共轭羰基(1731cm-1
)和芳环(1650cm-1
、1612cm-1
、1581cm-1
、1518cm-1
)的特征吸收。由1h nmr(400mhz,dmso-d6)可观察到1个缔合酚羟基信号δh12.94(1h,s);7个芳香族质子信号δh7.65(1h,d,j=8.8hz)、7.09(1h,overlap)、6.41(1h,d,j=2.0hz)、6.22(1h,d,j=2.0hz,)、7.07(1h,overlap)、6.82(1h,d,j=8.0hz)和6.89(1h,dd,j=8.0,1.0hz);1个甲氧基氢原子信号δh3.78(3h,s);由
13
c nmr(100mhz,dmso-d6)可观察到个25碳信号,包括δc179.2处的1个共轭羰基碳信号以及δc117.2、145.5、149.0、94.2、98.3、101.8、114.3的2个带有含氧季碳的芳环证实该化合物具有氧杂蒽酮类母核;此外还有1,3,4位三取代的苯环碳原子信号δc125.7、111.8、147.8、147.5、115.5、120.7;1个甲氧基碳信号δc55.7。此外,化合物4的1d nmr数据与5'-demethoxycadensin g[abou-shoer m,habib a a,chang c j,et al.seven xanthonolignoids from psorospermum febrifugum[j].phytochemistry,1989,9(28):2483-2487]相似,结合hmbc谱图分析,差异主要体现在侧链取代基上,5'-demethoxycadensin g的9'碳原子与羟基相连,而化合物4的9'号碳原子上与乙酰基相连;化合物4的och
3-3'(δh3.78)与c-3'(δc147.8)相关;h-2'(δh7.07)与c-6'(δc120.7)和c-7'(δc76.4)相关;h-7'(δh5.10)与c-6'(δc120.7)和c-8'(δc74.9)相关;h-9'(δh4.19,4.07)与c-8'(δc74.9)相关,以上hmbc数据证明7'位碳原子与苯环相连,且8'号碳原子还与乙酰氧基基团相连。因此,推测出化合物4的结构如下所示:
[0135][0136]
将化合物4命名为9'-o-acetyl-5'-demethoxycadensin g;其核磁数据见表4。
[0137]
表4化合物4的1h nmr(400mhz)和
13
c nmr(100mhz)数据(in dmso-d6)
[0138][0139][0140]
实施例2
[0141]
将实施例1分离纯化得到的4种化合物(化合物1、化合物2、化合物3和化合物4)对紫色色杆菌c.violaceum atcc 12472进行抑制紫色杆菌素的活性实验。
[0142]
(1)供试药物配制
[0143]
依据化合物1、化合物2、化合物3和化合物4的分子量,加入相应量的dmso试剂将化合物配制成10mm的母液,再用无菌水稀释为浓度1mm的贮存液待用。
[0144]
(2)细菌培养
[0145]
菌株活化:将保存在-80℃30%甘油内的c.violaceum atcc 12472,在lb固体培养基上涂布复苏,置于30℃恒温培养箱中培养24h;将复苏好的菌株接种至另一培养基中以获得单菌落,继续培养24h。
[0146]
菌液制备:挑取火柴头大小的单菌落接种至10ml lb液体培养基中并且尽可能打散细菌,置于30℃恒温培养箱静置培养16h后,将处于生长期的菌液与lb液体培养基1:1000稀释待用。
[0147]
(3)紫色素抑制率的定量方法
[0148]
96孔板的制备:在96孔板的a1~d12以及f1~f12孔中加入100μl lb液体培养基,在a1~a3、a4~a6、a7~a9、a10~a12各孔中分别加入100μl 4种不同的化合物(化合物1、化合物2、化合物3和化合物4),各化合物的浓度均为1mm,在此基础上按列依次倍数稀释,稀释到d1~d12孔时弃去100μl(化合物+lb液体培养基)混合液。此时,a~d行药物浓度分别为250、125、62.5、32.25μmol/l。在a1~d12(处理组)以及f1~f12(阴性对照)孔中加入100μl稀释后并且混匀的菌液,在e1~e12(空白对照)孔中加入200μl lb液体培养基(空白对照),置于30℃恒温培养箱中培养16h。
[0149]
将96孔板中经过化合物处理的同一浓度的菌液吸取至1.5ml离心管中,离心12000r/min,10min,使c.violaceum atcc 12472菌体聚集并且弃去上清液;往离心管中加入200μl dmso溶液,超声后涡旋振荡使菌体散开,让dmso充分提取紫色素,再离心12000r/min,10min;结束后吸取150μl离心管中的上清液置于新的96孔板中进行酶标仪读数(od
585nm
)
[0150]
紫色素抑制率(%)=(对照组od
585nm-处理组od
585nm
)/对照组od
585nm
×
100%。
[0151]
(4)结果
[0152]
化合物1、化合物2、化合物3和化合物4均对c.violaceum atcc 12472色素的产生具有不同程度的抑制作用,尤其是在样品浓度为250μmol/l时,紫色素抑制率分别为43.6%、40.8%、67.2%、51.7%。
[0153]
由于c.violaceum atcc 12472的色素合成受群感效应调控,因此,上述结果说明,化合物1、化合物2、化合物3和化合物4具有抑制c.violaceum atcc 12472群感效应的生物活性,可将以应用于抑制细菌群感效应中。
[0154]
综上,本发明采用甲醇进行热回流法提取弯萼金丝桃的粗提取物,对其乙酸乙酯洗脱段进行分离纯化,得到化合物1、化合物2、化合物3和化合物4四个新化合物,采用现代波谱技术如uv、ir、1d/2d nmr、高分辨质谱结合化合物的理化性质对分离得到的单体化合物进行结构鉴定,最终推断出化合物1-4的化学结构;采用微量稀释法测定化合物1-4群感效应抑制活性,实验结果表明这些化合物均对紫色色杆菌c.violaceum atcc 12472的色素形成具有一定抑制作用,说明该类化合物具有抑制群感效应活性,本发明为弯萼金丝桃天然产物的开发及研究奠定了实验基础。
[0155]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本专利申请权利要求的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1