一种玉米白斑病的抗病性鉴定方法与流程
1.本发明属于玉米白斑病技术领域,具体涉及一种玉米白斑病的抗病性鉴定方法。
背景技术:
2.玉米白斑病(epicoccum spp.)广泛分布于中南美洲、亚洲和非洲雨水充足、温度适中的热带、亚热带高原地区,在巴西,白斑病是一种广泛存在的病害,对易感品种的玉米产量造成的损失高达63%。该病在中国已有较长的发生史,前期主要集中在西南地区,目前北方和江南也有发生。目前玉米白斑病已成为西南地区危害玉米生产最严重的新发病害,也将成为西南中高海拔玉米生产区的一种常态化病害。
3.选育和推广抗病品种是防治玉米白斑病的关键措施。建立一个能客观、稳定反应玉米对白斑病抗、感特性的鉴定方法,是对玉米资源、品种进行抗性鉴定及抗病育种的基础。目前白斑病没有免疫品种,一旦出现,不会来了又走,经过怀化金亿玉米研究所连续多年田间鉴定发现,绝大多数玉米品种和育种材料都可感病,只是发病程度和发病时期存在差异。目前,本领域尚缺乏能够模拟玉米在自然环境中感染玉米白斑病菌的抗性鉴定方法,及缺少科学、简明、规范的用于评价玉米白斑病病害的分级标准和评价方法。抗性鉴定方法对于评估产量损失、抗病品种筛选、病害发生及预防评价等至关重要,因此,玉米白斑病抗性鉴定方法的确定对于进一步提高该病预测预报、抗感品种鉴定(量化指标)、综合治理和经济效益分析都具有重要意义。因此,建立玉米白斑病的抗病性鉴定方法显得尤为必要和迫切。
技术实现要素:
4.本发明所要解决的技术问题在于针对上述现有技术的不足,提供一种玉米白斑病的抗病性鉴定方法,该方法鉴定结果稳定性好,有利于提高抗病材料的筛选效率,有利于对不同玉米材料进行抗病性鉴定。
5.为解决上述技术问题,本发明采用的技术方案是:一种玉米白斑病的抗病性鉴定方法,该方法为:
6.s1、采集发病典型玉米白斑病病叶,分离纯化玉米白斑病病原菌epicoccum sorghinum,通过液体培养得到菌丝段和分生孢子混合液;
7.玉米白斑病病原菌为高粱附球孢菌epicoccum sorghinum,epicoccum sorghinum作为玉米白斑病病原菌已被tangmin(2021)等和邹成佳(2021)等报道);
8.所述菌丝段和分生孢子混合液的分离纯化方法为:
9.在病健交界处切取若干尺寸为3mm
×
3mm小块,用质量分数为75%酒精溶液表面消毒30s,无菌水冲洗3次,再用质量分数为5%的naclo溶液消毒60s,无菌水冲洗3次,晾干后,置于pda培养基上,在温度为28℃的黑暗条件下培养,直至长出菌丝,挑取所述菌丝尖端移于新鲜pda培基上培养,连续多次转接直至菌落形态一致后,挑取所述菌落,转移到pda斜面上,在温度为4℃的条件下保存,通过致病性测定和形态学、分生生物学手段鉴定其为玉米
白斑病病原菌,将病原菌株在pda培养基上活化培养7天后,从菌落边缘取直径5mm的菌饼,取7块,置于装有300ml的pdb培养基中,在温度为28℃、160rpm的摇床上,黑暗的条件下震荡培养10天后,用破壁机打碎处理40s,经4层灭菌纱布过滤后,得到菌丝段和分生孢子混合液;
10.s2、用于接菌的玉米材料的准备:
11.s201、种子催芽:将玉米种子进行催芽处理,把玉米种子放入铺有四层灭菌纱布的培养皿内,注入温度为35℃的温水,浸泡所述玉米种子,在温度为35℃的恒温箱内催芽24h后,去除多余的水,在温度为20℃的恒温箱内培养至发芽,得到发芽种子;
12.s202、移栽:将s201中得到的发芽种子移栽入营养土中,浇水湿透后,进行光照和暗光交替处理培养;所述光照和暗光交替处理培养的方法为:在温度为24℃的光照条件下培养12h,然后在在温度为20℃的光照条件下培养12h,交替进行,得到用于接菌的玉米材料;
13.s3、在s202中所述用于接菌的玉米材料的小喇叭口期,在s1中得到的菌丝段和分生孢子混合液中加入20%吐温溶液,对玉米叶片进行喷雾接种;
14.s4、接种后的玉米植株保持遮阴,接种当晚不进行喷水保湿,第二天进行喷雾保湿,保持相对湿度在90%以上,得到保湿处理后的玉米植株,第三天起,将保湿处理后的玉米植株在人工气候培养箱中培养,至玉米白斑病发病稳定;
15.所述人工气候培养箱中培养的培养条件为:每天在温度为20℃的条件下光照培养12h,然后在温度为16℃的条件下黑暗培养12h,光照和黑暗交替进行,且相对湿度保持在90%以上;
16.s5、不同玉米材料抗病性鉴定评价:待玉米白斑病发病稳定后,根据玉米白斑病叶片发病症状进行发病严重度分级,计算病情指数,根据所述病情指数进行玉米白斑病抗病性评价。
17.优选地,s3中所述喷雾接种喷雾均匀,叶片均匀打湿。
18.优选地,s3中所述菌丝段和分生孢子混合液和20%吐温溶液的体积比为2000:1。
19.优选地,s5中所述发病严重度分级的标准为:
20.0级:叶片上无病斑;
21.1级:叶片上有零星病斑,病斑占叶面积少于或等于5%;
22.3级:叶片上有少量病斑,占叶面积6%~10%;
23.5级:叶片上有较多病斑,占叶面积11%~30%;
24.7级:叶片上有大量病斑,病斑相连,占叶面积31%~50%;
25.9级:叶片病斑占叶面积50%以上,叶片枯死;
26.优选地,s5中所述玉米白斑病抗病性评价的分级标准为:
27.0级:di=0,为免疫材料;
28.1级:di≤10,为高抗材料;
29.3级:10《di≤30,为抗病材料;
30.5级:30《di≤50,为中抗材料;
31.7级:50《di≤70,为感病材料;
32.9级:di》70,为高病材料。
33.本发明与现有技术相比具有以下优点:
34.1、本发明通过人工气候培养室真实模拟出玉米白斑病发病所需要的适宜接种环境条件,以菌丝段和分生孢子混合液对玉米植株进行喷雾接种,接种后发病均匀、发病快、效果显著、可操作性强、致病性测试周期短,不受季节、外部环境和地域等因素的限制,有效地提高了玉米白斑病人工接种的成功率,有利于观察玉米白斑病菌侵染玉米植株的侵染动态变化,鉴定结果稳定性好,有利于提高抗病材料的筛选效率,有利于对不同玉米材料进行抗病性鉴定。
35.2、本发明的鉴定方法在室内即可进行,克服了由于大田自然条件复杂多样、影响因子较多、难以精确操控和定量分析的缺点,无需大面积实验即可顺利操作,鉴定成本大大降低。
36.下面结合附图和实施例对本发明作进一步详细说明。
附图说明
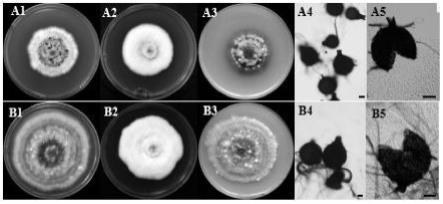
37.图1是本发明的实施例1的玉米白斑菌epicoccum sorghinum代表菌株的形态图。
38.图2为玉米白斑菌epicoccum sorghinum的系统发育树。
具体实施方式
39.实施例1
40.本实施例为玉米白斑病病原菌的分离、鉴定和致病性测定:
41.从云南省采集玉米白斑病病叶,采用常规组织分离法进行病原菌的分离纯化,具体分离步骤为:在病健交界处切取若干尺寸为3mm
×
3mm小块,用质量分数为75%酒精溶液表面消毒30s,无菌水冲洗3次,再用质量分数为5%的naclo溶液消毒60s,无菌水冲洗3次,晾干后,置于pda培养基上,在温度为28℃的黑暗条件下培养,直至长出菌丝,挑取所述菌丝尖端移于新鲜pda培基上培养,连续多次转接直至菌落形态一致后,挑取所述菌落,转移到pda斜面上,在温度为4℃的条件下保存。
42.基于tub和rpb2基因联合构建的系统发育树(图2,a:tub基因;b:rpb2基因),纯化后的菌株,挑取菌丝利用fungal dna mini kit试剂盒提取提取dna,使用引物frpb2-5f/frpb2-7cr和tub2f/tub4r进行pcr扩增,测序后在genbank进行序列比对,鉴定分离菌株主要是高粱附球孢菌epicoccum sorghinum。致病性测定表明epicoccum sorghinum代表菌株sl-56-2和jx-e600-1均能使玉米植株致病(图1和图2)。
43.图1中a:菌株jx-e600-1;b:菌株sl-56-2(图中标尺为40μm)。
44.图1中第1列:菌株在pda上菌落形态;第2列:菌株在mea上菌落形态;第3列:菌株在oa上菌落形态;第4~5列:分生孢子器形态。
45.表1引物序列
46.引物名称引物序列frpb2-5f5'-gaygaymgwgatcayttygg-3'frpb2-7cr5'-cccatrgcttgyttrcccat-3'tub2f5'-gtbcacctycaraccggycartg-3'tub4r5'-ccrgaytgrccraaracraagttgtc-3'
47.实施例2:不同玉米材料对玉米白斑病菌的抗病性鉴定
48.(1)用于接菌的玉米品种材料准备
49.选择znc442、qb2398、qb2182、qb3574、qb506、qb1013、e21、e3、e8等9个玉米自交系作为玉米白斑病抗性鉴定试验材料,对不同抗性材料玉米种子(znc442、qb2398、qb2182、qb3574、qb506、qb1013、e21、e3、e8等)进行催芽处理,把种子放入铺有四层灭菌纱布的培养皿内,注入35℃温水(水尽量淹过种子),放入35℃恒温箱内催芽24h,之后倒掉部分水(水未浸泡到种子,保持纱布湿润即可),放入20℃恒温箱内培养至发芽,得到发芽种子,备用;将发芽种子移栽于装满营养土的塑料桶内(50mm
×
70mm),每穴移栽3~5株,当幼苗长出1~2片真叶时进行间苗,每穴保留3株健壮苗,多余的间掉,进行常规水肥管理。每个参试品种设三次重复,每次重复9株。
50.(2)接种体制备
51.选取强致病性菌株sl-56-2(epicoccum sorghinum)作为抗病性鉴定菌株,将保存的sl-56-2菌株在pda培养基上活化培养7天后,从菌落边缘打取直径为5mm的菌饼,取7块,置于装有300ml的pdb培养基的500ml三角瓶中,于28℃、160rpm摇床上,黑暗震荡培养10天后,用破壁机打碎40s,经4层灭菌纱布过滤后,得到菌丝段和分生孢子混合液,作为接种体备用。
52.(3)接种方法
53.于玉米小喇叭口期,在菌丝段和分生孢子混合液中加入20%吐温溶液(体积比为2000:1),对玉米叶片进行喷雾接种,保证喷雾均匀,叶片均匀打湿。
54.接种后的玉米植株保持遮阴,接种当晚不进行喷水保湿,第二天进行喷雾保湿,保持相对湿度在90%以上,得到保湿处理后的玉米植株,第三天起,将保湿处理后的玉米植株在人工气候培养箱中培养,至玉米白斑病发病稳定;
55.所述人工气候培养箱中培养的培养条件为:每天在温度为20℃的条件下光照培养12h,然后在温度为16℃的条件下黑暗培养12h,光照和黑暗交替进行,且相对湿度保持在90%以上。
56.(4)病情调查方法
57.待各材料玉米白斑病发病稳定后,选取植株中部6片叶子,根据玉米白斑病叶片发病症状进行发病严重度分级,计算病害病情指数,根据病情指数评价各材料抗性水平(病情指数计算方法及抗性评价水平见技术方案的详细阐述)。
58.(5)不同玉米材料抗病性鉴定评价:待玉米白斑病发病稳定后,根据玉米白斑病叶片发病症状进行发病严重度分级,计算病情指数,根据所述病情指数进行玉米白斑病抗病性评价。
59.本实施例对采自于云南省普洱市墨江哈尼族自治县、昆明市宜良县九乡彝族回族乡和昆明市石林彝族自治县300多份不同玉米品种或资源白斑病病叶进行系统调查,应用软件image-pro plus 6.0计算各片病斑面积约占整片叶片表面积的百分比,应用excel软件进行数据统计分析。
60.发病严重度分级的标准为:
61.0级:叶片上无病斑;
62.1级:叶片上有零星病斑,病斑占叶面积少于或等于5%;
63.3级:叶片上有少量病斑,占叶面积6%~10%;
64.5级:叶片上有较多病斑,占叶面积11%~30%;
65.7级:叶片上有大量病斑,病斑相连,占叶面积31%~50%;
66.9级:叶片病斑占叶面积50%以上,叶片枯死;
[0067][0068]
病情指数(di)=∑(各级病叶数
×
该级严重度级别)/(调查总叶数
×
9)
×
100;
[0069]
玉米白斑病抗病性评价的分级标准为:
[0070]
0级:di=0,为免疫植株;
[0071]
1级:di≤10,为高抗植株;
[0072]
3级:10《di≤30,为抗病植株;
[0073]
5级:30《di≤50,为中抗植株;
[0074]
7级:50《di≤70,为感病植株;
[0075]
9级:di》70,为高病植株。
[0076]
本实例结果如表1所示,在参加抗病鉴定的9个玉米自交系中,没有发现哪个自交系对白斑病完全免疫;e21病情指数小于10,属于高抗材料;znc442、qb2398和qb2182病情指数在30~50之间,属于中抗材料;qb3574、qb506和e8病情指数在50~70之间,属于感病材料;qb1013和e3病情指数在70以上,属于高感材料。
[0077]
表1不同玉米自交系病情指数和抗病性水平
[0078]
序号品种病情指数抗病性水平1znc44237.87中抗(mr)2qb239842.74中抗(mr)3qb218241.59中抗(mr)4qb357453.25感病(s)5qb50656.31感病(s)6qb101377.78高感(hs)7e218.56高抗(hr)8e375.28高感(hs)9e860.24感病(s)
[0079]
以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制。凡是根据发明技术实质对以上实施例所作的任何简单修改、变更以及等效变化,均仍属于本发明技术方案的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1