一种蓝藻水提物及其作为替代血清的应用
1.本发明涉及生物工程技术领域,尤其涉及一种蓝藻水提物及其作为替代血清的应用。
背景技术:
2.在细胞体外培养过程中,血清是一种理想的细胞生长补充剂。血清含有血浆蛋白、多肽、脂肪、碳水化合物、生长因子、激素等成分,提供维持细胞生长的营养物质。虽然血清是细胞培养的理想补充剂,但其存在批次间质量差异大、易增加人畜共患病风险以及伦理道德问题等缺点,这些促使人们不断寻找血清的替代品。到目前为止,还未发现能较广泛替代血清并应用于所有细胞系的物质。
3.国内外学者研制了一系列用于骨髓瘤、cho、bhk、vero、淋巴细胞的血清替代物组合,比如各种重组蛋白、半乳糖、脂质、微量元素、维生素、氨基酸、激素等成分明确的组合替代血清维持细胞功能,但多种添加成分和基础培养基以不同比例复合,添加物冗杂,优化条件比较复杂。虽然上述技术公开了一些血清替代物,能满足一定的需要,但仍存在一些缺陷如成本高、食品安全性低、血清替代程度低等,会影响到血清替代物在细胞培养肉中的广泛应用。为进一步解决上述问题,减少动物源添加物的缺点,植物源血清替代物受到越来越多的关注。
4.蓝藻是自然界营养成分最丰富、最全面的生物,富含高质量的蛋白质,蛋白质含量高达60%-70%,而蛋白质又主要为水溶性蛋白,因此蓝藻水提物可能在细胞增殖和分化方面发挥积极作用,从而具有作为替代血清的潜力。现有技术仅有提及藻类多糖作为功能成分添加在无血清培养基中用于干细胞培养,但是并未指明是否可以作为血清替代物作用,也未提及藻类蛋白是否也能具有类似的替代作用,而且不同细胞增殖和分化所需要的培养条件各不相同,针对不同细胞类型开发的血清替代物不具有普适性。目前,现有技术应用于肌肉细胞培养的无血清培养基大多存在传代速率慢、细胞生长缓慢、传代次数有限、细胞扩增速度慢、难以实现扩大培养等问题,限制了无血清细胞培养肉的生产。
技术实现要素:
5.为克服现有技术存在的上述问题,本发明提供了一种蓝藻水提物,作为血清替代物培养鱼肌肉细胞,可以实现全部替代血清和长期稳定扩大培养细胞的目标,可将其应用于细胞培养肉的规模化生产过程。
6.为达到上述目的,本发明具体通过以下技术方案实现,一种蓝藻水提物,其制备方法包括以下步骤:
7.(1)将蓝藻粉加水混合均匀,静置;
8.(2)冻融提取:取经过步骤(1)处理所获得藻液,冷冻-解冻处理后,离心取上清液;通过冻融方式破裂蓝藻细胞壁,提取水溶性活性物质。
9.(3)装柱:将纳米级虾蟹壳粉末装入层析柱,获得专用吸附层析柱装置;所述虾蟹
壳来源于虾蟹等水产动物的甲壳,甲壳经超微粉碎获得纳米级甲壳粉。甲壳素是自然界中唯一的碱性多糖,甲壳素分子结构中存在氨基、羟基、乙酰氨基、糖苷键等多种活性基团,具有生物相容性好、天然无毒等多种独特的功能性质,同时,特殊的糖环结构赋予甲壳素分子独特的界面特性。因此,基于甲壳素的新材料具有独特的生物活性及功能特性。因为甲壳素特殊的纤维状结构,可以通过机械作用得到甲壳素纳米纤维。甲壳素纳米纤维可以吸附带负电的蛋白质、核酸等功能分子,从而有效富集功能因子(此处可否再进一步解释下,与普通柱子相比,甲壳素纳米纤维吸附得到的功能分子为何可以应用于细胞培养肉,如果不好补充,请忽略本条)。
10.(4)精制纯化:取经过步骤(2)处理所获得的上清液,流过步骤(3)所制备的吸附层析柱,收集流出液,流出液干燥即可。
11.进一步的,所述蓝藻为螺旋藻或聚球藻。
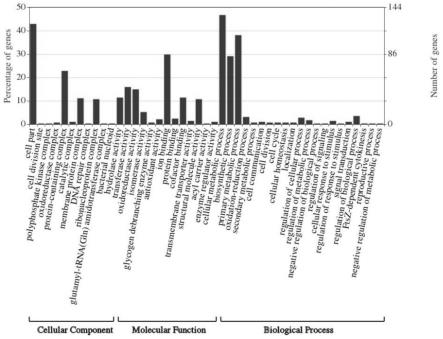
12.进一步的,所述步骤(1)中螺旋藻粉与水的料液比为1:5~1:20,静置过夜。
13.进一步的,所述步骤(2)为在-20~-80℃冷冻过夜后室温解冻,反复冻融2-5次再离心,收集上清液。
14.进一步的,步骤(4)采用冷冻干燥。
15.如图1所示,以螺旋藻为例,其水提物中的主要成分为蛋白质,蛋白质含量为61%。通过对水提物中蛋白功能因子进行go分析,发现本发明的水提物中含有多种参与细胞分裂和周期调控的功能因子如延长因子(elongation factor)、触发因子(trigger factor)、细胞分裂蛋白(cell division protein ftsz)等,含有调控细胞信号过程的激酶如丝氨酸/苏氨酸蛋白激酶、组氨酸激酶等。丝氨酸/苏氨酸蛋白激酶主要参与调节肌肉细胞代谢过程,转录起始/延长/终止因子等主要参与蛋白质合成过程,生长因子可以诱导成肌细胞增殖,保持肌细胞分化潜能。胎牛血清为细胞增殖提供营养物质,如激素、氨基酸、蛋白质、生长因子、微量元素、碳水化合物等。与胎牛血清相比,蓝藻水提物的部分蛋白功能因子可以替代fbs中活性成分如生长因子促进肌细胞增殖。
16.上述蓝藻水提物替代血清在细胞培养肉中的应用。可完全替代血清用于培养肌肉细胞。
17.进一步的,所述细胞培养肉为鱼肌肉。
18.不同细胞增殖和分化所需要的培养条件各不相同。胚胎干细胞可以无限增殖,但是定向分化为肌肉细胞存在不确定性,不能直接应用于细胞培养肉的生产。而自身不具有肌源性细胞命运的细胞类型,需要进行诱导才能作为种子细胞。本发明所用的鱼肌肉细胞为鱼肌肉干细胞分化后的成熟永生性肌细胞,可以表达肌肉细胞特征因子myf5,并进一步分化形成肌管,进而形成细胞培养肉。将本发明的蓝藻水提物,添加到无血清培养基中,在96孔板中培养鱼肌肉细胞3-7d,可以使鱼肌肉细胞达到添加10%胎牛血清(fbs)培养基的生长效果,且不影响鱼肌肉细胞基因表达的稳定性,也可实现扩大培养至培养瓶中连续传代培养至4代以上。
19.一种添加上述蓝藻水提物的培养液,含有0.5~1.5mg/ml的蓝藻水提物。蓝藻水提物添加量过低,替代fbs促进肌肉细胞增殖效果不够明显;添加量过高增加细胞培养成本,且易增加细胞渗透压,导致细胞壁皱缩引起细胞凋亡。
20.进一步的,包括:80%-90%基础培养基,10%鱼肌肉提取液、0%-10%血清、1%青
霉素、链霉素双抗、1
‰
两性霉素b,蓝藻水提物冻干粉溶于上述培养液中,过滤除菌,即得含蓝藻水提物的培养液;其中含蓝藻水提物的培养液浓度为0.5~1.5mg/ml。进一步的,所述血清用量为10%、5%、2%、0%。
21.该培养液可供肌肉细胞体外长期扩大培养。细胞体外长期扩大培养需要较多的胎牛血清维持细胞增殖,增加了细胞培养成本,如果减少血清用量则难以维持细胞多次传代培养。本实施例首先在96孔板中验证蓝藻水提物的增殖活性。
22.进一步的,转移细胞培养至24孔板、12孔板、6孔板、t25培养瓶中连续传代和扩大培养,实现鱼肌肉细胞的扩大培养,可实现连续传代至4代以上。
23.进一步的,包括以下步骤:
24.(1)800~1200rpm离心5~10min收集细胞,收集0.1~1ml条件培养基复配0.1~1ml权利3所述的低血清培养液,混合培养液重悬细胞后接种于24孔板培养;
25.(2)收集24孔板细胞上清液,配制0.1~1ml条件培养基和1~2ml培养液;细胞消化后吹打细胞悬液,接种到12孔板中培养;
26.(3)收集12孔板细胞上清液,配制0.1~1ml条件培养基和1~2ml培养液;细胞消化后吹打细胞悬液,接种到6孔板中培养;
27.(4)收集6孔板细胞上清液,配制0.1~1ml条件培养基和3~5ml培养液;细胞消化后吹打细胞悬液,接种到t25培养瓶中培养。
28.本发明的有益效果在于:
29.(1)本发明选择的蓝藻水提物,作为血清替代物,可以稳定替代血清培养鱼肌肉细胞,能够刺激和维持肌细胞增殖和特征基因表达,与干细胞增殖完全不同。
30.(2)蓝藻水提物作为血清替代物培养鱼肌肉细胞,可以实现全部替代血清和长期稳定扩大培养细胞的目标,可将其应用于细胞培养肉的规模化生产过程。
31.(3)本发明所述蓝藻水提物制备工艺简单、生产得率高、替代效果好,可以应用于无血清细胞培养肉的规模化生产。
32.(4)本发明所述蓝藻水提物应用于鱼肌肉细胞培养时,可直接溶于基础培养基,与培养基复配方式简单,对鱼肌肉细胞生长无毒副作用,能完全替代血清用于鱼肌肉细胞培养。
附图说明
33.图1为螺旋藻水提物蛋白功能因子的go分析结果。
34.图2为螺旋藻水提物替代100%fbs培养鱼肌肉细胞5天的增殖活性比较,对照组:10%fbs组、0%fbs组,实验组:1mg/ml螺旋藻水提物+0%fbs。
35.图3为免疫荧光法检测鱼肌肉细胞特征基因myf5实验结果(20
×
),a:0%fbs组,b:10%fbs组,c:实验组:1mg/ml螺旋藻水提物+0%fbs。
36.图4为螺旋藻水提物替代50%fbs扩大培养鱼肌肉细胞第4代生长情况(10
×
),对照组:10%fbs组、5%fbs组,实验组:1mg/ml螺旋藻水提物+5%fbs。
37.图5为螺旋藻水提物蛋白酶降解产物替代100%胎牛血清(fbs)培养鱼肌肉细胞5天的增殖活性比较,对照组:1mg/ml的螺旋藻水提物+0%fbs,实验组:1mg/ml的螺旋藻水提物蛋白酶降解产物+0%fbs。
具体实施方式
38.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
39.实施例1:
40.一种蓝藻水提物,其制备方法包括以下步骤:
41.a)原料浸提:取螺旋藻粉1kg,按照质量比1:10加水,混合均匀,过夜静置。
42.b)冻融提取:取经过步骤a处理所获得藻液,在-20℃冷冻过夜,室温解冻,反复冻融处理3次,离心30min,收集上清液。
43.c)装柱:将纳米级虾蟹壳粉末装入层析柱,获得专用吸附层析柱装置。
44.d)精制纯化:取经过步骤b处理所获得的上清液,流过步骤c所制备的吸附层析柱,收集流出液。
45.e)冷冻干燥:取步骤d处理获得的流出液,冷冻干燥,即获得水提物冻干粉。
46.实验结果:螺旋藻水提物中的主要成分为蛋白质,蛋白质含量为61%。通过对螺旋藻水提物中蛋白功能因子进行go分析,发现螺旋藻水提物中含有多种参与细胞分裂和周期调控的功能因子如延长因子(elongation factor)、触发因子(trigger factor)、细胞分裂蛋白(cell divisionprotein ftsz)等,含有调控细胞信号过程的激酶如丝氨酸/苏氨酸蛋白激酶、组氨酸激酶等(图1)。
47.实施例2:
48.(1)取融合率为80-90%的鱼肌肉细胞,300μl胰蛋白酶将细胞单层消化成细胞悬液,l-15完全培养液(79%l-15基础培养液+10%fbs+10%肌肉提取液+1%青霉素、链霉素双抗+1
‰
两性霉素b)调整细胞接种密度为1
×
105个/ml,每孔100μl铺板至96孔板,在培养箱中28℃培养24h。对照组:10%fbs组、2%fbs组,实验组:1mg/ml螺旋藻水提物+87%l-15+2%fbs+10%鱼肌肉提取液+1%青霉素、链霉素双抗+1
‰
两性霉素b。更换100μl上述培养液,继续培养3-7d。避光条件下,弃掉旧培养液,cck8和l-15基础培养液(1:10)混合后每孔加100μl,孵育2h,比较450nm下细胞的吸光度值。
49.(2)取融合率为80-90%的鱼肌肉细胞,300μl胰蛋白酶将细胞单层消化成细胞悬液,l-15完全培养液调整细胞接种密度为1
×
105个/ml,每孔100μl铺板至96孔板,在培养箱中28℃培养24h。对照组:10%fbs组、0%fbs组,实验组:1mg/ml螺旋藻水提物+89%l-15+0%fbs+10%肌肉提取液+1%青霉素、链霉素双抗+1
‰
两性霉素b。更换100μl上述培养液,继续培养3-7d。避光条件下,弃掉旧培养液,cck8和l-15基础培养液(1:10)混合后每孔加100μl,孵育2h,比较450nm下细胞的吸光度值。
50.实验结果:在替代100%fbs(以上第(2)组)实验中,螺旋藻水提物可以达到和10%fbs相当的细胞吸光度,说明螺旋藻水提物可以达到与10%fbs类似的生长效果,可以替代血清应用于制作细胞培养肉。
51.实施例3:
52.取融合率为80-90%的鱼肌肉细胞,300μl胰蛋白酶将细胞单层消化成细胞悬液,l-15完全培养液调整细胞悬液密度至2
×
105个/ml,每孔500μl接种于24孔板中,28℃培养
24h。
53.对照组:10%fbs组、0%fbs组,实验组:1mg/ml螺旋藻水提物+89%l-15+5%fbs+10%肌肉提取液+1%青霉素、链霉素双抗+1
‰
两性霉素b。更换500μl上述培养液,28℃培养3d,免疫荧光法检测鱼肌肉细胞的特征基因myf5在细胞核内的表达情况。
54.免疫荧光法检测的过程如下:
55.(1)细胞固定:每孔加200μl细胞固定液,室温孵育15min后弃掉,200μl的pbs清洗2遍。
56.(2)细胞通透:每孔加150μl细胞通透剂,室温孵育15min后弃掉,200μl的pbs清洗2遍。
57.(3)细胞封闭:每孔加200μl细胞封闭液(10%山羊血清),室温孵育60min后弃掉,200μl的pbs清洗2遍。
58.(4)一抗孵育:每孔加150μl一抗,4℃孵育过夜。
59.(5)二抗孵育:室温平衡24孔板30min,弃掉一抗,pbs清洗2遍,避光加150μl二抗,避光孵育1h。
60.(6)dapi染色:弃掉二抗,pbs清洗2遍,避光加150μl的dapi,室温避光孵育5min。弃掉dapi,pbs清洗2遍,荧光显微镜下拍照。
61.实验结果:在鱼肌肉细胞增殖过程中,免疫荧光结果发现,肌肉干细胞特征因子pax 7在鱼肌肉细胞中不表达,但肌细胞特征基因myf5能在细胞核中正常表达,同时螺旋藻水提物的添加也不影响鱼肌肉细胞基因表达的稳定性(图3)。
62.实施例4:
63.对照组:10%fbs组、5%fbs组,实验组:1mg/ml螺旋藻水提物+84%l-15+5%fbs+10%肌肉提取液+1%青霉素、链霉素双抗+1
‰
两性霉素b。
64.第1代:取1瓶融合率为90%的鱼肌肉细胞,pe清洗2遍细胞单层,胰酶消化细胞,l-15完全培养液吹打成细胞悬液,计数后l-15完全培养液调整细胞悬液为1
×
105个/ml,分装细胞悬液,离心收集细胞,用上述培养液重悬细胞,接种于24孔板培养,1-2d进行半换液,连续拍照观察细胞贴壁情况和生长状况。
65.第2代:pe清洗2遍细胞单层,胰酶消化细胞,配制培养液重悬细胞,吹打成细胞悬液,倒置显微镜下观察细胞单层是否消化完全,并将其全部接种到12孔板中培养,补充剩余新鲜培养液,1-2d进行半换液,连续拍照观察细胞贴壁情况和生长密度。
66.第3代:pe清洗2遍细胞单层,胰酶消化细胞,配制培养液重悬细胞,吹打成细胞悬液,倒置显微镜下观察细胞单层是否消化完全,并将其全部接种到6孔板中培养,补充剩余新鲜培养液,1-2d进行半换液,连续拍照观察细胞贴壁情况和生长密度。
67.第4代:pe清洗2遍细胞单层,胰酶消化细胞,配制培养液重悬细胞,吹打成细胞悬液,倒置显微镜下观察细胞单层是否消化完全,并将其全部接种到t25培养瓶中培养,补充剩余新鲜培养液,连续拍照观察细胞贴壁情况和生长密度。
68.第5代:pe清洗2遍细胞单层,胰酶消化细胞,终止消化,吹打成细胞悬液,进行细胞计数,比较对照组、实验组细胞数。
69.实验结果:如图4所示,在鱼肌肉细胞连续传代扩大培养过程中,替代50%fbs,传到第4代时,发现实验组(螺旋藻水提物+5%fbs)细胞数高于5%fbs组和10%fbs组,进一步
说明螺旋藻水提物可以促进细胞增值,可以达到扩大培养过程中替代血清的效果。
70.实施例5:
71.(1)蛋白酶解:将螺旋藻水提物粉末溶于1
×
pbs中,配制浓度为1mg/ml的溶液,加入胰蛋白酶,37℃水浴反应2h,进行蛋白质酶解。反应完成后,沸水浴10min进行酶灭活,离心后取上清液,得到螺旋藻水提物蛋白酶降解产物,冻干。
72.(2)取融合率为80-90%的鱼肌肉细胞,300μl的胰蛋白酶将细胞单层消化成细胞悬液,l-15完全培养液调整细胞接种密度为1
×
105个/ml,每孔100μl铺板至96孔板,在培养箱中28℃培养24h。对照组:1mg/ml的螺旋藻水提物+0%fbs培养液,实验组:1mg/ml螺旋藻水提物蛋白酶降解产物+0%fbs培养液。更换100μl上述培养液,继续培养3-7d。避光条件下,弃掉旧培养液,cck8和l-15基础培养液(1:10)混合后每孔加100μl,孵育2h,比较450nm下细胞的吸光度值。
73.实验结果:如图5所示,螺旋藻水提物经过蛋白酶处理后,细胞增殖活性显著降低,说明替代物中的主要活性成分为蛋白功能因子。其中,丝氨酸/苏氨酸蛋白激酶dst1,它们主要参与调节细胞代谢过程和转移酶活性。表皮生长因子、血小板活化因子诱导成肌细胞增殖、分化,转录起始/延长/终止因子参与蛋白质合成过程。
74.综上可以看出,本发明根据cck8法筛选得到了可替代fbs促进鱼肌肉细胞增殖的蓝藻水提物,并探索到将该物质添加到基础培养基中的条件为0.5~1.5mg/ml,在96孔板中培养鱼肌肉细胞3-7天能达到10%fbs组的细胞增殖率;将该蓝藻水提物培养基应用到体外扩大培养鱼肌肉细胞中,可实现连续传代培养至4代以上,最终收获细胞数高于10%fbs组;同时,该蓝藻水提物在促进鱼肌肉细胞增殖过程中,不影响细胞特征基因myod稳定表达,可实现完全血清替代的作用,应用于制作细胞培养肉。
75.需要说明的是,虽然已经对本发明的具体实施方案进行了描述,但是本领域技术人员根据发明的基本思想,可以对本发明进行种修改和改进。只要不脱离本发明的基本思想,均应当在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1