一株美网柄牛肝菌内生木霉真菌及其应用的制作方法
1.本发明属于食用菌栽培技术领域,具体涉及一株美网柄牛肝菌内生木霉真菌及其应用。
背景技术:
2.美网柄牛肝菌(boletus reticulatus schaeff.)是一种珍稀的外生菌根性食用菌,属于牛肝菌目(boletales)、牛肝菌科(boletaceae)、牛肝菌属(boletus),其味道鲜美、营养价值高,在我国多个地区广泛分布。美网柄牛肝菌常与松属植物的根系共生,因其独特的共生生态环境、营养方式和子实体分化条件,不易形成子实体。由于生态环境的变化,我国野生美网柄牛肝菌的产量急剧下降,为了保护野生食用真菌资源的多样性,有必要进行美网柄牛肝菌资源的开发。近十年多来,国内外研究者开展了美网柄牛肝菌的菌种制备与栽培工作,部分研究者利用美网柄牛肝菌菌丝体的纯培养物接种松树根系,待菌丝体生物量积累达一定量,在合适的自然气候条件下出菇。但美网柄牛肝菌均表现为菌丝生长缓慢、出菇周期长、出菇量低,这与自然条件下美网柄牛肝菌菌丝积累需要较长时间有必然联系。
3.此外,在野生菌根性食用菌的半人工栽培过程中,接种的菌根性食用菌菌种易腐败,生产者常常利用市售化学抑菌剂防治食用菌病害,存在潜在的化学物质污染,其副作用一直困扰着消费者和管理者。
技术实现要素:
4.本发明所要解决的技术问题是提高美网柄牛肝菌的菌丝生长速度,同时降低其培养过程中的污染。
5.为解决上述技术问题,本发明提供一株美网柄牛肝菌内生木霉真菌,其保藏编号为cctcc no:m 2022944,名称为木霉sf-2。该菌株在改良的pda平板培养基上培养时,菌丝初期为白色、浓密、毛毡状,老化菌丝为黄色。
6.本发明还提供一种菌剂,其包含所述美网柄牛肝菌内生木霉真菌sf-2。
7.上述菌剂可以包含所述木霉真菌sf-2的菌粉;所述菌粉的制备方法包括:液体培养所述木霉真菌3-5天,将所得木霉真菌培养液进行无菌过滤,得到木霉真菌菌丝,无菌水冲洗后,于60
±
1℃烘干灭活(利用pda平板培养检测,其无生长活性),将菌丝磨成粉末,过60目筛。
8.上述菌剂也可以包含所述木霉真菌sf-2的固定化菌粉,所述固定化菌粉为海藻酸钠微球固定化菌粉或海藻酸钠海绵固定化菌粉。
9.所述海藻酸钠微球固定化菌粉的制备方法可以包括如下步骤:配制2-3%海藻酸钠溶液,每20ml加入0.25-2g上述木霉真菌sf-2的菌粉,搅拌均匀,将混合液缓慢滴入2-4%cacl2溶液中固定3-5h,无菌过滤,获得海藻酸钠微球固定化菌粉,无菌水冲洗后,于37
±
1℃烘干。
10.所述海藻酸钠海绵固定化菌粉的制备方法可以包括如下步骤:采用脱脂牛乳配制
1-2%海藻酸钠溶液,每20ml加入0.25-2g上述木霉真菌sf-2的菌粉,搅拌混匀,室温放置一段时间以排出混合液内的空气,置于-20℃冷冻3-5h,再置于-80℃真空冷冻干燥24-48h;将真空冷冻干燥的样品放入1-3%cacl2溶液中交联3-5h,获得海藻酸钠海绵固定化菌粉,无菌水洗涤后,于37
±
1℃烘干。
11.所述美网柄牛肝菌内生木霉真菌sf-2或任一所述菌剂在制备美网柄牛肝菌液体菌种和固体菌种中的应用也属于本发明的保护范围。
12.本发明还提供一种制备美网柄牛肝菌液体菌种的方法,包括如下步骤:液体培养美网柄牛肝菌,当培养液中美网柄牛肝菌处于优势生长时,向培养液中添加上述木霉真菌sf-2的菌粉或上述木霉真菌sf-2的固定化菌粉,继续培养得到美网柄牛肝菌液体菌种。
13.上述方法中,每150ml美网柄牛肝菌培养液可添加0.25-2g上述木霉真菌sf-2的菌粉或固定化菌粉。
14.上述方法中,可采用改良的pda液体培养基对美网柄牛肝菌进行液体培养;所述培养基的配方为:称取去皮土豆200g,切成小块,加水1000ml,加热至沸腾,维持5-10min,用纱布趁热过滤,弃滤渣,待滤液冷却至50-60℃时,向滤液中加入葡萄糖20g、玉米粉20g、酵母粉2g、kh2po
4 0.1-0.5g、mgso
4 1g、vc 0.01-0.05g,加入ddh2o,加热溶解后定容至1000ml。
15.上述方法中,可在28℃、160r/min条件下对美网柄牛肝菌进行液体培养。
16.上述方法中,向美网柄牛肝菌培养液中添加上述木霉真菌sf-2的菌粉或上述木霉真菌sf-2的固定化菌粉后,可继续培养5-7天,获得美网柄牛肝菌液体菌种。
17.本发明还提供一种制备美网柄牛肝菌固体菌种的方法,包括如下步骤:使用上述方法制备美网柄牛肝菌液体菌种,将所述液体菌种接种到固体培养基质中,培养得到美网柄牛肝菌固体菌种。
18.所述固体培养基质的配方可以是:按质量百分比计,马尾松木屑10-15%、马尾松松针粉5-10%、稻草粉10-20%、棉籽壳10-20%、牛粪10-15%、玉米芯10-15%、珍珠岩10-15%、葡萄糖1-1.5%、石膏1-1.5%、磷酸二氢钾0.01-0.05%、vc 0.001-0.005%,调节水分含量至65-70%,ph 7.2。
19.上述方法中,可按照1%(v/v)的接种量将所述美网柄牛肝菌液体菌种接种到固体培养基质中,于24
±
1℃暗培养19-25天,得到美网柄牛肝菌固体菌种。
20.本发明利用低剂量、环境友好、具有生防作用的内生真菌木霉sf-2与外生菌根真菌美网柄牛肝菌共培养,获得了优良的美网柄牛肝菌液体菌种和固体菌种。相较于利用纯培养方法制备的美网柄牛肝菌菌种,该液体菌种和固体菌种既含有适量的生防内生真菌木霉sf-2,又含有处于优势生长的美网柄牛肝菌,木霉sf-2能够有效促进美网柄牛肝菌生长并降低污染。若将该液体菌种或固体菌种接种松树林(例如天然马尾松林),可以起到协同增效的作用,木霉sf-2可以促进松树林中美网柄牛肝菌的菌丝生长和子实体发育,从而缩短美网柄牛肝菌子实体的生产周期,提高美网柄牛肝菌的产量。这将是一种高效的半人工栽培美网柄牛肝菌的方法。
21.本发明具有以下有益效果:
22.(1)本发明提供的木霉sf-2能够显著提高美网柄牛肝菌的菌丝生长速度以及胞外酶活性。
23.经实验证明,按照每150ml培养液添加0.5g木霉sf-2菌粉的比例向美网柄牛肝菌
培养液中添加海藻酸钠海绵固定化木霉菌粉后,美网柄牛肝菌的菌丝干重可达到15.05mg/ml,漆酶活性可达到23.61u/ml,多酚氧化酶活性可达到38.67u/ml,中性蛋白酶活性可达到3.519u/ml,淀粉酶活性可达到0.596u/ml,纤维素酶活性可达到0.566u/ml。采用木霉sf-2诱导制备美网柄牛肝菌液体菌种,获得的美网柄牛肝菌液体菌种长势好、发菌快、菌丝生物量高、培养6-7天就能够用于栽培接种。将所得美网柄牛肝菌液体菌种接种到固体培养基质后,菌丝长势强,在基质中的分布均匀,19-25天即可长满固体培养基质。
24.(2)本发明提供的木霉sf-2具有良好的生防作用,可降低污染。
25.经实验证明,将上述美网柄牛肝菌液体菌种接种到固体培养基质后,在不使用任何化学药剂的情况下,当菌丝长满固体培养基质时,10袋固体培养物中平均有1-2袋出现污染。
26.本发明提供的木霉sf-2,其专利保藏信息如下:
27.保藏名称:trichoderma sp.sf-2
28.保藏日期:2022年06月22日
29.保藏编号:cctcc no:m 2022944
30.保藏机构:中国典型培养物保藏中心
31.地址:中国.武汉.武汉大学。
附图说明
32.图1显示了在改良的pda平板上培养的木霉sf-2的菌落形态。
33.图2显示了基于rdna-its序列构建的木霉sf-2的系统发育树。
34.图3显示了木霉sf-2与美网柄牛肝菌的平板对峙培养结果。左侧为美网柄牛肝菌菌落,右侧为木霉sf-2菌落。
35.图4显示了木霉sf-2菌粉。
36.图5显示了海藻酸钠微球固定化木霉sf-2菌粉。
37.图6显示了海藻酸钠海绵固定化木霉sf-2菌粉。
38.图7显示了木霉菌粉诱导培养的美网柄牛肝菌液体菌种;ck组为未添加木霉菌粉的对照组美网柄牛肝菌培养液;a组为添加了木霉sf-2菌粉的美网柄牛肝菌培养液;b组为添加了海藻酸钠微球固定化木霉sf-2菌粉的美网柄牛肝菌培养液;c组为添加了海藻酸钠海绵固定化木霉sf-2菌粉的美网柄牛肝菌培养液。
39.图8显示了木霉菌粉诱导培养的美网柄牛肝菌固体菌种;ck组为未添加木霉菌粉的对照组美网柄牛肝菌液体菌种接种固体基质后培养15天得到的固体菌种;a处理组为添加了游离木霉sf-2菌粉的美网柄牛肝菌液体菌种接种固体基质后培养15天得到的固体菌种。
具体实施方式
40.下面结合具体实施例和附图对本发明的技术方案进行详细描述。
41.以下实施例中使用的美网柄牛肝菌为本实验室分离和保存的菌株。公众可从湖北民族大学生物科学与技术学院获得该菌株,该菌株只为重复本发明的相关实验所用,不可作为其它用途使用。本发明的实现不依赖于该菌株。
42.以下实施例中使用的培养基:
43.改良的pda液体培养基:称取去皮土豆200g,切成小块放入锅中,加水1000ml,加热至沸腾,维持5-10min,用2层纱布趁热过滤,弃滤渣。待滤液冷却至50-60℃,向滤液中加入葡萄糖20g、玉米粉20g、酵母粉2g、kh2po
4 0.1-0.5g、mgso
4 1g、vc 0.01-0.05g、加入ddh2o,加热溶解后定容至1000ml,分装于250ml玻璃三角瓶中,每瓶150ml,121℃灭菌20min,备用。
44.改良的pda固体培养基:在改良的pda液体培养基的基础上加入琼脂粉20g。
45.以下实施例中使用的测定方法:
46.美网柄牛肝菌的菌丝生长量的测定方法:将样品放入10ml离心管中,在4℃、4000r/min下离心10min,离心后沉淀物即为菌丝,将菌丝置于60
±
1℃烘干至恒重,称量即得菌丝干重,以菌丝干重衡量美网柄牛肝菌的菌丝生长量。
47.美网柄牛肝菌的胞外酶活性的测定方法:将样品放入10ml离心管中,在4℃、9000r/min条件下离心10min,上清液即为粗酶液,对粗酶液中的胞外酶活性进行测定。
48.①
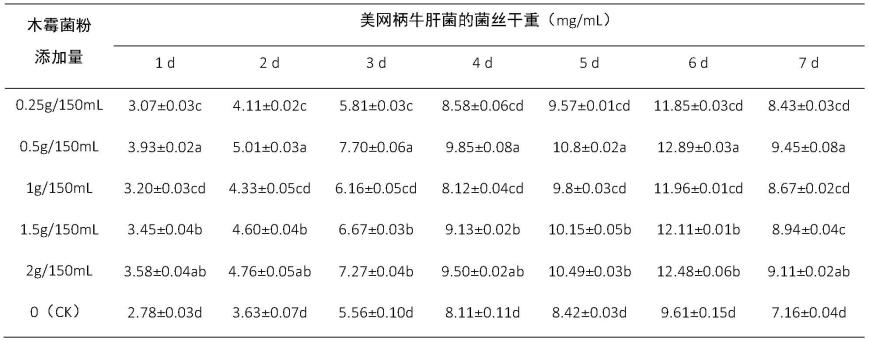
漆酶活性测定:利用邻联甲苯胺法测定漆酶活性,参见文献(陈桂梅.油松菌根伴生真菌与外生菌根真菌的互作研究[d].西北农林科技大学,2009)。
②
多酚氧化酶活性测定:利用邻苯二酚法测定多酚氧化酶活性,参见文献(王伟科,陆娜,周祖法,宋吉玲,袁卫东,闫静.8种胞外酶在香菇不同生长阶段的活性变化[j].浙江农业科学,2014(4):498-501)。
③
中性蛋白酶活性测定:利用福林酚法测定蛋白酶活性,参见文献(白燕,王维新.刺参肠道蛋白酶、淀粉酶、脂肪酶与纤维素酶活性的测定方法[j].饲料工业,2012,33(20):28-32)。
④
淀粉酶活性测定:利用dns比色法测定淀粉酶活性,参见文献(张桦主编.生物化学实验指导(第2版)[m].中国农业大学出版社,2020)中的dns比色法。
⑤
纤维素酶活性测定:利用dns比色法测定纤维素酶活性,参见文献(黄春霖.巴尔喀什黑伞8种胞外酶活力变化规律研究[d].新疆农业大学,2018)中的dns比色法。
[0049]
以下实施例中使用的数据处理与分析方法:试验数据采用spss statistics 20软件进行单因素方差分析,以平均数
±
标准差表示。
[0050]
若未特别说明,以下实施例中使用的试剂均为本领域常规试剂,可商购获得或按照本领域常规方法配制而得,规格为实验室级即可。若未特别说明,以下实施例所使用的实验方法和条件均为本领域常规实验方法和条件,可参考相关实验手册、公知文献或厂商说明书。除非另有定义,本文使用的所有技术和科学术语的含义与本发明所属领域普通技术人员通常理解的含义相同。
[0051]
实施例1、菌株的分离与鉴定
[0052]
本发明的发明人在分离野生美网柄牛肝菌的过程中,在改良的pda固体培养基上意外获得一株内生真菌。将该菌株置于28℃条件下培养,得到菌丝体。采用真菌基因组dna提取试剂盒(omega公司,货号d3471-00)按照试剂盒说明书提取菌丝体总dna。利用正向引物its1f(5
′‑
cttggtcattttagaggaagtaa-3
′
)和反向引物its4b(5
′‑
caggagacttgtacacggtccag-3
′
)进行rdna-its序列pcr扩增,并对pcr纯化产物进行双向测序,获得了该菌株的its序列(如seq id no:1所示),其与genbank中已登录的木霉真菌韩国新种trichoderma songyi sp.nov.的its序列(genbank登录号:mn809171.1)的相似度达98.09%,因此鉴定该菌株为木霉真菌(trichoderma sp.),命名为木霉sf-2。
[0053]
木霉sf-2的its序列如下:
[0054]
ccttttctaggggaacttcacgagggatcattaccgagtccagcaactcccaaacccaatgtgaaccataccaaactgttgcctcggcgagggtcacgccccgggtgcgtcgcagccccggaaccaggcgcccgccggagggaccaaccaaactctttactgtagtcccctcgcggacgttatttcttacagctctgagcaaaaattcaaatgaatcaaaactttcaacaacggatctcttggttctggcatcgatgaagaacgcagcgaaatgcgataagtaatgtgaattgcagaattcagtgaatcatcgaatctttgaacgcacattgcgcccgccagtattctggcgggcatgcctgtccgagcgtcatttcaaccctcgaacccctccggggggtcggcgttggggatcgggaacccctcagacgggatcccggccccgaaatacagtggcggtctcgccgcagcctctcctgcgcagtagtttgcacaactcgcaccgggagcgcggcgcgtccacgtccgtaaaacacccaacttctgaaatgttgacctaggaacaggtagaaaaacccgctaaacttacccatatcagtaaccgaagagagaatc(seq id no:1)
[0055]
在改良的pda固体培养基上培养木霉sf-2,该菌株的菌丝初期为白色、浓密、毛毡状(图1),菌丝老化后呈黄色,并且产孢量少,与韩国新种trichoderma songyi sp.nov.的特征相似,两者为近缘种。基于rdna-its序列构建的木霉sf-2的系统发育树如图2所示。
[0056]
木霉sf-2已进行专利保藏,保藏机构为中国典型培养物保藏中心,保藏编号为cctcc no:m 2022944。
[0057]
实施例2、美网柄牛肝菌与木霉sf-2的对峙培养
[0058]
用直径6mm无菌打孔器在已活化的美网柄牛肝菌的菌落边缘打取菌饼1块,接种在直径90mm的改良的pda固体培养基中,置于28℃培养箱中暗培养,待美网柄牛肝菌菌落培养至1.5-2cm时(培养约8-10d后),在与美网柄牛肝菌菌落相距30mm处接入直径6mm的已培养5d的木霉sf-2菌饼1块,继续置于28℃培养箱中暗培养,观察美网柄牛肝菌与木霉真菌有无对峙生长。
[0059]
结果显示:美网柄牛肝菌在改良的pda固体培养基上菌丝生长缓慢,菌丝浓密粗壮。接种木霉sf-2后,木霉菌丝生长速度较快,菌丝纤细疏松。在美网柄牛肝菌与木霉sf-2共培养2d后,美网柄牛肝菌与木霉sf-2呈现交叉生长,美网柄牛肝菌的生长未受木霉sf-2影响,且交叉生长处未形成明显的拮抗线(图3)。
[0060]
实施例3、美网柄牛肝菌液体菌种的制备
[0061]
1、菌种的液体培养
[0062]
(1)美网柄牛肝菌的液体培养
[0063]
从改良的pda固体培养基上选取菌丝长势良好的美网柄牛肝菌,用直径6mm无菌打孔器在菌落边缘打取菌饼,接种于150ml改良的pda液体培养基中(3块/瓶,直径6mm/块),置于28℃、160r/min振荡培养7-10d,获得美网柄牛肝菌的液体培养液。
[0064]
(2)木霉真菌的液体培养
[0065]
从改良的pda固体培养基上选取菌丝长势良好的木霉sf-2,用直径6mm无菌打孔器在菌落边缘打取菌饼,接种于150ml改良的pda液体培养基中(3块/瓶,6mm/块),置于28℃、160r/min条件下振荡培养3-5d,获得木霉sf-2的液体培养液。
[0066]
2、木霉菌粉的制备
[0067]
将上述培养3-5d获得的木霉sf-2的液体培养液用2层无菌纱布过滤,得到木霉真菌菌丝,用无菌水冲洗菌丝2次,在60
±
1℃烘干灭活(利用pda平板培养检测,其无生长活性),将菌丝磨成粉末,过60目筛,即得木霉sf-2菌粉,密封备用。
[0068]
3、木霉菌粉添加量的优化
[0069]
处理组:将灭活的木霉sf-2菌粉置于超净工作台中紫外线消毒30min,以不同梯度浓度(设置0g/150ml、0.25g/150ml、0.5g/150ml、1g/150ml、1.5g/150ml、2g/150ml)添加到已培养3-5d的美网柄牛肝菌的液体培养液中(此时美网柄牛肝菌已处于优势生长,表现为培养液中出现米粒大小的菌丝球),然后置于28℃、160r/min条件下振荡培养。添加木霉sf-2菌粉后,采用无菌操作技术每天吸取培养液样品,每次取样10ml,每种处理3个重复,连续取样7d,测定样品中美网柄牛肝菌菌丝干重。
[0070]
对照组(ck组):不添加木霉sf-2菌粉,其余同处理组。
[0071]
结果如表1所示,相较于未添加木霉菌粉的ck组,添加不同量的木霉菌粉的处理组的美网柄牛肝菌菌丝干重均显著增加,且均在添加木霉菌粉后第6d菌丝干重达到最大值,其中以添加木霉菌粉0.5g/150ml的处理组菌丝干重增效最显著,菌丝干重最大值达12.89mg/ml。
[0072]
表1木霉菌粉不同添加量对美网柄牛肝菌菌丝干重的影响
[0073][0074]
表中每个数值均表示为三次测试的平均值(mean)
±
标准差(sd),同一列中不同的字母表示具有显著差异(p《0.05)。
[0075]
4、木霉菌粉添加方式的优化
[0076]
(1)木霉菌粉的制备
[0077]
①
木霉菌粉:按上述2中的方法制备木霉sf-2菌粉。
[0078]
②
海藻酸钠微球固定化木霉菌粉的制备
[0079]
配制20ml 2-3%(g/ml)的海藻酸钠溶液,加入0.5g木霉sf-2菌粉,搅拌均匀,用20-30ml无菌注射器将混合液缓慢滴入100ml 2-4%(g/ml)cacl2溶液中固定3-5h,用无菌纱布过滤,获得海藻酸钠微球固定化木霉菌粉,经无菌水冲洗2次,37
±
1℃烘干,密封,4℃保存备用。
[0080]
③
海藻酸钠海绵固定化木霉菌粉的制备
[0081]
采用市售脱脂牛乳配制20ml 1-2%(g/ml)的海藻酸钠溶液,加入0.5g木霉sf-2菌粉,搅拌混匀,室温放置一段时间以排出混合液内的空气,置于-20℃冷冻3-5h,再转移至-80℃真空冷冻干燥24-48h。将真空冷冻干燥的样品放入100ml 1-3%(g/ml)cacl2溶液中交联3-5h,即得海藻酸钠海绵固定化木霉菌粉,用无菌水洗涤2次,37
±
1℃烘干,密封备用。
[0082]
④
海藻酸钠微球的制备
[0083]
配制20ml 2-3%(g/ml)的海藻酸钠溶液,不添加木霉菌粉,用20-30ml无菌注射器
将海藻酸钠溶液缓慢滴入100ml 2-4%(g/ml)cacl2溶液中固定3-5h,用无菌纱布过滤,获得海藻酸钠微球,经无菌水冲洗2次,37
±
1℃烘干,密封,4℃保存备用。
[0084]
⑤
海藻酸钠海绵的制备
[0085]
采用市售脱脂牛乳配制20ml 1-2%(g/ml)的海藻酸钠溶液,不添加木霉菌粉,室温放置一段时间以排出溶液中的空气,置于-20℃冷冻3-5h,再转移至-80℃真空冷冻干燥24-48h。将真空冷冻干燥的样品放入100ml 1-3%(g/ml)cacl2溶液中交联3-5h,获得海藻酸钠海绵,用无菌水洗涤2次,37
±
1℃烘干,密封备用。
[0086]
(2)木霉菌粉不同添加方式的效果检测
[0087]
设置以下实验组:
[0088]
a处理组:按照每150ml培养液添加0.5g木霉sf-2菌粉的比例,将上述
①
中制备的木霉sf-2菌粉添加到已培养3-5d的美网柄牛肝菌的液体培养液中。
[0089]
b处理组:按照每150ml培养液添加0.5g木霉sf-2菌粉的比例,将上述
②
中制备的海藻酸钠微球固定化木霉菌粉添加到已培养3-5d的美网柄牛肝菌的液体培养液中。
[0090]
c处理组:按照每150ml培养液添加0.5g木霉sf-2菌粉的比例,将上述
③
中制备的海藻酸钠海绵固定化木霉菌粉添加到已培养3-5d的美网柄牛肝菌的液体培养液中。
[0091]
b-a对照组:将与b处理组等量的上述
④
中制备的海藻酸钠微球添加到已培养3-5d的美网柄牛肝菌的液体培养液中。
[0092]
c-a对照组:将与c处理组等量的上述
⑤
中制备的海藻酸钠海绵添加到已培养3-5d的美网柄牛肝菌的液体培养液中。
[0093]
ck对照组:未添加木霉菌粉和海藻酸钠的已培养3-5d的美网柄牛肝菌的液体培养液。
[0094]
将各实验组的美网柄牛肝菌培养液置于28℃、160r/min条件下振荡培养。每天采用无菌操作技术吸取美网柄牛肝菌培养液样品,每次取样10ml,每个实验组3个重复,连续取样7d,测定培养液中美网柄牛肝菌的菌丝生长量(用菌丝干重来衡量)和胞外酶活性,从而选取美网柄牛肝菌液体菌种培养的最适木霉菌粉添加方式。
[0095]
实验结果:
[0096]
美网柄牛肝菌的菌丝生长量:
[0097]
表2木霉菌粉不同添加方式对美网柄牛肝菌菌丝生长量的影响
[0098][0099][0100]
表中每个数值均表示为三次测试的平均值(mean)
±
标准差(sd),同一列中不同的
字母表示具有显著差异(p《0.05)。
[0101]
由表2可知,与未添加木霉菌粉的b-a对照组、c-a对照组和ck对照组相比,以不同方式添加木霉菌粉的a处理组、b处理组、c处理组的美网柄牛肝菌的菌丝生长速度均显著提高。在添加木霉菌粉诱导培养2d后,美网柄牛肝菌菌丝长势明显增快,菌丝干重显著增加,至第6d时菌丝干重均达到最大值,之后随着培养时间的延长,菌丝开始老化,菌丝干重缓慢下降。在各处理组中,c处理组美网柄牛肝菌菌丝长势最好,菌丝干重高达15.05mg/ml,显著高于其他处理组。
[0102]
美网柄牛肝菌的胞外酶活性:
[0103]
美网柄牛肝菌能够产生漆酶、多酚氧化酶、中性蛋白酶、淀粉酶、纤维素酶等分解复杂营养物质的胞外酶类。这些酶在其重寄生、降解木质素以及与周围微生物的对抗作用中扮演着非常重要的角色,它们不仅可以使美网柄牛肝菌吸收利用简单的有机物,还可以吸收利用植物或真菌残体等复杂的有机物。
[0104]
表3木霉菌粉不同添加方式对美网柄牛肝菌培养液的漆酶活性的影响
[0105][0106]
表中每个数值均表示为三次测试的平均值(mean)
±
标准差(sd),同一列中不同的字母表示具有显著差异(p《0.05)。
[0107]
由表3可知,a处理组、b处理组、c处理组的美网柄牛肝菌培养液中漆酶的活性显著高于b-a对照组、c-a对照组及ck对照组。a处理组、b处理组、c处理组与ck对照组的漆酶活性的变化趋势相同,在添加木霉菌粉诱导培养的第6d均达到最大值,在第7d开始下降。在各处理组中,c处理组效果最优,美网柄牛肝菌漆酶活性在培养的第6d达到最大值23.61u/ml,显著高于其他处理组。
[0108]
表4木霉菌粉不同添加方式对美网柄牛肝菌培养液的多酚氧化酶活性的影响
[0109]
[0110]
表中每个数值均表示为三次测试的平均值(mean)
±
标准差(sd),同一列中不同的字母表示具有显著差异(p《0.05)。
[0111]
由表4可知,处理组的美网柄牛肝菌培养液中多酚氧化酶的活性显著高于b-a对照组、c-a对照组及ck对照组。a处理组、b处理组与ck对照组的多酚氧化酶活性的变化趋势相同,在第6d均达到最大,在第7d开始下降,而c处理组在第1-7d多酚氧化酶活性均处于强势上升趋势,第7d高达38.67u/ml,在第8d开始下降。c处理组的多酚氧化酶活性显著高于a处理组和b处理组。
[0112]
表5木霉菌粉不同添加方式对美网柄牛肝菌培养液的中性蛋白酶活性的影响
[0113][0114]
表中每个数值均表示为三次测试的平均值(mean)
±
标准差(sd),同一列中不同的字母表示具有显著差异(p《0.05)。
[0115]
由表5可知,美网柄牛肝菌经木霉菌粉诱导处理后,其培养液的中性蛋白酶活性变化显著。经木霉菌粉诱导处理后,培养液的中性蛋白酶活性在第1-4d快速提升,在第4-6d中性蛋白酶活性保持高平稳状态,在第7d中性蛋白酶活性开始降低。比较木霉不同添加方式组,c处理组在整个培养过程中培养液的中性蛋白酶活性显著高于a处理组和b处理组,在第6d高达3.519u/ml。
[0116]
表6木霉菌粉不同添加方式对美网柄牛肝菌培养液的淀粉酶活性的影响
[0117][0118]
表中每个数值均表示为三次测试的平均值(mean)
±
标准差(sd),同一列中不同的字母表示具有显著差异(p《0.05)。
[0119]
由表6可知,在美网柄牛肝菌液体培养第1-4d,木霉菌粉诱导处理组与ck对照组淀粉酶活性均不同程度地升高,诱导处理组淀粉酶活性均高于ck对照组。在培养第4d淀粉酶活性达到峰值,随后开始缓慢下降。c处理组在整个培养过程中培养液的淀粉酶活性显著高于a处理组和b处理组,在第4d高达0.596u/ml。
[0120]
表7木霉菌粉不同添加方式对美网柄牛肝菌培养液的纤维素酶活性的影响
[0121][0122]
表中每个数值均表示为三次测试的平均值(mean)
±
标准差(sd),同一列中不同的字母表示具有显著差异(p《0.05)。
[0123]
由表7可知,在整个培养过程中,诱导处理组与ck对照组的纤维素酶活性呈相同的变化趋势。在第1-3d培养液的纤维素酶活性快速提高,在第3d纤维素酶活性达到最大值,随后开始缓慢下降,在第5d纤维素酶活性稍有回升,但整体呈下降趋势。c处理组在整个培养过程中培养液的纤维素活性显著高于a处理组和b处理组,在第3d高达0.566u/ml。
[0124]
实施例4、美网柄牛肝菌固体菌种的制备
[0125]
按常规方法制备固体培养基质,配方如下:按质量百分比计,马尾松木屑10-15%、马尾松松针粉5-10%、稻草粉10-20%、棉籽壳10-20%、牛粪10-15%、玉米芯10-15%、珍珠岩10-15%、葡萄糖1-1.5%、石膏1-1.5%、磷酸二氢钾0.01-0.05%、vc 0.001-0.005%,调节水分含量至65-70%,ph 7.2。
[0126]
将实施例3第4节中a处理组、b处理组、c处理组、b-a对照组、c-a对照组以及ck对照组培养得到的美网柄牛肝菌液体菌种按1%(v/v)的接种量(即美网柄牛肝菌培养液与固体培养基质的体积比为1:100)分别接种到制备的固体培养基质中,于24
±
1℃培养室中暗培养至菌丝长满固体培养基质。观察各组美网柄牛肝菌的菌丝长势,每组接种10袋固体培养基质,3次实验重复,从而选取美网柄牛肝菌固体菌种培养的最适木霉菌粉添加方式。
[0127]
结果如表8所示,采用以马尾松木屑、马尾松松针粉为主的固体培养基质制备美网柄牛肝菌固体菌种,木霉sf-2菌粉均能显著促进美网柄牛肝菌在固体培养基质中的生长,菌丝体浓密粗壮,且污染少。其中a处理组的美网柄牛肝菌的菌丝长势较强并且菌丝生长最快,约19d长满固体培养基质,10袋中平均约有1袋出现污染;b处理组的美网柄牛肝菌的菌丝长势较强,约25d长满固体培养基质,10袋中平均约有2袋出现污染;c处理组的美网柄牛肝菌菌丝长势最强,约22d长满固体培养基质,10袋中平均约有2袋出现污染。未添加木霉sf-2菌粉的b-a对照组、c-a对照组及ck对照组的菌丝长势弱,约36
–
37d才能长满固体基质,10袋中平均有3袋出现污染。
[0128]
表8木霉菌粉不同添加方式对美网柄牛肝菌固体菌种生长的影响
[0129][0130][0131]
注:“++++”表示菌丝长势强,“+++”表示菌丝长势较强,“+”表示菌丝长势弱。表中每个数值均表示为三次实验测试的平均值(mean)
±
标准差(sd),同一列中不同的字母表示具有显著差异(p《0.05)。
[0132]
以上实施例只是本发明的部分实施例,而非全部实施例。上述实施例仅用于对本发明的技术方案进行解释和说明,而非用于限制本发明的保护范围。任何熟悉本领域技术的人员在本发明公开的技术范围内对上述实施例所做的修饰或改变,均应涵盖在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1