一种靶向调控抗原特异性T细胞的融合蛋白及应用
一种靶向调控抗原特异性t细胞的融合蛋白及应用
技术领域
1.本发明涉及生物医药技术领域,特别是涉及一种靶向调控抗原特异性t细胞的融合蛋白及应用。
背景技术:
2.近年来,肿瘤免疫治疗的成功也突出了利用免疫系统对抗癌症的影响力,t细胞通常被称为我们免疫系统的“引导导弹”,因为它们在感染或疾病的部位进行积累,特异且灵敏的杀伤肿瘤细胞,引发全身免疫应答,并产生持久的记忆。所以,它们是一系列癌症免疫治疗关注的焦点。随着测序技术和组学研究的发展,肿瘤抗原疫苗逐步进入大众的视野,许多动物肿瘤模型和临床试验都已证明肿瘤抗原疫苗的安全性及有效性,为了增强其疗法的成功,就必须动员具有正确肿瘤靶向特异性的t细胞亚群,其中关键的科学问题是如何增加疫苗激活的特异性t细胞数量。
3.t细胞的激活离不开抗原递呈细胞(antigen presentation cell,apc),抗原提呈细胞将抗原加工处理、降解为抗原肽片段并与胞内mhc分子结合,以抗原肽/mhc分子复合物的形式递呈给t细胞提供激活所需的第一信号,共刺激分子提供激活所需的第二信号,从而使t细胞被激活。目前免疫学家们已经分离出了很多种不同的t细胞共刺激分子,例如b淋巴细胞激活抗原(b7/cd28)、细胞间黏附分子(ifa-1/icam-1、icam-2)、淋巴细胞功能相关抗原(cd2/lfa-3)、血管内皮黏附分子(vcam-1)、热稳定抗原(hsa)等,其中研究最清楚的一种是表达在抗原呈递细胞(apc)表面的b7蛋白(b7-1和b7-2),cd80(也称b7-1)是b7家族重要的共刺激分子,人cd80分子编码基因定位于人类染色体3q13.3-q21区内,是分子量约为44-54kd的i型跨膜糖蛋白,cd80与cd28结合为t细胞的活化提供第二信号,促进t细胞的增殖与分化,若缺乏此共刺激信号,抗原特异性的第一信号非但不能有效激活特异性t细胞,反而导致t细胞无能或者耐受。研究表明,cd80介导的信号通路不仅能调节t细胞活化过程,而且还参与许多疾病的发生发展及预后状况。2019年,来自日本德岛大学的研究人员证实cd80与抗原呈递细胞表面上的pd-l1发生顺式相互作用,从而破坏pd-l1/pd-1结合,并且同时促进cd28介导的共刺激(daisuke,sugiura,takumi,et al.restriction ofpd-1 function by cis-pd-l1/cd80interactions is required for optimal t cell responses.science(new york,n.y.),2019.),这项新的研究取得的发现揭示了cd80不仅通过介导cd28共刺激信号,而且通过减弱pd-1驱动的共抑制信号来增强t细胞激活的合理和详细的机制。意味着cd28/b7通路在癌症患者的pd-1治疗中起着重要作用,因此cd80是诱导最佳免疫反应的关键组分之一。
4.现有的用于扩增肿瘤抗原特异性t细胞的生物材料平台包括人工抗原呈递细胞、t细胞刺激骨架、基于生物材料的疫苗和人工淋巴器官,其中人工抗原提呈细胞(artificial antigen-presenting cells,aapcs)在t细胞扩增及肿瘤免疫治疗中应用较为广泛,aapcs所用载体多为纳米磁珠、聚苯乙烯胶乳微球等材料,john w.hickey,ariel isser等人通过将氧化铁颗粒上偶联了未加载抗原肽的mhc分子以及抗cd28抗体,通过孵育不同多肽以实
现对多种抗原特异性t细胞群体的扩增和富集(hickey j w,isser a,salathe s f,et al.adaptive nanoparticle platforms for high throughput expansion and detection of antigen-specific t cells.nano letters,2020,20(9).),2020年,yao jiang,nishta krishnan等使用工程化癌细胞的细胞膜涂层包裹纳米颗粒以表达共刺激分子和天然呈现在膜表面上的抗原肽-mhc复合物,最终制剂含有促进肿瘤抗原特异性免疫应答的必要信号,并且可有效增加抗原特异性t细胞的数量(engineered cell-membrane-coated nanoparticles directly present tumor antigens to promote anticancer immunity.advanced materials,2020,32(30).),但上述类型的aapcs显著的弊端就是不能在体内生物降解,只能通过体外富集后回输至病人体内,需耗费较多的人力物力,不适用于临床应用。
技术实现要素:
5.申请人设计了一种更为有效的靶向调控抗原特异性t细胞的融合蛋白,利用抗原肽-mhc分子与tcr复合物结合提供t细胞激活所需第一信号,引入cd28的配体cd80胞外区、pd-l1胞外区、抗共刺激受体的激动型单链抗体及细胞因子赋予融合蛋白对t细胞的靶向调控功能,以期望达到更好的效果。本发明的目的就是提供一种更为有效的靶向调控抗原特异性t细胞的融合蛋白及应用。
6.本发明提供了一种靶向调控抗原特异性t细胞的融合蛋白,为异源二聚体,第一亚基包括依次连接的抗原肽-mhc分子复合物-fc区域,第二亚基包括依次连接的蛋白片段-fc区域,其中,第一亚基和第二亚基通过fc区域形成异源二聚体;所述蛋白片段是具有激活或抑制t细胞功能的蛋白质。
7.本技术中所述抗原肽作为特定肿瘤细胞或者其他疾病的新生抗原序列,与mhc分子形成复合物,从而可以将抗原肽递呈给t细胞,提供t细胞激活所需第一信号。不同肿瘤细胞类型、病毒感染或者其他疾病中对应的特定的抗原肽可以通过生物信息学分析等各种方式来获取得到,对于本技术来说,并不局限于特定的抗原肽序列,只要是能够由mhc分子递呈给t细胞的抗原肽都能够使用。
8.对于本技术中所述蛋白片段的选择,特异性调控t细胞功能时免疫治疗中的关键,而调控可以分为正向的激活和负向的抑制,都会具有相应医学上应用的意义,调控因子和特异性靶点的融合分子能够起到特异性调控t细胞功能的作用。在抗原肽递呈给t细胞后,由所述蛋白片段对t细胞进行调控,这种调控根据不同医学上的应用需要可以是激活也可以是抑制。
9.作为示例,蛋白片段为cd80胞外区、pd-l1胞外区、抗共刺激受体的激动型单链抗体acd28或细胞因子il-2。
10.作为示例,所述抗原肽-mhc分子复合物加载的多肽为cmv pp65
495-503
,序列为nlvpmvatv。抗原肽-mhc分子复合物中多肽种类包括但不限于cmv pp65
495-503
。优选的,第一亚基中还包括β2微球蛋白和hla-a*0201突变体,所述第一亚基的氨基酸序列如seq id no.1所示。具体的,当蛋白片段为cd80胞外区时,第二亚基的氨基酸序列如seq id no.2所示;当蛋白片段为pd-l1胞外区时,第二亚基的氨基酸序列如seq id no.3所示;当蛋白片段为抗共刺激受体的激动型单链抗体acd28时,第二亚基的氨基酸序列如seq id no.4所示;
当蛋白片段为细胞因子il-2时,第二亚基的氨基酸序列如seq id no.5所示。优选的,第一亚基和第二亚基中fc区域包含铰链区、随后的ch2和ch3结构域,第一亚基和第二亚基的两个ch3之间分别使用knob-into-hole技术设计成knob结构和hole结构。本发明还提供了编码所述融合蛋白的基因,第一亚基的编码基因序列如seq id no.8所示;当蛋白片段为cd80胞外区时,第二亚基的编码基因序列如seq id no.9所示;当蛋白片段为pd-l1胞外区时,第二亚基的编码基因序列如seq id no.10所示;当蛋白片段为抗共刺激受体的激动型单链抗体acd28时,第二亚基的编码基因序列如seq id no.11所示;当蛋白片段为细胞因子il-2时,第二亚基的编码基因序列如seq id no.12所示。
11.本发明还提供了所述的融合蛋白的制备方法,包括以下步骤:(1)构建表达第一亚基的编码基因和第二亚基的编码基因载体;(2)将步骤(1)表达第一亚基的编码基因和第二亚基的编码基因载体转染到哺乳动物细胞中,培养后进行蛋白纯化,得到所述融合蛋白。优选的,步骤(1)所述载体为pcdna3.1(+);步骤(2)所述哺乳动物细胞为hek293f细胞。本发明还提供了所述的融合蛋白在制备抗病毒或抗肿瘤药物中的应用。本发明还提供了所述的基因在制备抗病毒或抗肿瘤药物中的应用。
12.本发明的有益效果:本发明设计了多种不同形式的异源二聚体融合蛋白,第一亚基和第二亚基的两个ch3之间分别使用knob-into-hole技术设计成knob结构和hole结构,此可溶性融合蛋白能够促进特异性t细胞的分化、增殖;减少特异性t细胞的耗竭并促进效应记忆t细胞的产生;以及经融合蛋白处理扩增后的pbmc可对t2细胞进行特异性杀伤作用并促进ifnγ的释放。本发明的融合蛋白或其编码的基因可用于制成抗病毒、抗肿瘤药物。比如,本发明中cd80-pp65-a2融合蛋白可以激活并扩增cmv pp65
495-503
抗原特异性t细胞,经cd80-pp65-a2融合蛋白扩增后的cd3
+ t细胞绝大多数(>99%)未耗竭且cmv pp65
495-503
抗原特异性t细胞接近全部为效应记忆t细胞。经cd80-pp65-a2融合蛋白扩增后的外周血单核细胞(pbmc)并具有特异性杀伤t2肿瘤细胞的作用,与构建的对照融合蛋白相比效果显著。
附图说明
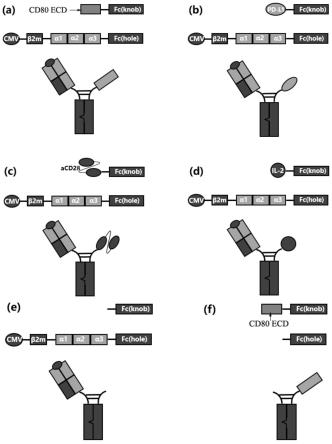
13.图1为不同形式融合蛋白的示意图;其中a~f分别为6种不同形式的融合蛋白,分别命名为cd80-pp65-a2、pd-l1-pp65-a2、acd28-pp65-a2、il-2-pp65-a2、fc-pp65-a2、cd80-fc。
14.图2为不同形式融合蛋白的sds-page分析结果图;其中,泳道1为cd80-fc,泳道2为pd-l1-pp65-a2,泳道3为fc-pp65-a2,泳道4为cd80-pp65-a2,泳道5为acd28-pp65-a2,泳道6为il-2-pp65-a2。
15.图3为抗原肽-mhc复合物构象的elisa验证结果图和cd80结构域的构象验证图;其中,图a为对cd80-pp65-a2、fc-pp65-a2、pd-l1-pp65-a2中抗原肽-mhc复合物构象的elisa验证结果,图b中为对cd80-pp65-a2中cd80结构域的构象验证。
16.图4为融合蛋白对特异性t细胞的富集能力验证图;其中,图a为不同种融合蛋白于不同浓度时对cmv pp65
495-503
特异性t细胞的富集比例图,图b为在特定浓度时融合蛋白对cmv pp65
495-503
特异性t细胞的富集比例分析图,图c为融合蛋白对cmv pp65
495-503
特异性t细胞的扩增倍数分析图。
17.图5为对融合蛋白处理后扩增出的t细胞的表型分析图;其中,图a为cd4/cd8比率分析图,图b为pd1
+
lag3
+
双阳性cd3
+
细胞比例图,图c为对cmv pp65
495-503
特异性t细胞记忆表型的分析图。
18.图6为对融合蛋白扩增出的cmv pp65
495-503
特异性t细胞的杀伤能力分析图;其中,图a为cd80-pp65-a2扩增后的外周血单个核细胞(pbmc)对负载cmv pp65
495-503
抗原肽t2的细胞杀伤作用图,图b为cd80-pp65-a2扩增后的pbmc与负载cmv pp65
495-503
抗原肽t2细胞共孵育4小时后上清中ifnγ释放量。
19.图7为cd80-wt1
126-134-a2对肿瘤相关抗原肽wt1
126-134
特异性t细胞的扩增能力分析图。
具体实施方式
20.实施例1
21.共设计6种不同形式的异源二聚体融合蛋白,第一亚基和第二亚基的两个ch3之间分别使用knob-into-hole技术设计成knob结构和hole结构便于异源二聚体的形成(图1),构建人肾上皮细胞(hek293f)表达质粒7个,由上海生工生物技术有限公司代为合成。图1为不同形式融合蛋白的示意图,其中a~f分别为6种不同形式的融合蛋白,分别命名为cd80-pp65-a2、pd-l1-pp65-a2、acd28-pp65-a2、il-2-pp65-a2、fc-pp65-a2、cd80-fc。
22.cd80-pp65-a2:第一亚基:cmv pp65
495-503-(g4s)
3-β2m-(g4s)
4-hla-a*0201(a1~a3)-gs-hinge-ch2-ch3(hole),氨基酸序列如seq id no.1所示,编码基因序列如seq id no.8;第二亚基:cd80 ecd-g4s-hinge-ch2-ch3(knob),氨基酸序列如seq id no.2所示,编码基因序列如seq id no.9所示;
23.pd-l1-pp65-a2:第一亚基:cmv pp65
495-503-(g4s)
3-β2m-(g4s)
4-hla-a*0201(a1~a3)-gs-hinge-ch2-ch3(hole),氨基酸序列如seq id no.1所示,编码基因序列如seq id no.8;第二亚基:pd-l1 ecd-g4s-hinge-ch2-ch3(knob),氨基酸序列如seq id no.3所示,编码基因序列如seq id no.10所示;
24.acd28-pp65-a2:第一亚基:cmv pp65
495-503-(g4s)
3-β2m-(g4s)
4-hla-a*0201(a1~a3)-gs-hinge-ch2-ch3(hole),氨基酸序列如seq id no.1所示,编码基因序列如seq id no.8;第二亚基:acd28-g4s-hinge-ch2-ch3(knob),氨基酸序列如seq id no.4所示,编码基因序列如seq id no.11所示;
25.il-2-pp65-a2:第一亚基:cmv pp65
495-503-(g4s)
3-β2m-(g4s)
4-hla-a*0201(a1~a3)-gs-hinge-ch2-ch3(hole),氨基酸序列如seq id no.1所示,编码基因序列如seq id no.8;第二亚基:il-2-g4s-hinge-ch2-ch3(knob),氨基酸序列如seq id no.5所示,编码基因序列如seq id no.12所示;
26.fc-pp65-a2:第一亚基:cmv pp65
495-503-(g4s)
3-β2m-(g4s)
4-hla-a*0201(a1~a3)-gs-hinge-ch2-ch3(hole),氨基酸序列如seq id no.1所示,编码基因序列如seq id no.8所示;第二亚基:hinge-ch2-ch3(knob),氨基酸序列如seq id no.6所示,编码基因序列如seq id no.13所示;
27.cd80-fc:第一亚基:hinge-ch2-ch3(hole),氨基酸序列如seq id no.7所示,编码基因序列如seq id no.14所示;第二亚基:cd80ecd-g4s-hinge-ch2-ch3(knob),氨基酸序
列如seq id no.2所示,编码基因序列如seq id no.9所示;其中,抗原肽-mhc复合物中多肽种类包括但不限于cmvpp65
495-503
,hinge表示铰链区,cd80ecd表示cd80胞外区,pd-l1 ecd表示pd-l1胞外区。
28.实施例2
29.不同形式融合蛋白的表达、纯化。
30.将上述4种融合蛋白的表达质粒分别转染hek293f细胞3-4天后,4000
×
g、20min离心,取细胞上清液,经0.22μm滤膜过滤后,使用akta蛋白纯化仪以及用hitrap proteina亲和柱进行纯化。纯化步骤如下:a.打开akta蛋白纯化仪及连接的控制电脑,待仪器与电脑连接后,设置压力参数(high pressure0.25mpa);b.将a和b泵头置于经0.45μm滤膜过滤过的纯水中,设置流速(3ml/min)以及ab泵的冲洗比例(50%b),待纯水冲至电导平衡后(约60ml),将hitrap proteina亲和柱(5ml)连接至akta纯化仪上,继续用纯水冲洗至少三个柱体积;c.将ab泵的冲洗比例改为0%b,并将a泵换至50mm tris-hcl(ph7.4)的上样缓冲液中,待电导平衡后,将a泵换至待纯化的培养基上清中,上样完成后,将a泵换至上样缓冲液中直至电导平衡;然后将ab泵的比例改为100%b,并将b泵换至1mol/l醋酸钠(ph3.0)洗脱缓冲液中,洗脱即可得到目的蛋白,akta纯化仪分别用纯水冲至电导平衡并用20%的乙醇(v/v)保存整个系统。不同形式的融合蛋百分别用50kda孔径大小的超滤膜超滤,将溶剂置换成pbs缓冲液后,用nanodrop nd-1000测定蛋白浓度,分装冻存于-80℃备用。蛋白进行sds-page分析其所含成分,如图2所示。
31.实施例3
32.elisa验证融合蛋白中抗原肽-mhc构象。
33.a.将cd80-pp65-a2、fc-pp65-a2、pd-l1-pp65-a2和阴性对照(癌胚胎抗原,ofa抗体)用pbs稀释成不同浓度(0.01、0.1、1、3、6、12、24μg/ml),每孔100μl加入96孔酶标板,4℃孵育过夜;b.洗板:将孔中所有液体甩掉,吸水纸上拍干,每孔加入300μl pbst,震荡后甩掉液体,如此重复洗三次;c.封闭:每孔中加入300μl1%bsa-pbs封闭液,在37℃下温育2h;d.一抗:甩掉封闭液,吸水纸上拍干,每孔中加入100μl稀释好的偶联生物素的w6/32抗体;e.洗板三次;f.二抗:每孔加入事先稀释好的辣根过氧化物酶标记streptavidin二抗,在37℃下温育40min;g.洗板七次;h.显色:每孔加入elisa显色液100μl,避光反应20-30min;i.终止:每孔加入elisa终止液100μl,轻轻拍动elisa板,确保各孔液体混合均匀;j.尽快用酶标仪读取各孔od 450值;
34.融合蛋白中cd80 ecd的构象验证,步骤d中一抗为偶联生物素的cd80抗体,其他步骤同上。cd80-pp65-a2、fc-pp65-a2、pd-l1-pp65-a2融合蛋白与阴性对照相比与w6/32抗体有明显结合(图3a),表明融合蛋白中抗原肽-mhc复合物构象表达正确;cd80-pp65-a2中的cd80ecd结构域与cd80抗体有明显结合(图3b),表明cd80 ecd结构域构象表达正确,因此表明融合蛋白构象表达正确,符合预期设计。
35.实施例4
36.cmv pp65
495-503
特异性t细胞扩增。
37.细胞培养步骤:将提前24h复苏好的pbmc,1000
×
g离心10min,收集pbmc,rpmi1640培养基(10%胎牛血清(fbs))重悬至细胞密度为1.0
×
106个/ml,于48孔细胞培养板中加入200μl/孔的细胞悬液。将4种不同形式的融合蛋白用rpmi1640培养基(10%fbs)依次稀释成
37.5nm的浓度待用。将稀释好的蛋白依次加入48孔板中,每孔100μl,混合充分后置于5%co2,37℃细胞培养箱孵育。48小时候补加il-2至终浓度为100u/ml,第6-8天期间每孔细胞半量换液,之后每隔一天半量换液,培养至第14天。取培养第7天、第14天的pbmc,600g,5min离心收集细胞,用1
×
pbs清洗2次后加入pe标记的抗原肽-mhc四聚体(mbl,ts-0010-1c)、pe-cy7标记的小鼠抗人cd8抗体(bdbiosciences,557746)对t细胞荧光染色,利用流式细胞仪技术分析特异性t细胞在cd8
+ t细胞中占比情况,如图4a所示,经cd80-pp65-a2刺激14天的pbmc,cd80-pp65-a2、acd28-pp65-a2、il-2-pp65-a2融合蛋白都对cmv pp65
495-503
特异性t细胞有扩增作用并且在一定浓度之前随着浓度升高,扩增出的特异性t细胞比例增加,图4b所示,经cd80-pp65-a2刺激的pbmc特异性cd8
+
t细胞的频率从0天的0.54%增加到7天的20.17%,14天的61.97%,分别增加了16倍和64倍(各组融合蛋白对特异性t细胞的扩增倍数见图4b),由图4b、4c可看出cd80-pp65-a2与其他几组对照蛋白在扩增特异性t细胞的能力上有显著差异。
38.实施例5
39.对融合蛋白扩增出的cmv pp65
495-503
特异性t细胞表型分析。
40.培养步骤同实施例4,取培养第7天、第14天的pbmc,600
×
g,5min离心收集细胞,用1
×
pbs清洗2次后加入pe标记的抗原肽-mhc四聚体(mbl,ts-0010-1c)、fitc标记小鼠抗人cd3抗体(biolegend,300406)、pe-cy7标记的小鼠抗人cd8抗体(bdbiosciences,557746)、bv421标记的小鼠抗人cd4抗体(bdbiosciences,562424)、apc标记小鼠抗人pd-1抗体(biolegend,329907)、brilliant violet 605
tm
标记小鼠抗人lag-3抗体(biolegend,369323)、fitc标记小鼠抗人cd197(ccr7)抗体(biolegend,353215)、pacific blue
tm
标记小鼠抗人cd45ro抗体(biolegend,304215)对t细胞荧光染色,利用流式细胞仪技术分析。cd4与cd8比值,这一特性最近被证明对过继转移的t细胞的功能很重要,值得注意的是,在培养14天后,cd80-pp65-a2融合蛋白促进了cd8
+ t细胞的大量增殖,具有>70%的cd8
+ t细胞,而其他组对照蛋白主要是促进了cd4
+ t细胞的增长(图5a)。为了探究扩增出的特异性t细胞是否已经耗竭,利用荧光抗体对耗竭标志pd-1和lag-3进行了标记,发现在培养14天后cd80-pp65-a2与fc-pp65-a2、pd-l1-pp65-a2扩增出的cd8
+ t细胞在pd-1和lag-3双阳性的频率有显著差异(图5b),从一方面验证了经融合蛋白cd80-pp65-a2刺激后产生的cd8
+
t细胞大部分(>99%)是未耗竭的t细胞,并且对扩增出的cmv pp65
495-503
特异性t细胞进行记忆表型分析,发现cd80-pp65-a2组别中>99%为效应记忆t细胞(图5c),可对靶细胞进行有效杀伤作用。
41.实施例6:对融合蛋白扩增出的cmv pp65
495-503
特异性t细胞的杀伤能力分析
42.为验证经cd80-pp65-a2融合蛋白激活扩增后的t细胞是否可以特异性杀伤靶细胞,利用了加载cmv pp65
495-503
(多肽序列:nlvpmvatv)的t2细胞模型作为靶细胞,加载wt11
26-134
(多肽序列:rmfpnapyl)的t2细胞模型作为阴性对照细胞,t2细胞是tap缺陷的细胞系,其细胞表面仅存在空的hla-a*0201突变体(genbank:cab4529282.1),孵育多肽之后,可在细胞表面形成特定的抗原肽-mhc分子复合物,用于后续的活性验证。
43.收集对数生长期的t2细胞,800
×
g,离心5min,弃上清,用无酚红rpmi-1640培养基清洗2次,重悬于含20%血清的无酚红rpmi-1640培养基(v/m),使其密度为106/ml铺于12孔板,分别加入多肽cmv pp65
495-503
、wt1
126-134
至终浓度为25μg/ml。混匀后置于5%co2,37℃细
胞培养箱孵育2h。孵育结束后,600
×
g,5min离心收集细胞,用1
×
pbs(灭菌)清洗2次后加入用dmso稀释的calcein am至终浓度为20μg/ml,置于5%co2,37℃细胞培养箱孵育0.5h,期间手弹两次使其混匀更加充分(calcein am,中文名为钙黄绿素乙酰氧基甲酯,本身并无荧光,进入细胞后被细胞中内源性酯酶水解生成具有强负电荷的不能通透细胞膜的极性分子钙黄绿素(calcein),从而被滞留在细胞内,而calcein可发出强绿色荧光,根据此原理可测定真核细胞活力。)。孵育结束后600
×
g,5min离心收集细胞,用1
×
pbs(灭菌)清洗2次后重悬于含20%血清的无酚红rpmi-1640培养基(v/m),使其密度为5
×
104/ml,每孔100μl铺于96孔。取经过cd80-pp65-a2扩增至第14天,600
×
g,5min离心,重悬于1ml含20%血清的无酚红rpmi-1640培养基(v/m),细胞计数。根据不同的效应细胞与靶细胞的比例比将细胞密度稀释为5
×
103/ml(e∶t=0.1)、5
×
104/ml(e∶t=1)、2.5
×
105/ml(e∶t=5)、5
×
105/ml(e∶t=10),每孔100μl铺于96孔,混匀后置于5%co2,37℃细胞培养箱孵育4h后,每孔取80μl细胞上清,测定490nm激发光的荧光强度,计算出t2细胞的凋亡比例。将剩余上清取出,根据elisa试剂盒说明测定ifnγ释放量。cd80-pp65-a2刺激扩增后pbmc对装载cmv pp65
495-503
抗原肽的t2细胞显示出剂量依赖性的细胞毒作用(图6a),并促进了ifnγ的释放(图6b),而对负载wt1
126-134
的t2细胞表现出微弱的细胞毒活性且无明显的ifnγ释放,验证了cd80-pp65-a2可以扩增cmv pp65
495-503
特异性t细胞且扩增出t细胞具有特异性的杀伤作用。
44.实施例7:对肿瘤相关抗原肽wt1
126-134
特异性t细胞的扩增
45.为了探究本发明涉及的融合蛋白形式是否可以对肿瘤抗原特异性t细胞同样起到扩增作用,将cd80-pp65-a2中抗原肽-mhc复合物中加载的多肽替换为肿瘤相关抗原肽wt1
126-134
,细胞培养过程同实施例4,取培养第10天的pbmc,600
×
g,5min离心收集细胞,用1
×
pbs清洗2次后加入pe标记的抗原肽-mhc四聚体、pe-cy7标记的小鼠抗人cd8抗体对t细胞荧光染色,利用流式细胞仪技术分析特异性t细胞在cd8
+ t细胞中占比情况。经cd80-wt1
126-134-a2刺激的pbmc,特异性cd8
+ t细胞的数量扩增至起始数量的9倍(图7),可看出cd80-wt1
126-134-a2同样对肿瘤相关抗原肽wt1
126-134
特异性t细胞可以起到扩增作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1