抗CD70内化的抗体、抗体偶联物及其应用的制作方法
本发明涉及生物,尤其涉及一种抗cd70内化的抗体、抗体偶联物及其应用。本发明是申请号202110675328.3,名称为抗cd70内化的抗体、抗体偶联物及其应用的分案申请。
背景技术:
1、cd70分子,即肿瘤坏死因子受体超家族7因子(tnfsf7),多肽链长193个a.a.,分子量21.1kd,是一种ⅱ型跨膜糖蛋白(尚未见可溶形式),c端155个氨基酸位于膜外;胞外的第一、三及第二、四个半胱氨酸之间形成二硫键,维持胞外部分的空间结构;通常其以同源三聚体形式存在于膜上。在正常组织中,cd70的细胞表达谱较窄,主要表达于生发中心的b细胞(诱导分泌抗体)和局部淋巴组织的t细胞,在胸腺髓质上皮细胞中低水平表达。但其表达可被抗原诱导大量增加并随着免疫应答的减弱而减少,比如抗原诱导活化的t、b细胞中高表达cd70。同时其表达受到细胞因子的调控,如il1a、il12、tnfa、gm-csf可上调cd70表达,il4、il10下调cd70表达。另外在成熟的dcs中,在tlr信号通路的介导下cd70表达。这些现象正好表明cd70为初始t细胞完全活化所需的一种协同刺激分子,在调控免疫应答中发挥重要作用。其与配体cd27相互作用,不仅起着t细胞活化第二信号的作用,而且二者之间的互作还可以调节b、nk等免疫细胞的增殖和分化。
2、短暂表达于活化的t和b淋巴细胞及成熟dc细胞中的cd70,在病理状态下却高表达于多种肿瘤组织中。大量研究表明,cd70在淋巴瘤、肾癌、胶质细胞瘤、乳腺癌、血源性恶性肿瘤(如霍奇金淋巴瘤、多发性骨髓瘤、白血病等)等多种肿瘤组织中高水平表达。同时观察到cd27在这些组织中的表达与cd70同步上升或下降。可能二者作为配体/受体对,形成了反馈环,促进淋巴细胞的增殖与分化,反而起到介导疾病发生的作用。cd70与cd27互作后,cd27活化,traf2/5结合到其胞内段,进一步激活nf-kb和c-jun激酶信号通路,引起细胞增殖、生存和分化等。另外,亦有人认为cd70与cd27结合后也可能使cd27胞内段结合siva从而引起caspase介导的细胞凋亡。
3、鉴于以上现象,以cd70为靶点制备特异性抗体,开展肿瘤免疫治疗引起人们浓厚兴趣。目前针对cd70靶点,cart治疗、抗体药和抗体偶联药物三种应用方式均在开发中,进展最快的为强生与argen-x合作开发的库萨图珠单抗(cusatuzumab,研发代号argx-110),目前已完成i期临床,结果显示库萨图珠单抗联合维达扎可显著降低aml患者骨髓中的白血病干细胞,证实该靶点的可靠性。
4、鉴于cd70/cd27分子对重要免疫调节功能,对cd70进行调控必然会引起一系列的t细胞、甚至b细胞及nk细胞等淋巴细胞的信号传递及生理反应,是一个很理想的免疫治疗靶点,合理应用有可能调动多种细胞免疫。目前靶向cd70的疗法有cart及裸抗,临床效果有限,特别是对实体瘤来说,这两种方法几乎无效。研发人员普遍认为,抗体药物偶联物adc将是未来治疗癌症的希望之一。
技术实现思路
1、发明目的:针对上述现有技术,本技术提供了一种抗cd70内化的抗体、抗体偶联物及其应用。
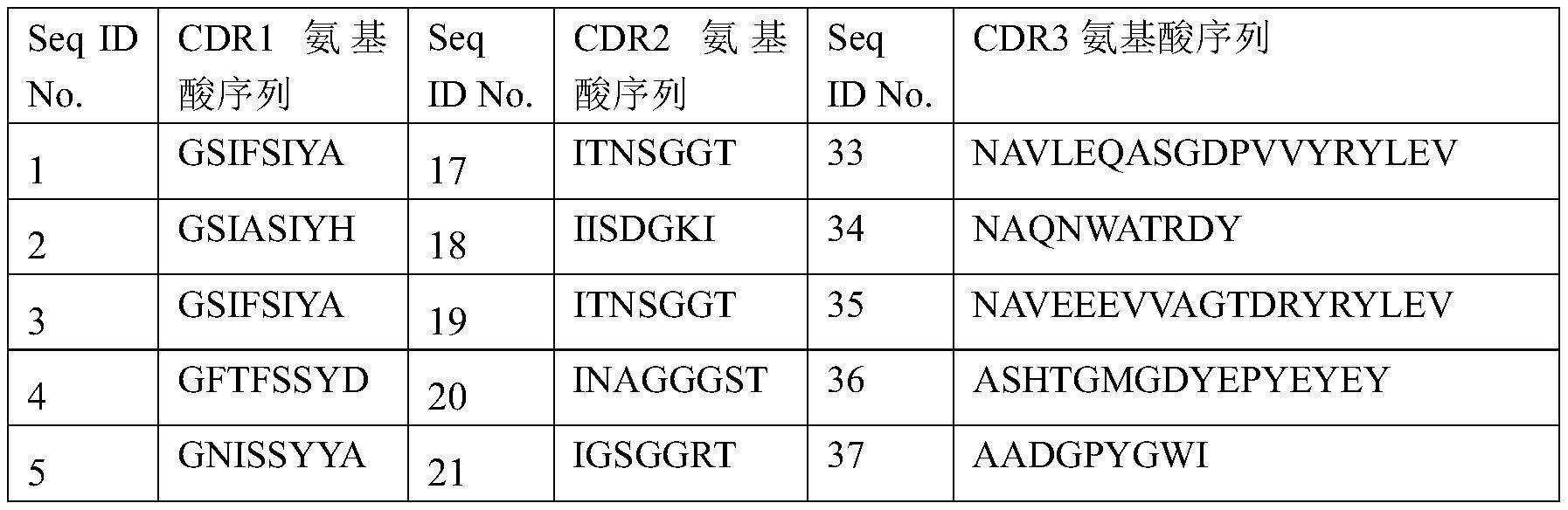
2、技术方案:本技术所述的一组抗cd70内化的抗体,其重链可变区cdr1的氨基酸序列选自seq id no:1-16,cdr2的氨基酸序列选自seq id no:17-32,cdr3的氨基酸序列选自seq id no:33-48。
3、进一步优选的,本技术所述抗cd70内化的抗体,包括以下任一所示重链可变区:
4、其重链可变区cdr1的氨基酸序列选自seq id no:1,cdr2的氨基酸序列选自seqid no:17,cdr3的氨基酸序列选自seq id no:33;
5、其重链可变区cdr1的氨基酸序列选自seq id no:2,cdr2的氨基酸序列选自seqid no:18,cdr3的氨基酸序列选自seq id no:34;
6、其重链可变区cdr1的氨基酸序列选自seq id no:3,cdr2的氨基酸序列选自seqid no:19,cdr3的氨基酸序列选自seq id no:35;
7、其重链可变区cdr1的氨基酸序列选自seq id no:4,cdr2的氨基酸序列选自seqid no:20,cdr3的氨基酸序列选自seq id no:36;
8、其重链可变区cdr1的氨基酸序列选自seq id no:5,cdr2的氨基酸序列选自seqid no:21,cdr3的氨基酸序列选自seq id no:37;
9、其重链可变区cdr1的氨基酸序列选自seq id no:6,cdr2的氨基酸序列选自seqid no:22,cdr3的氨基酸序列选自seq id no:38;
10、其重链可变区cdr1的氨基酸序列选自seq id no:7,cdr2的氨基酸序列选自seqid no:23,cdr3的氨基酸序列选自seq id no:39;
11、其重链可变区cdr1的氨基酸序列选自seq id no:8,cdr2的氨基酸序列选自seqid no:24,cdr3的氨基酸序列选自seq id no:40;
12、其重链可变区cdr1的氨基酸序列选自seq id no:9,cdr2的氨基酸序列选自seqid no:25,cdr3的氨基酸序列选自seq id no:41;
13、其重链可变区cdr1的氨基酸序列选自seq id no:10,cdr2的氨基酸序列选自seqid no:26,cdr3的氨基酸序列选自seq id no:42;
14、其重链可变区cdr1的氨基酸序列选自seq id no:11,cdr2的氨基酸序列选自seqid no:27,cdr3的氨基酸序列选自seq id no:43;
15、其重链可变区cdr1的氨基酸序列选自seq id no:12,cdr2的氨基酸序列选自seqid no:28,cdr3的氨基酸序列选自seq id no:44;
16、其重链可变区cdr1的氨基酸序列选自seq id no:13,cdr2的氨基酸序列选自seqid no:29,cdr3的氨基酸序列选自seq id no:45;
17、其重链可变区cdr1的氨基酸序列选自seq id no:14,cdr2的氨基酸序列选自seqid no:30,cdr3的氨基酸序列选自seq id no:46;
18、其重链可变区cdr1的氨基酸序列选自seq id no:15,cdr2的氨基酸序列选自seqid no:31,cdr3的氨基酸序列选自seq id no:47;
19、其重链可变区cdr1的氨基酸序列选自seq id no:16,cdr2的氨基酸序列选自seqid no:32,cdr3的氨基酸序列选自seq id no:48。
20、seq id no:1-48如下表所示:
21、
22、
23、本技术还公开了编码上述抗cd70内化的抗体的dna分子,其重链可变区seq idno:1-48所述氨基酸对应的核苷酸序列依次如seq id no:49-96所示。
24、seq id no:49-96如下表所示:
25、
26、
27、本技术还公开了所述抗cd70内化的抗体用于检测cd70分子的应用。
28、进一步的,本技术还公开了所述抗cd70内化的抗体在制备治疗肿瘤的药物中的应用。所述肿瘤优选为肾透明细胞腺癌。
29、本技术还公开了一种抗体偶联物,其包括上述的抗cd70内化的抗体。
30、所述抗体偶联物在制备治疗肿瘤的药物中的应用也在本技术的保护范围内。
31、本技术以商品化的重组人cd70生物素标签蛋白和噬菌体展示抗体库为起始材料。将cd70生物素标签蛋白与链霉亲和素包被磁珠共孵育,通过链霉亲和素与生物素之间的互作将cd70固定在磁珠上,用抗体库与其孵育,洗去未结合/结合弱的噬菌体,将与cd70蛋白结合的噬菌体洗脱下来。如此反复3次,每次改变cd70生物素标签蛋白的使用量和洗涤条件,逐次淘汰掉结合弱的噬菌体并尽可能保留更多的结合强的噬菌体。用强结合的噬菌体侵染宿主菌,涂板并过夜培养,获得单克隆菌落,即将可结合cd70的噬菌体抗体进行单克隆化。利用单克隆培养上清进行elisa筛选,并对单克隆进行核酸序列测定。
32、将信号肽、抗cd70抗体、人源igg1 fc的编码序列连接,同框阅读,构建哺乳动物表达载体。转染293f细胞,振荡培养5天后收获上清,利用蛋白a磁珠亲和层析从上清中纯化获得融合蛋白,并对其与cd70结合特性进行鉴定。培养靶细胞,于4℃将抗体与其共孵育,平行做两组。一组经4℃孵育后转移至37℃继续孵育,另一组继续于4℃孵育。孵育结束后,加入荧光标记检测抗体,4℃孵育并用流式细胞术检测荧光抗体,即获知细胞表面被cd70捕获的抗cd70抗体。将靶细胞铺于96孔板中,过夜培养使细胞充分贴壁。加入抗体和/或毒素试剂后进行细胞培养并观察细胞生长特性。培养结束后,检测细胞活率。
33、技术效果:本技术以人源cd70为靶点,成功开发得到可结合人源cd70分子的抗体(融合蛋白),该抗体特异性好,亲合力较高,结合细胞表面表达的人源cd70,并可被细胞高效转运至胞内;由于该抗体具有内化功能,进而可以携带毒素分子进入细胞杀死该细胞,即利用抗体药物偶联物(antibody-drug conjugate,adc)途径,癌细胞中cd70表达量远高于正常细胞,该adc主要地靶向癌细胞,从而起到治疗癌症的作用。因此,该抗体具有新颖的特性及药物开发方向,是肿瘤免疫治疗的潜在药物。
- 还没有人留言评论。精彩留言会获得点赞!