一种PD-L1/CXCL12双靶点抑制剂、制备方法和用途
一种pd-l1/cxcl12双靶点抑制剂、制备方法和用途
技术领域
1.本发明涉及有机化合物,具体涉及一种pd-l1/cxcl12双靶点抑制剂、制备方法和用途。
背景技术:
2.针对程序性死亡受体1/程序性死亡配体1(pd-1/pd-l1)通路是一种非常有前景的抗癌治疗方式。临床研究表面,pd-l1抑制剂的总体反应率(orr)较低(《30%),研究人员试图将pd-l1抑制剂与其他抗癌药物联合用于治疗癌症。
3.趋化因子cxcl12(c-x-c motif chemokine ligand 12)是cxcr4(c-x-c motif chemokine receptor4)的配体,在肿瘤转移、免疫逃逸和炎症中起关键作用。此外,cxcl12通过调节肿瘤免疫微环境发挥免疫抑制作用并减少t细胞浸润,与pd-1/pd-l1轴互补。因此,cxcl12/cxcr4轴被认为是抗癌和抗炎治疗的极好靶点。最近的研究表明,抗pd-1/l1抗体和cxcl12抑制剂显示出比单一疗法更好的抗肿瘤功效,并且耐受性良好且安全,表明靶向pd-l1和cxcl12/cxcr4轴作为癌症治疗的双重免疫疗法具有潜在的临床应用价值。
4.然而,联合治疗有几个缺点,包括不可预测的pk/pd与两种或多种药物的混合物。联合治疗的一种潜在替代方法是使用具有双重或多靶向能力的单个分子,因为单个分子的pk和pd很容易预测。因此设计了一系列同时靶向pd-l1和cxcl12的化合物,作为潜在的双重免疫疗法具有非常好的应用前期,有助于提升肿瘤免疫治疗的效果。
技术实现要素:
5.本发明所要解决的技术问题是提供一种pd-l1/cxcl12双靶点抑制剂,该衍生物能够抑制程序性细胞死亡受体1/程序性细胞死亡配1(pd-1/pd-l1)的相互结合,且对cxcl12具有高亲和力,效果显著。
6.本发明解决上述技术问题的方案如下:
7.一种pd-l1/cxcl12双靶点抑制剂,化学结构如下式(i)所示,
[0008][0009]
其中,r1代表br、cl;
[0010]
r2代表h、
[0011]
r3代表
[0012]
x代表h、
[0013]
本发明所述的一种pd-l1/cxcl12双靶点抑制剂能够抑制程序性细胞死亡受体1/程序性细胞死亡配体1(pd-1/pd-l1)的相互结合,可用于制备pd-1/pd-l1与cxcl12抑制剂,该抑制剂的效果显著。
[0014]
本发明所述的一种pd-l1/cxcl12双靶点抑制剂优选下述化合物之一:
[0015]
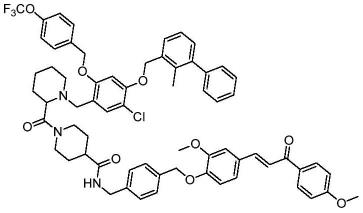
所述一种pd-l1/cxcl12双靶点抑制剂cp1的化学结构为:
[0016][0017]
所述一种pd-l1/cxcl12双靶点抑制剂cp2的化学结构为:
[0018][0019]
所述一种pd-l1/cxcl12双靶点抑制剂cp3的化学结构为:
[0020][0021]
所述一种pd-l1/cxcl12双靶点抑制剂p4的化学结构为:
[0022][0023]
所述一种pd-l1/cxcl12双靶点抑制剂cp5的化学结构为:
[0024][0025]
所述一种pd-l1/cxcl12双靶点抑制剂cp6的化学结构为:
[0026][0027]
所述一种pd-l1/cxcl12双靶点抑制剂cp7的化学结构为:
[0028][0029]
所述一种pd-l1/cxcl12双靶点抑制剂cp8的化学结构为:
[0030][0031]
所述一种pd-l1/cxcl12双靶点抑制剂cp9的化学结构为:
[0032][0033]
所述一种pd-l1/cxcl12双靶点抑制剂cp10的化学结构为:
[0034][0035]
所述一种pd-l1/cxcl12双靶点抑制剂cp11的化学结构为:
[0036][0037]
所述一种pd-l1/cxcl12双靶点抑制剂cp12的化学结构为:
[0038][0039]
所述一种pd-l1/cxcl12双靶点抑制剂cp13的化学结构为:
[0040][0041]
所述一种pd-l1/cxcl12双靶点抑制剂cp14的化学结构为:
[0042][0043]
所述一种pd-l1/cxcl12双靶点抑制剂p15的化学结构为:
[0044][0045]
所述一种pd-l1/cxcl12双靶点抑制剂cp16的化学结构为:
[0046][0047]
所述一种pd-l1/cxcl12双靶点抑制剂cp17的化学结构为:
[0048][0049]
所述一种pd-l1/cxcl12双靶点抑制剂cp18的化学结构为:
[0050][0051]
所述一种pd-l1/cxcl12双靶点抑制剂cp19的化学结构为:
[0052][0053]
所述一种pd-l1/cxcl12双靶点抑制剂cp20的化学结构为:
[0054][0055]
所述一种pd-l1/cxcl12双靶点抑制剂cp21的化学结构为:
[0056][0057]
所述一种pd-l1/cxcl12双靶点抑制剂cp22的化学结构为:
[0058][0059]
所述一种pd-l1/cxcl12双靶点抑制剂cp23的化学结构为:
[0060][0061]
上述一种pd-l1/cxcl12双靶点抑制剂的制备方法包括以下步骤:
[0062]
本发明的一种pd-l1/cxcl12双靶点抑制剂的制备方法,该制备方法通过四条合成路线合成。路线一至三为pd-l1抑制剂部分的合成,路线四为所设计的pd-l1&cxcl12双靶点抑制剂的合成。
[0063]
路线一如下所示:
[0064][0065]
α
reagents and conditions:(a)dcm,0℃,0.5h,80%;(b)nahco3,dmf,60℃,1h,45%;(c)naco3,dmf,80 ℃,1h,65%;(d)acoh,nabh3cn,dmf,80℃,2hrs,15%~25%.
[0066]
路线二如下所示:
[0067][0068]
α
reagentsandconditions:(a)dcm,0℃,0.5h,90%;(b)nahco3,dmf,60℃,1h,40%;(c)acoh,nabh3cn,dmf,80℃,2hrs,15%~25%.
[0069]
路线三
[0070][0071]
α
reagentsandconditions:(a)dcm,0℃,0.5h,90%;(b)nahco3,dmf,60℃,1h,40%;(c)nahco3,dmf,80℃,1h,40%~45%;(d)acoh,nabh3cn,dmf,80℃,2hrs,15%~25%.
[0072]
路线四
[0073][0074]
reagentsandconditions:(a)naoh,meoh,25℃,12h,50%;(b)na2co3,dmf,80℃,1h,60%;(c)4mhcl/1,4-dioxane,dcm,0℃,1h,60%;(d)i,hatu,dipea,dmf,25℃,1h,60%~70%;ii,4mhcl/1,4-dioxane,dcm,0℃,2h;70~80%(e)hatu,dipea,dmf,25℃,1h,60%~70%.
[0075]
上述反应式中,r1代表br、cl;r2代表h、r3代表x代表h、
[0076]
上述一种pd-l1/cxcl12双靶点抑制剂能够抑制程序性细胞死亡受体1/程序性细胞死亡配体1(pd-1/pd-l1)的相互结合,对cxcl12表现出高结合亲和力,能够抑制cxcl12
和cxcr4轴,可用于制备pd-l1和cxcl12双重抑制剂,该抑制剂的抗肿瘤效果显著。
[0077]
采用htrf(均相时间分辨荧光)技术标准操作程序测定本发明所述的一种pd-l1/cxcl12双靶点抑制剂对pd-1/pd-l1的抑制效果,结果显示该化合物对pd-1/pd-l1抑制效果明显。采用表面等离子共振(spr) 和圆二色光谱(简称cd)分析确定了该化合物与cxcl12的结合亲和力。其中,优选化合物cp23的核磁共振氢谱(见附图1)和核磁共振碳谱(见附图2)已附上。
[0078]
此外,本发明所述的一种pd-l1/cxcl12双靶点抑制剂对小鼠黑色素瘤模型进行治疗,表现出较好的体内抗肿瘤活性(见附图3)。
附图说明
[0079]
下面结合附图和实施例对本发明作进一步的说明,其中:
[0080]
图1为本发明式(i)所示化合物(e)-1-(1-(5-氯-2-((3-氰基苄基)氧基)-4-((2-甲基-[1,1'-联苯]-3-基)甲氧基)苄基)哌啶-2-羰基)-n-(4-(2-甲氧基-4-(3-(4-甲氧基苯基)-3-氧代-1-烯-1-基)苯氧基)甲基)苄基哌啶-4-甲酰胺(cp23)的核磁共振氢谱图。
[0081]
图2为本发明式(i)所示化合物(e)-1-(1-(5-氯-2-((3-氰基苄基)氧基)-4-((2-甲基-[1,1'-联苯]-3-基)甲氧基)苄基)哌啶-2-羰基)-n-(4-(2-甲氧基-4-(3-(4-甲氧基苯基)-3-氧代-1-烯-1-基)苯氧基)甲基)苄基哌啶-4-甲酰胺(cp23)的核磁共振碳谱图。
[0082]
图3为本发明式(i)所示化合物cp23对荷b16-f10黑色素瘤肿瘤的小鼠的治疗效果。(a)为肿瘤图像,可见给药治疗之后肿瘤的大小显著变化;(b)为小鼠肿瘤重量,治疗组与非治疗组相比明显降低且存在显著差异;(c)为小鼠肿瘤体积随时间的变化情况,治疗组的体积增长较非治疗组慢;(d)为治疗期间小鼠的体重变化,可见在小鼠的体重无明显变化。(**p《0.05,n=6)。
具体实施方式
[0083]
以下结合具体实施方式对本发明作进一步说明。
[0084]
实施例1(化合物制备及其鉴定)
[0085]
本发明所述pd-l1/cxcl12双靶点抑制剂路线具体操作方法如下所述,通过路线1-4合成目标产物:
[0086]
路线一:将(1-1)溶于二氯甲醇中,将三溴化硼溶液缓慢滴入,于冰浴反应30分钟,反应结束后,用甲醇淬灭反应,硅胶过柱可得目标产物(1-2);再按(1-2)的摩尔量加入1.2摩尔倍的5-氯-2,4-二羟基苯甲醛、2摩尔倍的碳酸氢钠,在60℃、dmf条件下反应1小时,反应液加入乙酸乙酯和水进行萃取,取有机相用无水硫酸钠干燥,除去溶剂,经过柱层析分离提纯得到中间体(1-3);(1-3)与(2当量)碳酸氢钠,80℃、dmf条件下分别与3-(溴甲基)苄腈、1-(溴甲基)-4-(三氟甲氧基)苯、2-溴乙酸乙酯反应,反应完毕后,将反应混合液倒入水中,乙酸乙酯萃取,有机相用盐水洗3次,并用无水硫酸钠干燥,硅胶过柱可得(1-4);联苯化合物(1-4)与(2当量)哌啶甲酸用dmf溶解,加入(2当量)氰基硼氢化钠,滴入两滴冰醋酸,加热至80℃反应2h,tlc监测,反应完毕后,将反应混合液倒入水中,乙酸乙酯萃取,有机相用盐水洗3次,并用无水硫酸钠干燥,硅胶过柱可得目标产物(1-5),分别是bms-1233、ch-1、 ch-11。
[0087]
路线二:在冰浴中,逐滴加三溴化硼到芳基苄醇的二氯甲烷溶液里面。反应结束后,用甲醇淬灭反应,硅胶过柱可得(2-2);此中间体与(1.2当量)3-溴-4-羟基苯甲醛和(2当量)碳酸氢钠,在60℃、dmf 条件下反应1小时,反应液加入乙酸乙酯和水进行萃取,取有机相用无水硫酸钠干燥,除去溶剂,经过柱层析分离提纯得到中间体(2-3),再与(2当量)哌啶甲酸用dmf溶解,加入(2当量)氰基硼氢化钠,滴入两滴冰醋酸,加热至80℃反应2h,tlc监测,反应完毕后,将反应混合液倒入水中,乙酸乙酯萃取,有机相用盐水洗3次,并用无水硫酸钠干燥,硅胶过柱可得目标产物bms-8(2-4)。
[0088]
路线三:(3-1)至(3-4)与路线一过程一致,中间体(3-4)与(2当量)2-氨基-2-甲基丙酸用dmf 溶解,加入(2当量)氰基硼氢化钠,滴入两滴冰醋酸,加热至80℃反应2h,tlc监测,反应完毕后,将反应混合液倒入水中,乙酸乙酯萃取,有机相用盐水洗3次,并用无水硫酸钠干燥,硅胶过柱可得目标产物np19,即(3-5)。
[0089]
路线四:4-甲氧基苯乙酮(4-1)溶解在甲醇中搅拌5-10min至完全溶解,加入(2当量)koh搅拌2h,,调节反应液ph至6.5-7,过滤,将滤液旋干,再加(1.05当量)香草醛至反应中,升温至80℃反应20h。 tlc监测,反应结束后旋干溶剂直接硅胶过柱得到中间体(4-2);接着,(4-2)与带boc保护基的苄溴(1 当量)、(2当量)碳酸氢钠,80℃、dmf条件下反应1h,反应完毕后,将反应混合液倒入水中,乙酸乙酯萃取,有机相用盐水洗3次,并用无水硫酸钠干燥,硅胶过柱可得(4-3),将其溶解到二氯甲烷溶液中,加入4m hcl/1,4-dioxane(1ml)去除boc保护基,反应结束后,旋干溶液可得产物(4-4);将含boc保护基有机酸(1当量)、有机胺(1当量)、hatu(1.2当量)、dipea(1.8当量)放到dmf中,室温反应,反应1 小时。酰胺缩合反应完毕后,将反应混合液倒入水中,乙酸乙酯萃取,有机相用盐水洗3次,并用无水硫酸钠干燥,硅胶过柱可得目标产物。将反应物溶解到二氯甲烷溶液中,加入4m hcl/1,4-dioxane(1ml)去除boc保护基,反应结束后,旋干溶液可得产物(4-5)。(4-5)将与前面路线一、二、三合成的产物(1 当量)进行缩合,hatu(1.2当量)、dipea(1.8当量)放到dmf中,室温反应,反应1小时,反应完毕后,将反应混合液倒入水中,乙酸乙酯萃取,有机相用盐水洗3次,并用无水硫酸钠干燥,硅胶过柱可得最终产物即cp1-23。
[0090]
目标产物cp1的鉴定结果如下:
[0091]
(e)-1-(3-bromo-4-((2-methyl-[1,1'-biphenyl]-3-yl)methoxy)benzyl)-n-(5-((4-((2-methoxy-4-(3-(4-methoxyph enyl)-3-oxoprop-1-en-1-yl)phenoxy)methyl)benzyl)amino)-5-oxopentyl)piperidine-2-carboxamide(cp1). yellow oil;1h nmr(400mhz,dmso)δ8.27(t,j=5.8hz,1h),8.17(d,j=8.8hz,2h),7.84(dd,j=16.2, 10.5hz,2h),7.66(d,j=15.5hz,1h),7.60(s,1h),7.53(d,j=8.8hz,2h),7.46(t,j=7.3hz,2h),7.40
–ꢀ
7.36(m,3h),7.31(d,j=7.1hz,4h),7.22(dd,j=15.7,7.2hz,4h),7.09(dd,j=8.5,5.0hz,3h),5.21(s,2h), 5.12(s,2h),4.25(d,j=5.7hz,2h),3.87(d,j=3.6hz,6h),3.65(d,j=13.5hz,1h),3.17(d,j=4.9hz,1h), 3.12(d,j=7.4hz,1h),3.08(d,j=7.3hz,1h),3.03(s,1h),2.68(d,j=7.7hz,2h),2.22(s,3h),2.13(d,j= 7.1hz,2h),1.99(d,j=7.3hz,1h),1.89(d,j=9.9hz,1h),1.69(dd,j=23.1,13.2hz,3h),1.53(dd,j=10.7, 8.1hz,3h),1.46
–
1.41(m,2h).ms:m/z=978.6[m+1]
+
.hplc:t
r 21.875min,purity 100%.
[0092]
本发明所述pd-l1/cxcl12双靶点抑制剂p2-17的制备方法与上述pd-l1/cxcl12双
靶点抑制剂p1 的制备方法相同。目标产物p1-17的鉴定结果分别如下所述:
[0093]
(e)-1-(3-bromo-4-((2-methyl-[1,1'-biphenyl]-3-yl)methoxy)benzyl)-n-(4-((2-methoxy-4-(3-(4-methoxyphenyl )-3-oxoprop-1-en-1-yl)phenoxy)methyl)benzyl)piperidine-2-carboxamide(cp2).light yellow solid;mp: 124.8
–
125.9℃;1h nmr(400mhz,dmso)δ8.42(t,j=6.1hz,1h),8.17(d,j=8.9hz,2h),7.82(d,j=15.5 hz,1h),7.65(d,j=15.4hz,1h),7.58(d,j=1.6hz,1h),7.54
–
7.50(m,2h),7.46(t,j=7.3hz,2h),7.38(s, 2h),7.31(dd,j=14.1,7.1hz,7h),7.27
–
7.12(m,3h),7.08(dd,j=11.2,8.7hz,3h),5.22(s,2h),5.10(s, 2h),4.33(dd,j=21.8,5.9hz,2h),4.14
–
4.07(m,2h),3.86(d,j=9.0hz,6h),3.65(s,1h),3.06(d,j=13.2 hz,1h),2.77(d,j=12.2hz,2h),2.22(s,3h),1.89(d,j=13.6hz,1h),1.77(d,j=14.1hz,1h),1.70
–
1.65 (m,1h),1.62(d,j=12.4hz,1h),1.53(s,1h),1.38(d,j=8.4hz,1h).
13
c nmr(101mhz,dmso)δ187.72, 173.60,163.48,153.82,150.48,149.69,143.98,142.52,141.69,140.02,135.70,135.53,134.15,133.58,132.75, 131.22,131.08,129.99,129.83,129.57,128.65,128.28,127.91,127.70,127.37,125.92,123.91,120.11,114.36, 113.96,113.55,111.47,111.33,70.09,69.66,67.53,58.65,56.20,55.96,51.22,49.00,42.11,30.04,26.97,24.97, 23.53,21.16,16.21.ms:m/z=879.4[m+1]
+
.hplc:tr22.734min,purity 98.834%.
[0094]
(e)-1-(1-(3-bromo-4-((2-methyl-[1,1'-biphenyl]-3-yl)methoxy)benzyl)piperidine-2-carbonyl)-n-(4-((2-metho xy-4-(3-(4-methoxyphenyl)-3-oxoprop-1-en-1-yl)phenoxy)methyl)benzyl)piperidine-4-carboxamide(cp3). yellow oil;1h nmr(400mhz,dmso)δ8.37(d,j=5.9hz,1h),8.17(d,j=8.8hz,2h),7.83(d,j=15.5hz, 1h),7.66(d,j=15.5hz,1h),7.53(d,j=7.8hz,3h),7.46(t,j=7.4hz,2h),7.40(d,j=7.8hz,2h),7.35(d, j=10.2hz,1h),7.31(d,j=7.2hz,3h),7.23(dd,j=19.1,6.6hz,5h),7.09(d,j=8.7hz,3h),5.23(s,2h), 5.13(s,2h),4.43(d,j=15.4hz,2h),4.27(d,j=3.4hz,2h),3.87(d,j=2.9hz,6h),3.71
–
3.54(m,2h), 3.17(d,j=3.1hz,2h),3.12(d,j=7.5hz,1h),3.04(d,j=11.7hz,2h),2.84(d,j=4.7hz,1h),2.69
–
2.56 (m,2h),1.99(d,j=2.4hz,1h),1.76(d,j=13.0hz,2h),1.64(d,j=5.3hz,2h),1.51
–
1.34(m,5h).ms: m/z=990.64[m+1]+.hplc:tr 21.682min,purity 95.907%.
[0095]
(e)-1-(3-bromo-4-((2-methyl-[1,1'-biphenyl]-3-yl)methoxy)benzyl)-n-(4-((4-((2-methoxy-4-(3-(4-methoxyph enyl)-3-oxoprop-1-en-1-yl)phenoxy)methyl)benzyl)amino)-4-oxobutyl)piperidine-2-carboxamide(cp4). yellow oil;1h nmr(400mhz,dmso)δ8.32(s,1h),8.17(d,j=8.9hz,2h),7.92(s,1h),7.82(d,j=15.4 hz,1h),7.72
–
7.59(m,3h),7.57
–
7.43(m,5h),7.39(d,j=8.0hz,3h),7.32(s,3h),7.28
–
7.19(m,4h), 7.12
–
7.06(m,2h),5.22(s,2h),5.12(s,2h),4.26(d,j=6.0hz,2h),3.86(d,j=10.5hz,6h),3.68
–
3.61(m, 2h),3.18(d,j=5.8hz,2h),3.12(s,2h),2.75(d,j=4.2hz,2h),2.68(d,j=6.0hz,2h),2.22(s,3h),2.17
–ꢀ
2.12(m,2h),1.99(d,j=5.3hz,2h),1.67(d,j=7.7hz,2h),1.48(d,j=13.4hz,2h).ms:m/z=964.6 [m+1]
+
.hplc:tr21.662min,purity 100%.
[0096]
(e)-1-(3-bromo-4-((2-methyl-[1,1'-biphenyl]-3-yl)methoxy)benzyl)-n-(3-((4-((2-methoxy-4-(3-(4-methoxyph enyl)-3-oxoprop-1-en-1-yl)phenoxy)
1h),7.65(d,j=15.4hz,1h),7.54
–
7.43(m,5h),7.39(d,j=7.4hz,1h),7.32(d,j=10.0hz,5h),7.28
–
7.17(m,4h),7.12
–
7.03(m,3h),6.93(s,1h),5.23(s,2h),5.10(s,2h),4.86(s,2h),4.31(dt,j=15.0,9.2hz,2h),4.16
–
4.10(m,2h),3.87(d,j=7.9hz,6h),3.55(d,j=13.9hz,1h),3.18(d,j=5.1hz,1h),2.81(d,j=9.3hz,2h),2.23(s,3h),1.94(s,1h),1.79(d,j=11.6hz,1h),1.67(dd,j=13.4,4.2hz,2h),1.51(s,1h),1.42
–
1.37(m,1h),1.31(s,1h),1.18(t,j=7.1hz,3h).ms:m/z=937.5[m+1]
+
.hplc:tr22.296min,purity95.312%.
[0107]
ethyl(e)-2-(4-chloro-2-((2-(4-((4-((2-methoxy-4-(3-(4-methoxyphenyl)-3-oxoprop-1-en-1-yl)phenoxy)methyl)benzyl)carbamoyl)piperidine-1-carbonyl)piperidin-1-yl)methyl)-5-((2-methyl-[1,1'-biphenyl]-3-yl)methoxy)phenoxy)acetate(cp16).yellowoil;1hnmr(400mhz,dmso)δ8.36(s,1h),8.17(d,j=8.9hz,2h),7.83(d,j=15.5hz,1h),7.66(d,j=15.4hz,1h),7.55
–
7.44(m,4h),7.42
–
7.28(m,8h),7.24(dd,j=21.6,8.7hz,4h),7.09(d,j=8.8hz,3h),6.94(s,1h),5.23(s,2h),5.13(s,2h),4.89(s,2h),4.40(d,j=12.7hz,1h),4.26(s,2h),4.15(dd,j=14.0,6.7hz,2h),3.87(d,j=2.8hz,6h),3.56(dd,j=40.1,36.0hz,2h),3.03(d,j=12.0hz,2h),2.92(d,j=12.4hz,2h),2.59(d,j=5.4hz,1h),2.44(s,2h),2.23(s,3h),2.05
–
1.96(m,2h),1.76(s,2h),1.67(d,j=10.1hz,3h),1.46(d,j=3.7hz,2h),1.19(d,j=7.1hz,3h).ms:m/z=1048.7[m+1]
+
.hplc:tr21.009min,purity99.412%.
[0108]
ethyl(e)-2-(4-chloro-2-((2-((4-((4-((2-methoxy-4-(3-(4-methoxyphenyl)-3-oxoprop-1-en-1-yl)phenoxy)methyl)benzyl)amino)-4-oxobutyl)carbamoyl)piperidin-1-yl)methyl)-5-((2-methyl-[1,1'-biphenyl]-3-yl)methoxy)phenoxy)acetate(cp17).yellowoil;1hnmr(400mhz,dmso)δ8.30(t,j=6.1hz,1h),8.17(d,j=8.8hz,2h),7.82(d,j=15.8hz,2h),7.66(d,j=15.4hz,1h),7.55
–
7.44(m,5h),7.39(d,j=8.1hz,3h),7.33
–
7.29(m,3h),7.26(d,j=8.1hz,2h),7.21(d,j=7.3hz,1h),7.09(dd,j=8.4,4.6hz,3h),6.94(s,1h),5.23(s,2h),5.12(s,2h),4.90(s,2h),4.26(d,j=5.6hz,2h),4.15(q,j=7.1hz,2h),3.87(d,j=4.4hz,6h),3.10(dd,j=11.3,5.0hz,3h),2.79(d,j=13.6hz,2h),2.71(d,j=13.0hz,2h),2.23(s,3h),2.12(d,j=7.1hz,2h),2.02
–
1.89(m,3h),1.75(d,j=11.5hz,1h),1.68
–
1.64(m,2h),1.52(dd,j=24.4,12.1hz,2h),1.37(d,j=9.0hz,1h),1.19(t,j=7.1hz,3h).ms:m/z=1022.6[m+1]
+
.hplc:tr21.776min,purity95.685%.
[0109]
ethyl(e)-2-(4-chloro-2-((2-((5-((4-((2-methoxy-4-(3-(4-methoxyphenyl)-3-oxoprop-1-en-1-yl)phenoxy)methyl)benzyl)amino)-5-oxopentyl)carbamoyl)piperidin-1-yl)methyl)-5-((2-methyl-[1,1'-biphenyl]-3-yl)methoxy)phenoxy)acetate(cp18).yellowoil;1hnmr(400mhz,dmso)δ8.26(t,j=5.9hz,1h),8.17(d,j=8.8hz,2h),7.82(d,j=15.5hz,1h),7.70(d,j=5.8hz,1h),7.66(d,j=15.4hz,1h),7.60(d,j=8.4hz,2h),7.54(s,1h),7.47(dd,j=13.6,7.5hz,4h),7.39(dd,j=13.7,8.1hz,4h),7.34
–
7.28(m,3h),7.22(t,j=8.7hz,3h),7.08(t,j=7.5hz,3h),5.24(d,j=3.3hz,4h),5.11(s,2h),4.24(d,j=5.6hz,2h),3.87(d,j=4.7hz,6h),3.55
–
3.46(m,2h),3.25(d,j=13.6hz,2h),3.07
–
2.90(m,3h),2.77
–
2.69(m,2h),2.23(s,3h),2.10
1-en-1-yl)phenoxy)methyl)benzyl)amino)-5-oxopentyl)piperidine-2-carboxamide(cp21).yellowoil;1hnmr(400mhz,dmso)δ8.25(s,1h),8.16(d,j=8.7hz,2h),7.82(d,j=15.6hz,1h),7.67(t,j=13.8hz,2h),7.60(d,j=8.5hz,2h),7.54(s,1h),7.47(dd,j=13.3,7.5hz,4h),7.39(dd,j=13.8,8.4hz,5h),7.32(d,j=7.2hz,2h),7.28(d,j=7.4hz,1h),7.22(t,j=8.6hz,3h),7.08(t,j=7.5hz,3h),5.24(d,j=3.3hz,4h),5.11(s,2h),4.24(d,j=5.4hz,2h),3.87(d,j=5.0hz,6h),3.60
–
3.47(m,2h),3.06
–
2.89(m,4h),2.73(dd,j=22.8,11.8hz,3h),2.23(s,3h),2.10(t,j=7.2hz,2h),2.04
–
1.94(m,2h),1.90(d,j=7.9hz,1h),1.71(d,j=7.2hz,1h),1.64(d,j=6.5hz,1h),1.53(s,1h),1.47(d,j=6.4hz,2h),1.37
–
1.32(m,2h).ms:m/z=1065.5[m+1]
+
.hplc:tr21.753min,purity100%.
[0113]
(e)-1-(5-chloro-2-((3-cyanobenzyl)oxy)-4-((2-methyl-[1,1'-biphenyl]-3-yl)methoxy)benzyl)-n-(3-((4-((2-methoxy-4-(3-(4-methoxyphenyl)-3-oxoprop-1-en-1-yl)phenoxy)methyl)benzyl)amino)-3-oxopropyl)piperidine-2-carboxamide(cp22).yellowoil;1hnmr(400mhz,dmso)δ8.35(s,1h),8.16(d,j=8.8hz,2h),7.93(s,1h),7.84
–
7.77(m,4h),7.63(dd,j=22.7,11.7hz,3h),7.53(s,1h),7.45(s,4h),7.40(s,1h),7.36(s,2h),7.30(s,2h),7.26(s,1h),7.21(d,j=7.6hz,3h),7.10(s,2h),7.05(s,2h),5.31(s,2h),5.22(s,2h),5.11(s,2h),4.23
–
4.16(m,2h),3.87(d,j=6.9hz,6h),2.32(d,j=6.8hz,3h),2.22(s,3h),2.00(d,j=5.1hz,2h),1.91
–
1.85(m,2h),1.73(d,j=11.5hz,2h),1.64(d,j=6.3hz,2h),1.53
–
1.45(m,4h).
13
cnmr(101mhz,dmso)δ173.35,172.30,172.11,163.53,149.78,143.92,138.83,137.56,134.37,134.09,132.83,131.50,131.23,131.14,131.09,130.19,129.63,129.56,129.48,128.66,128.42,128.36,128.29,127.39,125.98,123.87,121.58,120.24,119.09,114.41,113.54,111.92,111.59,66.76,56.24,56.00,51.81,42.24,36.50,35.21,34.67,34.50,31.88,28.61,16.23.ms:m/z=1037.6[m+1]
+
.hplc:tr21.219min,purity97.625%.
[0114]
(e)-1-(1-(5-chloro-2-((3-cyanobenzyl)oxy)-4-((2-methyl-[1,1'-biphenyl]-3-yl)methoxy)benzyl)piperidine-2-carbonyl)-n-(4-((2-methoxy-4-(3-(4-methoxyphenyl)-3-oxoprop-1-en-1-yl)phenoxy)methyl)benzyl)piperidine-4-carboxamide(cp23).yellowsolid;mp:125.3
–
126.3℃;1hnmr(400mhz,dmso)δ8.35(s,1h),8.17(d,j=8.3hz,2h),7.95(s,2h),7.81(s,3h),7.71
–
7.59(m,2h),7.55(s,1h),7.47(dd,j=16.0,7.4hz,3h),7.42
–
7.36(m,3h),7.31(d,j=7.4hz,2h),7.24(d,j=14.3hz,4h),7.07(t,j=11.0hz,2h),6.86(d,j=42.4hz,1h),5.26(d,j=12.6hz,3h),5.08(d,j=38.5hz,1h),4.38(s,2h),4.26(s,2h),3.87(s,3h),3.77(s,1h),3.63
–
3.50(m,2h),2.94(d,j=20.0hz,2h),2.42(s,2h),2.24(s,3h),2.03(d,j=27.0hz,2h),1.68(d,j=24.3hz,5h),1.46(s,3h),1.33(d,j=18.8hz,2h).
13
cnmr(101mhz,dmso)δ170.78,163.56,162.62,153.38,150.31,149.81,143.77,142.46,135.68,135.46,134.88,131.58,131.22,131.10,130.20,129.57,128.67,128.34,127.55,127.39,125.98,124.49,122.66,121.56,120.73,120.16,114.36,113.96,113.58,113.51,111.92,111.74,111.55,70.00,60.24,56.23,56.01,53.48,51.98,36.17,33.29,31.22,28.21,28.12,27.07,24.54,16.22.ms:m/z=1077.6[m+1]
+
.hplc:tr21.651min,purity
97.154%.
[0115]
实施例2、本发明所述的一种pd-l1/cxcl12双靶点抑制剂对pd-1/pd-l1的抑制效果研究
[0116]
本发明化合物的对pd-1/pd-l1的抑制效果采用如下方法测试所证明。
[0117]
这些效果表明本发明化合物对pd-1/pd-l1的抑制效果明显,其可用于治疗癌症,特别是治疗黑色素瘤。具体测试方法如下:
[0118]
一、实验目的及原理
[0119]
pd-1/pd-l1蛋白-蛋白互作抑制活性的检测方法为基于生化水平的均相时间分辨荧光法(homogeneoustime-resolved fluorescence,htrf),利用htrf(均相时间分辨荧光)技术,该检测方法简单快速以高通量形式表征化合物和抗体阻断剂。使用铕标记的anti-tag1检测pd-l1和pd1之间的相互作用(htrf供体)和用xl665(htrf受体)标记的抗tag2。当供体和受体抗体由于pd-l1和pd1结合而紧密靠近,供体抗体的激发触发荧光共振能量转移(fret)向受体抗体,后者又在665nm处特异性发射。这具体信号与pd1/pd-l1相互作用的程度成正比。因此,化合物或抗体阻断pd1/pd-l1相互作用会导致htrf 信号减少。通过酶标仪检测产生的荧光强度,以665nm/620nm的比值来反映化合物阻断pd-1/pd-l1活性的大小。
[0120]
二、试剂基本信息
[0121]
表1:试剂品牌货号
[0122][0123]
三、实验试剂准备
[0124]
表2:实验试剂配制方法
[0125][0126][0127]
四、实验过程
[0128]
(1)向96孔板中每孔加入2μl的化合物稀释液,1000rpm离心1min.
[0129]
(2)向每孔加入4μl(2.5x)pd-l1混合液,1000rpm离心1min.
[0130]
(3)向每孔加入4ul(2.5x)pd-1混合液,1000rpm离心1min,室温孵育15min.
[0131]
(4)每孔加入10μl(2x)测试混合液,1000rpm离心1min.
[0132]
(5)室温孵育120min,使用tecan酶标仪读取荧光值(ex:320nm;em:620and 665nm).
[0133]
(6)按下列公式计算抑制率,抑制率(inibition)%=(1-(各孔665nm/620nm信号值-低对照组平均值) /(高对照组平均值-低对照组平均值))*100。其中高对照组为没有加化合物处理,仅用等量浓度dmso 溶液加入反应体系组;低对照组为没有pd-1混合液,只加入等量检测混合液。该检测体系中,dmso终浓度为0.5%。
[0134]
(7)拟合量效曲线:以浓度的log值作为x轴,百分比抑制率为y轴,采用分析软件graphpad prism 5 的log(inhibitor)vs.response-variable slope拟合量效曲线,从而得出各个化合物对酶活性的ic50值(+表示ic50=1~10μm,++表示ic50=0.001~1μm)。
[0135]
表3:化合物cp1~cp23对pd-1/pd-l1的抑制效果
[0136][0137]
根据上述体外实验结果,我们可以得出本发明所述的一种pd-l1/cxcl12双靶点抑制剂能够抑制程序性细胞死亡受体1/程序性细胞死亡配体1(pd-1/pd-l1)的相互结合。
[0138]
实施例3、本发明所述的一种pd-l1/cxcl12双靶点抑制剂对cxcl12的抑制效果研究
[0139]
一、实验目的及原理
[0140]
由于cp23在htrf结果中显示抑制pd-1/pd-l1最强,我们选择cp23进一步验证。为了进一步验证 cp23是否可以与cxcl12发生交叉反应,我们通过表面等离子共振(spr)和圆二色光谱(简称cd) 分析确定了其与人cxcl12和鼠cxcl12的结合亲和力。
[0141]
表面等离子共振(spr)是一种光学现象,可被用来实时跟踪在天然状态下生物分子间的相互作用。这种方法对生物分子无任何损伤,且不需任何标记物。先将一种生物分子(靶分子)键合在生物传感器表面,再将含有另一种能与靶分子产生相互作用的生物分子(分析物)的溶液注入并流经生物传感器表面。生物分子间的结合引起生物传感器表面质量的增加,导致折射指数按同样的比例增强,生物分子间反应的变化即被观察到。当分析物被注入时,分析物-靶分子复合物在生物传感器表面形成,导致反应增强。而当分析物被注入完毕后,分析物-靶分子复合物解离,导致反应减弱。通过结合式相互作用模型拟合这种反应曲线,动力学常数便可被确定。而非特异性结合和总折射指数移相等效应则可通过参照曲线减除功能予以驱除。
[0142]
二、实验过程
[0143]
(1).重生液准备:500ml50mm的甘氨酸盐酸,ph=2.0;
[0144]
(2).缓冲液准备:500ml1xpbs磷酸盐缓冲液;
[0145]
(3).pd-l1蛋白点样:点样浓度0.5-1mg/ml,体积10-20μl,用h2o或pbs溶解;
[0146]
(4).依据spr测试拟合曲线可得各个化合物对cxcl12/cxcr4的抑制效果,如下表所示(+表示ic50= 1~10μm,++表示ic50=0.001~1μm)。
[0147]
表4:化合物cp1~cp23对cxcl12/cxcr4的抑制效果
[0148][0149][0150]
根据上述体外实验结果,我们可以得出本发明所述的一种pd-l1/cxcl12双靶点抑制剂能够抑制 cxcl12/cxcr4的相互结合。
[0151]
实施例4本发明化合物对小鼠黑色素瘤模型治疗效果研究
[0152]
一、实验材料
[0153]
细胞系:鼠黑色素瘤细胞(b16 f10)。
[0154]
实验动物:七周龄c57bl/6雄鼠购自辽宁长生生物技术股份有限公司。
[0155]
二、实验方法
[0156]
小鼠肿瘤模型建立、分组及给药:将b16 f10细胞注射于小鼠前肢腋下,每只注射2
×
105个细胞,肿瘤体积达到100mm3时开始给药,本实验小鼠共分为3组,每组6只,分别口服给予空白对照组(5%二甲基亚砜,30%聚乙二醇200,65%生理盐水)、化合物cp23(75mg/kg/day)和化合物cp23(125mg/kg /day)连续给药14天。治疗过程中监测小鼠体重和肿瘤体积变化,肿瘤体积计算公式:(宽度2×
长度)/2。
[0157]
三、实验结果
[0158]
优选化合物体内肿瘤模型治疗如图3所示,化合物cp23表现出较好的体内抗肿瘤活性。与对照组相比,口服125mg/kg的cp23分别使肿瘤重量和肿瘤体积减少60.5%和85.5%。而剂量为75mg/kg的cp23 分别使肿瘤重量和肿瘤体积减少了55%和85.1%,效果明显。
[0159]
图3为cp23对荷b16-f10黑色素瘤肿瘤的小鼠的治疗效果。(a)为肿瘤图像,可见给药治疗之后肿瘤的大小显著变化;(b)为小鼠肿瘤重量,治疗组与非治疗组相比明显降低且存在显著差异;(c)为小鼠肿瘤体积随时间的变化情况,治疗组的体积增长较非治疗组慢;(d)为治疗期间小鼠的体重变化,可见在小鼠的体重无明显变化。(**p《0.05,n=6) 。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1