一种荧光探针及其合成方法和检测CN-的应用
一种荧光探针及其合成方法和检测cn-的应用
技术领域
1.本发明属于分析检测领域,涉及一种检测氰根离子探针,该探针的合成方法以及其在含水体系中检测氰根离子的应用。
背景技术:
2.氰根离子(cn-)具有令人生畏的毒性,其可以通过呼吸系统或者消化系统直接进入人体内部,导致人体代谢紊乱,中枢神经系统、血管和心脏受到损伤,当人在吸入高浓度气体或吞服大量氰化钠时,可在2-3分钟内停止呼吸,造成猝死。因此,氰根离子对人体的伤害非常大。目前cn-对人体的毒理作用被广泛接受的是:氰化物进入机体后,cn-能抑制组织细胞内42种酶的活性,可与氧化性细胞色素氧化酶的fe
3+
结合,使fe
3+
无法被还原成fe
2+
,氧化过程被阻断,组织细胞不能利用血液中的氧而造成内窒息,大脑首先受损,最后由于中枢性呼吸衰竭而死亡。
3.工业上大量的使用氰化物势必会对环境造成一定的污染,特别是水体环境。此外,环境中的一些细菌、藻类或真菌会产生氰化物。藻类是一类自养微生物,存在于淡水、海洋和土壤生态系统中。由于富含植物蛋白,它被广泛用于营养食品和膳食补充剂中。此外,藻类还富含生物活性物质,包括β-胡萝卜素、二十碳五烯酸(epa)和二十二碳六烯酸(dha)。为了保证藻类食品的食品安全,开发能够检测藻类细胞中微量cn-的探针非常重要。传统检测氰根离子的方法主要有:电化学法、异烟酸-吡唑啉酮(巴比妥酸)分光光度法、气质联用法、离子色谱法、电位滴定法等,但以上几种检测方式或需要依赖大型仪器设备,或处理过程较为繁琐耗时,或灵敏度和选择性较低。因此,开发一类易于操作,具有高选择性和灵敏度,且成本低廉的氰根离子检测方法具有重要的意义。
4.近年来,利用荧光光谱法检测物质荧光光谱性质的变化来测定氰根离子的分子荧光探针成为研究的热点之一。其具有易于操作,灵敏度高,选择性好等优势,进而被应用于生理和环境检测等领域。目前,大多数报道的氰根检测荧光探针的荧光发射波长在500-750nm之间。但一些食用植物和藻类细胞在500-750nm范围内具有较强的自发荧光。由于光谱重叠,这些荧光探针无法用于检测藻类细胞中的氰化物。为了避免藻类细胞的自发荧光,人们致力于寻找具有不同发射波长的新型荧光探针,以拓展其应用领域。其中,最大荧光发射位于500nm以下或近红外的探针可能适合检测食品样品中的氰化物。因此,开发一种灵敏度高,选择性好,价格低廉,且荧光最大发射波长低于500nm或近红外,可应用于检测食品样品中的氰根离子的荧光探针具有重要的意义。
技术实现要素:
5.本发明有三个目的:(1)提供一种检测氰根离子的小分子荧光探针;(2)提供一种上述小分子荧光探针的合成方法;(3)提供上述小分子荧光探针在制备检测含水体系及藻类细胞中氰根离子探针中的应用。
6.为了实现上述目的,本发明采取下述技术方案:
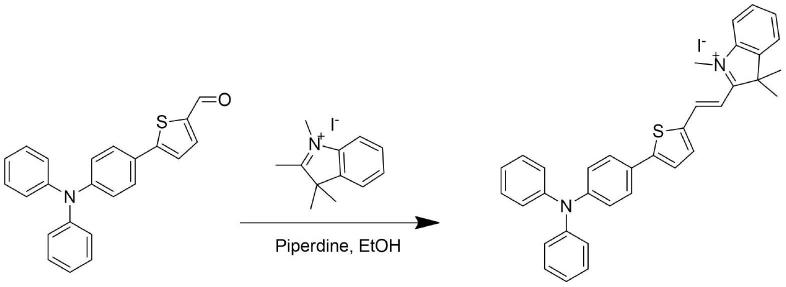
7.一种小分子荧光探针,其化学名称为(e)-2-(2-(5-(4-(二苯胺)苯基)噻吩-2
‑ꢀ
基)-1,3,3-三甲基-3h-碘化吲哚盐,标记为ti,所述小分子荧光探针能专一性检测氰根离子。其结构式如下:
[0008][0009]
本发明检测氰根离子(cn-)的荧光探针分子结构中c=n双键易与cn-发生亲核加成反应,使得c=n双键中共轭π键被破坏,分子内共轭体系缩小,各能级之间能量差增加,吸收光谱向短波方向移动,从而产生颜色和光谱的变化。
[0010]
一种检测氰根离子的小分子荧光探针的合成方法,是以5-(4-(二苯胺)苯基)噻吩-2-甲醛为原料,与1,2,3,3-四甲基-3h-碘化吲哚盐通过克脑文盖尔缩合反应所得,合成路线如下所示:
[0011][0012]
具体制备工艺步骤为:取干燥的反应容器,容器内置换成氮气,按物质的量之比1:(2-3)取5-(4-(二苯胺)苯基)噻吩-2-甲醛和1,2,3,3-四甲基-3h
‑ꢀ
碘化吲哚盐至反应容器中,再加入乙醇和少量哌啶,在氮气保护下,70-80℃加热回流搅拌3-5h,接着减压蒸馏除去反应溶剂乙醇和哌啶得到红黑色固体。随后硅胶柱层析梯度洗脱,分离提纯(二氯甲烷:甲醇=100:1,二氯甲烷:甲醇= 50:1,二氯甲烷:甲醇=30:1,二氯甲烷:甲醇=20:1),得到深蓝色固体。
[0013]
上述小分子荧光探针在制备检测含水体系中氰根离子探针中的应用。
[0014]
上述小分子荧光探针在制备定性或定量检测藻类细胞内氰根离子探针中的应用,所述小分子荧光探针的荧光最大发射波长与藻类细胞的自发荧光波长不重叠。
[0015]
上述小分子荧光探针在定性或定量检测藻类食品中氰根离子中的应用,所述小分子荧光探针的荧光最大发射波长与藻类食品中所含藻类细胞的自发荧光波长不重叠。
[0016]
相对于现有技术,本发明具有以下优点及有益效果:
[0017]
通过以上技术方案,本发明所述的检测氰根离子(cn-)的荧光探针,当其分子结构
中碳氮双键与cn-发生亲核加成反应后,碳氮双键中共轭π键被打断,进而导致分子的性能和光谱发生变化。随着探针与cn-的反应,其紫外吸收光谱发生蓝移,并在473nm处出现显著的荧光发射峰;在日光灯下溶液由紫色变为无色,在紫外灯下,溶液由无荧光变为蓝绿色荧光。通过荧光光谱研究其在无水乙醇和超纯水(v/v=7:3)的混合溶液中对aco-、br-、cl-、clo
4-、f-、hso
4-、 h2po
4-、i-、no
3-、cn-十种阴离子的检测效果,实验结果表明该荧光探针可以单一性检测cn-,在与其他阴离子共存时,检测过程不受其他阴离子的干扰。在 cn-的浓度为0-6μmol
·
l-1
范围时,最低检测限为:95.7nm。此外,本发明所述的检测cn-的荧光探针其荧光最大发射波长为473nm,与藻类细胞自发荧光光谱不重叠,在检测细胞内cn-时,可避免藻类细胞自发荧光的干扰,因此可用于藻类细胞(例如莱茵衣藻细胞)成像,并对细胞内cn-进行定性和定量检测。
[0018]
综上所述,本发明所述小分子荧光探针是一种选择性好、灵敏度高、可在含水体系和藻类细胞中检测氰根离子的探针。探针的制备方法简单、合成成本较低,因此在cn-的检测中具有较好的应用前景。
附图说明
[0019]
图1为ti探针(10μmol
·
l-1
)的无水乙醇和超纯水(v/v=7:3)混合溶液中加入不同阴离子(50μmol
·
l-1
)时的荧光光谱图;
[0020]
图2:(a)为ti探针(10μmol
·
l-1
)的无水乙醇和超纯水(v/v=7:3)混合溶液中加入不同阴离子(50μmol
·
l-1
)时在日光灯下图片;
[0021]
(b)为ti探针(10μmol
·
l-1
)的无水乙醇和超纯水(v/v=7:3)混合溶液中加入不同阴离子(50μmol
·
l-1
)时在紫外灯下图片;
[0022]
图3为ti探针(10μmol
·
l-1
)的无水乙醇和超纯水(v/v=7:3)混合溶液在不同cn-浓度(0—50μmol
·
l-1
)下的荧光光谱;
[0023]
图4为ti探针(5μmol
·
l-1
)的无水乙醇和超纯水(v/v=7:3)混合溶液i
473nm
与cn-浓度(0-6μmol
·
l
-1
)线性拟合图;
[0024]
图5为ti探针(10μmol
·
l
-1
)的无水乙醇和超纯水(v/v=7:3)混合溶液与其它阴离子(50μmol
·
l
-1
)共存时对cn-(50μmol
·
l
-1
)响应的i
473nm
柱状图;
[0025]
图6为ti探针(10μmol
·
l-1
)、ti与cn-(50μmol
·
l-1
)在无水乙醇和不同ph 值的缓冲溶液(v:v=7:3)的混合溶液中,荧光强度i
473nm
随ph值变化曲线;
[0026]
图7为ti探针(10μmol
·
l-1
)在无水乙醇与水(v:v=7:3)溶液中加入不同浓度cn-(0μmol
·
l-1
、25μmol
·
l-1
、40μmol
·
l-1
、50μmol
·
l-1
、80μmol
·
l-1
)时位于473nm波长处荧光强度i
473nm
随cn-浓度变化曲线;
[0027]
图8为莱茵衣藻细胞在(a)tap培养基;(b)cn-;(c)探针ti(20μmol
·
l-1
);(d)探针ti和cn-(20μmol
·
l-1
)中孵育30min后的荧光共聚焦图像和dic图像;
[0028]
图9为莱茵衣藻粉末样品溶液中探针ti荧光强度i
473 nm
与cn-浓度(0-10 μmol
·
l
-1
)的非线性拟合图。
具体实施方式
[0029]
下面结合附图和具体实施例对本发明进行详细说明。
mol
·
l
-1
的cn-储备液。检测时往比色皿中加入2475μl无水乙醇和超纯水(无水乙醇与超纯水的v/v=7:3)的混合溶液,随后加入25μl的ti储备液(ti 最终浓度10μmol
·
l
-1
),加入cn-储备液0.5μl,摇晃均匀,5min后检测其荧光光谱,重复此操作,直至加4μl的cn-溶液;接着加入cn-储备液1μl,摇晃均匀,5min后检测其荧光光谱,重复此操作,直至加9μl的cn-溶液;继续加入cn-储备液1.5μl,摇晃均匀,5min后检测其荧光光谱,重复此操作,直至加25μl的cn-溶液。
[0041]
实验结果表明,随着待测样中cn-的浓度逐渐增大,溶液在473nm处的荧光发射峰逐渐增强,直至加入待测样中cn
‑‑
达到30μmol
·
l-1
时接近平衡(图3)。 cn-的浓度在0—6μmol
·
l-1
范围内时,i
473nm
与cn-的浓度呈现较好的线性关系,进行拟合,得到的线性方程为y=7.5536e7x+65.2216(r2=0.99078)(图4),故可通过荧光光谱法定量检测含水体系中cn-的浓度。
[0042]
3、ti荧光探针对cn-检测限的测定
[0043]
依据“检测限=3σ/k”,可计算ti荧光探针对cn-的检测限,其中σ为标准平均偏差,k为线性拟合直线的斜率。将荧光探针ti(10μmol
·
l-1
)加入无水乙醇和超纯水(无水乙醇和超纯水的v/v=7:3)混合溶液进行15次荧光光谱检测,15组i
473nm
计算标准偏差σ为2.41,当cn-的浓度为0—6μmol
·
l-1
时,ti与 cn-的浓度表现出较好的线性关系,拟合得到的线性方程为y=7.5536e7x+65.2216 (r2=0.99078),k为7.5536e7,经计算,检出限为:95.7nmol/l,远低于世界卫生组织对居民生活饮用水中,cn-的最高允许浓度的规定(1.9μmol/l)。
[0044]
4、复杂环境抗干扰能力检测
[0045]
将2475μl无水乙醇和超纯水(无水乙醇与超纯水的v/v=7:3)混合溶液加入比色皿中,接着将25μlti储备液加入比色皿中(ti最终浓度10μmol
·
l-1
),进行荧光光谱检测,随后再加入25μl阴离子储备液(例如aco-、br-、cl-、 clo
4-、f-、hso
4-、h2po
4-、i-、no
3-),摇匀,进行荧光光谱检测,最后加入 25μl cn-,摇匀,5min后再次进行荧光光谱检测,其它各阴离子均重复上述操作。
[0046]
实验结果表明,在与其他阴离子同时存在的情况下,cn-可以与ti发生反应,探针分子构型发生变化,导致其在473nm处出现新的荧光发射峰(图5)。因此,当荧光探针用于检测cn-时,其具有非常强的抗干扰能力,在与其他阴离子的共存时不会对检测结果带来影响。
[0047]
5、ti荧光探针与cn-反应动力学研究
[0048]
无水乙醇配制10-3
mol
·
l
-1
的ti探针储备液,超纯水配制5
×
10-3
mol
·
l
-1
cn-储备液。取2475μl无水乙醇和超纯水(无水乙醇与超纯水的v/v=7:3)混合溶液和25μlti探针储备液至比色皿中,随后再分批次加入不同体积的cn-储备液(0μl、12.5μl、20μl、25μl、40μl),不同时间段检测荧光光谱。
[0049]
实验结果表明,随着cn-浓度的增大,同一反应时间下473nm处的荧光强度逐渐增大。同时,当探针溶液中加入cn-后,i
473nm
在30s后显著增大,在5min 内基本达到平衡(图7)。因此,可将ti荧光探针用于cn-的实时检测。
[0050]
6、ti荧光探针在不同ph值含水体系中对cn-检测的研究
[0051]
超纯水配制0.02mol
·
l
-1
的ph=3.0、4.0、5.0的naac-hac缓冲溶液和ph= 6.0、7.2、8.0、9.0、10.0、11.0、12.0的hepes缓冲溶液。取2475μl无水乙醇和ph=3的naac-hac缓
冲溶液(无水乙醇与naac-hac缓冲溶液的v/v=7:3)混合溶液和25mlti储备液至比色皿中(ti最终浓度10μmol
·
l-1
),摇匀,进行荧光光谱检测;接着将25μl 5
×
10-3
mol
·
l
-1
cn-储备液加入比色皿中,摇匀, 5min后进行荧光光谱检测。每个不同ph值的溶液重复以上操作。
[0052]
结果表明,在ph为3-8范围内,探针位于473nm处几乎无荧光,保持稳定,当ph在9-12范围内时,荧光强度有所增长,表明探针在碱性环境中不稳定。当加入cn-后,在ph为7-9范围内,与cn-反应后的探针位于473nm荧光强度显著增强,但是荧光强度没有在无水乙醇和超纯水(无水乙醇与超纯水的v/v= 7:3)混合溶液中的荧光强度大(图6)。因此,ti探针可在中性及弱碱性环境中保持稳定,对cn-响应较好。
[0053]
7、ti探针用于细胞成像
[0054]
为进一步研究ti荧光探针在藻类细胞中检测cn-的应用,利用徕卡tcs sp8 共聚焦激光扫描显微镜进行细胞成像实验,设置通道(480nm
±
50nm)以捕获荧光发射图像。图8为莱茵衣藻细胞在(a)tap培养基;(b)cn-溶液(20μmol
·
l-1
);(c)探针ti溶液(20μmol
·
l-1
);(d)探针ti和cn-(20μmol
·
l-1
)中孵育30min后的荧光共聚焦图像和dic图像;如图8所示,将莱茵衣藻细胞分别在tap培养基, cn-溶液(20μmol
·
l-1
)或者探针ti溶液(20μmol
·
l-1
)中培养后,均几乎没有观察到荧光,这表明探针ti在莱茵衣藻细胞环境中较为稳定,对莱茵衣藻细胞中的cn-检测没有干扰。将莱茵衣藻细胞与ti探针在tap培养基中培养30min后,再用tap将细胞清洗三次,接着将(ti荧光探针)染色后的莱茵衣藻细胞加入至 cn-溶液(20μmol
·
l-1
)培养30min,进行细胞成像,通道中的蓝色荧光显著增加,表明cn-与活藻细胞内的探针ti发生亲核反应,形成的产物产生蓝色荧光。因此,ti荧光探针可用于莱茵衣藻细胞中的cn-检测。
[0055]
8.莱茵衣藻冻干粉样品中的cn-检测
[0056]
莱茵衣藻细胞作为食物是以冻干粉的形式存在的,因此将莱茵衣藻细胞与不同浓度cn-在25℃下培养30min,随后用tap培养基清洗三次,冻干备用。将不同浓度cn-培养的莱茵衣藻细胞冻干粉分别加入探针ti溶液(20μmol
·
l-1
)中。随着cn-含量的增加,荧光强度显著增加,并在添加1μmol
·
l-1
cn时达到平衡(图9)。实验结果表明,探针ti可用于粉状藻类食品中cn-的定量检测。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1