阳离子表面活性剂和介孔二氧化硅在协同抑制多酚氧化酶活性中的应用
1.本发明属于生物酶技术领域,涉及阳离子表面活性剂和介孔二氧化硅在协同抑制多酚氧化酶活性中的应用。
背景技术:
2.多酚氧化酶(ppo)是一类含铜蛋白,广泛分布于植物细胞内。ppo对酚类底物的氧化被认为是许多水果和蔬菜在催熟、运输、贮藏和加工过程中褐变的主要原因。褐变影响食品外观与口感,降低消费者接受度,对食品工业造成巨大的经济损失。此外,酶促反应产物—醌类化合物能与植物蛋白质结合,降低蛋白质的消化率,降低植物营养价值。因此,如何抑制植物中多酚氧化酶的活性是研究人员关注的问题。
3.目前较为成熟的抑制ppo酶活性的方法为热失活。将雅龙果在100-150℃进行烘烤加热30-120分钟能使雅龙果中ppo失活,防止其褐变。但高温处理会对水果的风味与外观造成影响,且容易导致维生素与矿物质的损失。
4.表面活性剂作为一种两亲性化合物能在溶液中发生自组装,这为蛋白质提供了丰富的微环境种类。研究表明通过表面活性剂可以调控蛋白质活性。中国专利cn105734025a公开了十六烷基三甲基溴化铵(ctab)和十二烷基三甲基溴化铵(dtab)等传统季铵盐类阳离子表面活性剂能够提升由苹果中提取的ppo粗酶的活性。文献(effect of ionic and non-ionic surfactants on the activity and stability of mushroom tyrosinase(doi:10.1016/j.molcatb.2007.03.001))使用阳离子表面活性剂ctab(20mm)、阴离子表面活性剂aot(1.5mm)、非离子表面活性剂brij 52(1.2mm)调控由蘑菇中提取并纯化的多酚氧化酶活性,结果显示:阴离子表面活性剂aot能显著增加该ppo酶促反应速率v
max
;非离子表面活性剂brij 52能通过减小km提升ppo酶活性;而阳离子表面活性剂ctab不会降低酶促反应速率v
max
,但能够通过增大酶的米氏常数km抑制酶活性。
5.综上所述,现有的抑制ppo酶活性的方法均存在不同的问题,高温处理对食品价值损失较大;ctab对由蘑菇中提取并纯化的多酚氧化酶活性的抑制作用有限,它不会降低酶促反应速率v
max
,是通过增大酶的米氏常数km抑制该ppo酶活性,且使用的ctab浓度达到了20mm,生物毒性较大,限制了其在食品中的进一步应用。
技术实现要素:
6.本发明的目的在于提供阳离子表面活性剂和介孔二氧化硅纳米颗粒(msns)在协同抑制多酚氧化酶活性中的应用。
7.实现本发明目的的技术方案如下:
8.阳离子表面活性剂和介孔二氧化硅在协同抑制多酚氧化酶活性中的应用,所述的阳离子表面活性剂为十二烷基三甲基溴化铵(dtab)或溴化1-十二烷基-3-甲基咪唑([c
12
mim]br)。
[0009]
本发明所述的dtab的结构式为
[0010]
本发明所述的[c
12
mim]br的结构式为
[0011]
进一步地,具体应用方法为:在含有多酚氧化酶的溶液中加入dtab和介孔二氧化硅,或在含有多酚氧化酶的溶液中加入[c
12
mim]br和介孔二氧化硅。
[0012]
本发明中,所述的介孔二氧化硅为花状介孔二氧化硅或球状介孔二氧化硅。
[0013]
优选地,为进一步抑制多酚氧化酶活性,调节含有多酚氧化酶的溶液的ph至多酚氧化酶的适宜ph,即ph为6~7.5,更优选为多酚氧化酶的最适ph,即ph为7.0;调节含有多酚氧化酶的溶液的温度至多酚氧化酶的适宜温度,即温度为20~40℃,优选为多酚氧化酶的最适温度,即30℃。
[0014]
优选地,为进一步抑制多酚氧化酶活性,dtab的加入量为0.5mm以上,更优选为3~5mm。
[0015]
优选地,为进一步抑制多酚氧化酶活性,[c
12
mim]br的加入量为0.5mm以上,更优选为1~3mm。
[0016]
优选地,为进一步抑制多酚氧化酶活性,介孔二氧化硅和多酚氧化酶的质量比为10:1。
[0017]
优选地,为进一步抑制多酚氧化酶活性,介孔二氧化硅的加入量为1~3.6mg/ml。
[0018]
优选地,为进一步抑制多酚氧化酶活性,多酚氧化酶的浓度为0.36~1mg/ml。
[0019]
本发明中,所述的含有多酚氧化酶的溶液通过将多酚氧化酶溶于ph 7.0,0.1m na2hpo
4-nah2po4缓冲溶液中配制。
[0020]
本发明中,阳离子表面活性剂和介孔二氧化硅的加入方式可以是先将阳离子表面活性剂和介孔二氧化硅混合后再加入到含有多酚氧化酶的溶液,或先将含有多酚氧化酶的溶液与阳离子表面活性剂混合后再加入介孔二氧化硅,或先将含有多酚氧化酶的溶液与介孔二氧化硅混合后再加入阳离子表面活性剂。孵育时的混合顺序对多酚氧化酶活性的抑制效果的影响不大。
[0021]
与现有技术相比,本发明具有以下优点:
[0022]
本发明发现在非高温的30℃条件下,将阳离子表面活性剂dtab或[c
12
mim]br、介孔二氧化硅纳米颗粒和多酚氧化酶共同孵育后,可使多酚氧化酶活性丧失90%以上,且阳离子表面活性剂dtab与[c
12
mim]br使用量明显低于单独使用dtab或[c
12
mim]br时的使用量。
附图说明
[0023]
图1为t=30℃,ph=7条件下,dtab/msns/ppo体系中dtab浓度对ppo酶活性影响图;
[0024]
图2为t=30℃,ph=7条件下,[c
12
mim]br/msns/ppo体系中[c
12
mim]br浓度对ppo酶活性影响图;
[0025]
图3为t=30℃,ph=7条件下,不同dtab浓度下,msns对ppo酶负载率图;
[0026]
图4为t=30℃,ph=7条件下,不同[c
12
mim]br浓度下,msns对ppo酶负载率图;
[0027]
图5为t=30℃,ph=7条件下,加样顺序对dtab/msns/ppo体系中ppo酶活性的影响图;
[0028]
图6为t=30℃,ph=7条件下,加样顺序对[c
12
mim]br/msns/ppo体系中ppo酶活性的影响图;
[0029]
图7为msns/dtab固定ppo后的红外光谱图;
[0030]
图8为t=30℃,ph=7条件下,dtab/msns/ppo体系中底物浓度对ppo活性影响图;
[0031]
表1为t=30℃,ph=7条件下,dtab和msns对ppo米氏常数km和最大反应速率v
max
的影响。
具体实施方式
[0032]
下面结合实施例和附图对本发明作进一步详述。
[0033]
实施例1
[0034]
dtab和介孔二氧化硅协同抑制多酚氧化酶活性实验:
[0035]
(1)多酚氧化酶溶液的配制
[0036]
商品化ppo酶购自北京索莱宝科技有限公司(cas:9002-10-2),该酶从蘑菇中提取。以na2hpo
4-nah2po4缓冲溶液(0.1m,ph 7.0)为溶剂,配制20mg/ml酶母液。
[0037]
(2)介孔二氧化硅分散液的配制
[0038]
介孔二氧化硅的制备参考文献(doi:10.1039/c7gc02139a),具体为使用双模板法,以阳离子表面活性剂ctab和阴离子表面活性剂sds为模板剂,以正硅酸乙酯为硅源,采用一锅法反应得到二氧化硅纳米球,再通过煅烧去除模板剂,得到介孔二氧化硅纳米球。其中,制备花状二氧化硅使用的模板剂为[ctab]:[sds]=42mm:6mm,制备球形二氧化硅使用的模板剂为[ctab]:[sds]=42mm:2mm。
[0039]
以na2hpo
4-nah2po4缓冲溶液(0.1m,ph 7.0)为分散剂,超声分散(100w,20min)得到20mg/ml的介孔二氧化硅分散液。
[0040]
(3)表面活性剂溶液的配制
[0041]
以na2hpo
4-nah2po4缓冲溶液(0.1m,ph 7.0)为溶剂,配制20mm的dtab母液。
[0042]
(4)底物溶液的配制
[0043]
以na2hpo
4-nah2po4缓冲溶液(0.1m,ph 7.0)为溶剂,配制浓度为75mm的邻苯二酚母液。
[0044]
(5)酶预处理
[0045]
将一定量dtab母液、介孔二氧化硅分散液加入ppo母液中,30℃振荡孵育1h,得到待测酶液。孵育体系中,介孔二氧化硅浓度为3.6mg/ml,ppo浓度为0.36mg/ml。
[0046]
(6)酶活性测定(紫外-可见分光光度法)
[0047]
以邻苯二酚为底物,对ppo进行酶活性的测试。将(4)中底物溶液与(5)中待测酶液混合,记录10s内反应体系于420nm处的吸光度值。测试体系中,邻苯二酚的浓度为4mm。将420nm处的吸光度值(a)与时间(t)作图,通过该动力学曲线的初始斜率,结合产物邻苯二醌的摩尔吸光系数(1100m-1
cm-1
),得到ppo催化氧化邻苯二酚的初始反应速率ν(mm
·
s-1
)。将不加任何添加剂的酶活性定义为100%。
[0048]
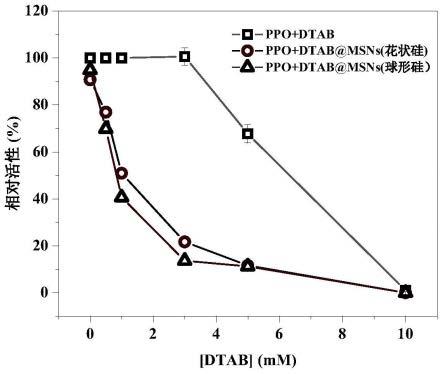
图1为t=30℃,ph=7条件下,dtab/msns/ppo体系中dtab浓度对ppo酶活性的影响
图。由图可知,体系中只加入dtab时,当dtab浓度不超过3mm时,ppo酶活性几乎不变;当dtab浓度达到3mm后,ppo活性开始降低:当dtab浓度为5mm时,ppo活性为68%;当dtab浓度达到10mm时,ppo完全失活。当dtab和花状介孔二氧化硅同时存在时,0.5mm的dtab即可使ppo酶活性降低至77%,3mm的dtab可使ppo酶活性下降至22%;当dtab浓度达到5mm时,ppo活性降低至10%以下。当dtab和球形介孔二氧化硅同时存在时,0.5mm的dtab即能使ppo酶活性降低至70%,3mm的dtab可使ppo酶活性下降至14%;当dtab浓度达到5mm时,ppo活性降低至10%以下。
[0049]
实施例2
[0050]
[c
12
mim]br和介孔二氧化硅协同抑制多酚氧化酶活性实验:
[0051]
(1)多酚氧化酶溶液的配制:与实施例1相同。
[0052]
(2)介孔二氧化硅分散液的配制:与实施例1相同。
[0053]
(3)表面活性剂溶液的配制
[0054]
以na2hpo
4-nah2po4缓冲溶液(0.1m,ph 7.0)为溶剂,配制20mm的[c
12
mim]br母液。
[0055]
(4)底物溶液的配制:与实施例1相同。
[0056]
(5)酶预处理
[0057]
将一定量[c
12
mim]br母液、介孔二氧化硅分散液加入ppo母液中,30℃振荡孵育1h,得到待测酶液。孵育体系中,介孔二氧化硅浓度为3.6mg/ml,ppo浓度为0.36mg/ml。
[0058]
(6)酶活性测定(紫外-可见分光光度法)
[0059]
以邻苯二酚为底物,对ppo进行酶活性的测试。将(4)中底物溶液与(5)中待测酶液混合,记录10s内反应体系于420nm处的吸光度值。测试体系中,邻苯二酚的浓度为4mm。将420nm处的吸光度值(a)与时间(t)作图,通过该动力学曲线的初始斜率,结合产物邻苯二醌的摩尔吸光系数(1100m-1
cm-1
),得到ppo催化氧化邻苯二酚的初始反应速率ν(mm
·
s-1
)。将不加任何添加剂的酶活性定义为100%。
[0060]
图2为t=30℃,ph=7条件下,[c
12
mim]br/msns/ppo体系中[c
12
mim]br浓度对ppo酶活性影响图。由图可知,体系中只加入[c
12
mim]br时,1mm的[c
12
mim]br对ppo酶活性几乎没有影响,3mm的[c
12
mim]br可使ppo酶活性下降至29%,5mm的[c
12
mim]br才能使ppo酶完全失活。同时加入[c
12
mim]br和花状介孔二氧化硅后,0.5mm的[c
12
mim]br即可使ppo活性下降至61%,1mm的[c
12
mim]br可使ppo酶活性下降至39%,3mm的[c
12
mim]br即可使ppo酶完全失活。同时加入[c
12
mim]br和球形介孔二氧化硅后,0.5mm的[c
12
mim]br即可使ppo活性下降至50%,1mm的[c
12
mim]br可使ppo酶活性下降至43%,3mm的[c
12
mim]br可使ppo酶活性降低至18%。
[0061]
实施例3
[0062]
不同浓度dtab存在下,msns对ppo酶负载率实验:
[0063]
(1)多酚氧化酶溶液的配制:与实施例1相同。
[0064]
(2)介孔二氧化硅分散液的配制:与实施例1相同。
[0065]
(3)表面活性剂溶液的配制:与实施例1相同。
[0066]
(4)dtab存在下msns对ppo的负载实验
[0067]
将一定量dtab母液、介孔二氧化硅分散液加入ppo母液中,30℃振荡孵育1h,在30℃、1000rpm条件下离心20min,取上清液待测。孵育体系中,介孔二氧化硅浓度为1mg/ml,
ppo浓度为1mg/ml。
[0068]
(5)ppo负载率测定(紫外-可见分光光度法)
[0069]
测定1mg/ml ppo溶液吸光度值,记a0,测定(4)中上清液280nm处吸光度值,记a1,以下列公式计算ppo负载率:
[0070]
ppo负载率=(a
0-a1)/a0×
100%
[0071]
图3为t=30℃,ph=7条件下,不同浓度dtab下,msns对ppo酶的负载率图。由图可知,介孔二氧化硅几乎不吸附ppo,随着体系中dtab含量增加,介孔二氧化硅对ppo负载率上升,当dtab使用量为1mm时,花状介孔二氧化硅对ppo负载率达到22%,球形介孔二氧化硅对ppo负载率达到19%。
[0072]
实施例4
[0073]
不同浓度[c
12
mim]br存在下,msns对ppo酶负载率实验:
[0074]
(1)多酚氧化酶溶液的配制:与实施例1相同。
[0075]
(2)介孔二氧化硅分散液的配制:与实施例1相同。
[0076]
(3)表面活性剂溶液的配制:与实施例2相同。
[0077]
(4)[c
12
mim]br存在下msns对ppo的负载实验:
[0078]
将一定量[c
12
mim]br母液、介孔二氧化硅分散液加入ppo母液中,30℃振荡孵育1h,在30℃、1000rpm条件下离心20min,取上清液待测。孵育体系中,介孔二氧化硅浓度为1mg/ml,ppo浓度为1mg/ml。
[0079]
(5)ppo负载率测定(紫外-可见分光光度法)
[0080]
测定1mg/ml ppo溶液吸光度值,记a0,测定(4)中上清液280nm处吸光度值,记a1,以下列公式计算ppo负载率:
[0081]
ppo负载率=(a
0-a1)/a0×
100%。
[0082]
图4为t=30℃,ph=7条件下,不同浓度[c
12
mim]br下,msns对ppo酶的负载率图。由图可知,介孔二氧化硅几乎不吸附ppo,随着体系中[c
12
mim]br含量增加,介孔二氧化硅对ppo负载率上升,当[c
12
mim]br使用量为1mm时,花状介孔二氧化硅对ppo负载率达到34%,球形介孔二氧化硅对ppo负载率达到30%。
[0083]
实施例5
[0084]
加样顺序对dtab/msns/ppo体系中ppo酶活性的影响实验:
[0085]
(1)多酚氧化酶溶液的配制:与实施例1相同。
[0086]
(2)介孔二氧化硅分散液的配制:
[0087]
介孔二氧化硅采用现有方法制备,参考文献(doi:10.1039/c7gc02139a)制备,具体为使用双模板法,以阳离子表面活性剂ctab(42mm)和阴离子表面活性剂sds(2mm)为模板剂,以正硅酸乙酯为硅源,采用一锅法反应得到二氧化硅纳米球,再通过煅烧去除模板剂,得到球形介孔二氧化硅纳米球。
[0088]
以na2hpo
4-nah2po4缓冲溶液(0.1m,ph 7.0)为分散剂,超声分散(100w,20min)得到20mg/ml的介孔二氧化硅分散液。
[0089]
(3)表面活性剂溶液的配制:与实施例1相同。
[0090]
(4)底物溶液的配制:与实施例1相同。
[0091]
(5)酶与底物预处理
[0092]
a.dtab与酶混合、msns与底物混合
[0093]
将一定量dtab母液加入ppo母液中,30℃振荡孵育1h,得到待测酶液。将一定量介孔二氧化硅分散液加入邻苯二酚母液中,30℃避光振荡孵育1h,得到待使用底物溶液。孵育体系中,介孔二氧化硅浓度为3.624mg/ml,ppo浓度为0.3624mg/ml,dtab浓度为1mm。
[0094]
b.msns与酶混合、dtab与底物混合
[0095]
将一定量介孔二氧化硅分散液加入ppo母液中,30℃振荡孵育1h,得到待测酶液。将一定量dtab母液加入邻苯二酚母液中,30℃避光振荡孵育1h,得到待使用底物溶液。孵育体系中,介孔二氧化硅浓度为3.624mg/ml,ppo浓度为0.3624mg/ml,dtab浓度为1mm。
[0096]
c.dtab、msns共同与底物混合
[0097]
将ppo母液于30℃振荡孵育1h,得到待测酶液。将一定量dtab母液、介孔二氧化硅分散液加入邻苯二酚母液中,30℃避光振荡孵育1h,得到待使用底物溶液。孵育体系中,介孔二氧化硅浓度为3.624mg/ml,ppo浓度为0.3624mg/ml,dtab浓度为1mm。
[0098]
(6)酶活性测定(紫外-可见分光光度法)
[0099]
以邻苯二酚为底物,对ppo进行酶活性的测试。将(5)中待使用底物溶液与待测酶液混合,记录10s内反应体系于420nm处的吸光度值。测试体系中,邻苯二酚的浓度为4mm。将420nm处的吸光度值(a)与时间(t)作图,通过该动力学曲线的初始斜率,结合产物邻苯二醌的摩尔吸光系数(1100m-1
cm-1
),得到ppo催化氧化邻苯二酚的初始反应速率ν(mm
·
s-1
)。将不加任何添加剂的酶活性定义为100%。
[0100]
图5为t=30℃,ph=7条件下,加样顺序对dtab/msns/ppo体系中ppo酶活性的影响图。由图可知,只有dtab与介孔二氧化硅同时与酶混合时,dtab/msns对ppo酶活性才有明显的抑制效果,而其他三种加样顺序(dtab与酶混合、msns与底物混合;msns与酶混合、dtab与底物混合;dtab与介孔二氧化硅同时与底物混合)对ppo酶活性的影响不明显。
[0101]
实施例6
[0102]
加样顺序对[c
12
mim]br/msns/ppo体系中ppo酶活性的影响实验:
[0103]
(1)多酚氧化酶溶液的配制:与实施例1相同。
[0104]
(2)介孔二氧化硅分散液的配制:与实施例5相同。
[0105]
(3)表面活性剂溶液的配制:与实施例2相同。
[0106]
(4)底物溶液的配制:与实施例1相同。
[0107]
(5)酶与底物预处理
[0108]
a.[c
12
mim]br与酶混合、msns与底物混合
[0109]
将一定量[c
12
mim]br母液加入ppo母液中,30℃振荡孵育1h,得到待测酶液。将一定量介孔二氧化硅分散液加入邻苯二酚母液中,30℃避光振荡孵育1h,得到待使用底物溶液。孵育体系中,介孔二氧化硅浓度为3.624mg/ml,ppo浓度为0.3624mg/ml,[c
12
mim]br浓度为1mm。
[0110]
b.msns与酶混合、[c
12
mim]br与底物混合
[0111]
将一定量介孔二氧化硅分散液加入ppo母液中,30℃振荡孵育1h,得到待测酶液。将一定量[c
12
mim]br母液加入邻苯二酚母液中,30℃避光振荡孵育1h,得到待使用底物溶液。孵育体系中,介孔二氧化硅浓度为3.624mg/ml,ppo浓度为0.3624mg/ml,[c
12
mim]br浓度为1mm。
[0112]
c.[c
12
mim]br和msns共同与底物混合
[0113]
将ppo母液于30℃振荡孵育1h,得到待测酶液。将一定量[c
12
mim]br母液、介孔二氧化硅分散液加入邻苯二酚母液中,30℃避光振荡孵育1h,得到待使用底物溶液。孵育体系中,介孔二氧化硅浓度为3.624mg/ml,ppo浓度为0.3624mg/ml,[c
12
mim]br浓度为1mm。
[0114]
(6)酶活性测定(紫外-可见分光光度法)
[0115]
以邻苯二酚为底物,对ppo进行酶活性的测试。将(5)中待使用底物溶液与待测酶液混合,记录10s内反应体系于420nm处的吸光度值。测试体系中,邻苯二酚的浓度为4mm。将420nm处的吸光度值(a)与时间(t)作图,通过该动力学曲线的初始斜率,结合产物邻苯二醌的摩尔吸光系数(1100m-1
cm-1
),得到ppo催化氧化邻苯二酚的初始反应速率ν(mm
·
s-1
)。将不加任何添加剂的酶活性定义为100%。
[0116]
图6为t=30℃,ph=7条件下,加样顺序对[c
12
mim]br/msns/ppo体系中ppo酶活性的影响图。由图可知,只有[c
12
mim]br与介孔二氧化硅同时与酶混合时,[c
12
mim]br/msns对ppo酶活性才有明显的抑制效果,而其他三种加样顺序([c
12
mim]br与酶混合msns与底物混合;msns与酶混合、[c
12
mim]br与底物混合;[c
12
mim]br与介孔二氧化硅同时与底物混合)对ppo酶活性影响很小。
[0117]
实施例7
[0118]
msns/dtab固定ppo后的红外光谱实验:
[0119]
(1)多酚氧化酶溶液的配制:与实施例1相同。
[0120]
(2)介孔二氧化硅分散液的配制:与实施例5相同。
[0121]
(3)表面活性剂溶液的配制:与实施例1相同。
[0122]
(4)msns/dtab固定化ppo
[0123]
将一定量dtab母液或/和ppo母液加入介孔二氧化硅分散液中,30℃振荡孵育1h,在30℃、1000rpm条件下离心20min,移除上清液,使用na2hpo
4-nah2po4缓冲溶液(0.1m,ph 7.0)洗涤沉淀,冷冻干燥,得到待测固体。孵育体系中,介孔二氧化硅浓度为1mg/ml,ppo浓度为1mg/ml,dtab浓度为1mm。
[0124]
(5)红外光谱测定
[0125]
将待测固体粉末与溴化钾按质量比1:100混合、压片,记录4000-400cm-1
波数范围内的红外吸收光谱。
[0126]
图7为msns/dtab固定化ppo后红外光谱图。其中1099cm-1
处的尖峰归因于介孔二氧化硅的si-o伸缩振动。固定ppo后可以观察到位于酰胺ⅰ带(1600-1700cm-1
)的ppo特征吸收峰。3400-3440cm-1
处的峰可归因于ppo的n-h伸缩振动,而2926cm-1
与2856cm-1
处的峰可归因于dtab的c-h伸缩振动。红外光谱图证明了dtab、msns、ppo三者复合物的形成。
[0127]
实施例8
[0128]
dtab与msns对ppo酶促反应米氏常数(km)、最大反应速率(v
max
)的影响实验:
[0129]
(1)多酚氧化酶溶液的配制:与实施例1相同。
[0130]
(2)介孔二氧化硅分散液的配制:与实施例5相同。
[0131]
(3)表面活性剂溶液的配制:与实施例1相同。
[0132]
(4)底物溶液配制
[0133]
以na2hpo
4-nah2po4缓冲溶液(0.1m,ph 7.0)为溶剂,配制浓度为75mm的邻苯二酚
母液。用na2hpo
4-nah2po4缓冲溶液(0.1m,ph 7.0)与邻苯二酚母液(75mm)配制0-8mm的邻苯二酚溶液。
[0134]
(5)酶预处理
[0135]
将一定量dtab母液、介孔二氧化硅分散液加入ppo母液中,30℃振荡孵育1h,得到待测酶液。孵育体系中,介孔二氧化硅浓度为3.6mg/ml,ppo浓度为0.36mg/ml,dtab浓度为1mm。
[0136]
(6)酶活性测定(紫外-可见分光光度法)
[0137]
以邻苯二酚为底物,对ppo进行酶活性的测试。测试体系中,邻苯二酚的浓度为0-8mm,测试波长为420nm。将420nm处的吸光度值(a)与时间(t)作图,通过该动力学曲线的初始斜率,结合产物邻苯二醌的摩尔吸光系数(1100m-1
cm-1
),得到ppo催化氧化邻苯二酚的初始反应速率ν(μm
·
s-1
)。将不加任何添加剂的酶活性定义为100%。
[0138]
(7)计算ppo酶促反应米氏常数(km)、最大反应速率(v
max
)
[0139]
以ppo酶活性对底物浓度作图,由图中读取ppo酶促反应最大反应速率v
max
,再由米氏常数定义,km即为v=v
max
/2时的底物浓度。
[0140]
图8为t=30℃,ph=7条件下,dtab/msns/ppo体系中底物浓度对ppo活性影响图。表1为由图8数据整理得到的dtab和msns对ppo的km、v
max
的影响。由表可得,单独阳离子表面活性剂dtab提升ppo米氏常数,单独介孔硅对ppo米氏常数基本没有影响,而dtab与msns的协同作用能够降低ppo米氏常数。说明dtab与msns对ppo酶活性的协同抑制属于反竞争性抑制。
[0141]
表1 dtab和介孔二氧化硅对ppo米氏常数km和最大反应速率v
max
的影响
[0142][0143][0144]
综合以上结果,可以得出以下结论:通过在使用阳离子表面活性剂的同时引入介孔二氧化硅纳米颗粒,能够达到高效抑制多酚氧化酶活性的效果,同时显著减少阳离子表面活性剂的使用量,且咪唑类阳离子表面活性剂提供的氢键作用能进一步减少阳离子表面活性剂使用量。阳离子表面活性剂存在下,介孔二氧化硅对ppo负载率的提升说明了阳离子表面活性剂存在下msns与ppo的相互作用增强。改变表面活性剂、msns与ppo酶的混合顺序不影响表面活性剂/msns对ppo酶活性的抑制效果,但是若表面活性剂和msns分别与ppo和底物混合,或者表面活性剂和msns均与底物混合时,表面活性剂/msns对ppo酶活性的抑制作用有限,说明只有阳离子表面活性剂与介孔二氧化硅与ppo酶共同孵育才能显著抑制ppo酶活性,表明ppo酶活性的减小是由阳离子表面活性剂与介孔二氧化硅的协同作用导致。ppo米氏常数的减小说明阳离子表面活性剂与介孔二氧化硅对ppo酶活性的协同抑制属于反竞争性抑制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1