一种慢病毒转染助转剂及其应用的制作方法
1.本发明涉及慢病毒转染技术领域,尤其涉及一种慢病毒转染助转剂及其应用。
背景技术:
2.随着免疫治疗产业的发展,car-t细胞产品上市,越来越多的研究机构、医药公司投身于car-t的研发、临床试验和产业化制备。car-t细胞俨然成了最热门的研究对象之一。car-t疗法即嵌合抗原受体t细胞免疫疗法(chimeric antigen receptor t-cell immunotherapy),属于过继性细胞免疫疗法(act)的一种,其家族还包括til(肿瘤浸润淋巴细胞疗法),tcr-t(工程化t细胞受体疗法),car-nk等方法。嵌合抗原受体t细胞(car-t细胞)是指将能识别某种肿瘤抗原的抗体的抗原结合部与cd3-ζ链或fcεriγ的胞内部分在体外偶联为一个嵌合蛋白,通过基因转导的方法转染患者的t细胞,使其表达嵌合抗原受体(car)。
3.慢病毒是基因转导最好的方法,其具有转导效率高、可整合t细胞基因组并持续表达目标蛋白等优势,是转染、电转、逆转录病毒、腺病毒等无法比拟的优势。但是,由于慢病毒本身和t细胞本身的特性,使携带目的基因的慢病毒进入t细胞时受阻,无法保证car-t细胞的阳性率。
4.现如今,市售的慢病毒转染助转剂多以聚凝胺(polybrene)为主要成分,其可提高慢病毒转染效率,有较提高car-t细胞的阳性率。polybrene是一种多聚阳离子聚合物,常用于哺乳动物细胞的dna转染实验以增强脂质体的转染效率;polybrene目前广泛用于逆转录病毒介导的基因转染,慢病毒介导的基因转染,作用机理可能是通过中和细胞表面唾液酸与病毒颗粒之间的静电排斥从而促进吸附作用。从而使病毒更容易将携带的目的基因带来转染细胞中,提高了转染效果。然而,polybrene的市价昂贵,且对某些细胞(如末端分化的神经元、dc细胞、t细胞等)毒性较大,对细胞的扩增、分化产生影响;由于polybene是聚合物添加剂,需严格控制其残留。增加了制备成本的同时加大了研发难度。
技术实现要素:
5.基于上述问题,本发明的提供一种成本低、毒性小且无需控制残留的慢病毒转染助转剂及慢病毒转染助转染方法。
6.本发明的技术方案一如下:一种慢病毒转染助转剂,包括含浓度为1mg/ml~50mg/ml碱性氨基酸的无血清培养基。
7.一实施例,慢病毒转染助转剂中,所述碱性氨基酸包括1mg/ml~50mg/ml组氨酸、1mg/ml~50mg/ml赖氨酸及1mg/ml~50mg/ml精氨酸。
8.一实施例,慢病毒转染助转剂中,所述无血清培养基为dmem、imem、rpmi-1640、kpm-581及optmizer tcell expansfmcts中的任一种无血清培养基。
9.本发明的技术方案二如下:
一种慢病毒转染助转染方法,包括如下步骤:从外周血中分选出免疫细胞;采用无血清培养基重悬所述免疫细胞后培养,同时激活免疫细胞,激活后得到免疫细胞悬液;往激活后的免疫细胞悬液中加入上述慢病毒转染助转剂,获得免疫细胞转染悬液;根据moi量,往所述免疫细胞转染悬液中加入慢病毒,进行慢病毒转染;慢病毒转染完成后,加入完全培养基,对转染的免疫细胞进行培养。
10.一实施例,所述免疫细胞重悬、激活步骤中,所述无血清培养基的加入量按照每1.0
×
106个细胞加入350μl;激活时间不超过24小时。
11.一实施例,所述免疫细胞转染悬液配制步骤中,每1ml细胞悬液添加5μl~30μl的助转剂。
12.一实施例,上述慢病毒转染步骤中,所述慢病毒的加入量为moi=1~moi=10,且转染时间为6~24小时。
13.一实施例,上述转染后的免疫细胞培养步骤中,完全培养基的加入量应保持细胞浓度为1.0
×
106个细胞/ml。
14.一实施例,上述免疫细胞为t细胞,也可以是nk、cik、nkt等细胞。所述免疫细胞分选步骤中,免疫细胞优选为t细胞。如果t细胞分选为阳选,则采用cd3/cd28beads分选激活磁珠分选t细胞;如果t细胞分选采用阴选,得到的t细胞还需采用cd3/cd28beads磁珠激活。
15.相对于现有技术,本发明还具有以下优点:1)、助转剂以碱性氨基酸为主,添加的氨基酸未带入其它残留成分,对细胞没有毒性作用,还能提升细胞的活力,减少了慢病毒对细胞的毒副作用,使得慢病毒转染后的免疫细胞具有更高的临床安全性;2)、碱性氨基酸以组氨酸、赖氨酸和精氨酸为主要成分,市场来源广,价格便宜,使得慢病毒转染工艺制作成本低;3)、碱性氨基酸中的组氨酸、赖氨酸和精氨酸,可以中和免疫细胞上所带电荷,具有排斥静电作用;同时,还可以为细胞生长提供必需的氨基酸;4)、以碱性氨基酸为助转剂的慢病毒转染工艺,操作简单,转染完成后,无需进行去除残留操作,使得转染工艺操作更简单、方便。
附图说明
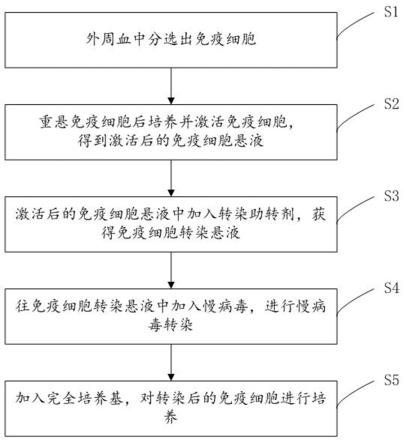
16.图1为本发明提供的慢病毒转染免疫细胞工艺流程图;图2为实施例6中慢病毒转染t细胞后car-t的阳性率检测图;图3为实施例7中慢病毒转染t细胞后car-t的阳性率检测图;图4为实施例8中慢病毒转染t细胞后car-t的阳性率检测图;图5为实施例9中慢病毒转染t细胞后car-t的阳性率检测图;图6为实施例10中慢病毒转染t细胞后car-t的阳性率检测图;图7为实施例11中慢病毒转染t细胞后car-t的阳性率检测图;图8为实施例12中慢病毒转染t细胞后car-t的阳性率检测图;
图9为实施例13中慢病毒转染t细胞后car-t的阳性率检测图;图10为实施例14中慢病毒转染t细胞后car-t的阳性率检测图;图11为实施例15中慢病毒转染t细胞后car-t的阳性率检测图;图12为实施例15中nk细胞阴性对照的阳性率检测图;图13为实施例11至14中慢病毒转染t细胞的生长扩增曲线图。
具体实施方式
17.下面结合附图,对本发明的较佳实施例作进一步详细说明。
18.具体地,本发明提供的慢病毒转染助转剂,其组分包括以含浓度为1mg/ml~50mg/ml碱性氨基酸的无血清培养基。这种转染助转剂,可有效中和细胞表面唾液酸与病毒颗粒之间的静电排斥,促进吸附作用,使慢病毒容易进入免疫细胞中,从而有效提高嵌合抗原受体的表达,如car-t细胞的阳性率,且这种助转剂没有细胞毒性。
19.进一步地,无血清培养基为dmem、imem、rpmi-1640、kpm-581、optmizer tcell expansfmcts等无血清培养基中的任一种。对于无血清培养基的选择,研发阶段可选用科研级培养基,临床阶段可选用临床级培养基;进一步地,所述碱性氨基酸,其包括组氨酸、赖氨酸和精氨酸。
20.如图1所示,本发明还提供一种使用上述助转剂对慢病毒转染的工艺方法,包括步骤如下;s1、采集人外周血(pbmc),分选出免疫细胞;s2、将分选出的免疫细胞用无血清培养基重悬后转移至培养瓶中培养,同时激活免疫细胞,从而得到激活后的免疫细胞悬液;s3、激活后的免疫细胞悬液中加入上述转染助转剂,获得免疫细胞转染悬液;s4、根据moi的量,往免疫细胞转染悬液中加入慢病毒,进行慢病毒转染;s5、慢病毒转染完成后,移至培养瓶中,加入完全培养基,对转染后的免疫细胞进行培养。
21.上述免疫细胞培养,可以是培养瓶、或培养袋,或培养皿。
22.进一步的,步骤s1中,从pbmc中分选出免疫细胞时,可选择阳选或阴选;如果免疫细胞为t细胞且采用阳选,则从pbmc中选用cd3/cd28beads分选激活磁珠分选出t细胞;t细胞采用阴选试剂盒进行阴选,得到的t细还需加入cd3/cd28beads磁珠激活t细胞。
23.进一步地,步骤s2中,无血清培养基的加入量按照每1.0
×
106个细胞加入350μl,免疫细胞激活的时间不超过24小时。
24.进一步地,步骤s3中,助转剂的添加量为每1ml细胞悬液中加5μl~30μl;优选为每1ml细胞悬液中加10μl助转剂。
25.进一步地,步骤s4中,慢病毒的加入量为moi=1~moi=10,且转染时间为6~24小时;最优转染时间为6小时;如果免疫细胞为cik、nk、nkt、dc等细胞时,慢病毒的加入量可以为小于等于moi=100。
26.进一步地,步骤s5中,慢病毒转染后培养,所完全培养基的加入量按照1.0
×
106个细胞/ml操作;完全培养基中含10 v/v %fbs。
27.本发明中所用免疫细胞为t细胞、cik细胞、nk细胞、nkt细胞、dc细胞等。
28.下面以t细胞和nk细胞为例,通过具体实施例进一步详细说明。
29.一、慢病毒转染助转剂配制实施例1按照溶液中氨基酸的浓度计算,提供成分:浓度10mg/ml的组氨酸、浓度10mg/ml的赖氨酸、浓度10mg/ml的精氨酸及余量为dmem无血清培养基,混合制得慢病毒转染助转剂a。
30.实施例2按照溶液中氨基酸的浓度计算,提供成分:浓度50mg/ml的组氨酸、浓度10mg/ml的赖氨酸、浓度10mg/ml的精氨酸及余量为optmizer tcell expansfmcts无血清培养基,混合制得慢病毒转染助转剂b。
31.实施例3按照溶液中氨基酸的浓度计算,提供成分:浓度25mg/ml的组氨酸、浓度1mg/ml的精氨酸、浓度10mg/ml的精氨酸及余量为rpmi-1640无血清培养基,混合制得慢病毒转染助转剂c。
32.实施例4按照溶液中氨基酸的浓度计算,提供成分:浓度1mg/ml的组氨酸、浓度10mg/ml的赖氨酸、浓度50mg/ml的精氨酸及余量为imem无血清培养基,混合制得慢病毒转染助转剂d。
33.实施例5按照溶液中氨基酸的浓度计算,提供成分:浓度1mg/ml的组氨酸、浓度1mg/ml的赖氨酸、浓度1mg/ml的精氨酸及余量为kpm-581无血清培养基,制得慢病毒转染助转剂e。
34.二、慢病毒转染免疫细胞实施例6用cd3/cd28beads分选激活磁珠从pbmc中分选出t细胞,取1.0
×
106的t细胞;用350μl生理盐水重悬1.0
×
106个t细胞,同时激活t细胞;按moi=3加入慢病毒,进行转染处理;转染6小时后,按1.0
×
10
6 细胞/ml加入1ml完全培养基,对转染后的t细胞进行培养;培养第3天计数t细胞,按0.5
×
10
6 细胞/ml补液,第5天进行流式检测car的阳性率为14.97%,如图2所示。
35.实施例7用cd3/cd28beads分选激活磁珠分选激活磁珠从pbmc中分选出t细胞,取1.0
×
106的t细胞;用350μl生理盐水重悬1.0
×
106个t细胞,同时激活t细胞;往t细胞悬液中,加入3.5ul的实施例2制得助转剂b;按moi=5加入慢病毒,进行转染处理;转染20小时后,按1.0
×
10
6 细胞/ml加入1ml完全培养基,对转染后的t细胞进行培养;培养第3天计数,按0.5
×
10
6 细胞/ml补液,第5天进行流式检测car的阳性率47.40%,如图3所示。
36.实施例8
用cd3/cd28beads分选激活磁珠从pbmc中分选出t细胞,取1.0
×
106的t细胞;用350μl生理盐水重悬1.0
×
106个t细胞,同时激活t细胞;往t细胞悬液中,加入3.5ul的polybrene;按moi=8加入慢病毒,进行转染处理;转染6小时后,按1.0
×
10
6 细胞/ml加入1ml完全培养基,对转染后的t细胞进行培养;培养第3天计数,按0.5
×
10
6 细胞/ml补液,第5天进行流式检测car的阳性率50.03%,如图4所示。
37.实施例9用cd3/cd28beads分选激活磁珠从pbmc中分选出t细胞,取1.0
×
106的t细胞;用350μl kpm-581无血清培养基重悬1.0
×
106个t细胞,同时激活t细胞;往t细胞悬液中,加入1.75ul的实施例5制得的助转剂e;按moi=10加入慢病毒,进行慢病毒转染处理;转染24小时后,按1.0
×
10
6 细胞/ml加入1ml完全培养基,对转染后的t细胞进行培养;培养第3天计数,按0.5
×
10
6 细胞/ml补液,第5天进行流式检测car的阳性率28.23%,如图5所示。
38.实施例10用cd3/cd28beads分选激活磁珠从pbmc中分选出t细胞,取1.0
×
106的t细胞;用350μl imem 无血清培养基重悬1.0
×
106个t细胞,同时激活t细胞;往t细胞悬液中,加入6.5ul的实施例4制得的助转剂d;按moi=1加入慢病毒,进行慢病毒转染处理;转染15小时后,按1.0
×
10
6 细胞/ml加入1ml完全培养基,对转染后的t细胞进行培养;培养第3天计数,按0.5
×
10
6 细胞/ml补液,第5天进行流式检测car的阳性率58.67%,如图6所示。
39.实施例11用cd3/cd28beads分选激活磁珠从pbmc中分选出t细胞,取1.0
×
106的t细胞;用350μl rpmi-1640无血清培养基重悬1.0
×
106个t细胞,同时激活t细胞;t细胞悬液中,加入4.5ul的实施例c制得的助转剂c;按moi=7加入慢病毒,对慢病毒进行转染处理;转染12小时后,按1.0
×
10
6 细胞/ml加入1ml完全培养基,对转染后的t细胞进行培养;培养第3天计数,按0.5
×
10
6 细胞/ml补液,第5天进行流式检测car的阳性率48.23%,如图7所示;然后每2天进行计数补液,培养至第13天,细胞由1.0
×
10
6 细胞/ml扩增到6.7
×
10
8 细胞/ml,扩增倍数达到670倍,如表2和图13所示。
40.实施例12用cd3/cd28beads分选激活磁珠从pbmc中分选出t细胞,取1.0
×
106的t细胞;
用350μl optmizer tcell expansfmcts无血清培养基重悬1.0
×
106个t细胞,同时激活t细胞;t细胞悬液中,加入10.5ul的实施例2制得的助转剂b;按moi=6加入慢病毒,对慢病毒进行转染处;转染8小时后,按1.0
×
10
6 细胞/ml加入完全培养基,对转染后的t细胞进行培养;培养第3天计数,按0.5
×
10
6 细胞/ml补液,第5天进行流式检测car的阳性率67.27%,如图8所示;然后每2天进行计数补液,培养至第13天,细胞由1.0
×
10
6 细胞/ml扩增到7.08
×
10
8 细胞/ml,扩增倍数达到708倍,如表2和图13所示。
41.实施例13用cd3/cd28beads分选激活磁珠从pbmc中分选出t细胞,取1.0
×
106的t细胞;用350μl dmem无血清培养基重悬1.0
×
106个t细胞,同时激活t细胞;t细胞悬液中,加入3.0ul的实施例1制得的助转剂a;按moi=3加入慢病毒,对慢病毒进行转染处;转染6小时后,按1.0
×
10
6 细胞/ml加入1ml完全培养基,对转染后的t细胞进行培养;培养第3天计数,按0.5
×
10
6 细胞/ml补液,第5天进行流式检测car的阳性率54.11%,如图9所示;然后每2天进行计数补液,培养至第13天,细胞由1.0
×
10
6 细胞/ml扩增到6.32
×
10
8 细胞/ml,扩增倍数达到632倍,如表2和图13所示。
42.实施例14用cd3/cd28beads分选激活磁珠从pbmc中分选出t细胞,取1.0
×
106的t细胞;用350μl dmem无血清培养基重悬1.0
×
106个t细胞,同时激活t细胞;t细胞悬液中,加入3.5ul的助转剂polybrene;按moi=6加入慢病毒,对慢病毒进行转染处;转染8小时后,按1.0
×
10
6 细胞/ml加入完全培养基,对转染后的t细胞进行培养;培养第3天计数,按0.5
×
10
6 细胞/ml补液,第5天进行流式检测car的阳性率69.20%,如图10所示;然后每2天进行计数补液,培养至第13天,细胞由1.0
×
10
6 细胞/ml扩增到5.1
×
10
8 细胞/ml,扩增倍数达到510倍,如表2和图13所示实施例15用分选磁珠从pbmc中分选出nk细胞,取1.0
×
106的nk细胞;用350μl dmem无血清培养基重悬1.0
×
106个nk细胞,同时激活nk细胞;往nk细胞悬液中,加入3.5ul的实施例1制得的助转剂a;按moi=10加入慢病毒,进行慢病毒转染处理;转染24小时后,按1.0
×
10
6 细胞/ml加入1ml完全培养基,对转染后的nk细胞进行培养;培养第3天计数,按0.5
×
10
6 细胞/ml补液,第5天进行流式检测car的阳性率30.81%,如图11所示。
43.三、慢病毒转染试验检测1、car-t和car-nk的阳性率检测1.1、上述实施例6、7和8,如图2、3、4及表1所示,实施例8中,单独使用生理盐水培养慢病毒时,慢病毒的转导效率(即car阳性率)为14.97%;实施例7中,采用生理盐水培养慢病毒,同时加入助转剂b后,car阳性率为47.40%;实施例8为现有慢病毒转染流程,其采用生理盐水培养慢病毒,同时加入助转剂polybrene,car阳性率为50.03%。因此,由实施例6、7和8可知,助转剂中的碱性氨基酸可以促进慢病毒的转导,且转导效率与助转剂polybrene的转导率相接近。
44.现阶段普遍使用助转剂polybrene进行慢病毒转染,这是因为:慢病毒转染t细胞的过程中, polybrene所带阳离子聚合物可以中和t细胞中的电子,从而提升了polybrene的慢病毒转导率。
45.表1为实施例6至15中各实施例慢病毒转染的参数及car阳性率注:表1中的助转剂a至e,分别为实施例1至5中各自对应配制的助转剂。
46.1.2、上述实施例9至14中,在慢病毒培养中,分别使用dmem、imem、rpmi-1640、kpm-581、optmizer tcell expansfmcts等无血清培养基中的一种,而慢病毒转染助转剂则分别使用本发明实施例1至5配制的助转剂1至e及现有助转剂polybrene。由图2至10及表1可知:1)、无血清培养基相对于生理盐水而言,有利于慢病毒转导,即car阳性率普遍较高;2)、助转剂a至e在慢病毒转导中,随助转剂加入量增加,car阳性率也增加,也就是慢病毒转导率也在提升;3)、本发明提供的助转剂的转导率可以达到现有助转剂polybrene的转导率。
47.1.3、实施例15采用nt细胞慢病毒转染,相对于实施例6至14采用t细胞慢病毒转染而言,由图11和12及表1可知,nk细胞在本发明提供的助转剂作用下,也具有慢病毒转染效果,只是其转导率相对要低一些,即car的阳性率30.81%。
48.二、转染后的car-t细胞扩增培养图13为实施例11至14中慢病毒转染后,car-t细胞培养过程的扩增曲线图;表2为图13对应细胞生长数量。
49.表2 转染后的car-t细胞生长数量统计表,(
×
106细胞/ml)
从表2和图13中可以看出,转染后的car-t细胞经过静置培养,并在培养时间的对应日进行细胞计数,在培养到第13日,通过car-t细胞的扩增倍数可以看出,本发明的助转剂对细胞的毒性更小,细胞的扩增倍数比加入助转剂polybrene的扩增倍数高。
50.应当理解的是,上述针对本发明较佳实施例的表述较为详细,并不能因此而认为是对本发明专利保护范围的限制,本发明的专利保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1