CRISPR/Cas13a结合杂交链式反应用于流感病毒H1N1可视化检测的方法
本发明属于病毒检验检测,涉及一种crispr/cas13a结合杂交链式反应用于流感病毒h1n1可视化检测的方法。
背景技术:
1、流感病毒是一种包膜、分段、负链、单链rna病毒。大多数温血动物都可以成为流感病毒的宿主,历史上曾引起许多大流行,在世界范围内有相当高的发病率和死亡率。目前,流感病毒包括a、b、c、d型。甲型流感病毒是最严重和最致命的病毒。在一年内,这种病毒传播到214个国家,造成全球超过18000人死亡,并已成为一个主要的国际公共卫生问题。
2、病毒的分离和培养是诊断流感病毒的金标准。但目前由于逆转录酶聚合酶链反应(rt-pcr)的优越的分析性和敏感性,其取代病毒分离培养成为新一代的金标准。同时,几种传统的检测方法被广泛应用于流感病毒的检测,包括elisa和蛋白质鉴定。随着时间的推移,流感病毒的传统检测技术有所改进。然而,该方法也有一些固有的缺点。它的操作很复杂,需要经过专业训练的人员或复杂的实验室仪器。因此,该技术不适用于常规医疗保健和资源贫乏地区。已经发展了许多检测流感病毒的新方法,包括电化学免疫传感器,表面增强拉曼散射成像适应传感器平台,荧光,比色和微流控芯片方法。其中,比色法是一种快速、方便的选择,不需要先进的仪器。
3、有规律间隔短回文重复序列(clustered regularly interspaced shortpalindromic repeats,crispr)是大多数古细菌(约87%)和细菌(约47%)源于防御病毒dna或rna的需要,已经进化出的一个免疫反应系统。完整的crispr基因组中包含一系列crispr阵列、crispr相关(cas)蛋白基因和由不同间隔区隔开的直接重复序列。随着病毒的出现,crispr-cas位点会触发“适应-表达-干扰”的三阶段免疫反应,破坏宿主细胞内的噬菌体入侵。目前crispr/cas9研究得最为清楚,其防御过程主要为三阶段:crispr捕获序列间隔序列、合成成熟的crispr rna、靶标干扰后定向切割。crispr/cas13a(c2c2)是张锋小组在2016年首次描述了一种靶向rna的crispr相关酶,与ii类中的其他cas蛋白相比,cas13a对单链rna(ssrna)具有顺式和反式切割活性,cas13a能够切割和修剪pre-crrna以产生成熟的crrna。crispr/cas系统因识别精确性,高效性和简便性等优点,目前已广泛应用于农业、生物、化学等各种领域。
4、为了进一步提高分析性能,cas13a系统已与多种信号扩增技术相结合,如滚动环扩增(rca)、重组酶聚合酶扩增(rpa)和环介导等温扩增(lamp),其中一些等温核酸扩增技术采用昂贵的酶,有些由于需要逆转录,操作繁琐,杂交链反应(hcr)是由dirks和pierce介导的链置换反应,hcr是一种无酶、熵驱动、等温的自发dna组装过程。一个普通的hcr需要三个成分,包括一个dna启动子和两个dna发夹,特别是两个稳定的dna发夹在溶液中共存,直到一个启动子链被引入后第一个发夹被打开。二级结构的丢失导致了第二个类似的发夹的打开。这个过程是一系列的dna组装事件。最终,hcr形成了一个具有许多重复单元的缺口双螺旋结构。与pcr相比,hcr用于等温核酸扩增,不需要繁琐的温度变化。与rca和lamp相比,hcr不需要酶和复杂的引物设计。
5、辣根过氧化物酶模拟dnazyme(hrp-dnazyme)来结合cas13a和hcr。hrp-dnazyme是生物传感器和生物识别技术中最常用的催化dnazymes之一。单链富含鸟嘌呤的核酸和血红素复合物成分相互作用,催化过氧化氢(h2o2)和2,2‘-叠氮-双(3-乙基-苯并噻唑啉)-6-磺酸(abts2-)之间的氧化还原反应,并伴随颜色变化。这种方法不需要繁琐的仪器和昂贵的改良探针(如荧光团、猝灭剂、亚甲基蓝等)。以实现分析物识别事件的转导到一个光学检测模式。该比色生物传感器放大信号,降低实验条件,以达到视觉检测流感h1n1的目的。我们观察到比色生物传感器在10pm到100nm之间存在良好的线性关系,检测限为0.152pm。由于cas13a具有突出的选择性,因此在扩增反应中可以排除其它靶标外的甲型流感病毒亚型。本文提供的数据表明,这种基于cas13a的比色生物传感器是一种很有前途的生物分析的分析方法。
技术实现思路
1、本发明提供了一种crispr/cas13a结合杂交链式反应用于流感病毒h1n1可视化检测的方法,该方法不需要改变温度环境,快速高效,对病毒的生物学检测具有重要的应用价值。
2、本发明的crispr/cas13a结合杂交链式反应用于流感病毒h1n1可视化检测的方法,步骤如下:
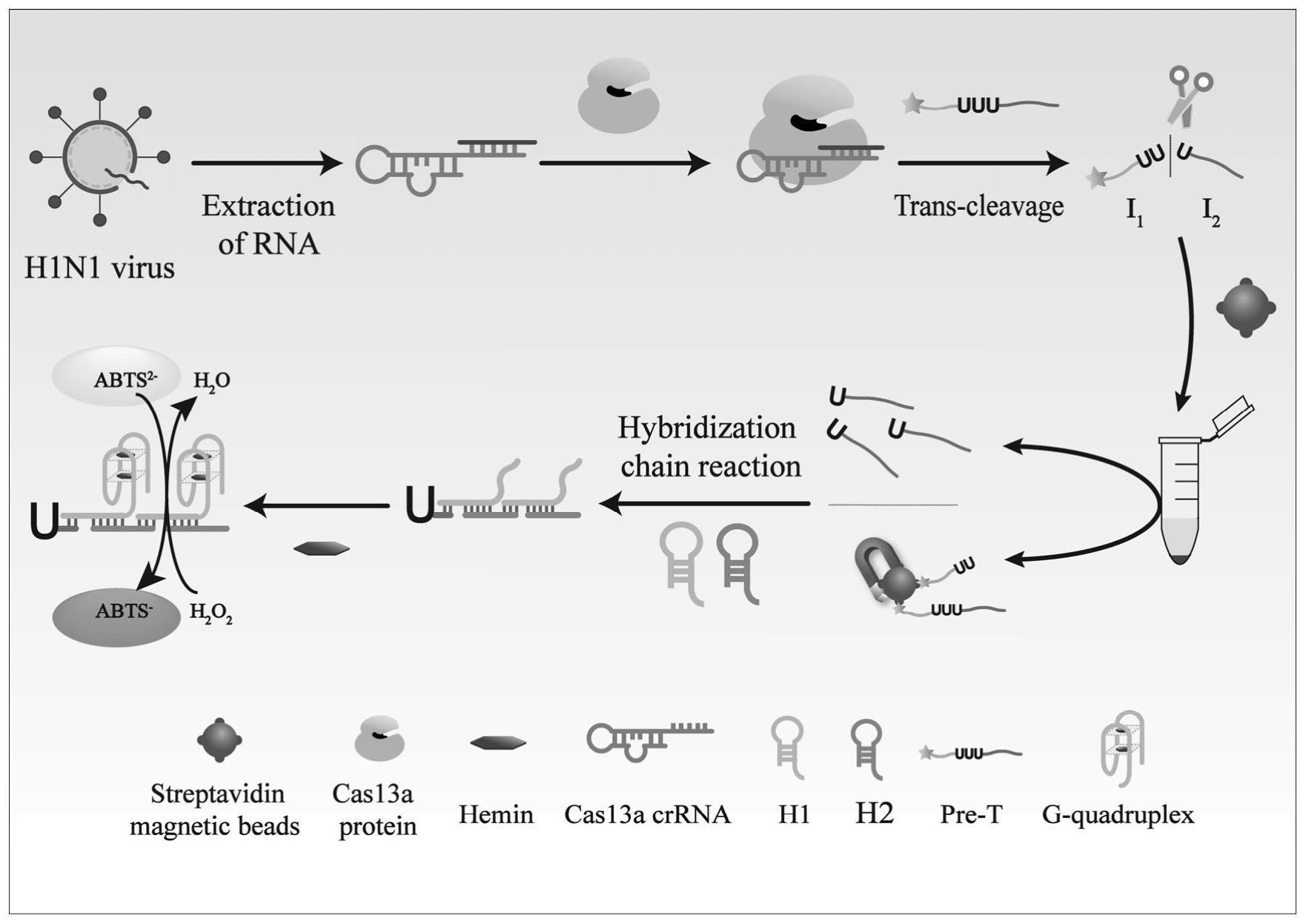
3、通过比色生物传感器识别h1n1,并通过crispr/cas13a蛋白系统保证反应的特异性。从h1n1流感病毒中提取的靶rna进入crispr/cas13a蛋白内部后,通过碱基互补配对与crrna结合。这改变了蛋白质的结构,并激活了crispr/cas13a蛋白的反式切割能力。设计了一个含有三个尿苷单磷酸的dna核苷酸链(探针i)。该探针被设计为cas13a/crrna反式裂解的底物。dna探针i由5′端的i1链、中间的一个特殊的rna序列(-uuu-)和3′端的i2链组成。用生物素修饰i1链,使该链能够启动hcr反应。该特殊的rna序列(-uuu-)被crispr/cas13a系统识别和切割。cas13a被激活并裂解探针i的rna序列,探针i分离成i1和i2链。加入sa-mbs,生物素与sa相互作用。含有生物素的未裂解探针i和i1链被sa-mbs吸附,然后通过磁分离将其从溶液中去除。加入发夹h1和h2后,i2链与h1结合,通过趾点介导的链置换打开h1发夹。i2-h1复合物的杂交打开了h2的发夹结构。打开的h2链与发夹h1链互补,导致h1链的发夹结构打开,从而引发hcr反应。由于h1和h2发夹结构不断地打开和组装,h1的g-四联体片段暴露出来。
4、随后,在血红素的存在下,g-四联体结构折叠,血红素插入到该结构中,形成一个dnazyme。g-四联体dnazyme可以催化abts2-和h2o2之间的氧化还原反应。abts溶液的颜色由浅绿色变成深绿色。由此开始的比色反应,产生肉眼可见的反应溶液的颜色变化,形成超灵敏的h1n1流感病毒视觉检测。
5、进一步特征,分别对crispr/cas13a蛋白浓度、crispr/cas13a酶切温度、crispr/cas13a酶切时间、探针i浓度、hcr反应时间以及hemin浓度进行了优化。
6、进一步特征,crispr/cas13a蛋白浓度:选择0.2、0.4、0.6、0.8及1.0μm的cas13a蛋白,按照具体步骤进行优化。分析如图2-4a,随着cas13a蛋白加入量的增加,比色度变化强度(i/i0)也随之增加,当cas13a蛋白浓度达到0.8μm时,i/i0值的变化强度逐渐趋于稳定。所以选择0.8μm作为最佳crispr/cas13a蛋白浓度加入量,不但能达到最佳实验条件,同时可以降低成本。
7、进一步特征,crispr/cas13a酶切温度:选择25℃、37℃、45℃、55℃及65℃进行优化,如图2-4b可以分析出,随着crispr/cas13a酶切温度的增加i/i0的值是先增加后减小,当酶切温度达到37℃时比色度变化强度的值达到最大,由此可知,crispr/cas13a酶切温度过低或着过高,对比色度变化强度都有影响,都不利于crispr/cas13a蛋白发挥最佳活性。所以选择37℃作为最佳酶切温度。
8、进一步特征,探针i浓度:选择了0.25、0.75、1.25、1.75、2.25及2.75μm作为探针i浓度,分别对应i:h1:h2为0.1(0.3,0.5,0.7,0.9,1.1):2:1.5,按照上述实验步骤进行优化。如图2c可以得出,比色度变化强度随着探针i加入量的不断增加,呈现先增大后减小的趋势,当探针i浓度高于1.25μm后,比色度变化强度的值增加平缓,可忽略不计,从成本上考虑选择1.25μm作为最佳引物探针i加入量。
9、进一步特征,hemin浓度:选择5、10、15、20、25及30μm的hemin浓度,按照具体步骤进行优化。分析如图2d,随着hemin浓度加入量的增加,比色度变化强度也随之增加,当hemin浓度超过10μm达到时15μm,比色度变化强度有很大程度的下降。所以选择10μm作为最佳hemin加入量,此条件下能达到最佳实验结果。
10、进一步特征,crispr/cas13a酶切时间:在酶切时间分别为10、20、30、40、50及60min的情况下,按照上述实验步骤进行优化,分析如图2e可以得出,比色度变化强度随着酶切时间的变化而变化,当酶切时间达到30min时,随着时间的增加,i/i0的值增加平缓且有少许的降低。从时间上考虑选择30min作为最佳酶切时间。
11、进一步特征,hcr反应时间:选择了10、20、30、40及50min作为hcr反应时间,进行实验条件的优化,分析如图2f可以看出,i/i0值随着hcr反应时间的增加而增加,当hcr反应时间达到40min时,i/i0值的增加逐渐趋于平缓。所以选择40min作最佳hcr反应时间。
12、本发明的有益效果是:
13、一种基于crispr/cas13a的h1n1流感病毒无标记等温检测方法,设计一条寡核苷酸探针i链作为cas13a/crrna的反式裂解底物,并作为裂解后的hcr的引物。该方法采用了双信号放大策略,可以大大提高灵敏度。该检测方法对h1n1流感病毒的检测限为0.152pm,在10pm~100nm之间线性度良好。该检测方法也有很好的特异性。其他甲型流感病毒和只有一个碱基差异的高度同源rna探针可以清楚地区分。
- 还没有人留言评论。精彩留言会获得点赞!