一种鲜艳乳菇多糖的提取方法
1.本发明涉及一种鲜艳乳菇多糖的提取方法,属于中药活性成分提取分离技术领域。
背景技术:
2.鲜艳乳菇(lactarius vividus)在分类学隶属于担子菌门(basidiomvcota)、伞菌纲(agaricomycetes)、红菇科(russulaceae)、乳菇属(lactarius),是一种珍贵的野生食用菌,其子实体营养丰富、美味可口、肉质鲜嫩。鲜艳乳菇虽然分布于世界各地,但是产量较低,于每年5-9月野外大量采收,故其自然种群数量下降严重。
3.20世纪60年代,菇类多糖逐渐引起了人们的兴趣,许多研究表明,从蘑菇中提取的多糖及其衍生物具有抗氧化、免疫调节、抗肿瘤、抗胃溃疡、抗高血糖活性等。近年来,用于多糖的提取有多种技术,例如热水提取、碱提取、超声波辅助提取、微波辅助提取、酶辅助提取等等。一些研究已经揭示了不同提取方法对多糖的微观结构有不同的影响,面对上述提取技术,人们往往根据多糖提取的产量做出选择,而忽略了对多糖的结构特征及生物活性的影响。此外,菇类多糖的提取对象多为香菇、金针菇等,关于鲜艳乳菇中多糖的提取缺少相关研究。因此,提出一种从鲜艳乳菇中提取多糖的方法,弥补鲜艳乳菇中多糖的提取工艺的空白,为鲜艳乳菇的进一步开发利用提供科学依据。
技术实现要素:
4.为了解决上述技术问题,本发明提出了一种鲜艳乳菇多糖的提取方法,该方法可以从鲜艳乳菇中经济、高效提取鲜艳乳菇多糖,条件简便、提取率高。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提出了一种鲜艳乳菇多糖的提取方法,包括以下步骤:
7.(1)鲜艳乳菇的预处理:将鲜艳乳菇干燥后,加入石油醚脱脂处理,烘干,粉碎,得到鲜艳乳菇粉末;
8.(2)鲜艳乳菇多糖的提取:将步骤(1)所述的鲜艳乳菇粉末和纤维素酶加入水中,并超声处理,水浴加热,即可得到所述鲜艳乳菇多糖。
9.进一步地,所述鲜艳乳菇粉末的粒径小于65目。
10.进一步地,所述鲜艳乳菇粉末和水的料液比为(20-60)ml/g。
11.进一步地,所述鲜艳乳菇粉末和水的料液比为40ml/g。
12.进一步地,所述纤维素酶的加入量为鲜艳乳菇粉末质量的2.0%-4.0%。
13.进一步地,所述纤维素酶的加入量为鲜艳乳菇粉末质量的3.0%。
14.进一步地,所述超声处理的功率为270w,温度为50-60℃,时间为30-45min。
15.进一步地,所述超声温度为60℃,时间为40min。
16.进一步地,所述水浴加热的温度为95℃,时间为30min。
17.本发明还提出了一种上述提取方法提取的鲜艳乳菇多糖。
18.本发明公开了以下技术效果:
19.本发明通过单因素实验,分别考察了纤维素酶用量、温度、液料比、超声时间对鲜艳乳菇多糖提取率的影响,处理四组单因素数据,可以发现随着纤维素酶用量、温度、液料比、超声时间的增加,鲜艳乳菇多糖的提取率会增加到峰值然后呈现出下降的趋势。
20.本发明的提取方法弥补了鲜艳乳菇这种野生食用菌中多糖提取的空白,并且提取方法简便易行,条件温和,提取过程清洁无污染,且提取率较高,可以达到(9.98
±
0.02)%,适用于工业大量鲜艳乳菇多糖的提取。同时抗氧化实验表明,本发明提取方法提取的鲜艳乳菇多糖具有较好的抗氧化能力,为鲜艳乳菇多糖的开发利用提供理论支持。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
22.图1为纤维素酶用量对鲜艳乳菇多糖提取率的影响图;
23.图2为超声温度对鲜艳乳菇多糖提取率的影响图;
24.图3为料液比对鲜艳乳菇多糖提取率的影响图;
25.图4为超声时间对鲜艳乳菇多糖提取率的影响图;
26.图5为纤维素酶用量-温度交互作用对鲜艳乳菇多糖提取率影响的响应面图;
27.图6为维素酶用量-温度交互作用对鲜艳乳菇多糖提取率影响的等高线图;
28.图7为纤维素酶用量-料液比交互作用对鲜艳乳菇多糖提取率影响的响应面图;
29.图8为维素酶用量-料液比交互作用对鲜艳乳菇多糖提取率影响的等高线图;
30.图9为纤维素酶用量-时间交互作用对鲜艳乳菇多糖提取率影响的响应面图;
31.图10为维素酶用量-时间交互作用对鲜艳乳菇多糖提取率影响的等高线图;
32.图11为温度-料液比交互作用对鲜艳乳菇多糖提取率影响的响应面图;
33.图12为温度-料液比交互作用对鲜艳乳菇多糖提取率影响的等高线图;
34.图13为温度-时间交互作用对鲜艳乳菇多糖提取率影响的响应面图;
35.图14为温度-时间交互作用对鲜艳乳菇多糖提取率影响的等高线图;
36.图15为料液比-时间交互作用对鲜艳乳菇多糖提取率影响的响应面图;
37.图16为料液比-时间交互作用对鲜艳乳菇多糖提取率影响的等高线图;
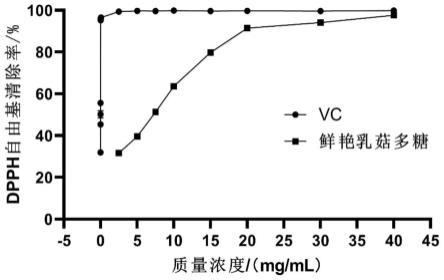
38.图17为不同浓度的鲜艳乳菇多糖溶液和维生素c对dpph自由基的清除率对比图;
39.图18为不同浓度的鲜艳乳菇多糖溶液和维生素c对abts自由基的清除率对比图。
具体实施方式
40.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
41.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中
间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
42.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
43.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
44.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
45.本发明所用设备有:mbf20ax型粉碎机(温岭市迈邦机械设备有限公司);quintix124-1cn型分析天平;kq-250de型数控超声波清洗器;zncl-g-c 190*90型水浴锅(上海凌科实业发展有限公司);synergy ht多功能酶标仪。
46.本发明所用鲜艳乳菇于2021年11月份采购于中国湖北省十堰市。所用纤维素酶(酶活≥20u/mg,批号:03280609)、1,1-二苯基-2-苦肼基自由基(dpph,批号:20200416)、abts(批号:20200624)和维生素c均采购于上海宝曼生物科技有限公司。所用葡萄糖对照品(hplc≥98%,批号:wkq21011805)购买自四川省维克奇生物科技有限公司;所用试剂均为分析纯。
47.以下通过实施例对本发明的技术方案做进一步说明。
48.实施例1
49.一种鲜艳乳菇多糖的提取方法,包括以下步骤:
50.(1)鲜艳乳菇的预处理:将鲜艳乳菇在烘箱中50℃下干燥,加入10倍量石油醚脱脂处理,烘干,粉碎,过3号筛(65目),得到鲜艳乳菇粉末,储存于干燥室温环境中备用;
51.(2)鲜艳乳菇多糖的提取:称取0.5g步骤(1)制备的鲜艳乳菇粉末置于50ml锥形瓶中,并加入鲜艳乳菇粉末质量3.0%的纤维素酶和超纯水,超纯水做溶剂,料液比为40ml/g,之后在超声功率270w、超声温度60℃下超声处理40min,利用纤维素酶协同超声波处理提取多糖,之后在95℃下水浴加热30min,并用sevag法除蛋白,即可得到鲜艳乳菇多糖。
52.一、单因素实验
53.鲜艳乳菇多糖提取率的测定
54.采用苯酚-硫酸法测定鲜艳乳菇多糖的提取率。精密称取葡萄糖对照品11.00mg,用超纯水溶解,于100ml容量瓶中定容,得到质量浓度为0.11mg/ml的葡萄糖对照品溶液。取对照品溶液0,0.02,0.04,0.08,0.12,0.16,0.20,0.24,0.28ml于试管中,补加超纯水至体积为0.40ml,加0.20ml的5%苯酚溶液,摇匀,沿着试管壁缓慢滴加1.00ml浓硫酸,摇匀,在沸水浴中加热15min,冷却至室温,使用酶标仪在490nm处测定吸光度,以超纯水作为空白对照校正零点,以葡萄糖质量浓度(c,mg/ml)和吸光度关系(a)作线性回归,得回归方程a=1.1543c+0.0151,相关系数r2=0.9991。
55.多糖提取率(mg/g)=(c
×v×
d)/(m
×
1000)
56.式中:c为供试品溶液中多糖的质量浓度,mg/ml;v为定容体积,ml;d为稀释倍数;m为鲜艳乳菇干粉的质量,g。
57.1.纤维素酶用量对鲜艳乳菇多糖提取率的影响
58.设置实施例2-5,同实施例1,区别仅在于,分别将纤维素酶用量更改为1.0%,2.0%,4.0%,5.0%,并对实施例1-5的鲜艳乳菇多糖提取率进行测定,结果见图1。
59.由图1可知,当纤维素酶用量为3.0%时,鲜艳乳菇多糖提取率达到最大值8.42%。随着纤维素酶用量的增加,酶与鲜艳乳菇粉末的接触,促进鲜艳乳菇粉末细胞壁破损,多糖溶出量增加;但纤维素酶用量过大时,鲜艳乳菇粉末被酶包裹,无法充分被提取,造成多糖提取率下降。因此,纤维素酶用量以3.0%左右为宜。
60.2.超声温度对鲜艳乳菇多糖提取率的影响
61.设置实施例6-9,同实施例1,区别仅在于,分别将超声温度更改为40℃,50℃,60℃,80℃,并对实施例1以及实施例6-9的鲜艳乳菇多糖提取率进行测定,结果见图2。
62.由图2可知,超声温度为60℃时,多糖提取率达到最大值8.45%。当温度升高到一定值时,纤维素酶的活性达到最大,温度继续升高,酶变性失去活性,造成多糖提取率下降。因此,超声温度以60℃左右为宜。
63.3.料液比对鲜艳乳菇多糖提取率的影响
64.设置实施例10-14,同实施例1,区别仅在于,分别将料液比更改为10ml/g,20ml/g,30ml/g,50ml/g,60ml/g,并对实施例1以及实施例10-14的鲜艳乳菇多糖提取率进行测定,结果见图3。
65.由图3可知,当液料比为40ml/g时,鲜艳乳菇多糖提取率达到最大值8.42%。当液料比太小时,鲜艳乳菇粉末在液体中流动性差,无法与酶完全反应;液料比太大时,粉末和酶浓度被稀释,造成多糖提取率下降。因此,液料比以40ml/g左右为宜。
66.4.超声时间对鲜艳乳菇多糖提取率的影响
67.设置实施例15-19,同实施例1,区别仅在于,分别将超声时间更改为25min,30min,35min,45min,50min,并对实施例1以及实施例15-19的鲜艳乳菇多糖提取率进行测定,结果见图4。
68.由图4可知,超声时间为40min时,多糖提取率达到最大值8.42%。超声40min时,多糖溶出率已达到最高值,随着时间的增加,溶出的部分小分子量的多糖会附着在蛋白上,造成多糖提取率下降。因此,超声时间以40min左右为宜。
69.二、响应面优化试验
70.为了确定提取鲜艳乳菇多糖的最佳工艺条件,在单因素试验的基础上,选取纤维素酶用量(a)、超声温度(b)、液料比(c)、超声时间(d)为自变量,以鲜艳乳菇多糖提取量(y)为响应值,采用4因素3水平的box-behnken响应面法,优化提取鲜艳乳菇多糖的最佳工艺参数。因素及水平见表1。
71.表1响应面试验因素与水平编码
[0072][0073]
(1)响应面试验设计及结果
[0074]
根据design-expert 8.0.6软件中的box-benhnken的中心组合试验设计原理,进行响应面试验,结果见表2。
[0075]
表2 box-behnken试验设计及结果
[0076]
[0077][0078]
(2)回归模型显著性检验及方差分析
[0079]
通过design-expert 8.0.6软件对表2中试验数据进行回归分析。得到鲜艳乳菇多糖提取量对编码自变量a(纤维素酶用量)、b(温度)、c(液料比)、d(超声时间)的回归方程:
[0080]
y=9.96+0.21a-0.47b+0.31c+0.16d+0.33ab+0.26ac+0.68ad+0.12bc-0.32bd+0.22cd-1.02a
2-0.93b
2-0.81c
2-0.72d2[0081]
说明考察的4个单因素对响应值的影响不是简单的线性关系。回归方程显著性检验及方差分析,结果见表3。
[0082]
表3回归模型显著性检验及方差分析
[0083][0084]
注:表中*p《0.05为显著,**p《0.01为极显著。
[0085]
由表3可知,该模型回归方程f=36.45,p《0.0001,此模型达到极显著。此模型失拟项p=0.0876》0.05,表现为不显著,说明该模型拟合度较好,故可用于设计试验范围内的预测。由表3可知,纤维素酶用量(a)、温度(b)、液料比(c)、纤维素酶用量与温度的交互项(ab)、纤维素酶用量与超声时间的交互项(ad)、温度与超声时间的交互项(bd)、纤维素酶用量的二次项(a2)、温度的二次项(b2)、液料比的二次项(c2)、超声时间的二次项(d2)对鲜艳乳菇多糖提取量的影响极显著(p《0.01),超声时间(d)、纤维素酶用量与液料比的交互项(ac)、液料比与超声时间(cd)对鲜艳乳菇多糖提取量的影响显著(p《0.05),说明上述因素对鲜艳乳菇多糖提取量影响大,改变这些因素的水平会对响应值产生极显著的影响。
[0086]
(3)因素交互作用响应面分析
[0087]
根据上述多元二次回归方程做出的响应曲面图和等高线图,根据图5-16的拟合响应曲面图的曲面形状分析纤维素酶用量、温度、液料比、超声时间这四个因素对鲜艳乳菇多糖提取率的影响。响应面的曲面越陡峭,说明此因素对其响应值的影响越大。响应面法的等高线图越接近圆形,两因素间的交互作用越弱;反之等高线呈椭圆,则表明两因素间的交互作用越强。
[0088]
图5为纤维素酶用量-温度交互作用对鲜艳乳菇多糖提取率影响的响应面图,图6为维素酶用量-温度交互作用对鲜艳乳菇多糖提取率影响的等高线图。图7为纤维素酶用量-料液比交互作用对鲜艳乳菇多糖提取率影响的响应面图,图8为维素酶用量-料液比交互作用对鲜艳乳菇多糖提取率影响的等高线图。图9为纤维素酶用量-时间交互作用对鲜艳乳菇多糖提取率影响的响应面图,图10为维素酶用量-时间交互作用对鲜艳乳菇多糖提取
率影响的等高线图。图11为温度-料液比交互作用对鲜艳乳菇多糖提取率影响的响应面图,图12为温度-料液比交互作用对鲜艳乳菇多糖提取率影响的等高线图。图13为温度-时间交互作用对鲜艳乳菇多糖提取率影响的响应面图,图14为温度-时间交互作用对鲜艳乳菇多糖提取率影响的等高线图。图15为料液比-时间交互作用对鲜艳乳菇多糖提取率影响的响应面图,图16为料液比-时间交互作用对鲜艳乳菇多糖提取率影响的等高线图。响应面的曲面越陡峭,说明此因素对其响应值的影响越大。响应面法的等高线图越接近圆形,两因素间的交互作用越弱;反之等高线呈椭圆,则表明两因素间的交互作用越强。由图5-16可以看出,ad交互曲面最为陡峭,说明当说明温度和液料比固定在0水平时,纤维素酶用量与提取时间对鲜艳乳菇多糖提取率的影响最为显著。bd交互曲面的陡峭程度仅次于ad,说明提取温度和时间对鲜艳乳菇多糖提取率的影响次之。同理,得出的交互因素影响鲜艳乳菇多糖提取率的显著程度与方差分析一致。(4)最佳工艺及验证性试验
[0089]
根据所得模型,利用design expert 8.0软件对纤维素酶用量、温度、液料比、时间四个因素进行分析,可预测鲜艳乳菇多糖的最佳提取条件为:纤维素酶用量3.20%、超声温度57.47℃、液料比42.46ml/g、超声时间42.97min,多糖提取率的理论预测值为10.098%。考虑实际操作,将最佳提取条件调整为:纤维素酶用量3.20%、超声温度57℃、液料比42ml/g、超声时间43min。对其进行3次平行试验,得到鲜艳乳菇多糖提取率平均值为(9.98
±
0.02)%,理论值与实际值的相对标准偏差为1.39%。
[0090]
在单因素试验的基础上,利用响应面法建立了优化纤维素酶协同超声辅助提取鲜艳乳菇多糖工艺条件的二次回归方程模型,软件数据表明该模型可靠。优化出的最佳工艺条件为:纤维素酶用量3.20%、超声温度57℃、液料比42ml/g、提取时间43min。此条件下,鲜艳乳菇多糖提取率为(9.98
±
0.02)%,与预测值(10.098%)接近。本试验优化的鲜艳乳菇多糖提取工艺,其提取率高、提取时间短、提取温度低,可作为一种有效提取鲜艳乳菇多糖的方法。
[0091]
三、鲜艳乳菇多糖对dpph自由基的清除能力的测定
[0092]
dpph是一种很稳定的氮中心的自由基。精密称取abts粉末0.0384g,用超纯水定容至10.0ml;精密称取过硫酸钾粉末0.0134g,用超纯水定容至10.0ml。将上述溶液一起转入到25ml的棕色容量瓶中,避光和室温下放置14-16h,即得abts原溶液。取上述abts原溶液1.0ml,无水乙醇稀释20倍,即得abts溶液。将实施例1提取的鲜艳乳菇多糖配制成2.5,5.0,7.5,10.0,15.0,20.0,30.0,40.0mg/ml共8种质量浓度。鲜艳乳菇样品溶液取3.0ml,空白组取3.0ml的无水乙醇,分别加入abts溶液3.0ml,混合均匀,避光条件下静置15min。在最大吸收波长734nm处测量吸光度,并记录其吸光值(a,a0)。取鲜艳乳菇样品溶液3.0ml,加入无水乙醇溶液3.0ml,混合均匀,避光条件下静置15min,在734nm处测量不同浓度的鲜艳乳菇样品溶液的吸光度,并记录其吸光值(ab)。同时,用维生素c作对照,分析抗氧化活性。清除率的计算公式为:
[0093]
清除率(%)=(1-(a-ab)/a0)
×
100%
[0094]
不同浓度的鲜艳乳菇多糖溶液和维生素c对dpph自由基的清除率对比见图17。由图17可知,当鲜艳乳菇多糖溶液的浓度从2.5mg/ml增加到40mg/ml时,dpph自由基的清除率从28.6%增加到97.94%;当维生素c的浓度从0.0015mg/ml增加到40mg/ml时,dpph的清除率从31.58%增加到99.85%。鲜艳乳菇多糖对dpph自由基的ic
50
值为5.845mg/ml。可知,鲜
艳乳菇多糖对dpph自由基的清除能力稍弱于维生素c对dpph自由基的能力。
[0095]
四、鲜艳乳菇多糖对abts自由基的清除能力的测定
[0096]
abts是一种具有稳定的氮中心的水溶性自由基。精密称取abts粉末0.0384g,用超纯水定容至10.0ml;精密称取过硫酸钾粉末0.0134g,用超纯水定容至10.0ml。将上述溶液一起转入到25ml的棕色容量瓶中,避光和室温下放置14-16h,即得abts原溶液。取上述abts原溶液1.0ml,无水乙醇稀释20倍,即得abts溶液。将实施例1提取的鲜艳乳菇多糖配制成2.5,5.0,7.5,10.0,15.0,20.0,30.0,40.0mg/ml共8种质量浓度。鲜艳乳菇样品溶液取3.0ml,空白组取3.0ml的无水乙醇,分别加入abts溶液3.0ml,混合均匀,避光条件下静置15min。在最大吸收波长734nm处测量吸光度,并记录其吸光值(a,a0)。取鲜艳乳菇样品溶液3.0ml,加入无水乙醇溶液3.0ml,混合均匀,避光条件下静置15min,在734nm处测量不同浓度的鲜艳乳菇样品溶液的吸光度,并记录其吸光值(ab)。同时,用维生素c作对照,分析抗氧化活性。清除率的计算公式为:
[0097]
清除率(%)=(1-(a-ab)/a0)
×
100%
[0098]
不同浓度的鲜艳乳菇多糖溶液和维生素c对abts自由基的清除率对比见图18。由图18可知,当鲜艳乳菇多糖溶液的浓度从2.5mg/ml增加到40mg/ml时,abts自由基的清除率从3.12%增加到99.63%;当维生素c的浓度从0.0015mg/ml增加到40mg/ml时,abts的清除率从11.04%增加到99.84%。鲜艳乳菇多糖对abts自由基的ic
50
值为8.773mg/ml。可知,鲜艳乳菇多糖对abts自由基的清除能力稍弱于维生素c对abts自由基的能力。
[0099]
由上述对鲜艳乳菇多糖进行抗氧化试验,鲜艳乳菇多糖对dpph自由基的ic
50
值为5.845mg/ml,对abts自由基的ic
50
值为8.773mg/ml。结果表明其对dpph和abts自由基有较强的清除能力,随多糖浓度的增加而逐渐增强。
[0100]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1