普雷沃氏菌内消旋—二氨基庚二酸脱氢酶突变体及其应用
普雷沃氏菌内消旋
—
二氨基庚二酸脱氢酶突变体及其应用
技术领域
1.本发明涉及一种普雷沃氏菌内消旋—二氨基庚二酸脱氢酶突变体及其应用,属于生物工程技术领域。
背景技术:
2.d-对羟基苯甘氨酸(d-p-hydroxyphenylglycine,d-hpg),又名4-羟基苯甘氨酸,是一种具有手性中心的非天然氨基酸。d-hpg是氨基酸生物合成的重要中间体,被广泛用于合成肽类激素和农药。特别是作为医药中间体,广泛用于制备β-内酰胺类抗生素,如阿莫西林、氨羟苄头孢菌素和头孢哌酮等。该类抗生素对革兰氏阳性菌、革兰氏阴性菌、致病螺旋体等均有良好的杀灭作用,并且具有副作用小、口服效果佳等优点。在临床上,β-内酰胺类抗生素可用于治疗敏感菌引起的肺炎、菌血症、尿道炎等器官软组织感染。
3.目前,d-hpg的主要生产方法为化学合成法和海因酶转化法,其中化学合成法主要为不对称转化法和化学拆分法,但是这些方法在不同程度上都存在反应条件苛刻、环境污染大、生产效率低以及生产成本高的问题;并且会对环境产生毒害作用,不符合绿色生产、安全生产和可持续发展的要求。目前酶转化法主要是海因酶法,由于酶催化剂具有特异性高、种类多样以及绿色环保的特点,酶转化法成为合成d-hpg的重要技术手段;因此,越来越多的研究人员寻求利用酶转化法来合成d-hpg。其中通过酮酸一步还原胺化制备手性d-对羟基苯甘氨酸具有生产工艺条件温和、高效、环保等特点,可以减轻环境和资源压力,因此迫切需要一种高效制备d-对羟基苯甘氨酸的生物法。
4.酮酸的一步还原胺化法生产d-对羟基苯甘氨酸涉及到一个关键的酶内消旋二氨基庚二酸脱氢酶(meso-dapdh,meso-diaminopimelate dehydrogenase,ec 1.4.1.16),它具有较宽泛的底物谱,能够催化脂肪族酮酸和部分芳香族酮酸的还原胺化,使得在酮酸的α-羰基还原胺化,形成对应的d-氨基酸。
5.此外,多酶级联反应也是酶生物转化中的重要手段,具有许多优点。例如,它可以避开反应中间体的积累,利用廉价易得的原料作为反应的起始底物,并且多酶反应间的协同性可以通过调控酶之间的表达比例得以调节,从而解决了底物酮酸的昂贵或者不易获得的问题。常用的级联路径是将内消旋-二氨基庚二酸脱氢酶(dapdh)、l-氨基酸氧化酶和葡萄糖脱氢酶偶联,l-氨基酸氧化酶可以利用l-对羟基苯甘氨酸为底物,催化l-对羟基苯甘氨酸脱氨生成酮酸,再进一步经过dapdh的还原胺化作用最终生成d-对羟基苯甘氨酸,同时通过引入辅酶再生系统实现还原型辅酶nadph的再生。
6.近几十年来,蛋白质工程已经成为在分子水平改善酶的性质的有效策略,如扩大底物范围、提高酶的活性和改善酶的稳定性的最有效的方法。因此,通过蛋白质工程设计ptdapdh,可能解决其催化活性低的问题。蛋白质工程改造主要可以分四类:传统的定向进化(即非理性设计)、半理性设计、理性设计(基于结构与计算机技术)和多种策略的组合应用。目前,关于利用蛋白质工程改造ptdapdh已经取得了一定的研究进展,然而,催化活性的改善效果仍然有限,远不能满足实际的工业化需求。
技术实现要素:
7.为解决上述技术问题,本发明提供了一种可以高效制备d-对羟基苯甘氨酸的ptdapdh突变体及其改造方法,并利用该突变体蛋白催化对羟基苯乙醛酸制备d-对羟基苯甘氨酸,以及进一步将得到的突变体与l-氨基酸氧化酶和葡萄糖脱氢酶偶联,以廉价底物l-对羟基苯甘氨酸制备d-对羟基苯甘氨酸。本发明所构建的菌株在d-对羟基苯甘氨酸制备中具有高生产强度,高催化稳定性,减少了转化中的投菌量,极大节约了工业化的生产成本。
8.本发明的第一个目的是提供一种普雷沃氏菌内消旋—二氨基庚二酸脱氢酶(ptdapdh)突变体,所述突变体是将氨基酸序列如seq id no.1所示的内消旋-二氨基庚二酸脱氢酶ptdapdh亲本的第13位、第90位、第254位的氨基酸中的一个或多个进行突变。
9.进一步地,所述的内消旋-二氨基庚二酸脱氢酶ptdapdh亲本的核苷酸序列如seq id no.2所示。
10.进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的内消旋-二氨基庚二酸脱氢酶ptdapdh亲本的第13位天冬酰胺突变为谷氨酸,突变体命名为n13e。
11.进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的内消旋-二氨基庚二酸脱氢酶ptdapdh亲本的第90位丝氨酸突变为精氨酸,突变体命名为s90r。
12.进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的内消旋-二氨基庚二酸脱氢酶ptdapdh亲本的第254位脯氨酸突变为丙氨酸,突变体命名为p254a。
13.进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的内消旋-二氨基庚二酸脱氢酶ptdapdh亲本的第13位天冬酰胺突变为谷氨酸,并将第90位丝氨酸突变为精氨酸,突变体命名为n13e/s90r。
14.进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的内消旋-二氨基庚二酸脱氢酶ptdapdh亲本的第13位天冬酰胺突变为谷氨酸、第90位丝氨酸突变为精氨酸,及第254位脯氨酸突变为丙氨酸,突变体命名为n13e/s90r/p254a。
15.本发明的第二个目的是提供一种编码所述的普雷沃氏菌内消旋—二氨基庚二酸脱氢酶(ptdapdh)突变体的基因。
16.本发明的第三个目的是提供一种包含所述的基因的表达载体。
17.进一步地,所述的表达载体以prsfduet为载体。
18.进一步地,所述的表达载体上还包含pmlaad编码基因和bmgdh编码基因。
19.进一步地,所述的pmlaad编码基因的核苷酸序列如seq id no.3所示。
20.进一步地,所述的bmgdh编码基因的核苷酸序列如seq id no.4所示。
21.本发明的第四个目的是提供一种表达所述载体的重组菌。
22.进一步地,所述的重组菌是以大肠杆菌为宿主。
23.进一步地,所述的重组菌是以大肠杆菌bl21(de3)为宿主。
24.本发明的第五个目的是提供所述的重组菌在制备d-对羟基苯甘氨酸中的应用。
25.进一步地,所述的应用是以l-对羟基苯甘氨酸为反应底物,以所述的重组菌细胞为催化剂催化生产d-对羟基苯甘氨酸。
26.进一步地,在催化反应中,反应条件为在ph8.0~8.5、30~37℃条件下反应12~24h。
27.进一步地,在催化反应中,重组菌细胞的添加量为终浓度10~60g/l。进一步优选为10~30g/l。
28.本发明的有益效果是:
29.本发明构建了一种普雷沃氏菌内消旋—二氨基庚二酸脱氢酶ptdapdh的突变体,用于催化生产d-对羟基苯甘氨酸。本发明突变体的催化半衰期和d-对羟基苯甘氨酸产量分别为野生型的1.10倍和2.67倍,提高了单位催化剂的生产能力,有效降低了生产成本,并且反应中仅以水为催化介质,具有反应条件温和、操作简便、收率高等优点。本发明得到的突变体在0.5l摇瓶中以l-对羟基苯甘氨酸为底物时,d-对羟基苯甘氨酸的产量可达3.2g/l,转化率为32%,加快了酶转化法生产d-对羟基苯甘氨酸的工业化进程。
附图说明
30.图1为三酶重组载体的连接方式。
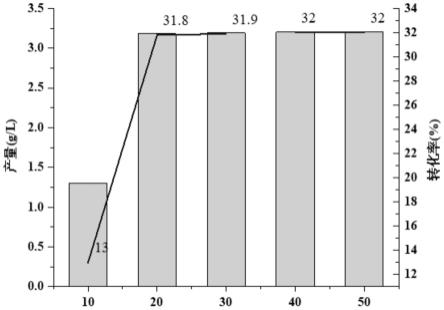
31.图2为全细胞催化浓度和d-对羟基苯甘氨酸生产量的关系。
具体实施方式
32.下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
33.基因来源:本专利所涉及到的生物酶ptdapdh基因来源于prevotella timonensis,prsfduet质粒购自novagen(madison,wi,u.s.a.),限制性内切酶、t4 dna连接酶、primestar等购自takara(dalian,china)。benzeneacetic acid和标样购自sigma。ptdapdh突变体均为分子改造所得,其余试剂均为市场购买所得。
34.配制lb培养基:蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l,在121℃灭菌20min。
35.配置发酵培养基:胰蛋白胨12g/l,酵母提取物(安琪酵母粉802)24g/l,甘油4ml/l,kh2po
4 2.31g/l和k2hpo
4 12.31g/l。
36.hplc法测定d-对羟基苯甘氨酸:具体步骤参见文献:宋慧敏,屠春燕,欧阳平凯.高效液相色谱法测定d-对羟基苯甘氨酸[j].南京工业大学学报(自然科学版),2002(04):97-99。
[0037]
比酶活测定方法:采用吸光值法测dapdh的酶活。1个单位的dapdh酶活被定义为氧化1μmol nadph所需的酶量(u)。通过测定nadph消耗量即可计算酶活力。
[0038]
比酶活定义为每毫克蛋白质所含的酶活力单位数(u/mg蛋白)。
[0039][0040]
下面结合实施例,进一步阐述本发明:
[0041]
实施例1:单突突变体的构建和筛选
[0042]
(1)单突突变体构建:设计ptdapdh
n13e
、ptdapdh
s90r
和ptdapdh
p254a
突变位点的引物,如表1所示,通过全质粒pcr进行突变体构建。
[0043]
表1单突变体突变引物序列
[0044][0045]
构建反应pcr扩增体系:primstar酶0.5μl、5
×
primestar buffer 10μl、dntp 4μl每个突变位点的两条引物各1μl、,模板(ptdapdh
wt
)4μl、水32.5μl;反应条件为:
①
94℃3min;
②
98℃10s;
③
55℃30s;
④
72℃3min;
⑤
将
②
~
④
三个步骤循环29次;
⑥
72℃5min;
⑦
12℃保温。
[0046]
将上述反应体系在37℃孵育3h以消化质粒模板(消化体系为:dpni 0.5μl、上述反应pcr产物45μl、10
×
t buffer 5μl),消化结束后得到的消化产物通过化学转化方法导入大肠杆菌bl21感受态细胞,化学转化法具体步骤:
[0047]
(1)将10μl同源重组产物导入100μl bl21感受态细胞;
[0048]
(2)冰浴15-30min;
[0049]
(3)42℃水浴热激90s,取出后迅速放入冰中静置冰浴3-5min;
[0050]
(4)加入800μl无抗性lb培养基混匀,于37℃,200rpm培养1h;
[0051]
(5)5000rpm离心2min收菌;
[0052]
(6)移去上清,剩余100-200μl吹吸混匀涂布至含0.05mg/ml卡那霉素抗性平板上,37℃恒温培养12h左右。
[0053]
(7)挑取单克隆于含0.05mg/ml卡那霉素抗性lb中,200rpm、37℃恒温培养12h后,送去公司测序,测序正确的即为阳性转化子。
[0054]
实施例2:双突和三突突变体的构建和筛选
[0055]
(1)双突突变体构建:在突变体ptdapdh
n13
的基础上,利用突变引物s90r-s和s90r-a(表1),通过全质粒pcr进行双突突变体构建,具体实施方式参见实施例2中步骤(1),制备得到双突突变体ptdapdh
n13e/s90r
。
[0056]
(2)三突突变体的构建:在突变体ptdapdh
n13e/s90r
的基础上,利用突变引物p254a-s和p254a-a(表1),通过全质粒pcr进行三突变体的构建,具体实施方式参见实施例1,制备得到三突突变体ptdapdh
n13e/s90r/p254a
。
[0057]
(3)多突变体的筛选:将测序正确的的突变体菌株接种至lb种子培养基,200rpm、37℃培养培养10h左右,分别以5%接种量接种至摇瓶发酵培养基,在200rpm、37℃培养至od
600
=0.8左右,加入终浓度为5g/l的乳糖诱导,诱导条件为200rpm、25℃诱导16h。将诱导表达后的菌液。
[0058]
转化条件为:转化温度37℃,反应ph为8.5,转化时间为24h,转速为550rpm。
[0059]
将转化结束后的转化液用hplc方法进行测定d-对羟基苯甘氨酸的产量,结果如表
2所示,最终三突变体ptdapdh
n13e/s90r/254a
效果最好。
[0060]
表2不同突变体摇瓶筛选结果
[0061][0062]
实施例3:突变体酶的表达纯化方法
[0063]
将实施例2制备得到的突变体重组菌株阳性转化子接种至lb培养基,37℃培养至od
600
为0.6~1.0时加入终浓度5g/l乳糖诱导酶的表达,诱导温度为25℃,诱导时间16h,得到发酵液。发酵液于4℃、6000rpm离心10min,取菌体。加入10ml结合液a(20mm磷酸钠、0.5mm nacl、20mm咪唑、1%甘油,用hcl调ph至8.5)充分重悬菌体,然后将离心管置于冰浴中,放入超声波细胞破碎仪中,超声破碎的条件为:工作时间4s,间隔时间4s,共计10min。将获得的破碎液进行低温高速离心,4℃、8000rpm离心30min,得粗酶液。用0.22μm微孔滤膜过滤,备用。
[0064]
准备镍离子亲和层析柱,首先,在4℃环境下利用恒流泵,向柱子里泵入超纯水冲洗柱子(约6~12倍柱体积),然后用10ml结合液a平衡柱子环境。待柱子下端的流出液与泵入柱子的低盐浓度缓冲液ph值一致时(约需5倍柱体积缓冲液),将得到的过膜粗酶液加入到柱子中。先用结合液a冲洗杂蛋白至基线平衡,再用洗脱液b(20mm磷酸钠、0.5mm nacl、250mm咪唑)洗脱。收集吸收峰的洗脱液,测定酶活,获得达到电泳纯的目的蛋白。
[0065]
实施例4:亲本酶和突变体的动力学参数测定
[0066]
为了对突变体进行评价,本发明测定了突变亲本t0及突变体t1至t5在37℃下的动力学参数。
[0067]kcat
/km通过在37℃条件下测定不同浓度的l-对羟基苯甘氨酸所产生的d-对羟基苯甘氨酸的初始利率计算。通过转化过程中的残留酶活实验测定亲本酶和突变体的催化半衰期(在全细胞体系中进行)。分别将ptdapdh亲本酶菌株和突变体菌株各以20g/l终浓度的湿细胞加入反应液中。以l-对羟基苯甘氨酸为底物,在整个转化过程中每隔1h测定它们的残留酶活(反应0h时的初始酶活设为100%),共测定12h。
[0068]
如表3所示,所有的突变体与q0相比,催化半衰期均变长,其中t5为10.1h,比q0的4.8h变长了110%。与之一致的是各突变体的总转化数(ttn)与t0相比均得到提高。t5的ttn是29200为t0的11200的2.59倍。
[0069]
表3ptdapdh亲本酶及其突变体的动力学参数
[0070][0071]
实施例5:构建ptdapdh、eclaad和bsgdh共表达菌株
[0072]
将ptdapdh
n13e/s90r/p254a
突变体基因以及核苷酸序列如seq id no.3所示的pmlaad基因和seq id no.4所示的bmgdh基因按顺序串联于prsfduet载体(图1)从而得到共表达载体。采用片段和载体双酶切连接的方式,将ptdapdh
n13e/s90r/p254a
突变体基因连接至prsfduet载体,最后将pmlaad基因和bmgdh基因连接至prsfduet载体。具体引物如表4所示,下划线处为酶切位点。
[0073]
表4引物序列
[0074][0075]
将重组质粒导入大肠杆菌bl21(de3)感受态细胞,具体转化步骤参见实施例1用化学转化法导入大肠杆菌bl21感受态细胞,最终构建成bl21-laad-dapdh-gdh菌株(突变体t5菌株)。
[0076]
实施例6:0.5l摇瓶水平优化l-对羟基苯甘氨酸生产d-对羟基苯甘氨酸
[0077]
将平板上测序正确的突变体t5菌株接种至含0.05mg/ml卡那霉素抗性lb中,200rpm、37℃培养10-12h,以体积比5%的接种量接种至tb培养基中,200rpm、37℃培养至od
600
为3时加入5g/l终浓度乳糖诱导,诱导温度为25℃,诱导时间14h后以6,000
×
g离心8min收集细胞,37℃放置16h后用于转化。
[0078]
(1)不同全细胞催化剂浓度对d-对羟基苯甘氨酸浓度的影响
[0079]
在摇瓶中配制转化反应体系:20g/l的l-对羟基苯甘氨酸,用naoh调至ph为8.5,装液量为0.1l,向反应体系中分别添加1g、2g、3g、4g、5g突变体湿菌体细胞(即为全细胞催化
剂),使得全细胞催化剂的浓度分别为10g/l、20g/l、30g/l、40g/l、50g/l。
[0080]
在37℃、550rpm条件下进行转化反应,在反应过程添加l-对羟基苯甘氨酸固体粉末使转化液中以维持ph在8.5左右,粉末补加时间从转化开始后持续11h后,再进行1h转化,此期间停止补加粉末,用氢氧化钠调节ph为8.5,转化反应后总体积为0.1l。
[0081]
转化反应结束后取部分转化液12,000
×
g离心15min,上清液用0.22μm的微滤膜过滤后进行hplc分析。结果如图2所示,当催化剂的浓度从10g/l提高至50g/l,d-对羟基苯甘氨酸的浓度从1.3g/l提高至3.2g/l。且在20g/l的全细胞催化剂浓度条件下,提高全细胞催化剂浓度转化率并未提高。考虑到工业对高产量以及低催化剂(菌体)用量,20g/l的全细胞催化剂浓度同时具备较高d-对羟基苯甘氨酸浓度及高产物/催化剂比例(即单位菌体生产d-对羟基苯甘氨酸能力)被用于转化实验。
[0082]
(2)不同转化反应ph对d-对羟基苯甘氨酸浓度的影响
[0083]
具体步骤同(1),将全细胞化剂浓度控制为20g/l,且将转化反应过程中的ph分别控制为7.5、8.0、8.5、9.0。结果如表5所示,在微碱性的条件更适合d-对羟基苯甘氨酸的合成,因此选择转化ph控制在8.5左右,此时d-对羟基苯甘氨酸浓度为3.2g/l。
[0084]
表5ph优化转化结果
[0085][0086]
(3)不同转化时长对d-对羟基苯甘氨酸浓度的影响
[0087]
具体步骤同(1),将转化ph控制为8.5,全细胞化剂浓度控制为20g/l,在不同转化时间取样测定d-对羟基苯甘氨酸产量(12-24h)(结果见表6),随着转化时间的延长,产量不断增加,但24h之后,增加不明显,考虑到工业运转成本,控制转化时间为24h,最终d-对羟基苯甘氨酸产量到达3.2g/l,转化率为32%。
[0088]
表6发酵时间优化结果
[0089][0090]
对比例1:
[0091]
具体实施方式参见实施例6,不同之处在于,将突变体t5菌株替换为野生型t0菌株去进行发酵与转化实验。转化结束后,取部分转化液12,000
×
g离心15min,上清液用0.22μm的微滤膜过滤后进行hplc分析。hplc色谱图结果显示:d-对羟基苯甘氨酸产量为1.2g/l,转化率为12%。
[0092]
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1