一种蚕丝蛋白和结构蛋白高分子复合纳米颗粒的制备及其应用
1.本发明属于材料科学领域,生物医用材料领域,具体是一种一步法制备,无需交联剂交联的可注射天然高分子复合胶体凝胶的制备方法;
背景技术:
2.胶体凝胶是一种基于“自下而上”设计理念,以微、纳米颗粒为基本单元,形成具有精细微观结构和稳定宏观性能的新型水凝胶材料。与传统水凝胶由连续高分子网络构成不同,胶体凝胶是由颗粒组成的。这种以微纳米颗粒为基本结构单元,通过自下而上的组装策略,控制基本结构单元之间的相互作用如:磁力、疏水相互作用、静电力、空间位阻等诱导其自组装形成的支架。由于物理“交联”的胶体颗粒间作用的可逆性,胶体凝胶表现出剪切变稀、自修复和组织表面的自适应性。同时,颗粒的合成步骤简单、混合时不易发生相分离以及在生理环境展现了稳定的机械性能。因此,颗粒水凝胶是进行生物医学应用剪切变稀、自修复水凝胶的理想选择。然而,颗粒水凝胶在实际应用中机械强度差,难以与组织形成结合的缺点使其难以满足人体承重组织/器官修复的基本要求,进一步限制了其在组织工程等医学领域的应用前景。
3.因此,如何提高胶体凝胶的力学强度,同时兼顾剪切变稀、自修复和组织适应性的优点,是该领域的一个技术难题。实现可生物降解颗粒凝胶的力学性能增强并实现功能化的丰富是颗粒水凝胶体系实现再生医学领域应用的关键,目前,研究者们主要通过加入硬质的纳米颗粒或纳米纤维与颗粒凝胶复合或通过引入聚合物共价网络的方式实现胶体凝胶力学强度的增加,硬材料的加入已证实可使颗粒凝胶显示增加的力学强度,然而,不同成分颗粒的共混易导致胶体凝胶的相分离使凝胶不均匀。因此兼具力学强度和优异生物功能性的颗粒材料具有重要意义。
4.现有的胶体凝胶大部分是由单一成分的纳米颗粒组成,这是导致胶体凝胶的功能性单一的主要原因。因此开发通过不同聚合物组成的纳米颗粒材料既能兼顾机械强度又可满足生物功能性可以有效解决这一问题。天然材料中蚕丝蛋白由于结构的疏水性以及蛋白二级结构使其具有优异的力学性能。然而蚕丝蛋白中广泛的疏水结构使其生物活性较弱,降解周期长。而天然结构蛋白如胶原蛋白、明胶、纤维蛋白等具有优异的生物降解性,以及支持细胞黏附和增殖,被认为是理想的生物医学材料。若将蚕丝蛋白和其他蛋白材料复合,制备复合纳米颗粒从而得到具有优异力学性能和生物活性的胶体凝胶材料具有重要的应用意义。
技术实现要素:
5.本发明提出了一种蚕丝蛋白和其他蛋白材料复合纳米颗粒及其制备方法,蚕丝蛋白和其他蛋白材料复合纳米颗粒直径在10nm~500μm之间,粒径均一,分散性良好,不易聚集,有构建不同功能和释放行为的药物载体的潜力,在制备过程中通过ph值,蚕丝蛋白溶液
与其他结构蛋白溶液的共混,有机相水相比例等因素的协调调控,最终形成稳定的明胶丝素蛋白纳米颗粒,同时该种制备方法工艺简单,避免了毒性交联剂的残留,生物相容性良好。颗粒保留明胶及蚕丝蛋白的高形变性和表面电荷,使得复合材料颗粒间能够通过可逆的相互作用(包括静电、疏水、氢键作用力),而保持胶体凝胶网络的自修复能力。并且本发明中经过改性的蚕丝蛋白和其他结构蛋白分子链上具有可交联基团,因而两相复合纳米颗粒不仅可以通过颗粒间的非共价相互作用组装成为胶体凝胶,也可利用颗粒表面的共价交联基团进行二次固化,当复合颗粒尺寸为10nm-5μm时,复合蛋白颗粒占水凝胶总体积的体积分数为2~120v/v%,颗粒表面共价交联之后的压缩弹性模量为0.5kpa~1mpa;当颗粒尺寸大于5μm时,所述复合颗粒占水凝胶总体积的体积分数为40~120v/v%,所得颗粒水凝胶共价交联之后的压缩弹性模量为0.5kpa~500kpa。进一步地,本发明提出了一种核壳结构的蚕丝蛋白/其他结构蛋白复合颗粒及其制备方法,当颗粒尺寸为10nm-5μm时,所述颗粒水凝胶材料中胶体颗粒占水凝胶总体积的体积分数为2~120v/v%,所得颗粒水凝胶具有剪切变稀、自修复特性;颗粒表面共价交联之后的压缩弹性模量为0.5kpa~1mpa;当颗粒尺寸大于5μm时,所述颗粒水凝胶材料中胶体颗粒占水凝胶总体积的体积分数为50~120v/v%;凝胶网络通过颗粒间静电、疏水、氢键作用组装而成;颗粒表面共价交联之后的压缩弹性模量为0.5kpa~5mpa。
6.本发明具体采用了以下技术方案:
7.本发明第一方面提供了一种复合蛋白颗粒,所述复合蛋白颗粒是由蚕丝蛋白和其他结构蛋白高分子通过所述蚕丝蛋白和其他结构蛋白两类蛋白质分子之间相互作用形成蛋白复合物,蛋白复合物再由蚕丝蛋白的β折叠实现两类蛋白的固化交联,形成所述复合蛋白颗粒,所述蚕丝蛋白与结构蛋白的质量比为0.01~100;所述复合蛋白颗粒的尺寸为10nm-500μm;所述其他结构蛋白包括胶原蛋白、弹性蛋白、明胶、白蛋白、角蛋白、昆虫表皮蛋白、蛋白聚糖、蛋白多肽及前述蛋白衍生物中的一种或多种的组合。
8.本发明第二方面提供了一种复合蛋白颗粒组装水凝胶材料,所述水凝胶材料由权利要求1所述的复合蛋白颗粒通过颗粒表面的静电作用、氢键作用、疏水作用自组装形成连续多孔的胶体凝胶网络;当复合颗粒尺寸为10nm-5μm时,复合蛋白颗粒占水凝胶总体积的体积分数为2~120v/v%;当颗粒尺寸大于5μm时,所述复合颗粒占水凝胶总体积的体积分数为40~120v/v%。
9.本发明第三方面提供了一种核壳结构复合蛋白颗粒,所述复合蛋白颗粒的核层由纳米颗粒组成,壳层由蚕丝蛋白和其他结构蛋白高分子通过蚕丝蛋白的β折叠实现颗粒内的交联复合而成壳层,其中,所述蚕丝蛋白与结构蛋白的质量比是0.01~100,核层纳米颗粒与壳层复合蛋白材料的质量比是0.1~50,所述复合颗粒的尺寸为10nm-500μm;
10.所述结构蛋白包括胶原蛋白、弹性蛋白、明胶、白蛋白、角蛋白、蚕丝蛋白、昆虫表皮蛋白、蛋白聚糖、蛋白多肽及前述蛋白衍生物中的一种或多种的组合;优选地,核层纳米颗粒选自二氧化硅纳米颗粒、硅酸镁锂纳米颗粒、纳米黏土颗粒、羟基磷灰石纳米颗粒、氧化铁磁性纳米颗粒、钛酸钡纳米颗粒、石墨烯纳米片、碳纳米管、生物玻璃纳米颗粒、黑磷纳米片、丝素蛋白纳米颗粒、聚乳酸纳米颗粒、聚乙烯纳米颗粒、聚苯乙烯纳米颗粒中的一种或多种。
11.本发明第四方面提供了一种核壳结构复合蛋白颗粒组装水凝胶材料,所述颗粒凝
胶由权利要求3所述的复合蛋白颗粒通过颗粒表面的静电作用、氢键作用、疏水作用自组装形成连续多孔的胶体凝胶网络;当颗粒尺寸为10nm-5μm时,所述颗粒水凝胶材料中胶体颗粒占水凝胶总体积的体积分数为2~120v/v%;当颗粒尺寸大于5μm时,所述颗粒水凝胶材料中胶体颗粒占水凝胶总体积的体积分数为50~120v/v%。
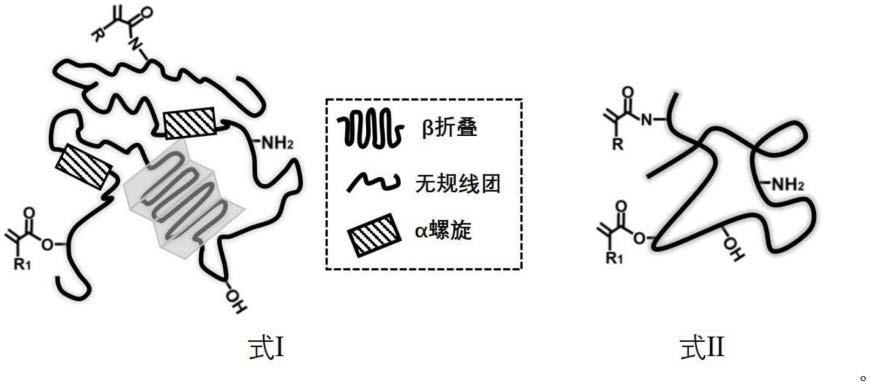
12.上述技术方案中,进一步地,当所述蚕丝蛋白为改性蚕丝蛋白,其结构式如式ⅰ所示,当所述其他结构蛋白为改性结构蛋白时,其结构式为式ⅱ所示;利用改性蚕丝蛋白/改性结构蛋白合成的复合蛋白颗粒通过接枝的可共价的交联基团实现复合蛋白颗粒之间的共价交联,从而形成非共价键和共价键双重交联的颗粒水凝胶材料;
13.当颗粒尺寸为10nm-5μm时,颗粒表面共价交联之后的压缩弹性模量为0.5kpa~1mpa;
14.当颗粒尺寸大于5μm时,颗粒表面共价交联之后的压缩弹性模量为0.5kpa~5mpa;
15.在式ⅰ和式ⅱ中r基团和r1基团选自氢、卤原子、羟基、巯基、胺基、硝基、氰基、醛基、酮基、酯基、酰胺基、膦酸基、膦酸酯基、磺酸基、磺酸酯基、砜基、亚砜基、芳基、烷基;
[0016][0017]
上述技术方案中,进一步地,前述第一方面所述的复合蛋白颗粒的制备方法为:
[0018]
当制备复合蛋白颗粒尺寸大于5μm时,使用乳液法制备复合微球颗粒;
[0019]
当制备复合颗粒尺寸为10nm-5μm时,所述制备方法为如下四种任一方法:
[0020]
方法一:将脱水溶剂加入蛋白溶液形成颗粒,依靠蚕丝蛋白的α螺旋向β折叠的二级结构转变使颗粒交联,步骤如下:
[0021]
(1)将天然蚕茧脱胶得到蚕丝蛋白纤维,并溶解于溴化锂的水溶液或氯化钙/乙醇的水溶液中,得到浓度为1-10w/v%的再生丝素溶液,速冻后真空冷冻干燥,得到可溶性冻干蚕丝蛋白;
[0022]
(2)将可溶性冻干蚕丝蛋白和其他结构蛋白在30~60℃下溶解在水性溶液中,得到蚕丝蛋白和结构蛋白混合溶液,其中蛋白总浓度为0.01~10w/v%;
[0023]
(3)调节蚕丝蛋白和结构蛋白混合溶液的ph至1~9,将极性有机溶剂缓慢滴加至上述溶液中,持续搅拌得到复合纳米颗粒的悬浊液;
[0024]
(4)将步骤(3)得到的复合颗粒悬浮液搅拌5min~12hrs,通过离心或过滤去除悬浊液中的杂质,最终获得复合颗粒分散液,干燥后得到蚕丝蛋白和其他结构蛋白复合的复合材料颗粒粉末;
[0025]
方法二:将脱水溶剂加入蛋白溶液形成颗粒,在蚕丝蛋白发生二级结构转变使颗粒交联的基础上加入蛋白交联剂使颗粒二次交联,步骤如下:
[0026]
将方法一步骤(3)得到的复合纳米颗粒的悬浊液中加入交联剂并持续搅拌反应5min~12hrs,通过离心或过滤去除悬液中的杂质,最终获得复合颗粒分散液干燥后得到蚕丝蛋白和其他结构蛋白复合的颗粒粉末;
[0027]
方法三:采用纳米沉淀法,将蛋白溶液加入脱水溶剂中形成颗粒,依靠蚕丝蛋白的α螺旋向β折叠的二级结构转变使颗粒交联,步骤如下:
[0028]
以方法一步骤(2)得到蚕丝蛋白和结构蛋白混合溶液,调节蚕丝蛋白和结构蛋白混合溶液的ph至1~9,将混合溶液逐渐滴加至搅拌中的极性有机试剂中,持续搅拌得到复合纳米颗粒的悬浊液;将复合颗粒悬浮液搅拌5min~12hrs,通过离心或过滤去除悬液中的杂质,最终获得复合颗粒分散液,干燥后得到蚕丝蛋白和其他结构蛋白复合的复合材料颗粒粉末;
[0029]
方法四:采用纳米沉淀法,将蛋白溶液加入脱水溶剂中形成颗粒,并在蚕丝蛋白发生二级结构转变使颗粒交联的基础上加入蛋白交联剂使颗粒二次交联,步骤如下:
[0030]
将方法三得到的复合纳米颗粒的悬浊液中加入交联剂并持续搅拌反应5min~12hrs,通过离心或过滤去除悬液中的杂质,最终获得复合颗粒分散液干燥后得到蚕丝蛋白和其他结构蛋白复合的颗粒粉末;
[0031]
优选地,所述极性有机溶剂为甲醇、乙醇、异丙醇、丁醇、丙酮、乙腈、四氢呋喃中的一种或几种的组合,更优选地,加入极性有机溶剂的体积是混合蛋白溶液或纳米颗粒、蛋白混合溶液体积的1~10倍;优选地,所述交联剂为碳二亚胺/n-羟基琥珀酰亚胺、甲醛、乙醛、甘油醛、芳草醛、戊二醛、丁二醛、京尼平中的一种或多种的组合;
[0032]
优选地,所述水性溶液为水或含有二氧化硅纳米颗粒、硅酸镁锂纳米颗粒、纳米黏土颗粒、羟基磷灰石纳米颗粒、氧化铁磁性纳米颗粒、钛酸钡纳米颗粒、石墨烯纳米片、碳纳米管、生物玻璃纳米颗粒、黑磷纳米片、丝素蛋白纳米颗粒、聚乳酸纳米颗粒、聚乙烯纳米颗粒、聚苯乙烯纳米颗粒、海藻酸、透明质酸、壳聚糖、硫酸软骨素、普鲁兰多糖、黄原胶、淀粉中的一种或几种的水溶液。
[0033]
上述技术方案中,进一步地,前述第二方面复合蛋白颗粒胶体凝胶材料的制备方法,所述制备方法是将前述合成的复合蛋白颗粒的粉末与水性溶液或有机溶液混合并搅拌,即得到可注射、自修复的胶体凝胶;当蚕丝蛋白或结构蛋白为前述改性的蚕丝蛋白、结构蛋白时,将复合蛋白颗粒粉末与水性溶液或有机溶液混合并搅拌,加入化学引发剂或光交联剂引发自由基聚合,使改性复合蛋白颗粒之间发生共价交联进一步得到力学增强的、非共价键和共价键复合交联的复合蛋白颗粒组装形成颗粒水凝胶材料。优选地,所述水性溶液为水或含有生物活性物质的溶液,生物活性物质为维生素,氨基酸,矿物元素,微生态调节剂,生长因子或血液;所述有机溶剂是甲醇、乙醇、异丙醇、丁醇、丙酮、乙腈、二氯甲烷、二甲基亚砜中的一种或多种。
[0034]
上述技术方案中,进一步地,前述第三方面所述的核壳颗粒的制备方法,其特征在于,
[0035]
当制备复合颗粒尺寸大于5μm时,统一使用乳液法制备核壳结构复合微球颗粒;
[0036]
当制备复合颗粒尺寸为10nm-5μm时,所述制备方法包为如下四种任一方法:
[0037]
方法一、将脱水溶剂加入纳米颗粒/蛋白混合溶液形成颗粒,依靠蚕丝蛋白的α螺旋向β折叠的二级结构转变使核壳结构颗粒交联,具体步骤如下:
[0038]
(1)将天然蚕茧脱胶得到蚕丝蛋白纤维,并溶解于溴化锂的水溶液或氯化钙/乙醇的水溶液中,得到浓度为1-10w/v%的再生丝素溶液,速冻后真空冷冻干燥,得到可溶性冻干蚕丝蛋白;
[0039]
(2)将可溶性冻干蚕丝蛋白和其他结构蛋白在30~60℃下溶解在含有纳米颗粒的水性溶液中,得到纳米颗粒、蚕丝蛋白和结构蛋白混合溶液,其中蛋白总浓度为0.01~10w/v%;
[0040]
(3)调节上述混合溶液的ph至1~9,将极性有机溶剂缓慢滴加至上述溶液中,持续搅拌得到核壳结构的复合纳米颗粒的悬浊液;
[0041]
(4)将步骤(3)得到的复合颗粒悬浮液搅拌5min~12hrs,通过离心或过滤去除悬液中的杂质,将悬浊冷冻干燥后得到具有核壳结构的蚕丝蛋白和其他结构蛋白复合的复合材料颗粒粉末;
[0042]
方法二、将脱水溶剂加入纳米颗粒/蛋白混合溶液形成颗粒,在蚕丝蛋白发生二级结构转变使颗粒交联的基础上加入蛋白交联剂使核壳结构颗粒二次交联,步骤如下:
[0043]
将方法一步骤(3)得到的核壳结构复合纳米颗粒的悬浊液中加入交联剂并持续搅拌反应5min~12hrs,通过离心或过滤去除悬液中的杂质,最终获得复合颗粒分散液干燥后得到蚕丝蛋白和其他结构蛋白复合的颗粒粉末;
[0044]
方法三、采用纳米沉淀法,将纳米颗粒/蛋白混合溶液加入脱水溶剂中形成核壳结构颗粒,依靠蚕丝蛋白的α螺旋向β折叠的二级结构转变使核壳结构颗粒交联,步骤如下:
[0045]
以方法一步骤(2)得到蚕丝蛋白和结构蛋白混合溶液,调节上述混合溶液的ph至1~9,将混合溶液逐渐滴加至搅拌中的极性有机试剂中,持续搅拌得到核壳结构复合纳米颗粒的悬浊液;将核壳结构复合颗粒悬浮液搅拌5min~12hrs,通过离心或过滤去除悬液中的杂质,冷冻干燥后得到核壳结构的蚕丝蛋白和其他结构蛋白复合颗粒粉末;
[0046]
方法四、采用纳米沉淀法,将纳米颗粒/蛋白混合溶液加入脱水溶剂中形成颗粒,并在蚕丝蛋白发生二级结构转变使颗粒交联的基础上加入蛋白交联剂使核壳结构颗粒二次交联,步骤如下:
[0047]
将方法三得到的核壳结构复合纳米颗粒的悬浊液中加入交联剂并持续搅拌反应5min~12hrs,通过离心或过滤去除悬液中的杂质,冷冻干燥后得到蚕丝蛋白和其他结构蛋白复合的核壳结构颗粒粉末;
[0048]
优选地,所述极性有机溶剂为甲醇、乙醇、异丙醇、丁醇、丙酮、乙腈、四氢呋喃中的一种或几种的组合,更优选地,加入极性有机溶剂的体积是混合蛋白溶液或纳米颗粒、蛋白混合溶液体积的1~10倍;优选地,所述交联剂为碳二亚胺/n-羟基琥珀酰亚胺、甲醛、乙醛、甘油醛、芳草醛、戊二醛、丁二醛、京尼平中的一种或多种的组合;
[0049]
优选地,所述水性溶液为水或含有二氧化硅纳米颗粒、硅酸镁锂纳米颗粒、纳米黏土颗粒、羟基磷灰石纳米颗粒、氧化铁磁性纳米颗粒、钛酸钡纳米颗粒、石墨烯纳米片、碳纳米管、生物玻璃纳米颗粒、黑磷纳米片、丝素蛋白纳米颗粒、聚乳酸纳米颗粒、聚乙烯纳米颗粒、聚苯乙烯纳米颗粒、海藻酸、透明质酸、壳聚糖、硫酸软骨素、普鲁兰多糖、黄原胶、淀粉中的一种或几种的水溶液。
[0050]
上述技术方案中,进一步地,前述第4方面所述的核壳颗粒胶体凝胶材料的制备方法,所述制备方法是前述合成的复合蛋白颗粒粉末与水性溶液或有机溶液混合并搅拌,即得到可注射、自修复的胶体凝胶。当蚕丝蛋白或结构蛋白为前述改性的蚕丝蛋白、结构蛋白时,将复合颗粒颗粒粉末与水性溶液或有机溶液混合并搅拌,加入化学引发剂或光交联剂引发自由基聚合,使改性核壳结构复合蛋白颗粒之间发生共价交联进一步得到力学增强的、非共价键和共价键复合交联的核壳结构的复合蛋白颗粒组装形成颗粒水凝胶材料。优选地,所述水性溶液为水或含有生物活性物质的溶液,生物活性物质为维生素,氨基酸,矿物元素,微生态调节剂,生长因子或血液;所述有机溶剂是甲醇、乙醇、异丙醇、丁醇、丙酮、乙腈、二氯甲烷、二甲基亚砜中的一种或多种。
[0051]
本发明第五方面提供了前述水凝胶材料的以下几方面应用:
[0052]
在制备浅层皮肤及皮下填充物的应用;优选在整形美容手术中;应用时,将胶体颗粒与水性溶液共混得到胶体凝胶,通过注射器针头将上述凝胶直接注射至浅层皮肤或皮下区域,蚕丝蛋白和其他结构蛋白复合颗粒在非共价键作用下可逆自组装形成连续多孔颗粒网络,在注射部位稳定、长期停留,作为减少皮肤褶皱或塑形的填充材料;
[0053]
或在制备载活细胞打印的生物打印墨水的应用,应用时,将胶体颗粒与水性溶液共混得到胶体凝胶,再与细胞悬浮液混合得到载细胞胶体凝胶,将上述墨水通过挤出3d打印方式,获得具有3d结构的支架,得到载细胞打印支架;
[0054]
或在制备药物成分的载体或支架中的应用,应用于骨组织、软骨组织、肌肉、血管等的创伤或缺损的修复填充;所述药物成分为维生素、氨基酸、矿物元素、微生态调节剂、生长因子、小分子药物、蛋白大分子药物、核酸类药物(如mrna)、抗生素类药物、激素类药物、麻醉剂类药物、抗病毒药物,抗菌药物,抗癌药物、免疫调节药物或活细胞的一种或多种组合;
[0055]
或在制备骨/软骨修复填充材料或药物的应用;应用时,将胶体凝胶直接注射至骨/软骨缺损区域,蚕丝蛋白和其他结构蛋白复合颗粒可逆自组装形成连续多孔颗粒网络,在骨缺损部位稳定停留,作为骨修复和再生的支架材料;
[0056]
或在快速止血密封粉中的应用,应用时,快速止血密封粉包括前述方法制备的复合蛋白颗粒粉末,将粉末喷洒至有血缺损创面处吸收渗出血液形成凝胶止血。
[0057]
本发明的有益效果:
[0058]
本发明报道的一种由蚕丝蛋白-其他结构蛋白复合颗粒组装而成的可注射胶体凝胶材料,由于复合颗粒表面具有静电、疏水、氢键相互作用,颗粒之间可通过可逆的氢键相互作用进行自组装形成凝胶网络,可逆的相互作用赋予了材料在注射时剪切变稀,注射后自修复形成稳定凝胶的性能。这一特性使其在微创植入材料、人工细胞外基质和3d生物打印墨水等领域具有广阔的应用前景。
[0059]
本发明报道的蚕丝蛋白-其他结构蛋白复合颗粒可通过丝素的β折叠作用实现颗粒的稳定,双相微球颗粒不需要通过化学交联剂进行交联,仅仅通过蚕丝蛋白形成beta折叠的作用即实现微球的稳定。与传统蛋白颗粒需要通过化学交联剂稳定微球的方法(如醛类、碳二胺类交联剂)相比,本专利所述方法制备过程更简便,无需引入化学交联即获得稳定微球颗粒,这对于植入类生物医用材料的应用有重要意义。因为无需引入化学交联剂,因此所得胶体材料的生物相容性更加优异,包括在植入后可以引起更弱的免疫排斥反应或者
炎症反应。
[0060]
由于蚕丝蛋白和其他结构蛋白两相共混及纳米尺度下的复合均受到分子间作用、溶剂、温度等繁杂因素的共同影响,所以到目前为止,尚没有相关发明和研究报道表明蚕丝蛋白-其他结构蛋白复合纳米颗粒被成功制备,本发明首次报道了使用反蚕丝蛋白-其他结构蛋白复杂溶解行为的精细调控,本工艺可以制备出尺寸均一、蚕丝蛋白和其他结构蛋白在其中均匀分散的均相颗粒,并且其他结构蛋白和蚕丝的成分比例可精细调控;
[0061]
蚕丝蛋白颗粒的β折叠可大幅度的提高纳米颗粒的刚度,因此本发明报道的复合颗粒具有优异的力学强度,并且以通过调控其他结构蛋白和蚕丝蛋白的比例调控材料的力学强度1kpa~5mpa。除了高机械强度,复合颗粒又不同于传统刚性颗粒仅具有硬度,结构蛋白材料如明胶、胶原蛋白、纤维蛋白等具有较高弹性和可变形能力,刚性蚕丝蛋白和上述柔性蛋白的复合会赋予复合颗粒与组织类似的兼具高机械强度和变形能力的力学特征,这对于生物医学应用领域具有重要意义。
[0062]
本发明报道的蚕丝蛋白-其他结构蛋白复合颗粒组装而成的可注射胶体凝胶材料,通过调控蚕丝蛋白和其他结构蛋白的比例、种类可精细、大范围调控材料的降解周期,从两周到1年不等,这与单一成分的胶体凝胶材料和传统复合水凝胶材料相比具有显著的优势。单一成分的凝胶材料仅能通过控制颗粒的种类和交联度控制降解时间,难以实现宽范围的降解调控。
[0063]
本发明报道的蚕丝蛋白-其他结构蛋白复合颗粒具有精细的纳米结构,并且蚕丝蛋白和其他结构蛋白的复合赋予了颗粒亲水和疏水的特性,因此可以同时满足亲水和疏水药物分子的缓释,与常规的纳米颗粒仅具有单一亲、疏水性相比,本发明报道的颗粒可广泛用于药物分子的递送。
附图说明
[0064]
图1是实施例1中复合纳米颗粒分散后的透射电子显微镜照片,球形度较高;
[0065]
图2是实施例1复合纳米颗粒冻干后的扫描电子显微镜照片;
[0066]
图3是对比例3中各组纳米颗粒冻干后的扫描电子显微镜照片;
[0067]
图4是对实施例6中的复合纳米颗粒的热重分析;
[0068]
图5是以实施例1中的复合纳米颗粒水凝胶为例,经历压缩形变后,快速恢复过程的光学图像;
[0069]
图6是以实施例1中的复合纳米颗粒的浸提液与3t3细胞进行细胞毒性检测结果;
[0070]
图7是复合纳米颗粒水凝胶的粘度随剪切速率变化趋势图以及3d打印骨头模型实物图;
[0071]
图8为是实施例1中复合纳米胶体凝胶凝胶模量经受剪切应变后恢复曲线;
[0072]
图9是以实施例1中的复合纳米颗粒水凝胶为例(30%(w/v)),进行3d打印后的精细结构的光学图像;其中a图打印支架具有稳定的力学支撑,b图显示支架可以通过镊子夹持,具有力学强度,c图是打印支架的显微图像,图像显示支架具有精细的微观网格结构,d图是对支架的轮廓建模,模型显示支架结构清晰;
[0073]
图10是实施例1中的复合纳米颗粒水凝胶支架材料细胞生长情况照片;图中绿色荧光代表活细胞,红色荧光代表死细胞,图像表明细胞在支架中以活细胞为主且状态良好,
表面材料具有优异的细胞相容性;
[0074]
图11是实施例19中以实施例1中的复合纳米颗粒水凝胶为例作为皮下填充材料的应用;a图显示凝胶可以通过注射针头注射至小鼠皮下,b图显示凝胶可稳定在皮下停留且稳定实现力学支撑。
具体实施方式
[0075]
下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。下述实施例中,如无特殊说明,所使用的实验方法均为常规方法,所用材料、试剂等均可从生物或化学公司购买。
[0076]
实施例1
[0077]
将10g天然蚕茧洗去表面的杂质后加入到1l浓度为1.5w/v%的碳酸钠溶液中,并在温度为90℃条件下溶解15min脱胶得到蚕丝蛋白纤维,取出丝素蛋白纤维并挤出多余水分,使用去离子水清洗蚕丝蛋白纤维去除多余杂质;将蚕丝蛋白纤维放置在50℃烘中干燥;
[0078]
将5g干燥的蚕丝蛋白,缓慢加入氯化钙:乙醇:水混合溶液中,其中三者摩尔比为1:2:8,蚕丝蛋白的终浓度为12%,在温度为80℃条件下,溶解3h,使蚕丝蛋白纤维完全溶解,所得蚕丝蛋白溶液置于室温下自然冷却后过滤去除溶液中的杂质,之后将蚕丝蛋白透析进一步纯化。为避免透析使蚕丝蛋白再生溶液聚集成胶,用去离子水将蚕丝蛋白溶液稀释至终浓度为3%。将透析后的蚕丝蛋白溶液置于液氮环境下快速冷冻,随后在-60℃条件下进行冷冻干燥,得到可溶解的冻干蚕丝蛋白;
[0079]
称量5g上述冻干蚕丝蛋白和5g的明胶蛋白溶解在200ml的40℃去离子水中混合均匀得到蚕丝和明胶混合溶液,将上述复合蛋白溶液ph调至4,向上述混合溶液中缓慢注入800ml的40℃的丙酮溶剂,剧烈搅拌得到复合蛋白纳米颗粒悬浊液。将悬浮液离心5min,并弃去上清液后,沉淀物用去离子水反复冲洗,最后得到纳米颗粒悬浊液,取一部分纳米颗粒悬浊液通过纳米激光粒度及zeta电位仪测定其水合粒径及zeta电位,结果如表1所示,复合蛋白颗粒的水合粒径约为291
±
5nm,zeta电位约为-15.4
±
2.1mv,再取一部分纳米颗粒悬浊液进行透射电镜测试,剩余悬浊液冷冻干燥,得到复合蛋白纳米颗粒粉末。颗粒的尺寸和形貌如图1和图2的透射电镜和扫描电镜照片所示,复合纳米颗粒的粒径约为200
±
25nm,纳米颗粒分散均匀,粒径较为均一。
[0080]
表1
[0081]
复合纳米颗粒尺寸表面电荷291
±
5nm-17.9
±
2.1mv
[0082]
将0.1、0.3、0.5g复合蛋白纳米颗粒粉末,1ml去离子水通过鲁尔转接头注射器反复吹打10次,得到可注射、自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’和自修复性能,复合颗粒凝胶具有优异的自修复的性能;
[0083]
表2
[0084]
质量分数弹性模量(kpa)自修复性能10%1.664.3%30%24.984.1%50%187.276.8%
[0085]
实施例2
[0086]
称量5g实施例1得到的冻干蚕丝蛋白,将其与5g的明胶蛋白一起溶解在200ml的40℃去离子水中混合均匀得到蚕丝和明胶混合溶液,将上述复合蛋白溶液ph调至4,将上述混合溶液缓慢滴加至400ml的处于搅拌状态的丙酮溶剂中,全部加完后继续维持搅拌状态30min,即得到复合蛋白纳米颗粒悬浊液。将悬浮液离心5min,并弃去上清液后,沉淀物用去离子水反复冲洗,最后得到纳米颗粒悬浊液,取一部分纳米颗粒悬浊液通过纳米激光粒度及zeta电位仪测定其水合粒径及zeta电位,结果如表3所示,复合蛋白颗粒的水合粒径约为270
±
12nm,zeta电位约为-14.8
±
3.0mv,可以看出与实施例1中的复合蛋白颗粒没有明显差别。
[0087]
表3
[0088]
复合纳米颗粒尺寸表面电荷270
±
12nm-14.8
±
3.0mv
[0089]
将0.1、0.3、0.5g复合蛋白纳米颗粒粉末,1ml去离子水通过鲁尔转接头注射器反复吹打10次,得到可注射、自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’和自修复性能,可以看出,本实施例得到的复合颗粒凝胶同样具有优异的自修复的性能,且与实施例1中的凝胶材料强度基本一致;
[0090]
表4
[0091]
质量分数弹性模量(kpa)自修复性能10%1.5560.9%30%22.879.8%50%175.272.7%
[0092]
实施例3
[0093]
由于蚕丝是高分子质量的蛋白质,蛋白分子质量的大小是影响其应用范围及应用价值的重要因素,因此控制分子质量对蚕丝蛋白产品的开发至关重要。有研究表明,在常用的几种溶解体系中,丝素蛋白的溶解性和分子链被打断程度有明显差异。因此本发明中采用多种溶解体系制备了再生丝素蛋白和相应的复合纳米颗粒。
[0094]
将10g天然蚕茧洗去表面的杂质后加入到1l浓度为1.5w/v%的碳酸钠溶液中,并在温度为90℃条件下溶解15min脱胶得到丝素蛋白纤维,取出丝素蛋白纤维并挤出多余水分,使用去离子水清洗丝素蛋白纤维去除多余杂质;将丝素蛋白纤维放置在50℃烘箱中干燥;
[0095]
将5g干燥的丝素蛋白,缓慢加入9.3m溴化锂溶液中,丝素蛋白的终浓度为12%,在温度为80℃条件下,溶解3hrs,使丝素蛋白纤维完全溶解,所得丝素蛋白溶液置于室温下自然冷却后过滤去除溶液中的杂质,之后将丝素蛋白透析进一步纯化。为避免透析使丝素蛋白再生溶液聚集成胶,用去离子水将丝素蛋白溶液稀释至终浓度为3%。将透析后的丝素蛋白溶液置于液氮环境下快速冷冻,随后在-60℃条件下进行冷冻干燥,得到可溶解的冻干丝素蛋白;
[0096]
称量5g上述冻干丝素蛋白和明胶蛋白溶解在150ml的40℃去离子水中混合均匀得到丝素和明胶混合溶液,使用盐酸将上述复合蛋白溶液ph调至4,向上述混合溶液中缓慢注入40℃的丙酮溶剂中,丙酮与再生丝素溶液比例至4:1,剧烈搅拌得到复合蛋白纳米颗粒悬
浊液;将悬浮液以16000r/min的速度离心5min,底层沉淀物用去离子水反复冲洗,最后,将离心沉淀物悬浮在去离子水中,并将上述颗粒分散液冷冻干燥得到复合蛋白纳米颗粒粉末。
[0097]
使用动态光散射(dls)测试合成的纳米粒子的粒径,粒径如表3所示,可以看出该条件制备的复合蛋白纳米颗粒的尺寸明显高于实施例1中由氯化钙/乙醇/水体系溶解的丝素蛋白制备的复合颗粒尺寸,说明不同溶解体系得到蚕丝蛋白均可与结构蛋白复合形成纳米颗粒,但其形成的纳米颗粒尺寸不同。
[0098]
表5
[0099]
复合纳米颗粒尺寸表面电荷339.7nm-14.8
±
1.9mv
[0100]
将0.3g复合蛋白纳米颗粒粉末,1ml去离子水通过鲁尔转接头注射器反复吹打10次,得到可注射、自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’如表6所示,其储能模量和自修复效率均略高于实施例1样品,说明采用此溶解体系对提高复合纳米颗粒凝胶的机械性能和自修复性能更为有利。
[0101]
表6
[0102]
储能模量(kpa)25.3自修复效率93%
[0103]
对比例1
[0104]
本发明中当采用向蛋白溶液中滴加有机试剂的方法制备纳米颗粒时,,需要通过调控溶剂-蛋白之间的作用、蛋白分子之间相互作用以及蛋白分子自身的构象转变,将高分子构象由最初的伸展调整为纳米或微米蜷缩球体,并通过蚕丝蛋白的二级结构转变来实现纳米或微米颗粒的交联;由于蛋白分子结构中含有大量可电离基团,而溶液ph会显著影响高分子的带电量和亲疏水性质,进而影响到其二级结构的转变和复合颗粒的合成,因此ph是合成此类复合蛋白颗粒的关键制备因素。
[0105]
称量多份5g实施例1制备的丝素蛋白和5g明胶蛋白溶解在200ml的40℃去离子水中混合均匀得到多份丝素和明胶混合溶液,将上述复合蛋白溶液ph调至1、2、6、8、9、10和11,向上述混合溶液中缓慢注入800ml40℃的丙酮溶剂,剧烈搅拌得到复合蛋白纳米颗粒悬浊液;将悬浮液离心5min,弃去上清液后,沉淀物用去离子水反复冲洗,得到颗粒悬浮液,用纳米激光粒度及zeta电位仪测定ph为1~11条件下合成的复合纳米颗粒的水合粒径及zeta电位,结果如表5所示,可以看出在ph在1~9范围内均可制备复合蛋白颗粒,且随着ph的增加,纳米颗粒的粒径逐渐上升,这是由于蚕丝蛋白在偏碱性条件下发生二级结构转变的程度逐渐减小的缘故;此外,当溶液ph为9以上(10、11)时,产物溶液经多次高速离心后仍未获得纳米颗粒,说明此ph条件不足以形成稳定的纳米球体,和实施例1对比说明,对溶液ph的精细调控对于合成此类复合蛋白纳米材料至关重要。
[0106]
表7
[0107]
ph值颗粒尺寸nmzeta电位mv1265.0-15.32287.3-15.1
6294.9-19.78338.6-25.69329.4-24.910
╳╳
11
╳╳
[0108]
对比例2
[0109]
本发明中当采用向蛋白溶液中滴加有机试剂的方法制备纳米颗粒时,有机溶剂在其中起到使蛋白分子脱水,使其分子构象从拉伸状态转变为卷曲状态的作用,并促使丝素蛋白转变为β-折叠结构,从而可以形成稳定颗粒。而不同浓度或体积的有机试剂对蛋白的脱水作用不同,具体地,提高有机试剂在整体溶液中的比例,会加剧蛋白脱水,当有机试剂加入到合适比例时,蛋白构象会调整为规则且均匀的纳米尺度的球体;当有机试剂加入量太少时,脱水能力不足,高分子蛋白与水之间残留的氢键还可维持其伸展构象,不足以使其成球;反之,当有机试剂加入过量,成球的高分子蛋白进一步脱水,导致高分子蛋白在溶液中成团析出,此外不同浓度的高分子蛋白对有机试剂的耐受程度不同,在添加相同体积的有机试剂时,高浓度溶液中的高分子蛋白更容易从中析出,因而有机试剂/水的比例对高分子蛋白构象调整成球以及纳米颗粒的制备具有重要影响。
[0110]
将实施例1制备的丝素蛋白和明胶蛋白以1%和5%和10%的总浓度(丝素蛋白和明胶蛋白等质量)溶解于40℃的去离子水中,分别加入水溶液0.5、1、2、4、8、10、12倍体积的丙酮,并快速搅拌,使蛋白质缓慢脱水卷曲形成球体并诱导蚕丝蛋白发生β折叠以对纳米颗粒进行交联。将悬浮液离心5min,并弃去上清液后,沉淀物用去离子水反复冲洗,最后得到纳米颗粒悬浊液。之后取部分悬浊液通过纳米激光粒度仪测定其中是否有颗粒产生,不同丙酮/水体积比条件下制备复合颗粒的合成结果如表8所示,
“╳”
表示乳浊液中无球状颗粒,
“○”
表示乳浊液中有纳米颗粒,
“□”
表示合成过程中纳米颗粒发生聚集析出,可以看出对应某一初始蚕丝蛋白/其他结构蛋白浓度,均有其可合成纳米颗粒的丙酮/水体积比的范围,综合各实验组,有机试剂/水的体积之比范围为:1~10。
[0111]
表8
[0112][0113]
对比例3
[0114]
本发明中当采用纳米沉淀法,即向有机试剂中滴加蛋白溶液的方法制备纳米颗粒时,有机溶剂在其中起到使蛋白分子脱水,并促使丝素蛋白转变为β-折叠结构,形成稳定颗粒的作用,此外有机试剂作为纳米颗粒悬浊液的连续相,起到让纳米颗粒稳定地分散于其中的作用,其体积不宜过低,当有机试剂体积过低,成球的纳米颗粒相遇碰撞的几率增大,纳米颗粒由于其高的表面能更容易团聚在一起,甚至颗粒从溶剂中团聚析出。
[0115]
将实施例1制备的丝素蛋白和明胶蛋白以5%的总浓度(丝素蛋白和明胶蛋白等质量)溶解于40℃的去离子水中,将上述复合蛋白溶液ph调至4,量取多份100ml上述混合溶液,分别缓慢滴加至50ml、100ml、200ml的处于搅拌状态的丙酮溶剂中,全部加完后继续维持搅拌状态30min,得到复合蛋白纳米颗粒悬浊液。将悬浮液离心5min,并弃去上清液后,沉淀物用去离子水反复冲洗,最后得到纳米颗粒悬浊液,取一部分纳米颗粒悬浊液通过纳米激光粒度及zeta电位仪测定其水合粒径及zeta电位,结果如表9所示,复合蛋白颗粒的水合粒径随着有机溶剂体积的增加而减小,将各组纳米颗粒悬浊液冷冻干燥后进扫描电镜观察,如图3所示,当丙酮的体积为水溶液的1/2倍时,颗粒出现大范围融合,当丙酮与水溶液等体积时,颗粒球形度较好,但仍有部分粘连现象,而当丙酮的体积为水溶液的2倍时,纳米颗粒球形度较好,且分散均匀,综合本对比例和实施例2,采取纳米沉淀法合成本发明中的复合蛋白颗粒时,丙酮/水溶液的体积之比应为1倍以上。
[0116]
表9
[0117]
丙酮/水溶液体积比颗粒尺寸nm1/2812
±
381/1329
±
262/1275
±8[0118]
实施例4
[0119]
称量5g实施例1制备的冻干蚕丝蛋白和5g胶原蛋白、弹性蛋白、明胶、白蛋白、角蛋白、丝素蛋白、昆虫表皮蛋白溶解在200ml的40℃去离子水中混合均匀得到丝素和其他结构蛋白混合溶液,使用盐酸将上述复合蛋白溶液ph调至4,向上述混合溶液中缓慢注入800ml的40℃的丙酮溶剂,剧烈搅拌得到复合蛋白纳米颗粒悬浊液;将悬浮液离心5min,弃去上清液后,沉淀物用去离子水反复冲洗.最后,将离心沉淀物悬浮在水或缓冲液中,并将上述颗粒分散液冷冻干燥得到复合蛋白纳米颗粒粉末。使用动态光散射(dls)测试合成的纳米粒子的粒径如表10所示,由不同结构蛋白制备的复合蛋白纳米颗粒的尺寸均有不同,这是由不同结构蛋白对相同溶剂条件(包括种类和体积占比)的耐受程度不同,有些结构蛋白容易脱水,其形成的纳米颗粒尺寸较小,反之较大。
[0120]
表10
[0121]
结构蛋白种类颗粒尺寸(nm)电位(mv)胶原蛋白198.6-19.5弹性蛋白297.3-14.6明胶291.8-17.9白蛋白157.9-8.9角蛋白149.4-6.8昆虫表皮782.6-4.9
[0122]
将0.3g复合蛋白纳米颗粒粉末,1ml去离子水通过鲁尔转接头注射器反复搅拌混合,得到可注射、自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’如表11所示,由不同结构蛋白制备的复合蛋白纳米颗粒形成的胶体凝胶的力学强度均有不同,说明可根据不同的组织修复场景制备不同力学强度的复合蛋白胶体凝胶。
[0123]
表11
[0124][0125][0126]
实施例5
[0127]
称量5g上述冻干蚕丝蛋白分别和5g明胶溶解在200ml的40℃去离子水中混合均匀得到丝素和其他结构蛋白混合溶液,使用盐酸将上述复合蛋白溶液ph调至4,向上述混合溶液中缓慢注入800ml 40℃的甲醇、乙醇、异丙醇、丁醇、丙酮、乙腈或四氢呋喃,剧烈搅拌得到复合蛋白纳米颗粒悬浊液;将悬浮液离心5min弃去上清液后,沉淀物用去离子水反复冲洗.最后,将离心沉淀物悬浮在水或缓冲液中,并将上述颗粒分散液冷冻干燥得到复合蛋白纳米颗粒粉末。使用动态光散射(dls)测试合成的纳米粒子的粒径和电位,如表12所示。
[0128]
表12
[0129]
溶剂种类颗粒尺寸(nm)电位(mv)乙腈893.4-13.8乙醇256.8-10.9异丙醇462.2-18.6四氢呋喃399.2-21.6甲醇356.4-19.9丁醇307.1-17.0
[0130]
将0.3g复合蛋白纳米颗粒粉末,1ml去离子水通过鲁尔转接头注射器反复吹打10次,得到可注射、自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’,如表13所示。
[0131]
表13
[0132]
结构蛋白种类弹性模量(kpa)乙腈13.5kpa乙醇26.9kpa异丙醇24.1kpa四氢呋喃20.6kpa甲醇25.4kpa丁醇19.5kpa
[0133]
实施例6
[0134]
称量5g实施例1制备的冻干丝素蛋白和1、2、5、10、20g明胶蛋白溶解在200ml的40
℃去离子水中混合均匀得到不同蛋白比例的丝素/其他结构蛋白混合溶液,使用盐酸将上述复合蛋白溶液ph调至4,向上述混合溶液中缓慢注入800ml的40℃的丙酮溶剂,剧烈搅拌得到复合蛋白纳米颗粒悬浊液;将悬浮液离心5min,弃去上清液后,沉淀物用去离子水反复冲洗.最后,将离心沉淀物悬浮在水或缓冲液中,并将上述颗粒分散液冷冻干燥得到复合蛋白纳米颗粒粉末。使用动态光散射(dls)测试合成的纳米粒子的粒径如表144所示。
[0135]
表14
[0136]
丝素/明胶质量比颗粒尺寸(nm)电位(mv)1:0.2198.6-23.51:0.4297.3-21.61:1291.8-17.91:2157.9-13.91:4149.4-11.1
[0137]
将0.3g以上各组复合蛋白纳米颗粒粉末与1ml去离子水通过鲁尔转接头注射器反复混匀10次,得到可注射、自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’和自修复效率,如表15所示,随着复合蛋白颗粒中明胶成分占比的增加,其储能模量逐渐下降,但其自修复效率逐渐上升,说明合适的蚕丝/其他结构蛋白比例,有利于赋予复合蛋白颗粒良好的机械强度和自修复性能。。
[0138]
表15
[0139]
丝素/明胶质量比储能模量(kpa)自修复效率(%)1:0.258.659.21:0.437.571.51:124.993.31:218.195.21:413.998.6
[0140]
实施例7
[0141]
称量5g实施例1得到的冻干丝素蛋白和明胶蛋白溶解在150ml的40℃去离子水中混合均匀得到丝素和明胶混合溶液,使用盐酸将上述复合蛋白溶液ph调至4,向上述混合溶液中缓慢注入40℃的丙酮溶剂,并调节丙酮与再生丝素溶液比例至4:1,剧烈搅拌得到复合蛋白纳米颗粒悬浊液,加入交联剂碳二亚胺/n-羟基琥珀酰亚胺、戊二醛、或京尼平;将悬浮液以16000r/min的速度离心5min,弃去上清液后,沉淀物用去离子水反复冲洗.最后,将离心沉淀物悬浮在水溶液中,并将上述颗粒分散液冷冻干燥得到复合蛋白纳米颗粒粉末。
[0142]
使用动态光散射(dls)测试合成的纳米粒子的粒径,如表16所示,与实施1得到的未进行化学试剂交联的复合蛋白纳米颗粒(dls粒径为279nm)相比,经过化学交联之后,纳米颗粒尺寸发生不同程度的减小,这是由于化学交联使得原本与水形成大量氢键的蛋白分子链被反应固定,分子内相互作用加剧,分子进一步脱水,使得形成的纳米球体更为致密所致。
[0143]
表16
[0144]
交联剂种类颗粒尺寸(nm)
碳二亚胺/n-羟基琥珀酰亚胺163.8戊二醛211.4京尼平239.5
[0145]
将0.3g以上各组复合蛋白纳米颗粒粉末与1ml去离子水通过鲁尔转接头注射器反复混匀10次,得到可注射、自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’,如表17所示,使用不同交联剂制备的复合蛋白纳米颗粒形成的胶体凝胶的机械强度均有不同,这是不同的交联机制导致的,说明可通过交联剂的选择来优选目标机械强度的蛋白颗粒材料。
[0146]
表17
[0147]
交联剂种类弹性模量(kpa)碳二亚胺/n-羟基琥珀酰亚胺89.6戊二醛72.9京尼平78.2
[0148]
实施例8
[0149]
称量5g上述冻干丝素蛋白和明胶蛋白溶解在200ml的40℃去离子水中混合均匀得到丝素和明胶混合溶液,并分别加入1g的二氧化硅纳米颗粒、纳米黏土颗粒、羟基磷灰石纳米颗粒、生物玻璃纳米颗粒、黑磷纳米片、丝素蛋白纳米颗粒或聚苯乙烯纳米颗粒,使用盐酸将上述复合蛋白溶液ph调至4,向上述混合溶液中缓慢注入800ml40℃的丙酮溶剂剧烈搅拌得到复合蛋白纳米颗粒悬浊液;将悬浮液离心5min,弃去上清液后,沉淀物用去离子水反复冲洗.最后,将离心沉淀物悬浮在水溶液中,并将上述颗粒分散液冷冻干燥得到复合蛋白纳米颗粒粉末。使用动态光散射(dls)测试合成的纳米粒子的粒径,如表18所示。
[0150]
表18
[0151]
纳米颗粒种类颗粒尺寸(nm)二氧化硅纳米颗粒484.2纳米黏土纳米颗粒863.2羟基磷灰石纳米颗粒578.5生物玻璃纳米颗粒621.3黑磷纳米片389.4丝素蛋白纳米颗粒1087.6聚苯乙烯纳米颗粒1462.5
[0152]
将0.3g复合蛋白纳米颗粒粉末,1ml去离子水通过鲁尔转接头注射器反复吹打10次,得到可注射、自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’,如表19所示,与实施例1得到的复合蛋白纳米颗粒相比,核壳结构的构建在不同程度上均提高了纳米颗粒胶体凝胶的强度,并且核层其他纳米颗粒的引入可以赋予复合蛋白颗粒多种组织修复的应用潜力。
[0153]
表19
[0154]
纳米颗粒种类弹性模量(kpa)二氧化硅纳米颗粒32.5
纳米黏土纳米颗粒29.3羟基磷灰石纳米颗粒31.6生物玻璃纳米颗粒29.5黑磷纳米片27.9丝素蛋白纳米颗粒30.5聚苯乙烯纳米颗粒24.3
[0155]
实施例9
[0156]
将5g可溶性冻干丝素蛋白海绵在30℃下溶解至200ml去离子水中,当丝素蛋白完全溶解后,加入浓度为5g明胶蛋白,得到丝素蛋白和明胶蛋白混合溶液,并将混合溶液以10ml/min的速度逐滴加入到200ml含有2w/v%司班80的乙酸乙酯中,获得悬浮在乙酸乙酯中的复合颗粒。使用去离子水清洗蛋白复合颗粒。并将上述颗粒分散液冷冻干燥得到复合蛋白纳米颗粒粉末。使用动态光散射(dls)测试合成的纳米粒子的粒径,如表20所示。
[0157]
表20
[0158]
颗粒尺寸53.4μm
[0159]
将0.1、0.3、0.5g复合蛋白颗粒粉末,1ml去离子水通过鲁尔转接头注射器反复吹打10次,得到可注射、自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’,如表21所示,与实施例1相比,在较低质量分数下,复合蛋白纳米颗粒可借助于其高比表面积和较强相互作用形成稳定的胶体凝胶,而微米颗粒则在低质量分数(10%)下不能成为凝胶,并且相同质量分数的胶体凝胶具有更高的力学强度。
[0160]
表21
[0161][0162]
实施例10
[0163]
将5g可溶性冻干丝素蛋白海绵在30℃下溶解至200ml去离子水中,当丝素蛋白完全溶解后,加入浓度为5g明胶蛋白,得到丝素蛋白和明胶蛋白混合溶液,并分别加入1g的二氧化硅纳米颗粒、纳米黏土颗粒、羟基磷灰石纳米颗粒,并将混合溶液以10ml/min的速度逐滴加入到200ml含有2w/v%司班80的乙酸乙酯中,获得悬浮在乙酸乙酯中的复合颗粒。使用去离子水清洗蛋白复合颗粒。并将上述颗粒分散液冷冻干燥得到复合蛋白纳米颗粒粉末。使用动态光散射(dls)测试合成的纳米粒子的粒径如表22所示。
[0164]
表22
[0165]
纳米颗粒种类颗粒尺寸二氧化硅纳米颗粒49.6μm纳米黏土颗粒51.7μm
羟基磷灰石纳米颗粒67.5μm
[0166]
将0.3g复合蛋白纳米颗粒粉末,1ml去离子水通过鲁尔转接头注射器反复吹打10次,得到可注射、自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’如表23所示,与实施例8得到的复合蛋白微米颗粒相比,核壳结构的构建在不同程度上均提高了颗粒胶体凝胶的强度,并且核层其他纳米颗粒的引入可以赋予复合蛋白颗粒多种组织修复的应用潜力。
[0167]
表23
[0168]
纳米颗粒种类储能模量二氧化硅纳米颗粒3.4kpa纳米黏土颗粒5.1kpa羟基磷灰石纳米颗粒2.7kpa
[0169]
实施例11
[0170]
在50℃下将5g明胶溶于100ml去离子水中得到明胶溶液。分别加入0.125,0.25,0.5,2g的甲基丙烯酸酐于高温下反应两小时,甲基丙烯酸酐与蛋白质分子链上游离的氨基发生亲核取代反应,用盐酸调节ph至7,并加入原溶液2倍体积的丙酮,破坏蛋白质分子表面的水化层,甲基丙烯酸酯明胶沉淀析出,使用去离子水反复清洗后,进行冷冻干燥,得到冻干的甲基丙烯酸酯明胶样品。通过核磁共振氢谱测试明胶表面的氨基的接枝度;根据相应基团谱图变化计算出的接枝度如表24所示;
[0171]
表24
[0172]
甲基丙烯酸酐质量0.125g0.25g0.5g2g氨基接枝度15%32%59%87%
[0173]
在50℃下将5g冻干蚕丝蛋白溶于100ml去离子水中得到蚕丝蛋白溶液。分别加入0.125,0.5,2g的甲基丙烯酸酐于高温下反应两小时,甲基丙烯酸酐与蚕丝蛋白质分子链上游离的氨基和羟基发生蚕丝表面的氨基的接枝度;根据相应基团谱图变化计算出的接枝度如表25所示;
[0174]
表25
[0175]
甲基丙烯酸酐质量0.125g0.5g2g氨基接枝度26%67%91%
[0176]
称量5g上述改性的冻干丝素蛋白和5g改性的明胶蛋白溶解在200ml的40℃去离子水中混合均匀得到蚕丝蛋白和明胶混合溶液,使用盐酸将上述复合蛋白溶液ph调至4,向上述混合溶液中缓慢注入800ml的40℃的丙酮溶剂,剧烈搅拌得到复合蛋白纳米颗粒悬浊液;将悬浮液离心5min,弃去上清液后,沉淀物用去离子水反复冲洗.最后,将离心沉淀物悬浮在水或缓冲液中,并将上述颗粒分散液冷冻干燥得到复合蛋白纳米颗粒粉末。使用动态光散射(dls)测试合成的复合纳米粒子的粒径,粒径如表26所示。
[0177]
表26
[0178]
[0179][0180]
将0.1、0.3和0.5g复合蛋白纳米颗粒粉末,0.005g光引发剂irgcure2959和1ml去离子水通过鲁尔转接头注射器反复吹打10次,得到可注射、自修复胶体凝胶。之后将将可注射,自修复颗粒凝胶在紫外光强100mw/m2下,交联30s,得到共价交联复合胶体凝胶,使用旋转流变仪的时间扫描模式得到水凝胶的储能模量g’如表27所示。其中频率为1hz,应变为0.5%。与实施例1相比,改性后的蚕丝蛋白和结构蛋白经共价交联后,复合颗粒水凝胶的强度增强。
[0181]
表27
[0182]
质量分数储能模量(kpa)10%19.530%78.650%549.6
[0183]
实施例12
[0184]
热重分析采用的样品为实施例6中蚕丝/明胶质量配比分别为1:0.2、1:1及1:4的复合蛋白纳米颗粒粉末,将干燥样品使用tg差热综合分析仪进行分析。取样品初始质量为5mg,温度范围设置为25至800℃,以150ml/min的速率通入气体,升温速率20℃/min,实验结果如图4所示,不同组样品之间的热稳定性具有显著差异,具体地,丝素含量越高,热稳定性越好,进一步表明可通过调控丝素成分的含量,调控颗粒材料的热稳定性。
[0185]
实施例13
[0186]
使用实施例1~11得到的复合蛋白颗粒,以实施例1中的复合颗粒为例,将其制备成质量分数为30%的颗粒水凝胶,通过在三维打印模具中成型得到圆柱形支架(直径12mm,高8mm)。使用万能力学测试机将复合颗粒水凝胶压缩至自身的0.8倍形变时,快速抬起压缩探头(10mm/s)。以实施例1中复合水凝胶为例,图5为探头快速抬起过程中双网络水凝胶结构变化的光学图片,双网络水凝胶能快速跟随探头回复,并且结构完整,表明改类水凝胶具有高弹性及优异的自修复特性,在组织工程应用中有巨大的优势;
[0187]
实施例14
[0188]
使用实施例1~11得到的复合蛋白颗粒,以实施例1中的复合颗粒为例,使用小鼠胚胎成纤维细胞(3t3细胞)评价了复合纳米颗粒的细胞毒性。将复合蛋白颗粒辐照灭菌后乙醇、pbs清洗,后以800ug/ml分散于细胞培养液(含10%胎牛血清)中,浸泡3天以获得浸提液;用细胞培养液(含10%胎牛血清)稀释3t3细胞悬液,调整浓度至1
×
105个细胞/ml,于96孔板内每孔接种100ul细胞悬液,取出生长细胞的96孔板,加入100ul的试验样品(纳米颗粒浸提液)。加样后继续在37℃、5%二氧化碳、湿度≥90%条件下培养24h。之后利用激光共聚焦显微镜观察细胞状态,结果如图6所示,细胞在浸提液中孵育24小时后,细胞正常增殖,细胞毒性可以忽略不计。
[0189]
实施例15
[0190]
使用实施例1~10得到的复合蛋白颗粒,以实施例1中的复合颗粒为例,将复合蛋白颗粒冻干粉末与不同量的去离子水共混,通过鲁尔转接头注射器反复吹打10次,得到可注射自修复胶体凝胶。使用旋转流变仪的时间扫描模式得到胶体凝胶的储能模量g’,自修
复效率通过振荡剪切后胶体凝胶的储能模量与剪切之前比较得到(应变0.1~1000%),图7和图8分别为该材料的剪切变稀和自修复流变测试结果,由图8看出胶体凝胶的储能、损耗模量经历剪切破坏之后能够完全恢复,表明凝胶具有优异的自修复性能。可以看出,复合蛋白颗粒组装水凝胶具有优异的自修复效率和剪切变稀的力学特点,具有可注射、可打印的性能,其自修复效率高于90%。
[0191]
实施例16
[0192]
使用实施例1制备的复合颗粒凝胶,选用30%质量分数组进行3d打印制明胶丝素复合蛋白3d打印支架以及打印性的评估,打印时,将具有剪切变稀自修复的打印墨水以线条挤出的方式层层堆积在玻璃片上:料筒及针头温度室温即可打印,打印针头21g,挤出气压100kpa,打印速度1mm/s,打印线条构成的相邻两打印层间的夹角90
°
,线条间距20μm,预设值10层;通过图9示,复合颗粒凝胶具有良好的生物打印性,打印结构精细。
[0193]
实施例17
[0194]
将0.3g实施例1中冻干丝素明胶复合纳米颗粒粉末与1ml含有间充质干细胞的高糖培养基溶液中(5*105个/cm2接种)通过鲁尔转接头注射器反复吹打10次,使用3d生物打印机将水凝胶打印成特定结构,得到载细胞复合水凝胶支架。水凝胶支架在培养基中培养第1,3天,使用2mm钙黄绿素(绿色荧光标记活细胞)和4mm乙锭同型二聚体(红色荧光标记死细胞)对支架进行死活染色,并使用激光共聚焦显微镜观察细胞增殖情况,绿色代表活细胞,红色代表死细胞,结果如图10所示,组织工程支架上基本呈现出绿色,几乎看不到红色,这表明细胞在组织工程支架材料存活状态良好,且细胞可以沿组织工程支架表面迁移生长。
[0195]
实施例18
[0196]
明胶纳米颗粒的制备:取5g的明胶蛋白溶解在200ml的40℃去离子水中混合均匀得到明胶溶液,将液ph调至4,向上述溶液中缓慢注入800ml的40℃的丙酮溶剂,30mins后加入0.33ml戊二醛溶液(50%浓度)以对纳米颗粒进行交联,继续搅拌12h得到明胶纳米颗粒悬浊液。将悬浮液离心5min,并弃去上清液后,沉淀物用去离子水反复冲洗以去除未反应交联剂,最后得到纳米颗粒悬浊液。将悬浊液冻干即得明胶纳米颗粒。
[0197]
将10mg实施例1得到的复合纳米颗粒与10mg明胶纳米颗粒分别与50μl 1mm nacl溶液(ph 7.0)在2ml管中混合,并在4℃下储存过夜,以使复合纳米颗粒完全膨胀。然后将含有800ng/ml胶原酶的1ml pbs添加到试管中,随后在旋转板上于37℃孵育。分别于1、4、7、10、13、16天后离心(2767g,5min)弃去上清液,并对离心沉淀进行冷冻干燥,之后对残余固体进行称重并计算降解率,n=3。降解率由以下公式计算得出:
[0198]
降解率=(10-冻干固体重量)/10*100%。
[0199]
表28为复合蛋白颗粒与明胶纳米颗粒在各时间点的累计降解率,可以看出,实施例1丝素/明胶复合蛋白颗粒在各时间点的降解率均显著低于明胶纳米颗粒,说明丝素与结构蛋白的复合可以显著延长材料的降解周期,这对将材料应用在医美填充等领域非常有利。
[0200]
表28
[0201]
累计降解率7d14d21d28d56d复合纳米颗粒2.5%15.9%32.8%50.8%59.5%明胶纳米颗粒28.5%69.4%92.4%100%100%
[0202]
实施例19
[0203]
使用实施例1,2所述的颗粒凝胶,使用21g针头注射至balbc小鼠两侧皮下共计100μl的凝胶材料(如图11所示):饲养1、4、8和12周后统一处死,取出植入材料进行称重,以评估材料体内降解性能。表29为各组材料不同时间点的降解率,实验发现复合蛋白颗粒凝胶可稳定填充小鼠皮下12周,而纯明胶蛋白纳米颗粒在第8周即全部降解,不能满足医美填充对植入材料的长期稳定要求。
[0204]
表29
[0205] 14812丝素蛋白/明胶7.5%18.9%59.5%83.9%丝素蛋白/白蛋白2.1%17.8%53.7%79.1%丝素蛋白/弹性蛋白1.%13.5%41.2%72.6%丝素蛋白/明胶5:10%2.8%21.7%53.9%丝素蛋白/明胶1:529.5%59.4%91.5%97.4%明胶34.5%75.9%100%100%
[0206]
实施例20
[0207]
使用实施例1~2所述的胶体凝胶,以实施例1中制备得到的颗粒凝胶为例分别与天然活性因子vegf、抗癌药物阿霉素、蛋白药物免疫球蛋白、核酸类药物mrna共混在37℃环境温度中置于振荡器上(30转/分钟),以模拟体内动态环境。分别在1d,3d,7d,14d和21d吸收1ml的pbs上清液,然后加入等量的新鲜pbs溶液。使用elisa试剂盒、高效液相色谱在每个时间点测量药物成分释放的含量,其中每组三个样品。表30为各种药物在各时间点的累计释放量,经检测,发现在由复合蛋白组装合成的胶体凝胶中,各类药物分子均以一个相对恒定的浓度进行缓慢释放,这种均匀的释放在第28天仍能被检测到,说明可共价交联胶体凝胶具有药物缓释性能,可作为生物活性物质的载体。
[0208]
表30
[0209] 1d4d7d14d28dvegf36.9%50.9%72.8%81.3%89.5%阿霉素29.5%48.4%62.5%73.8%79.5%免疫球蛋白30.5%51.8%68.4%71.8%79.6%mrna36.4%52.6%75.1%84.9%90.5%
[0210]
对于任何熟悉本领域的技术人员而言,在不脱离本发明技术方案范围情况下,都可利用上述揭示的技术内容对本发明技术方案作出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同变化及修饰,均应仍属于本发明技术方案保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1