基因片段B在培育植物新材料中的应用的制作方法
基因片段b在培育植物新材料中的应用
技术领域
1.本发明属于遗传育种领域,涉及基因序列的应用。
背景技术:
2.植物在生长过程中受到许多非生物胁迫的影响,高温、干旱、土壤盐渍化等非生物胁迫不仅限制了作物的生长范围,还制约着作物的产量,造成全作物的损失。随着全球气候变化,各种极端环境的出现严重影响粮食作物的生产;伴随全球人口的增加和可用耕地面积的减少,粮食安全越来越重要。中国是人口大国,可用耕地面积少,存在很多边际土地和盐碱地,面临的粮食安全挑战十分严峻。
3.因此,通过现代生物学技术培育高产、抗逆性强的作物新品种,是提高作物产量、保障粮食安全和农业可持续发展的重要手段。
4.鸭茅(dactylis glomerata)又名果园草(orchardgrass),是一种世界范围内广泛栽培的高产优质的多年生冷季型禾本科牧草。其产量高、品质好、适应性强,抗逆性优于其他多年生冷季型禾草,在我国被广泛用于割草地和放牧草地,是林下种草和人工混播草地重要的优良草种,也是我国西南石漠化治理的骨干草种。
5.我国农业结构调整和居民生活水平不断提高,人们对畜产品的需求量不断增长。如果利用耕地种植牧草,则会造成人畜争粮,加剧我国粮食安全挑战。
6.培育高产、抗逆的鸭茅新品种,提高边际土地和盐碱地的利用率,不仅能够满足迅猛发展的畜牧业需求,还能减轻粮食安全带来的挑战。
7.发明人在完成本发明的过程中,发现鸭茅基因组复杂,对其高产和抗逆相关基因的研究较少。虽然鸭茅基因组已经公布,但功能基因资源还需要进一步挖掘、探索,以更好地服务于生产。
技术实现要素:
8.鉴于此,本发明目的在于提供一种新挖掘到的功能基因片段b,该功能基因片段b能够用于培育植物新材料。
9.发明人通过长期的探索和尝试,以及多次的实验和努力,不断的改革创新,为解决以上技术问题,本发明提供的技术方案是,提供一种基因片段b在培育植物新材料中的应用,所述基因片段b包含选自下组的核苷酸序列:
10.a、序列表seq id no.1所示核苷酸序列;
11.b、与a所述序列互补的核苷酸序列,或具有70%以上同源性的核苷酸序列;
12.c、编码序列表seq id no.2所示的氨基酸序列的核苷酸序列。
13.进一步地,所述基因片段b用于提高植物新材料的生长量。
14.进一步地,所述基因片段b用于增强植物新材料的逆境胁迫抵抗能力。
15.进一步地,所述逆境胁迫包括干旱、高温、盐胁迫、aba中的一种或多种。
16.优选地,所述植物为禾本科植物。
17.优选地,所述植物为禾本科牧草。
18.优选地,所述植物为鸭茅。
19.进一步地,应用步骤如下:
20.s1、提取植物材料中的rna,
21.s2、鉴定rna中是否存在基因片段b;
22.s3、扩增得到全长基因片段b;
23.s4、构建植物表达载体;
24.s5、侵染转化,筛选阳性植株进行培养;
25.s6、繁殖世代至转基因纯合型株系。
26.进一步地,所述s2中,使用seq id no.3和seq id no.4所示核苷酸序列作为基因片段b的特异性引物,用seq id no.5和seq id no.6作为内参基因。
27.进一步地,所述s3中,使用seq id no.7和seq id no.8所示核苷酸序列作为基因片段b的全长扩增引物。
28.与现有技术相比,上述技术方案中的一个技术方案具有如下优点:
29.a)申请人挖掘到的新的功能基因片段b,经过试验验证,该基因片段b能够被干旱、高温、盐胁迫和aba处理显著诱导表达,通过转基因及功能鉴定证实过量表达基因片段b能够提高转基因植株生物量和抗逆性。
30.b)本发明的结果有助于改良植物特别是鸭茅的抗逆性,并通过分子辅助育种缩短育种年限。
附图说明
31.为了更清楚地说明本发明实施方式的技术方案,下面将对实施方式中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
32.图1是鸭茅dgma ds114序列分析结果。
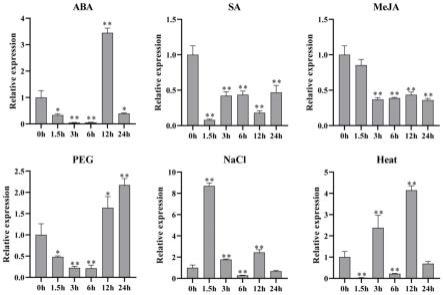
33.图2是鸭茅dgmads114在不同处理下的表达模式分析结果。
34.图3是转mada-box基因拟南芥和野生型拟南芥在正常条件下的生长34d的对比结果。图3中,a为表型对比,b为植株鲜重对比,**表示差异水平极显著,p《0.01。
35.图4是转mada-box基因拟南芥和野生型拟南芥在不同处理下的生长对比结果。图4中,a为表型对比,b为植株根长对比,*表示差异水平显著,p《0.05;**表示差异水平极显著,p《0.01。
36.图5是转基因拟南芥和野生型拟南芥在高温(35℃)处理5d后,在正常条件下恢复10d后的对比结果。图5中,a为表型对比,b为存活率对比。图a中的*表示存活的拟南芥植株;图b中的*表示差异水平显著,p《0.05。
具体实施方式
37.下面结合附图与一个具体实施例进行说明。
38.为使本发明实施方式的目的、技术方案和优点更加清楚,下面将结合本发明实施
方式中的附图,对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。因此,以下对在附图中提供的本发明的实施方式的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施方式。
39.应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中可以不对其进行进一步定义和解释。
40.本实施例所描述的基因片段b包含选自下组的核苷酸序列:a、序列表seq id no.1所示核苷酸序列;b、与a所述序列互补的核苷酸序列,或具有70%以上同源性的核苷酸序列;c、编码序列表seq id no.2所示的氨基酸序列的核苷酸序列。具体地,基因片段b是鸭茅dgmads114基因,以下都以鸭茅dgmads114基因或dgmads114进行说明,核苷酸序列如序列表seq id no.1所示,该核苷酸序列编码的氨基酸序列如序列表seq id no.2所示。
41.虽然鸭茅全基因组已经公布,但是基于该基因组的遗传功能资源还没有得到充分开发利用。鸭茅的染色体数量多,基因组复杂,申请人根据鸭茅生长特点首先提出鸭茅基因组中具有高产、抗逆相关基因的猜想,并通过科学技术手段分析、鉴定得到鸭茅dgmads114基因,进一步验证了鸭茅dgmads114基因在拟南芥转基因植株中的表达结果,充分说明了本发明所述基因片段b可以用于培育植物新材料,进一步筛选出适用于农业生产的植物新品种,所述植物为禾本科植物,特别是禾本科牧草,例如鸭茅。
42.发明人首先从pfam数据库(http://pfam.xfam.org/)中下载mads-box转录因子保守结构域srf-tf和k-box的隐马可夫模型(hidden markov model,hmm)文件(pf00319和pf01486),然后利用下载的hmm文件在hmmer软件(version 3.0)中以默认参数对鸭茅的所有蛋白进行搜索,搜索鸭茅中潜在的mads-box蛋白。再通过pfam数据库、ncbi cdd和smart对搜索出来的mads-box进行进一步确认。经过进一步对结构域确定后,在鸭茅基因组中鉴定到了123个mads-box转录因子,本技术中的dgmads114(dg7c03991.1)就是其中之一。核苷酸序列如序列表seq id no.1所示。通过dgmads114的基因id从鸭茅基因组注释文件中获得dgmads114(dg7c03991.1)基因的cds序列和编码的氨基酸序列,cds编码区全长531bp,编码176个氨基酸,该基因位于鸭茅7号染色体,氨基酸序列如序列表seq id no.2所示,该基因位于鸭茅7号染色体,位置是176042088-176042618,申请人将其命名为dgmads114。
43.通过理化性质分析,其蛋白的相对分子质量为19632.2da,等电点为10.36。基因结构分析显示,参见图1中a,该基因只有一个外显子,不含内含子;参见图1中b,该基因编码的蛋白含有一个mads domain,属于mads-box转录因子家族。从鸭茅基因组中提取dgmads114上游2000bp序列,对其启动子进行分析,参见图1中的c,发现dgmads114含有3种类型的元件:
44.(1)激素响应元件,如aba、生长素、ga、meja响应元件;
45.(2)光响应元件;
46.(3)胁迫响应元件,如干旱、胁迫防御元件。
47.基于以上技术分析,发明人推测dgmads114可能在鸭茅生长发育、逆境胁迫以及光周期调控中发挥重要作用。
48.鸭茅dgmads114在不同逆境处理下的表达模式分析
49.1、鸭茅材料培养与处理
50.为了验证dgmads114基因在不同处理下的表达模式,选取鸭茅品种“德娜塔”为材料。德娜塔种子在放置装有石英砂的方形小白盆中,并浇灌蒸馏水以保证种子萌发,在14h(22℃)白天/10h(20℃)黑暗条件下进行萌发,待种子发芽后浇灌霍格兰营养液培养60d,然后分别进行20%聚乙二醇(peg-6000)处理、38℃热胁迫处理、250mm nacl处理、100μm aba处理、100μm sa处理、100μm meja处理,分别在0h、1.5h、3h、6h、12h、24h收集植株,并迅速在液氮中冷冻,然后储存在-80℃冰箱用于rna提取。
51.2、鸭茅rna提取
52.使用direct-zol
tm rna miniprep试剂盒(zymo research)试剂盒按照内附说明书提取胁迫处理鸭茅样品的rna。提取得到的rna用1%的琼脂糖凝胶电泳检测其完整性,并用nanodrop nd-2000分光光度计(thermo scientific)检测rna浓度和纯度。
53.3、cdna第一链的合成:
54.使用monscript
tm
rtiii all-in-one mix with dsdnase试剂盒(monad biotech)将提取的rna合成为cdna。
55.4、荧光定量pcr检测dgmads114基因的表达量
56.(1)利用primer 6.0软件设计dgmads114基因的特异性引物(正向引物见seq id no.3,反向引物见seq id no.4),用鸭茅dggapdh基因作为内参基因(正向引物见seq id no.5,反向引物见seq id no.6),引物序列见下表:
57.dgmads114-f:cggcaacggcaagaagacgaa,
58.dgmads114-r:acggcaagctcggaggtctt,
59.dggapdh-f:tctgaccgttagacttgagaagg,
60.dggapdh-r:cttgagcttaccctcagactcct。
61.(2)荧光定量pcr:使用evagreen 2x qpcr master mix试剂盒(abm inc.)和cxf connect
tm
荧光定量pcr仪(bio-rad)完成。具体过程如下:
62.1)将上述合成的cdna原液稀释20倍;
63.2)配制反应体系(冰上操作),总反应体系为20μl:
[0064][0065]
将配制好的体系混匀,离心至无气泡,然后使用cxf connect
tm
荧光定量pcr仪进行荧光定量pcr,根据evagreen 2x qpcr master mix试剂盒制造商的建议按照两步法设置prc程序:95℃预变性3min;95℃变性15s,60℃退火&延伸1min,共40个循环,采用cxf connect
tm
荧光定量pcr仪默认程序进行溶解曲线分析。完成上述反应后,将数据导出,根据2
‑△△
ct
法计算基因的表达量。
[0066]
(3)结果分析:
[0067]
由图2可知,在不同处理下,dgmads114的表达量均发生了显著的变化,各处理条件及不同时间点下其表达量不同。
[0068]
在aba处理下,dgmads114在12h被显著诱导上调表达,而sa和meja均显著抑制其表达。
[0069]
peg处理下,dgmads114的表达在前6个小时被抑制,而在12h和24h表达量显著提高。
[0070]
nacl处理下,dgmads114在1.5h表达量最高,然后开始降低,与对照(0h)相比,处理3h和12h后其表达量均高于对照。
[0071]
在热处理下,dgmads114的表达量显著高于对照。
[0072]
这些结果表明,dgmads114在鸭茅对抗逆境胁迫中发挥了重要作用。
[0073]
拟南芥异源超表达鉴定dgmads114基因的功能
[0074]
1、dgmads114基因全长扩增引物设计
[0075]
利用primer 6.0软件设计引物,采用pcr方法从德娜塔鸭茅中进行扩增,所用cdna为上述步骤中0h的样品。为了扩增基因编码区全长,并加上特定酶切位点,根据cds序列,分别在起始密码子atg和终止密码子处设计含有适合酶切位点引物。所用酶切位点为hind3和xba1。引物序列见下表(seq id no.7和seq id no.8):
[0076]
f:ccagtctctctctcaagcttatggcgcagtcaccgctcgg,
[0077]
r:gatacgaacgaaagctctagattaattaactgaagcgtgtgct。
[0078]
2、dgmads114-phb植物表达载体构建
[0079]
遗传转化所用的载体为phb,启动子为camv35s,转化植物的筛选标记为潮霉素(hyg)。通过载体上hind3和xba1两个酶切位点将目的基因dgmads114的编码区连接到载体phb上。具体包括以下步骤:以德娜塔鸭茅cdna为模板利用上述引物通过max master mix(dye plus)高保真酶(vazyme)进行pcr扩增得到鸭茅dgmads114基因;将pcr产物用1%琼脂糖凝胶电泳检测,确认是否含有目的基因的片段;将具目的基因条带的凝胶用gel dna extraction mini kit(vazyme)凝胶试剂盒根据内附说明书进行回收;然后将带有接头的pcr产物和双酶切的phb质粒用ii one step cloning kit试剂盒根据内附说明书进行连接。将连接产物转化到大肠杆菌dh5α感受态中,用含有kan抗生素的lb培养皿进行筛选,取培养皿上的单克隆菌落进行扩繁,同时进行pcr检测,选取检测为阳性的单克隆菌落送测序公司进行测序。经测序鉴定后,将重组质粒转化eha105农杆菌感受态,并通过菌液pcr鉴定筛选阳性克隆,检测为阳性的单克隆菌则为构建好的植物表达载体,并保存于-80℃。
[0080]
3、农杆菌介导的拟南芥已转转化及阳性转基因株系的筛选
[0081]
(1)拟南芥培养:在1.5ml的ep管中装入适量的col生态型拟南芥种子(野生型,wt),然后加入1ml10%的naclo溶液灭菌10min,然后用无菌水冲洗5次,用枪头吸取种子,播于提前配制好的ms固体培养基上,用封口膜封口后放置在4℃暗条件下春化3d,放入到人工气候室中开始萌发生长,温度22℃;16h光/8h暗,光照强度为80-200μmol/m2/s条件下培养。种子在ms培养基上萌发7d后,选取健壮、生长一致的苗子移栽到事先用水浸透的栽培基质
中,栽培基质由2:1:1泥炭土、蛭石和珍珠岩组成,拟南芥苗子移栽后覆盖保鲜膜,到苗生长正常后揭去。在拟南芥生长时注意浇水和施用花多多复合肥(n:p:k=20:20:20)保持拟南芥生长所需要的湿度和营养。
[0082]
(2)拟南芥花序侵染转化:取适量于-80℃具植物表达载体的农杆菌菌液,接种到含1.5ml抗生素(kan、rif)的lb液体培养基(用50ml蓝盖离心管)中,30℃,200rpm振荡培养24小时活化农杆菌菌液。取1ml活化后的菌液加入加入100ml含有抗生素(kan、rif)的lb液体培养基中,30℃,200rpm振荡培养到od600=1.0左右;于4000rpm,离心15min,弃掉上清收集菌体。将收集的菌体用5%蔗糖溶液重悬菌体至od600=1.0左右;然后加入0.05%(v/v)silwet l-77摇匀,作为转化液。待移栽的拟南芥处于开始开花时,挑选生长健壮的植株为待转化植株,转化前不断去除顶端花序,以使植株产生更多的花蕾,转化前一天需将待转化植株充分浇水。将拟南芥花序置于转化介质中30-50s,浸染后,将拟南芥在避光条件下平放24h。将侵染后的拟南芥放置正常条件下培养;为了提高转化效率,可在约一周后进行重复侵染。待侵染植株种子成熟后,收获拟南芥种子,为转基因t0代种子。将收获的拟南芥种子至于离心管中,先用1ml10%的naclo溶液灭菌10min,然后用无菌水冲洗5遍,用枪头吸取种子,播于含有50ug/ml潮霉素的ms固体培养基上。4℃黑暗条件下春化3d,转移至人工气候室中,温度22℃;光周期16h光/8h暗,光照强度为80-200umol/m2/s条件下培养。培养8-15d后,选取叶片绿色、根系发育正常的阳性植株移植到栽培基质中继续培养,阴性植株叶片发黄甚至死亡。移植前栽培基质充分吸水,移植后覆盖保鲜膜,到苗生长正常后揭去,以后管理同上。待植株生长一个月后取适量叶片提取dna用pcr检测目的基因是否插入到拟南芥基因组。每一代的植株都要进行阳性株系检测,直至繁殖至t3代,获得纯合转基因拟南芥株系用于实验。
[0083]
4、转基因拟南芥植株培养与处理的表型鉴定与分析
[0084]
为了探究过表达dgmads114对拟南芥生物量的影响,将野生型(wt)和过表达植株(oe)种子点播在0.5ml ep管上。具体操作如下:0.5ml离心管盖子中部打有直径2mm的圆孔,底部被剪掉,用透明胶带封住圆孔后,从剪开的底部加入150μl 0.7%的琼脂糖,然后在充满1/2霍格兰营养液。将准备好的0.5ml ep管放到充满1/2霍格兰溶液的2ml ep管盒子中,再将种子点播在0.5ml ep管盖子的圆孔中,盖上ep管盒子的盖子。将ep管盒子放到人工气候室中,温度22℃;光周期16h光/8h暗,光照强度为80-200μmol/m2/s条件下培养。2周后,将长势一致的wt和oe植株连同0.5ml ep管一起转移并插入提前准备好的eu箱盖的圆孔中,并将箱盖盖在充满1/2霍格兰溶液的eu箱上继续培养植株,20d后进行拍照和植株鲜重测量。注意在培养过程中补充1/2霍格兰营养液。
[0085]
干旱、盐胁迫、aba胁迫处理:将转基因t3代植株(oe)和野生型(wt)拟南芥种子用10%naclo灭菌10min、然后用无菌水冲洗5遍,用枪头吸取种子,播于ms固体培养基上。4℃黑暗条件下春化3d,转移至人工气候室中,温度22℃;光周期16h光/8h暗,光照强度为80-200μmol/m2/s条件下培养。种子萌发3d后,将幼苗转移到含有100mm nacl、8%peg-6000和30μm aba的ms培养基上,培养10d,用根系扫描仪测定wt和oe植物的根长。
[0086]
热处理:wt和oe灭菌种子经过灭菌后,播于ms固体培养基上,4℃黑暗条件下春化3d,然后转移至人工气候室中进行培养,待种子萌发13d后,将平板转移到培养箱,35℃培养5d,再回到22℃恢复10d,观察表型并统计wt和oe的存活率。
[0087]
5、转基因拟南芥植株的表型鉴定与分析
[0088]
如图3所示,在1/2霍格兰营养液水培34d后,野生型拟南芥植株明显小于转基因拟南芥(参见图3中a图),对其植株的鲜重进行测量,发现转基因拟南芥的鲜重显著高于野生型拟南芥(参见图3中b图)。
[0089]
如图4所示,在aba、peg和nacl处理下,野生型拟南芥的根生长受到限制,而转基因拟南芥的明显要好于野生型,而在对照条件(ms)下,转基因拟南芥和野生型拟南芥的根生长发育较一致,无明显差异(参见图4中的a图)。通过测定转基因和野生型拟南芥的根长,发现在对照条件(ms)下,转基因拟南芥和野生型拟南芥的根长没有明显差异,而在aba、peg和nacl处理下,转基因拟南芥的根长明显长于野生型(参见图4中的b图)。
[0090]
在aba处理下,转基因株系oe12的根长显著长于野生型。
[0091]
在peg处理下,转基因株系oe6和oe12的根长显著长于野生型。
[0092]
在nacl处理下,三个转基因株系(oe6、oe12和oe16)的根长均显著长于野生型。
[0093]
表明过表达dgmads114基因能够增强植物的逆境胁迫的抵抗能力。
[0094]
参见图5,在高温处理后,转基因拟南芥的植株长势明显好于野生型(参见图5中的a图)。通过统计转基因拟南芥和野生型拟南芥高温处理后的存活率,发现转基因株系的存活率明显高于野生型,尤其是转基因株系oe12和oe16的存活率与野生型相比达到显著水平(参见图5中的b图)。
[0095]
表明过表达dgmads114基因能够减轻高温对植物的伤害。
[0096]
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1