一种1,2,3,4-四氢-β-咔啉衍生物及其制备方法和应用
1.本发明属于药物化学技术领域,具体涉及一类1,2,3,4-四氢-β-咔啉衍生物及其制备方法和应用,尤其是涉及一类含3-氨基丙酰胺、2-氨基乙酰胺、1,3-丙二胺和二硫代氨基甲酸酯亚结构的1,2,3,4-四氢-β-咔啉类化合物及其制备方法和应用。
背景技术:
2.植物病害是影响全球农业生产的主要因素之一,严重影响农产品的产量和质量,不但造成极大的经济损失,还威胁着人类的健康。如水稻白叶枯病、柑橘溃疡病、猕猴桃溃疡病、烟草青枯病、小麦赤霉病、水稻纹枯病等,每年都会不同程度地爆发,给农民造成巨大的经济损失。长期使用传统杀菌剂,如噻菌铜、叶枯唑、硫酸链霉素、多菌灵等,不仅增加了植物病原菌的抗药性,而且对生态环境和植物的安全都造成了有害影响。因此,迫切需要开发具有高活性、高选择性且结构新颖的新型农药。
技术实现要素:
3.针对以上问题,本发明目的之一在于提供一种1,2,3,4-四氢-β-咔啉衍生物,1,2,3,4-四氢-β-咔啉衍生物作为一种具有高活性、高选择性的新型农药,该化合物是以1,2,3,4-四氢-β-咔啉为起始原料,合成系列含3-氨基丙酰胺、2-氨基乙酰胺、1,3-丙二胺和二硫代氨基甲酸酯亚结构的1,2,3,4-四氢-β-咔啉类化合物;该化合物对致病植物病原细菌具有良好的抑制作用,针对病原细菌[如水稻白叶枯病菌(xanthomonas oryzaepv.oryzae,xoo)、柑橘溃疡病菌(xanthomonas axonopodispv.citri,xac)和猕猴桃溃疡病菌(pseudomonas syringaepv.actinidiae,psa)等]和真菌[如水稻纹枯病菌(rhizoctonia solani)等]均具有良好的抑制效果。
[0004]
为了达到上述目的,可以采用以下技术方案:
[0005]
本发明一方面提供一种1,2,3,4-四氢-β-咔啉衍生物或其立体异构体、或其盐或其溶剂化物,化合物结构式如式a所示,
[0006][0007]
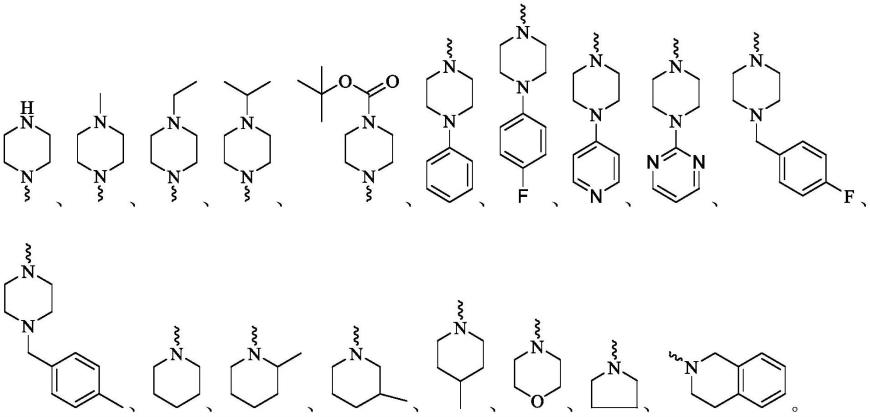
其中,r选自以下结构中的任一种:
[0008][0009]
其中,r1和r2各自独立的选自氢,任意取代或未取代的烷基,任意取代或未取代的
烯基,任意取代或未取代的环烷基,任意取代或未取代的芳基,任意取代或未取代的杂芳基中的一个或多个,任意取代或未取代的苄基;或r1和r2相连构成任意取代的4至10元环中任一种或含杂原子的环,杂原子为n、o和s中的一个或多个。
[0010]
本发明另一方面提供一种上述1,2,3,4-四氢-β-咔啉衍生物的制备方法,r选自结构a的化合物的制备方法包括:
[0011][0012]
r选自结构b的化合物的制备方法包括:
[0013][0014]
r选自结构c的化合物的制备方法包括:
[0015][0016]
r选自结构d的化合物的制备方法包括:
[0017][0018]
r选自结构e的化合物的制备方法包括:
[0019][0020]
本发明再一方面提供一种组合物,其包括上述的1,2,3,4-四氢-β-咔啉衍生物或其立体异构体或其盐或其溶剂化物。
[0021]
本发明再一方面提供一种药物,其特征在于,其包括上述的1,2,3,4-四氢-β-咔啉衍生物或上述的组合物;及稀释剂或辅料。
[0022]
本发明再一方面提供一种上述的1,2,3,4-四氢-β-咔啉衍生物或其立体异构体或其盐或其溶剂化物或上述的组合物或上述的药物在防治农业真菌和细菌病害中的应用。
[0023]
本发明有益效果至少包括:
[0024]
(1)本发明提供的1,2,3,4-四氢-β-咔啉衍生物对致病植物病原菌具有良好的抑制作用,针对病原细菌[如水稻白叶枯病菌、柑橘溃疡病菌和猕猴桃溃疡病菌等]和植物病原真菌[如水稻纹枯病菌等]均具有良好的抑制效果;
[0025]
(2)本发明提供的1,2,3,4-四氢-β-咔啉衍生物的制备方法简单,反应条件温和。
具体实施方式
[0026]
所举实施例是为了更好地对本发明进行说明,但并不是本发明的内容仅局限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
[0027]
本文中使用的术语仅用于描述特定实施例,并且无意于限制本公开。除非在上下文中具有明显不同的含义,否则单数形式的表达包括复数形式的表达。如本文所使用的,应当理解,诸如“包括”、“具有”、“包含”之类的术语旨在指示特征、数字、操作、组件、零件、元件、材料或组合的存在。在说明书中公开了本发明的术语,并且不旨在排除可能存在或可以添加一个或多个其他特征、数字、操作、组件、部件、元件、材料或其组合的可能性。如在此使用的,根据情况,“/”可以被解释为“和”或“或”。
[0028]
本发明中所使用到的术语“烷基”是包括具有特定数目碳原子的支链和直链饱和烃基。例如“c
1-10
烷基”(或亚烷基)目的是c1、c2、c3、c4、c5、c6、c7、c8、c9和c10烷基。另外,例如“c
1-6
烷基”表示具有1到6个碳原子的烷基。烷基可为非取代或取代的,以使一个或多个其氢原子被其它化学基团取代。烷基的实施例包括但不限于甲基(me)、乙基(et)、丙基(如正丙基和异丙基)、丁基(如正丁基、异丁基、叔丁基)、戊基(如正戊基、异戊基、新戊基)及其类似物。
[0029]
本发明中所使用到的术语“烯基”是既包括直链或支链结构的烃,且具有一个或多个出现在链中任何稳定点的碳-碳双键。例如“c
2-6
烯基”(或亚烯基)目的是包括c2、c3、c4、c5和c6烯基。烯基的实例包括但不限于乙烯基、1-丙烯基,2-丙烯基、2-丁烯基、3-丁烯基、2-戊烯基、3-戊烯基、4-戊烯基、2-己烯基、3-己烯基、4-己烯基、5-己烯基、2-甲基-2-丙烯基、4-甲基-3-戊烯基及其类似物。
[0030]
本发明中所使用到的术语“炔基”是既包括直链或支链结构的烃,且具有一个或多个出现在链中任何稳定点的碳-碳叁键。例如“c
2-6
炔基”(或亚炔基)目的是包括c2、c3、c4、c5和c6炔基;如乙炔基、丙炔基、丁炔基、戊炔基、己炔基及其类似物。
[0031]
本发明中所使用到的术语“取代的”指的是在指定原子或基团上的任意一个或多个氢原子以选择的指定基团取代,前提是不超过指定原子的一般化合价。如果没有其它说明,取代基命名至中心结构。例如,可以理解的是当(环烷基)烷基是可能的取代基,该取代基至中心结构的连接点是在烷基部分中。此处使用的环双键是形成于两个临近环原子之间的双键(如c=c、c=n或n=n)。当提到取代时,特别是多取代时,指的是多个取代基在指定基团上的各个位置上取代,如二氯苯基指的是1,2-二氯苯基、1,3-二氯苯基、1,4-二氯苯基和2,4-二氯苯基。取代基和或变量的组合是允许的,仅当这些组合产生稳定的化合物或有用的合成中间体。稳定的化合物或稳定结构暗示所述化合物以有用的纯度从反应混合物分离出来时是足够稳定的,随之配制形成有效的治疗试剂。优选地,目前所述化合物不包含n-卤素、s(o)2h或s(o)h基。
[0032]
本发明中所使用到的术语“芳基”指的是在环部分具有6到12个碳原子的单环或双环芳香烃基,如苯基和萘基,每个可被取代的。
[0033]
本发明中所使用到的术语“卤素”或“卤素原子”指的是氯、溴、氟和碘。
[0034]
本发明中所使用到的术语“卤代烷基”指的是具有一个或多个卤素取代基的取代烷基。例如“卤代烷基”包括单、双和三氟甲基;即便卤代烷基中的卤代被明确为氟、氯、溴、碘,同样指的是具有一个或多个氟、氯、溴、碘取代基的取代烷基。
[0035]
本发明中所使用到的术语“杂芳基”指的是取代和非取代芳香5或6元单环基团,9-或10-元双环基团,和11到14元三环基团,在至少一个环中具有至少一个杂原子(o,s或n),所述含杂原子的环优选具有1、2或3个选自o、s和n中的杂原子。含杂原子的杂芳基的每个环可含一个或两个氧或硫原子和/或由1到4个氮原子,前提是每个环中杂原子的总数是4或更少,且每个环具有至少一个碳原子。完成双环和三环基团的稠合环可仅含有碳原子,并可以是饱和、部分饱和或不饱和。氮和硫原子可任选被氧化且氮原子可任选被季铵化。双环或三环的杂芳基必须包括至少一个全芳香环,氮其它稠合环可为芳香性或非芳香性的。杂芳基可在任何环的任何可利用氮或碳原子上连接。当化合价允许,如果所述其它环是环烷基或杂环,其另外任选以=o(氧)取代。示例性单环杂芳基包括吡咯基、吡唑基、吡唑啉基、咪唑基、噁唑基、异噁唑基、噻唑基、噻二唑基、呋喃基、噻吩基、噁二唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基及其类似物。示例性双环杂芳基包括吲哚基、苯并噻唑基、苯并二氧杂环戊烯基、苯并噁唑基、苯并噻吩基、喹啉基、四氢异喹啉基、异喹啉基、苯并咪唑基、苯并呋喃基、吲哚嗪基、苯并呋喃基、色酮基、香豆素基、苯并呋喃基、噌啉基、喹喔啉基、吲唑基、吡咯并吡啶基、氟代吡啶基、二氢异吲哚基、四氢喹啉基及其类似物。
[0036]
本发明中所使用到的术语“化合物”如果没有其它说明,理解为包括游离态和其盐。“盐”表示以无机和/或有机酸和碱形成酸式和/或碱式盐;另外,“盐可包括两性离子(内盐),如当式i化合物含有碱性片段如胺或吡啶或咪唑环,和酸式片段如羧酸。药物上可接受的(即非毒性、生理学上可接受的)盐是优选的,如可接受的金属和胺盐,其中阳离子没有显著贡献毒性或盐的生物活性。然而,其它盐可是有用的,如在制备过程中采用分离或纯化步骤,因此也包含于本发明范围中。
[0037]
本发明中,c
1-c
10
烷基指的是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基及其同分异构体;c
1-c
10
烷氧基指的是甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基、庚氧基、辛氧基、壬氧基、癸氧基及其同分异构体;c
2-c5烯基指的是乙烯基、丙烯基、烯丙基、丁烯基、戊烯基及其同分异构体。
[0038]
本发明中,当提到取代基为烯基、炔基、烷基、卤素、芳基、杂芳基、烷氧基、环烷基、羟基、氨基、巯基、膦基时,或这些取代基具体的为某个具体的烯基、炔基、烷基、卤素、芳基、杂芳基、烷氧基、环烷基、羟基、氨基、巯基、膦基时,指的是一个到三个上述取代基。如甲基苯基指的是一个到三个甲基取代的苯基。
[0039]
本发明一方面提供一种1,2,3,4-四氢-β-咔啉衍生物或其立体异构体、或其盐或其溶剂化物,化合物结构式如式a所示,
[0040][0041]
其中,r选自以下结构中的任一种:
[0042][0043]
其中,r1和r2各自独立的选自氢,任意取代或未取代的烷基,任意取代或未取代的烯基,任意取代或未取代的环烷基,任意取代或未取代的芳基,任意取代或未取代的杂芳基中的一个或多个,任意取代或未取代的苄基;或r1和r2相连构成任意取代的4至10元环中任一种或含杂原子的环,杂原子为n、o和s中的一个或多个。
[0044]
根据权利要求1所述的化合物,其特征在于,r1和r2各自独立的选自氢、任意取代或未取代的c
1-6
烷基、任意取代或未取代的c
2-6
烯基、任意取代或未取代的c
5-10
环烷基、任意取代或未取代的c
5-10
芳基、任意取代或未取代的c
5-10
杂芳基、任意取代或未取代的苄基;或r1和r2相连构成任意取代的5-10元环或含杂原子的环。
[0045]
在一些实施例中,上述1,2,3,4-四氢-β-咔啉衍生物中,r1和r2各自独立的选自氢、甲基、烯丙基、苯基、苄基、氟苄基、氯苄基、三氟甲基苄基、甲基苄基、甲氧基苄基、2-呋喃甲基或2-噻吩甲基。
[0046]
在一些实施例中,上述1,2,3,4-四氢-β-咔啉衍生物中,当r1和r2相连成环时为下列基团中的任一一种:
[0047][0048]
在一些实施例中,上述1,2,3,4-四氢-β-咔啉衍生物可以选自以下结构中的任一种:
[0049]
[0050]
[0051][0052]
本发明另一方面提供一种上述1,2,3,4-四氢-β-咔啉衍生物的制备方法,其中,
[0053]
r选自结构a的化合物的制备方法包括:
[0054][0055]
r选自结构b的化合物的制备方法包括:
[0056][0057]
r选自结构c的化合物的制备方法包括:
[0058][0059]
r选自结构d的化合物的制备方法包括:
[0060][0061]
r选自结构e的化合物的制备方法包括:
[0062][0063]
需要说明的是,上述r选自结构a-e的化合物分别对应上述的式(i)-式(v)的化合物。
[0064]
在一些实施例中,上述1,2,3,4-四氢-β-咔啉衍生物的制备方法中,式(vi)所示化合物的制备方法包括:
[0065][0066]
式(vii)所示化合物的制备方法包括:
[0067][0068]
式(viii)所示化合物的制备方法包括:
[0069][0070]
式(ix)所示化合物的制备方法包括:
[0071][0072]
在一些实施例中,上述1,2,3,4-四氢-β-咔啉衍生物的制备方法中,
[0073]
r选自结构a的化合物的制备方法包括:
[0074][0075]
r选自结构b的化合物的制备方法包括:
[0076][0077]
r选自结构c的化合物的制备方法包括:
[0078][0079]
r选自结构d的化合物的制备方法包括:
[0080][0081]
r选自结构e的化合物的制备方法包括:
antiviral,fungicidal,and insecticidal activities of tetrahydro-β-carboline-3-carbohydrazide derivatives[j].j.agric.food chem.,2014,62,9987
–
9999.]设计并合成了一系列1,2,3,4-四氢-β-咔啉-3-羧酸衍生物,并评估了所有目标分子的生物活性。研究结果表明,多数化合物对烟草花叶病毒(tmv)表现出优异的活性,同时还发现此类化合物在田间对烟草花叶病也具有较为优异的防效。同时,还发现此类化合物还具有一定的杀虫及抗真菌活性。
[0092]
2018年,ombiro等[ombiro,g.s.;sawai,t.;noutoshi,y.;matsui,h.;yamamoto,m.;toyoda,k.;ichinose,y.specific growth inhibitors of ralstonia solanacearum,xanthomonas oryzaepv.oryzae,x.campestrispv.campestris,and clavibactermichiganensis subsp.michiganensis[j].microbiol.res.,2018,215,29
–
35.]报道了多个1,2,3,4-四氢-β-咔啉类化合物,并评估了其抗植物病菌活性。生物活性研究结果表明,部分化合物对青枯病菌(ralstonia solanacearum)、水稻白叶枯病菌(xanthomonas oryzaepv.oryzae)、十字花科黑腐病菌(xanthomonascampestrispv.campestris)和番茄细菌性溃疡病菌(clavibactermichiganensis subsp.michiganensis)等植物病原细菌都有较好的生长抑制作用。
[0093]
2020年,liu等[liu,h.w.;ji,q.t.;ren,g.g.;wang,f.;su,f.;wang,p.y.;zhou,x.;wu,z.b.;li,z.;yang,s.antibacterial functions and proposed modes of action of novel1,2,3,4-tetrahydro-β-carboline derivatives that possess an attractive 1,3-diaminopropan-2-ol pattern against rice bacterial blight,kiwifruit bacterial canker,and citrus bacterial canker[j].j.agric.food chem.2020,68(45),12558-12568.]报道了系列含异丙醇胺亚结构的1,2,3,4-四氢-β-咔啉衍生物,并评估了其抗植物病原细菌活性。生物活性测试结果表明,合成得到的大多数化合物对水稻白叶枯病菌(xanthomonas oryzaepv.oryzae,xoo)、柑橘溃疡病菌(xanthomonas axonopodispv.citri,xac)和猕猴桃溃疡病菌(pseudomonas syringaepv.actinidiae,psa)都有较好的抑制作用,其ec
50
大多都小于10μg/ml。
[0094]
为了更好地理解本发明,下面结合具体示例进一步阐明本发明的内容,但本发明的内容不仅仅局限于下面的示例。
[0095]
一、化合物制备及表征
[0096]
实施例1中间体2-丙烯酰基-1,2,3,4-四氢-β-咔啉的制备
[0097]
将1,2,3,4-四氢-β-咔啉(2.64g,15.0mmol),三乙胺(1.84g,18.0mmol)及15mln,n-二甲基甲酰胺加入到50ml圆底烧瓶中,于冰盐浴条件下搅拌30min,然后将丙烯酰氯(1.54g,16.5mmol)溶解于5ml无水n,n-二甲基甲酰胺后缓慢加入,常温过夜。用水淬灭反应,乙酸乙酯萃取,饱和氯化铵溶液洗涤,取有机相,无水硫酸钠干燥,脱溶,柱层析,得黄色固体3.11g,收率91.5%。其核磁数据为:1hnmr(400mhz,cdcl3)δ8.68(s,1h,-nh),7.45(d,j=7.7hz,1h,ar-h),7.31(d,j=7.9hz,1h,ar-h),7.15(t,j=7.2hz,1h,ar-h),7.09(t,j=7.4hz,1h,ar-h),6.72(dd,j=16.8,10.6hz,1h,-ch1=ch2),6.39(d,j=18.2hz,1h,-ch1=ch2),5.79(d,j=12.0hz,1h,-ch1=ch2),4.87(s,2h,-n-ch
2-),3.86(t,j=5.6hz,2h,-ch2ch
2-),2.86(t,j=5.4hz,2h,-ch2ch
2-);
13
cnmr(101mhz,cdcl3)δ166.5,136.3,130.2,128.3,127.9,126.8,121.7,119.5,117.8,111.1,107.7,44.4,41.1,22.2。
[0098]
实施例2中间体3-溴-1-[4-(4-氟苯基)哌嗪-1-基]丙烷-1-酮的制备
[0099]
将4-氟苯基哌嗪(0.35g,2.00mmol),三乙胺(0.25g,2.40mmol)及3ml无水二氯甲烷加入到25ml圆底烧瓶中,于冰盐浴条件下搅拌30min后,将3-溴丙酰氯(0.37g,2.10mmol)溶于2ml二氯甲烷后缓慢滴加至体系,并继续在室温下反应30h。用水淬灭反应,二氯甲烷萃取,取有机相,无水硫酸钠干燥,脱溶,柱层析,得白色固体0.35g,收率57.1%。其核磁数据为:1hnmr(400mhz,cdcl3)δ6.97(d,j=8.3hz,2h,phenyl-h),6.90(d,j=4.6hz,2h,phenyl-h),3.83
–
3.76(m,2h,piperazine-ch2),3.68(t,j=7.1hz,2h,-ch2ch
2-),3.65
–
3.59(m,2h,piperazine-ch2),3.14
–
3.04(m,4h,piperazine-ch2),2.96(t,j=7.1hz,2h,-ch2ch
2-);
13
cnmr(101mhz,cdcl3)δ168.5,157.7(d,1j
c-f
=240.2hz),147.5(d,4j
c-f
=2.2hz),118.7(d,3j
c-f
=7.6hz),115.8(d,2j
c-f
=22.2hz),50.8,50.4,45.5,41.7,36.3,27.2;
19
fnmr(377mhz,cdcl3)δ-123.1。
[0100]
实施例3中间体2-溴乙酰基-1,2,3,4-四氢-β-咔啉的制备
[0101]
将1,2,3,4-四氢-β-咔啉(0.35g,2.00mmol),三乙胺(0.25g,2.40mmol)及5ml二氯甲烷加入到25ml圆底烧瓶中,于冰盐浴条件下搅拌30min,然后将溴乙酰溴(0.44g,2.10mmol)溶解于5ml无水二氯甲烷后缓慢加入,室温反应30h。用水淬灭反应,二氯甲烷萃取,取有机相,无水硫酸钠干燥,脱溶,柱层析,得黄色固体0.51g,收率86.5%。其核磁数据为:1hnmr(400mhz,cdcl3)δ8.21(s,1h,-nh),7.47(d,j=7.7hz,1h,ar-h),7.33(d,j=8.0hz,1h,ar-h),7.19
–
7.15(m,1h,ar-h),7.13
–
7.09(m,1h,ar-h),4.78(s,2h,-n-ch
2-),4.00(s,2h,-coch
2-),3.82(t,j=5.6hz,2h,-ch2ch
2-),2.94(t,j=5.3hz,2h,-ch2ch
2-);
13
cnmr(101mhz,cdcl3)δ166.4,136.3,129.5,126.6,122.0,119.7,117.9,111.1,107.8,45.2,41.1,26.1,21.9。
[0102]
实施例4中间体1-(3-溴丙基)-4-(4-氟苯基)哌嗪的制备
[0103]
将4-氟苯基哌嗪(0.70g,4.00mmol),三乙胺(0.49g,4.80mmol)及5ml无水二氯甲烷加入到25ml圆底烧瓶中,于冰盐浴条件下搅拌30min,然后将1,3-二溴丙烷(1.67g,8.00mmol)缓慢加入,室温反应30h。用水淬灭反应,二氯甲烷萃取,取有机相,无水硫酸钠干燥,脱溶,柱层析,黄色油状物0.34g,收率28.2%。其核磁数据为:1hnmr(400mhz,cdcl3)δ6.95(d,j=8.3hz,2h,phenyl-h),6.89(d,j=4.6hz,2h,phenyl-h),3.49(t,j=6.6hz,2h,-n-ch2ch
2-),3.17
–
3.08(m,4h,piperazine-ch2),2.67
–
2.59(m,4h,piperazine-ch2),2.56(t,j=7.0hz,2h,br-ch2ch
2-),2.08(p,j=6.7hz,2h,-ch2ch2ch
2-);
13
cnmr(101mhz,cdcl3)δ157.2(d,1j
c-f
=239.0hz),147.9(d,4j
c-f
=2.0hz),117.9(d,3j
c-f
=7.5hz),115.5(d,2j
c-f
=22.0hz),56.5,53.3,50.1,31.7,29.9;
19
fnmr(377mhz,cdcl3)δ-124.5。
[0104]
实施例5目标化合物3-(叔丁胺基)-1-(1,2,3,4-四氢-β-咔啉-2-基-)丙烷-1-酮的制备
[0105]
将2-丙烯酰基-1,2,3,4-四氢-β-咔啉(0.23g,1.0mmol),叔丁胺(0.08g,1.05mmol)及4ml无水甲醇投入到15ml反应瓶中,然后于60℃反应,tlc跟踪,直至2-丙烯酰基-1,2,3,4-四氢-β-咔啉消耗完全,结束反应。加20ml水淬灭反应,并用30ml二氯甲烷萃取两次,收集有机相,无水硫酸钠干燥,脱溶,薄层层析,得白色固体,收率83.5%。其核磁数据为:1hnmr(400mhz,cdcl3)δ10.17(s,1h,-nh),7.32(dd,j=7.2,5.6hz,2h,ar-h),7.12(t,j=7.5hz,1h,ar-h),7.06(t,j=7.4hz,1h,ar-h),4.68(s,2h,-n-ch
2-),3.47(t,j=5.6hz,
2h,-ch2ch
2-),2.98(t,j=6.0hz,2h,-ch2ch
2-),2.66(t,j=5.9hz,2h,-coch2ch
2-),2.28(t,j=4.9hz,2h,-coch2ch
2-),1.19(s,9h,-ch3);
13
cnmr(101mhz,cdcl3)δ170.8,136.3,130.3,126.8,126.8,121.3,119.0,117.9,110.9,107.2,51.3,43.5,40.4,37.9,33.7,28.5,21.2。
[0106]
实施例6目标化合物1-(4-(4-氟苯基)哌嗪-1-基)-3-(1,2,3,4-四氢-β-咔啉-2-基)丙烷-1-酮的制备
[0107]
将1,2,3,4-四氢-β-咔啉(0.12g,0.70mmol),3-溴-1-[4-(4-氟苯基)哌嗪-1-基]丙烷-1-酮(0.22g,0.70mmol),碳酸钾(0.12g,0.84mmol),碘化钾(0.01g,0.07mmol)及4ml乙腈一锅法投入到15ml反应瓶中,然后于60℃反应,tlc跟踪,直至3-溴-1-[4-(4-氟苯基)哌嗪-1-基]丙烷-1-酮消耗完全,结束反应。加20ml水淬灭反应,并用30ml二氯甲烷萃取两次,收集有机相,无水硫酸钠干燥,脱溶,薄层层析,得白色固体0.21g,收率73.6%。其核磁数据为1hnmr(400mhz,cdcl3)δ7.92(s,1h,-nh),7.46(d,j=7.6hz,1h,ar-h),7.29(d,j=7.8hz,1h,ar-h),7.13(t,j=7.5hz,1h,ar-h),7.08(t,j=7.1hz,1h,ar-h),6.95(t,j=8.6hz,2h,phenyl-h),6.84(dd,j=9.0,4.5hz,2h,phenyl-h),3.81
–
3.76(m,2h,-ch2ch
2-),3.75(s,2h,-n-ch
2-),3.68
–
3.62(m,2h,-ch2ch
2-),3.08
–
2.99(m,6h),2.92(t,j=5.5hz,2h,piperazine-ch2),2.84(d,j=5.1hz,2h,piperazine-ch2),2.70(t,j=7.4hz,2h,-coch
2-);
13
cnmr(101mhz,cdcl3)δ170.2,157.7(d,1j
c-f
=239.9hz),147.6(d,4j
c-f
=2.1hz),136.1,131.5,127.2,121.4,119.4,118.7(d,3j
c-f
=7.8hz),118.0,115.7(d,2j
c-f
=22.1hz),110.7,108.3,53.4,51.19,50.8,50.7,50.6,45.7,41.6,31.8,21.4;
19
fnmr(377mhz,cdcl3)δ-123.2。
[0108]
实施例7目标化合物2-(4-(4-氟苯基)哌嗪-1-基)-3-(1,2,3,4-四氢-β-咔啉-2-基)乙烷-1-酮的制备
[0109]
将2-溴乙酰基-1,2,3,4-四氢-β-咔啉(0.15g,0.60mmol),碳酸钾(0.10g,0.72mmol),碘化钾(0.01g,0.06mmol),4-氟苯基哌嗪(0.12g,0.66mmol)及4ml乙腈一锅法投入到15ml反应瓶中,然后于60℃反应,tlc跟踪,直至2-溴乙酰基-1,2,3,4-四氢-β-咔啉消耗完全,结束反应。加20ml水淬灭反应,并用30ml二氯甲烷萃取两次,收集有机相,无水硫酸钠干燥,脱溶,薄层层析,得浅黄色固体,收率76.6%。其核磁数据为:1hnmr(400mhz,cdcl3)δ8.62(s,1h,-nh),7.46(d,j=7.6hz,1h,ar-h),7.32(d,j=7.9hz,1h,ar-h),7.14(t,j=7.5hz,1h,ar-h),7.12
–
7.07(m,1h,ar-h),6.95(t,j=8.7hz,2h,phenyl-h),6.87
–
6.82(m,2h,phenyl-h),4.81(s,2h,-n-ch
2-),3.90(t,j=5.5hz,2h,-ch2ch
2-),3.41(s,2h,-coch
2-),3.15
–
3.08(m,4h,piperazine-ch2),2.89(t,j=5.2hz,2h,-ch2ch
2-),2.74
–
2.68(m,4h,piperazine-ch2);
13
cnmr(101mhz,cdcl3)δ169.1,157.2(d,1j
c-f
=238.7hz),147.8(d,4j
c-f
=2.1hz),136.3,130.19,126.8,121.8,119.5,117.9,117.9(d,3j
c-f
=7.3hz),115.6(d,2j
c-f
=22.0hz),111.1,107.9,61.8,53.2,50.2,44.2,40.8,22.2;
19
fnmr(377mhz,cdcl3)δ-124.4;hrms(esi)[m+h]
+
calcdforc
23h26
on4f:393.2085,found:393.2083。
[0110]
实施例8目标化合物2-(3-(4-(4-氟苯基)哌嗪-1-基)丙基)-1,2,3,4-四氢-β-咔啉的制备
[0111]
将1,2,3,4-四氢-β-咔啉(0.12g,0.70mmol),1-(3-溴丙基)-4-(4-氟苯基)哌嗪
(0.21g,0.70mmol),碳酸钾(0.12g,0.84mmol),碘化钾(0.01g,0.07mmol)及4ml乙腈一锅法投入到15ml反应瓶中,然后于60℃反应,tlc跟踪,直至1-(3-溴丙基)-4-(4-氟苯基)哌嗪消耗完全,结束反应。加20ml水淬灭反应,并用30ml二氯甲烷萃取两次,收集有机相,无水硫酸钠干燥,脱溶,薄层层析,得黄色固体0.21g,收率76.4%。其核磁数据为:1hnmr(400mhz,cdcl3)δ8.38(s,1h,-nh),7.43(d,j=7.5hz,1h,ar-h),7.31(d,j=7.7hz,1h,ar-h),7.13
–
7.08(m,1h,ar-h),7.08
–
7.04(m,1h,ar-h),6.94(t,j=8.7hz,2h,phenyl-h),6.83(dd,j=9.0,4.5hz,2h,phenyl-h),3.71(s,2h,-n-ch
2-),3.12
–
3.05(m,4h,piperazine-ch2),2.89(t,j=5.5hz,2h,-ch2ch
2-),2.82(d,j=5.0hz,2h,-ch2ch
2-),2.69
–
2.64(m,2h,-ch2ch
2-),2.63
–
2.55(m,4h,piperazine-ch2),2.49
–
2.43(m,2h,-n-ch2ch
2-),1.83(p,j=6.7hz,2h,-ch2ch2ch
2-);
13
cnmr(101mhz,cdcl3)δ157.2(d,1j
c-f
=238.9hz),147.8,136.1,131.1,127.0,121.4,119.3,117.9(d,3j
c-f
=7.8hz),117.8,115.5(d,2j
c-f
=22.0hz),110.9,107.9,56.5,55.7,53.2,51.1,50.2,50.0,29.7,24.2,21.0;
19
fnmr(376mhz,cdcl3)δ-124.4。
[0112]
实施例9目标化合物3-氧代-3-(1,2,3,4-四氢-β-咔啉-2-基)丙基4-(4-氟苯基)哌嗪-1-碳二硫的制备
[0113]
在冰浴条件下,将二硫化碳(0.21g,5.00mmol)缓慢滴加到含有4-氟苯基哌嗪(0.27g,1.50mmol)和4ml四氢呋喃的反应瓶中,搅拌反应3h后,将2-丙烯酰基-1,2,3,4-四氢-β-咔啉(0.23g,1.0mmol)加入反应体系,于60℃反应,tlc跟踪,直至2-丙烯酰基-1,2,3,4-四氢-β-咔啉消耗完全,结束反应。加20ml水淬灭反应,并用30ml二氯甲烷萃取两次,收集有机相,无水硫酸钠干燥,脱溶,薄层层析,得黄色固体0.23g,收率95.8%。其核磁数据为:1hnmr(400mhz,cdcl3)δ8.76(s,1h,-nh),7.45(d,j=7.7hz,1h,ar-h),7.31(d,j=7.9hz,1h,ar-h),7.17
–
7.12(m,1h,ar-h),7.12
–
7.06(m,1h,ar-h),6.95(t,j=8.7hz,2h,phenyl-h),6.87(d,j=4.5hz,2h,phenyl-h),4.80(s,2h,-n-ch
2-),3.79(t,j=5.6hz,2h,-ch2ch
2-),3.18
–
3.07(m,4h,piperazine-ch2),2.86(d,j=12.8hz,4h,piperazine-ch2),2.78
–
2.71(m,2h,-ch2ch
2-),2.71
–
2.62(m,4h,-coch2ch
2-);
13
cnmr(101mhz,cdcl3)δ197.2,171.0,157.2(d,1j
c-f
=238.9hz),147.8(d,4j
c-f
=2.2hz),136.2,130.4,126.7,121.7,119.5,117.9(d,3j
c-f
=7.9hz),115.5(d,2j
c-f
=22.2hz),111.1,107.6,54.1,53.3,50.1,44.0,40.6,31.3,22.0;
19
fnmr(377mhz,cdcl3)δ-124.4。
[0114]
表1化合物的核磁共振及高分辨质谱数据
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122]
[0123]
[0124]
[0125]
[0126]
[0127]
[0128]
[0129][0130]
表2目标化合物的理化性质
[0131]
[0132][0133]
二、化合物应用
[0134]
实施例10化合物对植物病原细菌的ec
50
[0135]
ec
50
(medianeffectiveconcentration)是评价植物病原菌对化合物敏感性的重要指标,同时也是对目标化合物作用机制研究时,化合物浓度设置的重要参数。在浓度梯度实验中,采用二倍稀释法设定合适的5个浓度,最后将药剂对植物病原菌的抑制率、药剂浓度换算成对数值,通过spss软件回归分析得到毒力曲线,计算出ec
50
。
[0136]
采用浊度法测试目标化合物对植物病原菌的有效中浓度ec
50
,试验对象为水稻白叶枯病菌(xoo)、柑橘溃疡病菌(xac)和猕猴桃溃疡病菌(psa)。dmso溶解在培养基中作为空白对照。具体操作如下:1)将xoo、xac和psa的单克隆(原培养在na固体培养基)放到nb培养基中,在28℃、180rpm恒温摇床中振荡培养到对数生长期备用;2)将药剂/化合物配置成不同浓度(例:100、50、25、12.5和6.25μg/ml)的含毒nb液体培养基5ml加入到试管中,测定对应浓度的含毒无菌nb液体培养基的od
595
值(记为无菌培养基od值);3)分别向所有处理的试管内加入40μl培养至对数生长期的菌液,在28℃、180rpm恒温摇床中振荡培养至ck组od
595
值为0.6-0.8后,将各个浓度的菌液在分光光度计上测定od
595
值(记为含菌培养基od值);4)使用以下公式计算抑制率(%):校正od值=含菌培养基od值-无菌培养基od值;抑制率%=[(校正后对照培养基菌液od值-校正含毒培养基od值)/校正后对照培养基菌液od值]
×
100;
[0137]
按照上述方法,上述表1中的目标化合物实验结果如表3所示。
[0138]
表3化合物对植物病原细菌的ec
50
[0139]
[0140][0141]
[0142]
实施例11化合物对植物病原真菌的抑制活性(50μg/ml)
[0143]
菌丝生长速率法又叫含毒介质法,是杀菌剂毒力测定的常规方法之一。主要原理是将供试药剂与培养基混合,通过菌落在含毒培养基上生长速率的快慢来衡量药剂的毒力大小。本实施例以小麦赤霉病菌、水稻纹枯病菌和葡萄座腔菌为测试对象,以dmso为空白对照。具体操作如下:1)根据测试浓度称取适量药物,用dmso(用量不超过最终含毒培养基的1%)将其溶解,然后加0.1%吐温20溶液定容至10ml,倒入90ml融化的pda培养基中,混匀后倒入9个培养皿中备用;2)将打孔器(内径为5mm)进行灼烧灭菌,待其冷却后,对预先活化的菌种靠边缘处的菌丝进行打孔,并用接种针将其菌丝面贴于含毒培养基中央,待处理完成后,统一至于25℃下培养;3)待对照品组菌落直径生长至5.5-6.6cm后,采用十字交叉法测定对照组和各药剂处理组的菌落直径;4)使用以下公式计算抑制率(%):抑制率%=(c-t)/(c-0.5)
×
100;其中,c为对照组的菌落直径,t为药剂处理组的菌落直径,0.5为接菌的菌饼直径。
[0144]
按照上述方法,上述表1中的目标化合物实验结果如表4所示。
[0145]
表4化合物对植物病原真菌的抑制活性(50μg/ml)
[0146][0147]
综上,从表3中可以看出,在离体试验中,目标化合物对植物致病病原细菌[如水稻白叶枯病菌、柑橘溃疡病菌和猕猴桃溃疡病菌]表现出了良好的抑制活性。其中结构中含有苄基的多数化合物对三种病原细菌的ec
50
都在10以内,尤其是化合物42对水稻白叶枯病菌的ec
50
为1.34μg/ml,化合物16对水柑橘溃疡病菌的ec
50
为3.43μg/ml;化合物6对猕猴桃溃疡病菌的ec
50
为2.86μg/ml。从表4中可以看出,目标化合物对植物病原真菌也表现出一定的抑制活性。由此,可知此类化合物可用于新型抗植物致病病原细菌和真菌农药,具有极高的研究价值。
[0148]
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1