一种基因和蛋白在增强TIL中的应用的制作方法
本发明属于生物医药领域,具体涉及一种基因和蛋白在增强til中的应用。
背景技术:
1、肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,til)是存在于肿瘤组织中已被激活的淋巴细胞,与癌细胞直接进行免疫反应,拥有精准的癌细胞识别和杀伤能力,由t细胞、b细胞和nk细胞等免疫细胞组成。在肿瘤的免疫过继疗法中,til细胞取得了很好的效果。til细胞过继疗法对于肿瘤的治疗中表现出巨大潜力,已经成为攻克癌症的重要希望。对于til疗法进行改进也是治疗癌症的重要研究方向。til疗法借助til得以实现,因此研究增强til作用的方法无疑可以为til疗法提供更好的方向。
2、现有技术中有研究til的培养方法。
3、如申请号为201910863394.6的中国专利中公开了:一种功能增强型til细胞的培养方法,包括:从肿瘤组织分离淋巴细胞,加入启动培养基,种于12孔培养板,4ml/孔,进行启动淋巴细胞培养,培养10天或14天获得启动til细胞,收获启动的til细胞冻存备用;用诱导培养基悬浮淋巴细胞于25cm2培养瓶中,20ml/瓶,置于37℃、5%co2孵箱进行til细胞诱导培养1天;用扩增培养基进行半量换液,进行扩瓶培养和扩袋培养,共培养13天或14天;在培养第14天或第15天,收集til细胞,生理盐水洗涤,用功能增强培养基重悬til细胞后,孵育30分钟;收集til细胞,进行功能检测,获得所述的功能增强型til细胞。该培养方法能获得具有更强的杀伤肿瘤细胞的活性、更高水平的抗肿瘤细胞因子分泌能力的功能增强型til细胞。但其对til的增强作用指标具有一定局限性,仅停留在细胞因子层面。
4、也有研究筛选了滋养细胞用于培养til。
5、如申请号为202011629408.7的中国专利中公开了:一种制备til的方法。具体地,提供一种制备til细胞的方法,所述的方法包括步骤:对含til细胞的初始细胞群与feeder细胞进行共培养后得到含扩增的til细胞的第一扩增细胞群,然后将所述第一扩增细胞群与第二feeder细胞进行共培养获得含扩增的til细胞的第二扩增细胞群。能够从极少量的易获取的肿瘤样本中快速培养得到大量til。但其使用的feeder细胞在进行生产时成本难免较高。
6、现有技术中对于增强til的相关基因研究也多停留在细胞因子表达相关基因上,有待进一步研究。
7、mf基因指编码β-1,3-n-乙酰葡萄糖氨基转移酶的基因(fringe)中的一种。哺乳动物有三种fringe:lunatic fringe(lfng),radical fringe(rfng)和manic fringe(mfng,即mf基因)。现有技术中已公开了与β-1,3-n-乙酰葡萄糖氨基转移酶的表达相关的疾病有:哮喘病(顾问,郭雪君,丁涛.哮喘大鼠β1,3-n-乙酰葡萄糖氨基转移酶的表达与tregs[c]//中华医学会呼吸病学年会——2011(第十二次全国呼吸病学学术会议)论文汇编.2011.)、人脑星形胶质瘤(刘珺.β1,3-n-乙酰氨基葡萄糖基转移酶(β3gn-t8)对人脑星形胶质瘤侵袭和增殖的影响[d].苏州大学,2012.)、白血病(仇灏.β3-乙酰氨基葡萄糖基转移酶对白血病细胞分化的影响及其调控机制.2010.)、人垂体瘤(王延後,杨伟,张玉宝,等.β1,3-n-乙酰氨基葡萄糖转移酶-8在人垂体瘤组织的表达及其对侵袭性的影响[j].中华实验外科杂志,2016,33(9):3.)等。
8、申请号为wous05003419的国际专利中公开了:用于表征,调节,诊断,和治疗癌症的组合物,其中包括mf基因表达的mf蛋白,癌症类型包括乳房癌的细胞和预防转移。还提供了系统和方法用于鉴定化合物的存在是调节肿瘤发生。但其对于mf蛋白的应用为直接服用,且收效甚微。
9、现有技术中尚未公开mf基因和蛋白与til的作用关系。
技术实现思路
1、为了解决上述问题,本发明提供了mf基因和蛋白在制备肿瘤药物中的应用。
2、本发明所述的“til”即肿瘤浸润性淋巴细胞,是指原本获得时是白细胞但其离开受试者的血流且迁移至肿瘤中的细胞群体。til包括但不限于cd8+细胞毒性t细胞(淋巴细胞)、th1和th17 cd4+t细胞、自然杀伤细胞、树突细胞和m1巨噬细胞。til包括原代til和继代til。“原代til”是如本文概述的获自患者组织样品的细胞(有时称为“新鲜获得”或“新鲜分离”),而“继代til”是任何经本文所述的扩增或增生的til细胞,包括但不限于本体til(bulk til)和经扩增的til(“rep til”或“rep后til”)。til细胞可包括遗传修饰的til。
3、本发明所述的“pbmc”即外周血单核细胞,是指具有圆形细胞核的外周血细胞,包括淋巴细胞(t细胞、b细胞、nk细胞)和单核细胞。当用作抗原呈递细胞(pbmc是抗原呈递细胞)时,外周血单核细胞是经照射的异体外周血单核细胞。
4、本发明所述的“cd3抗体”是指针对成熟t细胞的t细胞抗原受体中的cd3受体的抗体或其变体,例如单克隆抗体,并且包括人、人源化、嵌合或鼠抗体。
5、本发明所述的“il-2”即白细胞介素2,是趋化因子家族的一种细胞因子。多细胞来源,其中主要由活化t细胞产生,具有多向性作用,主要促进淋巴细胞生长、增殖、分化;il-2对机体的免疫应答和抗病毒感染等有重要作用,能刺激已被特异性抗原或致丝裂因数启动的t细胞增殖。
6、本发明所述的“肿瘤细胞”指细胞在致瘤因素作用下,基因发生了改变,失去对其生长的正常调控,导致异常增殖的细胞。肿瘤细胞生长迅速,可转移到身体其它部位,还会产生有害物质,破坏正常器官结构,使机体功能失调。肿瘤细胞。具有代表性的肿瘤细胞hela细胞,是生物学与医学研究中使用的一种细胞,被广泛应用于肿瘤研究、生物实验或者细胞培养,具有可以连续传代、无限分裂、增殖异常迅速、感染性极强等特点。
7、本发明所述的“蛋白”指蛋白质,是由氨基酸以“脱水缩合”的方式组成的多肽链经过盘曲折叠形成的具有一定空间结构的物质。蛋白质是由α-氨基酸按一定顺序结合形成一条多肽链,再由一条或一条以上的多肽链按照其特定方式结合而成的高分子化合物。基因表达产物通常是蛋白质,基因表达(gene expression)是指将来自基因的遗传信息合成功能性基因产物的过程。
8、本发明所述的“杀伤力”指细胞杀伤力,即对于细胞的杀伤作用。在研究肿瘤治疗药物或者方法中,多需要进行体外实验,对于肿瘤细胞杀伤力的实验是其中一种。
9、本发明所述的“基因表达量”即dna序列最后会被翻译成蛋白质的量,有时候也被称为蛋白表达量。其针对的是能够进行翻译的蛋白序列,在dna序列中,并非所有都能进行翻译表达合成蛋白质,仅有部分dna序列能够表达蛋白,即基因,因此也称为基因表达量。
10、本发明所述的“ifn-γ”即γ-干扰素,是一种可溶性二聚体细胞因子,为ii型干扰素,也是唯一一种ii型干扰素。ifn-γ主要由自然杀伤细胞和自然杀伤t细胞细胞分泌;也可以由cd4 th1和cd8细胞毒性t细胞分泌。ifn-γ是巨噬细胞重要的激活剂,也是ii型主要组织相容性复合物(mhc ii)表达的诱导剂。ifn-γ的异常表达和很多自身炎症和自身免疫疾病相关。ifn-γ具有抗病毒,抗肿瘤和免疫调控的作用。它可以调控30个基因的表达水平,产生多种的细胞反应,并可以促进nk细胞活性,促进抗原递呈和提高巨噬细胞溶酶体活性。
11、本发明中所述的“穿孔素”指溶素,全称是细胞溶素,分子量60000,是由大颗粒淋巴细胞和活化的tc细胞的胞浆颗粒释放出来,能杀伤的靶细胞范围较宽,杀伤作用较nkcf快,能在靶细胞膜上形成孔洞。所以细胞溶素可称为穿孔素。
12、本发明中,所述的“一致性”是指序列相似度,即两条序列中相同位置具有相同的碱基或氨基酸所占的比例。
13、本发明中,“截短”指在一段序列上选取一部分得到的序列。在一般意义上,序列可以是氨基酸序列或核苷酸序列,具体截取的长度没有限制。
14、一方面,本发明提供了mf基因和mf蛋白在提高til肿瘤细胞杀伤力中的应用。
15、所述的mf基因通过高表达mf蛋白提高til肿瘤细胞杀伤力。
16、所述的mf基因的高表达通过构建高表达载体完成。
17、优选地,所述的高表达载体为慢病毒载体。
18、所述的mf蛋白通过直接添加至til的培养体系提高til肿瘤细胞杀伤力。
19、所述的mf蛋白序列为seq id no:1或其突变序列,重组序列或修饰序列;或者,与前述序列具有60%以上一致性的序列。
20、或者,与前述序列具有60%-100%、70%-100%、80%-100%、90%-100%、92%-100%、95%-100%、98%-100%一致性的序列。
21、优选地,所述的肿瘤细胞选自肺癌、头颈癌、黑色素瘤、乳腺癌、宫颈癌、卵巢癌、子宫内膜癌、结直肠癌、胃癌、肾癌、鼻咽癌、甲状腺癌口腔癌、食管癌、肝癌、胰腺癌、脑胶质癌、前列腺癌、膀胱癌、脑胶质癌、皮肤癌、髓母细胞瘤或脂肪肉瘤。
22、优选地,所述的til与肿瘤细胞的作用比例为5:1。
23、在一些实施例中,所述的肿瘤细胞为宫颈癌细胞;所述的til细胞与肿瘤细胞的作用比例为5:1。
24、所述的til可以通过培养癌组织或癌旁组织得到,也可以通过其他组织培养得到,优选为癌组织或癌旁组织。
25、在一些实施例中,所述的til制备方法包括以下步骤:
26、1.采集癌组织或癌旁组织,将肿瘤组织剪碎;
27、2.将剪碎的肿瘤组织移入50ml离心管内,加入15ml iv型胶原酶消化液,37℃水浴摇晃2小时,消化肿瘤组织,随后用无血清培养液清洗细胞沉淀1-2次,600g离心8min后弃上清;
28、3.配制含细胞因子il-2的无血清培养液,使用该培养基调整活细胞浓度为1×106个/ml,按2ml/孔接种于24孔细胞培养板,置于37℃及co2体积浓度为5%的培养箱中培养,细胞铺板后3-7天根据细胞生长状态给细胞1/2换液及将细胞扩孔培养,扩孔时调整细胞浓度为1×106个/孔。继续培养细胞,每2天镜检,直至镜下可见多为淋巴细胞形态、细胞活率≥70%、活细胞总数≥3×107个,纯化;
29、4.将步骤3纯化的细胞与经辐射后pbmc按1:30-1:50的活细胞总数比例进行混合,以无血清培养液调整总活细胞浓度为3×106个/ml,加入cd3抗体、mf(manic fringe)全蛋白,接种于细胞培养装置中,37.0±1.0℃,5.0±0.5%co2、饱和湿度的培养箱中培养。
30、5.培养一天后加入il-2,每2-3天取样镜检,根据细胞生长状态给细胞1/2换液及将细胞扩孔培养,扩孔时调整细胞浓度为1×106个/孔,直至检镜下观察淋巴细胞形态均一、饱满,活细胞总数≥1.2×109个/ml,细胞活率≥80%,可完成扩增,得到til。
31、优选地,所述的il-2的添加量为500-3000iu/ml。
32、在一些实施例中,所述的il-2的添加量可以是500-1000iu/ml;
33、在一些实施例中,所述的il-2的添加量可以是500-2000iu/ml;
34、在一些实施例中,所述的il-2的添加量可以是500-2500iu/ml;
35、在一些实施例中,所述的il-2的添加量可以是1000-3000iu/ml;
36、在一些实施例中,所述的il-2的添加量可以是1000-2500iu/ml;
37、在一些实施例中,所述的il-2的添加量可以是1000-2000iu/ml;
38、在一些实施例中,所述的il-2的添加量可以是1000-1500iu/ml;
39、在一些实施例中,所述的il-2的添加量可以是1500-2500iu/ml;
40、在一些实施例中,所述的il-2的添加量可以是2000-2500iu/ml;
41、在一些实施例中,所述的il-2的添加量可以是2500-3000iu/ml;
42、在一些实施例中,所述的il-2的添加量可以是800-2300iu/ml;
43、在一些实施例中,所述的il-2的添加量可以是1600-2400iu/ml;
44、在一些实施例中,所述的il-2的添加量可以是1600-1800iu/ml;
45、在一些实施例中,所述的il-2的添加量可以是1800-2500iu/ml;
46、在一些实施例中,所述的il-2的添加量可以是1800-2000iu/ml。
47、优选地,所述的cd3抗体的添加量为终浓度20-40ng/ml。
48、优选地,所述的cd3抗体的添加量为终浓度20-30ng/ml、终浓度30-40ng/ml、终浓度20-35ng/ml、终浓度20-25ng/ml、终浓度25-35ng/ml、终浓度25-30ng/ml、终浓度30-35ng/ml、终浓度21-40ng/ml、终浓度29-40ng/ml、终浓度20-39ng/ml、终浓度20-44ng/ml、终浓度21-39ng/ml、终浓度28-39ng/ml或终浓度28-32ng/ml。
49、进一步优选地,所述的cd3抗体的添加量为30ng/ml。
50、优选地,所述的pbmc的辐射处理的条件为:250gy的x-ray总剂量下辐照30min。
51、所述的til细胞与pbmc的活细胞总数比例为1:30-1:40、1:40-1:50、1:35-1:50、1:35-1:40、1:30-1:45、1:35-1:45、1:32-1:50、1:38-1:50、1:30-1:48、1:30-1:42、1:34-1:48或1:37-1:43。
52、优选地,所述的til细胞与pbmc的活细胞总数比例为1:40。
53、另一方面,本发明提供了mf基因和mf蛋白在促进til中ifn-γ释放中的应用。
54、所述的mf基因通过高表达mf蛋白促进til中ifn-γ释放。
55、所述的mf基因的高表达通过构建高表达载体完成。
56、优选地,所述的高表达载体为慢病毒载体。
57、所述的mf蛋白通过直接添加至til的培养体系促进til中ifn-γ释放。
58、所述的mf蛋白序列为seq id no:1或其突变序列,重组序列或修饰序列;或者,与前述序列具有60%以上一致性的序列。
59、或者,与前述序列具有60%-100%、70%-100%、80%-100%、90%-100%、92%-100%、95%-100%、98%-100%一致性的序列。
60、所述的til可以通过培养癌组织或癌旁组织得到,也可以通过其他组织培养得到,优选为癌组织或癌旁组织。
61、在一些实施例中,所述的til制备方法包括以下步骤:
62、1.采集癌组织或癌旁组织,将肿瘤组织剪碎。
63、2.将剪碎的肿瘤组织移入50ml离心管内,加入15ml iv型胶原酶消化液,37℃水浴摇晃2小时,消化肿瘤组织,随后用无血清培养液清洗细胞沉淀1-2次,600g离心8min后弃上清;
64、3.配制含细胞因子il-2的无血清培养液,使用该培养基调整活细胞浓度为1×106个/ml,按2ml/孔接种于24孔细胞培养板,置于37℃及co2体积浓度为5%的培养箱中培养,细胞铺板后3-7天根据细胞生长状态给细胞1/2换液及将细胞扩孔培养,扩孔时调整细胞浓度为1×106个/孔。继续培养细胞,每2天镜检,直至镜下可见多为淋巴细胞形态、细胞活率≥70%、活细胞总数≥3×107个,纯化;
65、4.将步骤3纯化的细胞与经辐射后pbmc按1:30-1:50的活细胞总数比例进行混合,以无血清培养液调整总活细胞浓度为3×106个/ml,加入cd3抗体、mf(manic fringe)全蛋白,接种于细胞培养装置中,37.0±1.0℃,5.0±0.5%co2、饱和湿度的培养箱中培养。
66、5.培养一天后加入il-2,每2-3天取样镜检,根据细胞生长状态给细胞1/2换液及将细胞扩孔培养,扩孔时调整细胞浓度为1×106个/孔,直至检镜下观察淋巴细胞形态均一、饱满,活细胞总数≥1.2×109个/ml,细胞活率≥80%,可完成扩增,得到til。
67、优选地,所述的il-2的添加量为500-3000iu/ml。
68、在一些实施例中,所述的il-2的添加量可以是500-1000iu/ml;
69、在一些实施例中,所述的il-2的添加量可以是500-2000iu/ml;
70、在一些实施例中,所述的il-2的添加量可以是500-1500iu/ml;
71、在一些实施例中,所述的il-2的添加量可以是500-2500iu/ml;
72、在一些实施例中,所述的il-2的添加量可以是1000-2000iu/ml;
73、在一些实施例中,所述的il-2的添加量可以是1000-1500iu/ml;
74、在一些实施例中,所述的il-2的添加量可以是1500-3000iu/ml;
75、在一些实施例中,所述的il-2的添加量可以是1500-2500iu/ml;
76、在一些实施例中,所述的il-2的添加量可以是1500-2000iu/ml;
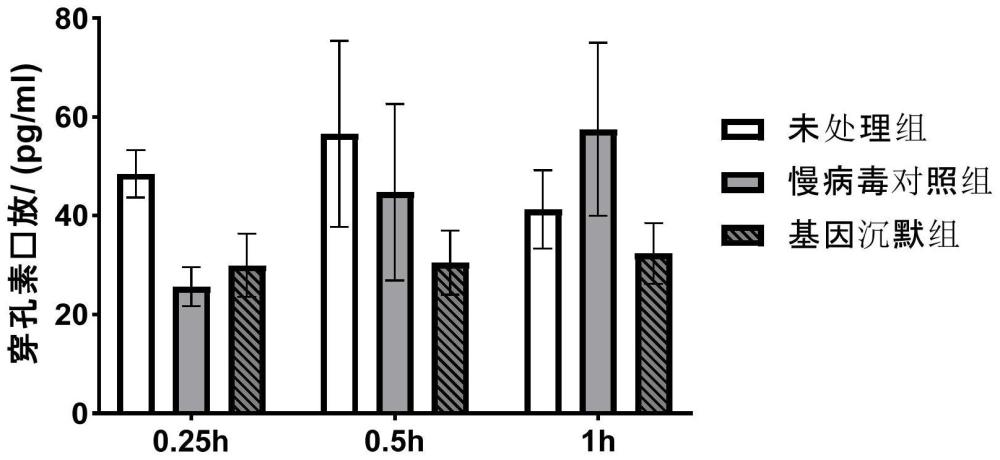
77、在一些实施例中,所述的il-2的添加量可以是2000-3000iu/ml;
78、在一些实施例中,所述的il-2的添加量可以是500-2400iu/ml;
79、在一些实施例中,所述的il-2的添加量可以是800-2500iu/ml;
80、在一些实施例中,所述的il-2的添加量可以是1600-1800iu/ml;
81、在一些实施例中,所述的il-2的添加量可以是1800-2500iu/ml;
82、在一些实施例中,所述的il-2的添加量可以是1800-2000iu/ml。
83、优选地,所述的cd3抗体的添加量为终浓度20-40ng/ml。
84、优选地,所述的cd3抗体的添加量为终浓度20-30ng/ml、终浓度30-40ng/ml、终浓度20-35ng/ml、终浓度20-25ng/ml、终浓度25-35ng/ml、终浓度25-30ng/ml、终浓度30-35ng/ml、终浓度21-40ng/ml、终浓度29-40ng/ml、终浓度20-39ng/ml、终浓度20-44ng/ml、终浓度21-39ng/ml、终浓度28-39ng/ml或终浓度28-32ng/ml。
85、进一步优选地,所述的cd3抗体的添加量为30ng/ml。
86、优选地,所述的pbmc的辐射处理的条件为:250gy的x-ray总剂量下辐照30min。
87、所述的til细胞与pbmc的活细胞总数比例为1:30-1:40、1:40-1:50、1:35-1:50、1:35-1:40、1:30-1:45、1:35-1:45、1:32-1:50、1:38-1:50、1:30-1:48、1:30-1:42、1:34-1:48或1:37-1:43。
88、优选地,所述的til细胞与pbmc的活细胞总数比例为1:40。
89、再一方面,本发明提供了mf基因和mf蛋白在促进til中穿孔素释放中的应用。
90、所述的mf基因通过高表达mf蛋白促进til中穿孔素释放。
91、所述的mf基因的高表达通过构建高表达载体完成。
92、优选地,所述的高表达载体为慢病毒载体。
93、所述的mf蛋白通过直接添加至til的培养体系促进til中穿孔素释放。
94、所述的mf蛋白序列为seq id no:1或其突变序列,重组序列或修饰序列;或者,与前述序列具有60%以上一致性的序列。
95、或者,与前述序列具有60%-100%、70%-100%、80%-100%、90%-100%、92%-100%、95%-100%、98%-100%一致性的序列。
96、或者,与前述序列具有一个或多个碱基缺失、碱基增加、碱基替换的序列。
97、所述的til可以通过培养癌组织或癌旁组织得到,也可以通过其他组织培养得到,优选为癌组织或癌旁组织。
98、在一些实施例中,所述的til制备方法包括以下步骤:
99、1.采集癌组织或癌旁组织,将肿瘤组织剪碎。
100、2.将剪碎的肿瘤组织移入50ml离心管内,加入15ml iv型胶原酶消化液,37℃水浴摇晃2小时,消化肿瘤组织,随后用无血清培养液清洗细胞沉淀1-2次,600g离心8min后弃上清;
101、3.配制含细胞因子il-2的无血清培养液,使用该培养基调整活细胞浓度为1×106个/ml,按2ml/孔接种于24孔细胞培养板,置于37℃及co2体积浓度为5%的培养箱中培养,细胞铺板后3-7天根据细胞生长状态给细胞1/2换液及将细胞扩孔培养,扩孔时调整细胞浓度为1×106个/孔。继续培养细胞,每2天镜检,直至镜下可见多为淋巴细胞形态、细胞活率≥70%、活细胞总数≥3×107个,纯化;
102、4.将步骤3纯化的细胞与经辐射后pbmc按1:30-1:50的活细胞总数比例进行混合,以无血清培养液调整总活细胞浓度为3×106个/ml,加入cd3抗体、mf(manic fringe)全蛋白,接种于细胞培养装置中,37.0±1.0℃,5.0±0.5%co2、饱和湿度的培养箱中培养。
103、5.培养一天后加入il-2,每2-3天取样镜检,根据细胞生长状态给细胞1/2换液及将细胞扩孔培养,扩孔时调整细胞浓度为1×106个/孔,直至检镜下观察淋巴细胞形态均一、饱满,活细胞总数≥1.2×109个/ml,细胞活率≥80%,可完成扩增,得到til。
104、优选地,所述的il-2的添加量为500-3000iu/ml。
105、在一些实施例中,所述的il-2的添加量可以是500-1000iu/ml;
106、在一些实施例中,所述的il-2的添加量可以是500-2000iu/ml;
107、在一些实施例中,所述的il-2的添加量可以是500-1500iu/ml;
108、在一些实施例中,所述的il-2的添加量可以是500-2500iu/ml;
109、在一些实施例中,所述的il-2的添加量可以是1000-3000iu/ml;
110、在一些实施例中,所述的il-2的添加量可以是1000-2500iu/ml;
111、在一些实施例中,所述的il-2的添加量可以是1000-2000iu/ml;
112、在一些实施例中,所述的il-2的添加量可以是1000-1500iu/ml;
113、在一些实施例中,所述的il-2的添加量可以是1500-3000iu/ml;
114、在一些实施例中,所述的il-2的添加量可以是1500-2500iu/ml;
115、在一些实施例中,所述的il-2的添加量可以是2000-3000iu/ml;
116、在一些实施例中,所述的il-2的添加量可以是2000-2500iu/ml;
117、在一些实施例中,所述的il-2的添加量可以是500-2400iu/ml;
118、在一些实施例中,所述的il-2的添加量可以是800-2500iu/ml;
119、在一些实施例中,所述的il-2的添加量可以是800-2300iu/ml;
120、在一些实施例中,所述的il-2的添加量可以是1600-1800iu/ml;
121、在一些实施例中,所述的il-2的添加量可以是1800-2500iu/ml;
122、在一些实施例中,所述的il-2的添加量可以是1800-2000iu/ml。
123、优选地,所述的cd3抗体的添加量为终浓度20-40ng/ml。
124、优选地,所述的cd3抗体的添加量为终浓度20-30ng/ml、终浓度30-40ng/ml、终浓度20-35ng/ml、终浓度20-25ng/ml、终浓度25-35ng/ml、终浓度25-30ng/ml、终浓度30-35ng/ml、终浓度21-40ng/ml、终浓度29-40ng/ml、终浓度20-39ng/ml、终浓度20-44ng/ml、终浓度21-39ng/ml、终浓度28-39ng/ml或终浓度28-32ng/ml。
125、进一步优选地,所述的cd3抗体的添加量为30ng/ml。
126、优选地,所述的pbmc的辐射处理的条件为:250gy的x-ray总剂量下辐照30min。
127、所述的til细胞与pbmc的活细胞总数比例为1:30-1:40、1:40-1:50、1:35-1:50、1:35-1:40、1:30-1:45、1:35-1:45、1:32-1:50、1:38-1:50、1:30-1:48、1:30-1:42、1:34-1:48或1:37-1:43。
128、优选地,所述的til细胞与pbmc的活细胞总数比例为1:40。
129、又一方面,本发明提供的mf基因和mf蛋白在提高til肿瘤细胞杀伤力中的应用、在促进til释放ifn-γ中的应用、在释放穿孔素中的应用可以同时发生,即本技术还提供了mf基因和mf蛋白在提高til肿瘤细胞杀伤力、促进til释放ifn-γ和释放穿孔素中的应用。
130、本发明的有益效果:
131、本发明通过对mf基因的功能研究发现,添加或表达mf可以提高til的肿瘤细胞杀伤能力(细胞毒性)、ifn-γ释放能力、穿孔素释放能力,本发明提供的技术方案,为mf在til中的应用提供了方向。
- 还没有人留言评论。精彩留言会获得点赞!