用于检测乙型病毒性肝炎耐药基因的引物探针组合、试剂盒及应用的制作方法
1.本技术属于分子生物学检测领域,涉及一种用于检测乙型病毒性肝炎耐药基因的引物探针组合、试剂盒及应用。
背景技术:
2.乙型肝炎是一种由乙型肝炎病毒(hbv)感染引起的疾病,呈全球性分布,全世界有超过20亿的人群感染过hbv,其中有3.5亿为慢性hbv感染者。使用核苷类似物治疗乙肝已经成为目前全世界临床治疗乙肝的主流,现有5种常见的核苷类乙肝治疗药物:拉米夫定、阿德福韦酯、恩替卡韦、替比夫定、替诺福韦酯。用于核苷初治患者时,某些核苷类药物的耐药发生率相对较高,如拉米夫定和阿德福韦的五年耐药率分别70%和29%。
3.但在乙肝治疗过程中,不能正确理解抗病毒治疗的意义和采取规范的抗病毒治疗,已使乙肝病毒变异、耐药逐渐成为抗病毒治疗道路上最大的绊脚石,如何及时的使用正确药物对于抗病毒治疗至关重要。研究表明,不同的基因突变可导致病毒对不同药物耐受性也不同,所以耐药基因检测逐渐成为乙型病毒肝炎治疗诊断的重要手段之一。
4.目前用于检测基因型耐药的方法主要有直接测序法、实时荧光聚合酶链式反应(realtime pcr)及限制性片段质谱多态性技术等。具体的:
①
直接测序法:是将hbv核酸进行测序分析的方法。测序法可检测已知和可能的未知耐药变异位点,是最常用的基因型耐药检测方法之一,一般作为基因型耐药检测的金标准。该方法的缺点是单个样本检测价格昂贵,且耗时长。
②
实时荧光pcr:该方法操作简便,具有较强的灵敏性,可检测变异发生率低于10%的耐药变异。但是只能检测已知、单一位点的变异,对于少数耐药变异位点监测不失为一种简便、快速且廉价的方法。但该方法难以胜任多位点变异的同时检测。
③
限制性片段质谱多态性技术:该技术是将pcr-rflp技术与基质辅助激光解吸电离飞行时间质谱技术结合,灵敏度高,能够发现数量不足hbv准种池1%的变异株,且价格昂贵,很难在临床推广应用。
5.综上,现有针对乙型肝炎耐药基因的检测存在操作复杂、检测成本高、耗时长,且无法同时对多个突变位点进行检测,比如当采用单一位点变异检测的方法时,需要采集大量的血浆样本,不仅检测成本高,检测时间长,且会造成患者的不适,严重者甚至会损害患者健康。
技术实现要素:
6.针对现有技术存在的缺陷,本技术旨在提供一种用于检测乙型病毒性肝炎耐药基因的引物和探针组合,其中引物组合在巢式pcr的基础上,结合实时荧光pcr技术,可以高灵敏和高特异性的同时对多个耐药基因的多个突变位点进行检测。
7.另一方面,本技术基于实时荧光pcr即时检测(point-of-care testing,poct)以及本技术的引物和探针体系,提供了一种用于检测乙型病毒性肝炎耐药基因的试剂盒,该
koh,20-100mm k
+
,1-5mm mg
2+
,2-5wt%甘油,25-250μm dntps,0.5-2u hotstarttaq酶。
22.其中,含有所述mg
2+
的试剂由六水氯化镁、海藻糖和水制成,具体为将2~4ul的50mm六水氯化镁水溶液与1~2ul的40wt%海藻糖水溶液1~2ul混合,用灭菌超纯水补充至5ul既得。
23.进一步的在本实施方案中,第一次巢式pcr的反应体系为:10-100mm tris-hcl或tricine-koh,20-100mm k
+
,1-5mm mg
2+
,2-5wt%甘油,25-250μm dntps,0.5-2u hotstarttaq酶,0.1-10μm各引物。
24.进一步的在本实施方案中,第二次巢式pcr的反应体系为:10-100mm tris-hcl或tricine-koh,20-100mm k
+
,1-5mm mg
2+
,2-5wt%甘油,25-250μm dntps,0.5-2u hotstarttaq酶,0.1-10μm各引物,0.1-10μm各探针。
25.进一步的,所述试剂盒还包括封闭隔离材料、裂解液、洗液a、洗液b和可熔性材料。
26.其中,所述封闭隔离材料的密度为0.1-1.5g/ml,粘度为1000-200000cstg/ml,该设置可以确保疏水性液态封闭材料能够对液体进行隔离,又能让负载有样本的磁珠穿过,且对磁珠有分散作用,清楚磁珠上的非极性杂质。
27.优选的,所述封闭隔离材料为硅油,或类似硅油,硅基物或其它高分子物质。
28.其中,所述裂解液包含1-1000mm乙酸-乙酸钠、0.1-10wt%聚乙二醇、0.1-10m异硫氰酸胍、0.1-10wt%tritonx-100、1-5wt%十二烷基硫酸钠。
29.其中,所述洗液a包含1-500mm ph8.0的tris-hcl、10-500mm kcl、0.1-10wt%聚乙二醇。
30.其中,所述洗液b包括:1-500mm ph8.0的tris-hcl、10-500mm kcl、0.1-10wt%聚乙二醇、0.75wt%非蛋白封闭剂。所述非蛋白封闭剂来自于jsr公司的blockmastertmpa1080。
31.其中,所述可熔性材料熔点范围为20℃-95℃,利用所述可熔性材料在低温下包埋反应液中的镁离子溶液,高温融化后里面的镁离子溶液可与反应液混合。使用时熔化形成油性物质,可防止气溶胶的pcr产物污染实验室。。
32.优选的,所述可熔性材料选自石蜡、十二烷、十四烷、十六烷等烷烃类物质中的任意一种或多种。
33.另外,上述引物探针组合或试剂盒在检测乙型肝炎病毒耐药基因中的应用,以及
34.上述试剂盒在基于poct检测乙型肝炎病毒耐药基因中的应用也在本技术的保护范围内。
35.本技术的有益效果为:
36.本技术提供了用于检测乙型病毒性肝炎耐药基因的引物探针组合,其中引物组合基于巢式pcr原理分为外引物和内引物,通过外引物先对少量的样本进行扩增,可以增加有限量的靶序列,为二次pcr提供了更多的靶序列,可以减少对样本采样量的需求,减少对患者的伤害,及减少采样耗材。同时本技术二次pcr采用了实时荧光的原理,通过设计二次引物和探针,可以实现针对多种乙型病毒性肝炎耐药基因的多重检测,在保证特异性和灵敏度的基础上,仅仅需要少量样本即可完成检测。
37.另外,本技术提供了基于poct技术的试剂盒,该试剂盒满足了微流控卡盒自动化与多重抗污染的试剂要求,集核酸提取、扩增、检测等功能于一体,一次上样即可实现同时
进行多个乙型肝炎病毒耐药基因的扩增检测,且保证高特异性,在检测的时效性、特异性、灵敏性、便捷性和技术参数等多个方面都优于其它乙型肝炎病毒耐药基因分子诊断试剂盒。
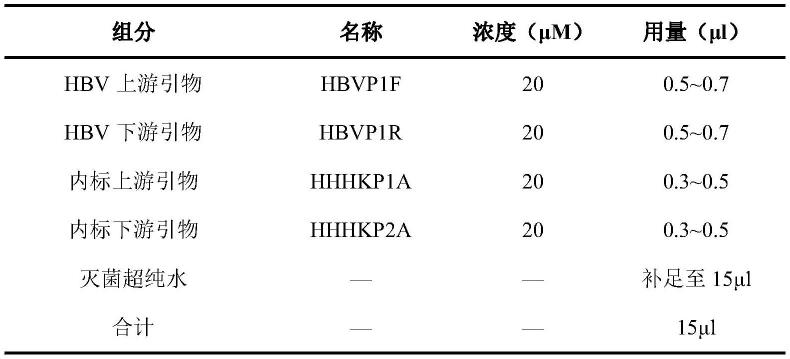
具体实施方式
38.下面将结合本技术具体的实施例,对本技术技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
39.本技术的第一个实施例提供了一种针对乙型肝炎病毒耐药基因的多重pcr检测引物探针组,其中,引物扩增体系基于巢式pcr的机理,分为用于第一次巢式pcr的外引物和第二次巢式pcr的内引物。巢式pcr是一种变异的聚合酶链反应(pcr),使用两对(而非一对)pcr引物扩增完整的片段。第一对pcr引物扩增片段和普通pcr相似。第二对引物称为巢式引物(因为他们在第一次pcr扩增片段的内部)结合在第一次pcr产物内部,使得第二次pcr扩增片段短于第一次扩增。巢式pcr的好处在于,如果第一次扩增产生了错误片段,则第二次能在错误片段上进行引物配对并扩增的概率极低,因此,巢式pcr的扩增非常特异。另外,由于第二pcr扩增是以第一次pcr扩增片段为模板,因此,采集少量样本即可在第二次pcr扩增时实现多重pcr,同时检测多个不同的突变位点,实现对多种乙型肝炎病毒的耐药基因进行检测的技术目的。
40.为了同时检测多种乙型肝炎病毒的耐药基因,本实施例提供了一种用于检测乙型病毒性肝炎耐药基因的引物组合,该引物组合包括用于第一次pcr的外引物和用于第二次pcr的内引物,所述内引物在目标基因的位置处于外引物的上下游引物之间。
41.所述外引物具体如下:
42.hbv上游引物:5
’‑
agaacatcgcatcaggactcc-3’(seq id no:1);
43.hbv下游引物:5
’‑
gcctgtttacaggaagtttcc-3’(seq id no:2)。
44.为了分析待检样品dna是否正常扩增,从而排除漏加试剂或样品、样品中含有pcr抑制剂以及dna回收率低等原因造成的pcr扩增异常或失败,在第一次巢式pcr扩增时,还添加了用于扩增内参基因的内标引物,所述内标引物具体如下:
45.内标上游引物:5
’‑
agatttggacctgcgagcg-3’(seq id no:9);
46.内标下游引物:5
’‑
gagcggctgtctccacaagt-3’(seq id no:10)。
47.进行第一次巢式pcr扩增后,可以测定内标引物扩增片段的表达量或进行琼脂糖凝胶电泳,判断内标基因是否表达,当内标基因表达正常时,说明待检样品完好,则进行第二次巢式pcr。
48.具体的,第一次巢式pcr引物混合液为:
[0049][0050]
第一次巢式pcr反应预混液为:10-100mm tris-hcl或tricine-koh,20-100mm k
+
,1-5mm mg
2+
,2-5%甘油,25-250μm dntps,0.5-2u hotstart taq酶。
[0051]
优选的,所述第一次巢式pcr反应预混液为:10mmtris-hcl或tricine-koh,70mm k
+
,1-5mm mg
2+
,2-5%甘油,200μm dntps,2u hotstart taq酶。
[0052]
按照反应预混液与引物混合液体积比3~4:1~3的比例混合,进行巢式一次pcr,扩增程序如下:
[0053][0054][0055]
所述内引物具体如下:
[0056]
hbv上游引物1:5
’‑
gaacacccgtgtgtcttggcc-3’(seq id no:3);
[0057]
hbv下游引物1:5
’‑
tgcataggaagatgataaaac-3’(seq id no:4);
[0058]
hbv上游引物2:5
’‑
aactgcacctgtattcccatc-3’(seq id no:5);
[0059]
hbv下游引物2:5
’‑
aagggactcaagatgttgtac-3’(seq id no:6);
[0060]
hbv上游引物3:5
’‑
atttgttcagtggttcgtagg-3’(seq id no:7);
[0061]
hbv下游引物3:5
’‑
tttcaacacaatatgttcctg-3’(seq i d no:8)。
[0062]
为了检测上述引物对的扩增片段中的突变位点,采用了实时荧光pcr技术,设计了针对突变位点的特异性探针,具体的所述特异性探针的核苷酸序列依次如下所示:
[0063]
hbv探针1:5
’‑
atttgtcctgggta-3’(seq id no:11);
[0064]
hbv探针2:5
’‑
atttgtcctggata-3’(seq id no:12);
[0065]
hbv探针3:5
’‑
cactcccataggtgt-3’(seq id no:13);
[0066]
hbv探针4:5
’‑
ttcgtaggactttc-3’(seq id no:14);
[0067]
hbv探针5:5
’‑
tacctatgggattgg-3’(seq id no:15);
[0068]
hbv探针6:5
’‑
ccgtttctcatggct-3’(seq id no:16);
[0069]
hbv探针7:5
’‑
ttctcttggttcagt-3’(seq id no:17);
[0070]
hbv探针8:5
’‑
ttctcttgactcagt-3’(seq id no:18);
[0071]
hbv探针9:5
’‑
ctcagtttggtagc-3’(seq id no:19);
[0072]
hbv探针10:5
’‑
ctcagttttctagc-3’(seq id no:20);
[0073]
hbv探针11:5
’‑
ctggctttcatttat-3’(seq id no:21);
[0074]
hbv探针12:5
’‑
ctggctttcggttat-3’(seq id no:22);
[0075]
hbv探针13:5
’‑
ttcagttatatcgat-3’(seq id no:23);
[0076]
hbv探针14:5
’‑
ttcagttatgtggat-3’(seq id no:24);
[0077]
hbv探针15:5
’‑
caagtctgtatgaca-3’(seq id no:25);
[0078]
hbv探针16:5
’‑
tatacatttaaccc-3’(seq id no:26);
[0079]
hbv探针17:5
’‑
cccttaatttcgtgg-3’(seq id no:27)。
[0080]
其中,每条所述特异性探针的5
′
端标记有荧光基团,每条所述特异性探针的3
′
端标记有淬灭基团,所述荧光基团选自fam、rox或cy5,所述淬灭基团为mgb。需要注意的是为了区别和接收各探针在反应过程中的荧光信号,同一反应体系中的探针的荧光基团互不相同。优选的,核苷酸序列如seq id no.11~seq id no.12、seq id no.13~seq id no.14、seq id no.15~seq id no.16、seq id no.17~seq id no.18、seq id no.19~seq id no.20、seq id no.21~seq id no.22、seq id no.23~seq id no.24的探针的5
′
端标分别依次标记有荧光基团rox和cy5,seq id no.25~seq id no.27的探针的5
′
端标分别依次标记有荧光基团fam、rox和cy5。
[0081]
所述特异性探针用于检测目标耐药基因的突变位点,其与用于扩增目标耐药基因的内引物之间存在相互对应关系。具体的,核苷酸序列如seq id no.11~seq id no.12所示的探针用于检测核苷酸序列如seq id no.3~seq id no.4所示的引物对扩增的目标耐药基因的突变位点,核苷酸序列如seq id no.13~seq id no.24所示的探针用于检测核苷酸序列如seq id no.5~seq id no.6所示的引物对扩增的目标耐药基因的突变位点,核苷酸序列如seq id no.25~seq id no.27所示的探针用于检测核苷酸序列如seq id no.7~seq id no.8所示的引物对扩增的目标耐药基因的突变位点。
[0082]
为了分析待检样品dna是否正常扩增,从而排除漏加试剂或样品、样品中含有pcr抑制剂以及dna回收率低等原因造成的pcr扩增异常或失败,在第二次巢式pcr扩增时,还添加了用于扩增内参基因的内标引物,所述内标引物具体如下:
[0083]
内标上游引物:5
’‑
agatttggacctgcgagcg-3’(seq id no:9);
[0084]
内标下游引物:5
’‑
gagcggctgtctccacaagt-3’(seq id no:10)。
[0085]
相应的,在探针组中也添加了用于检测针对内标引物所扩增的内参基因的内标探针,所述内标探针具体如下:
[0086]
内标探针:5
’‑
ttctgacctgaaggctctgcgcg-3’(seq id no:35)。
[0087]
其中,在所述内标探针的5’端连接有荧光标记hex,在所述内标探针的3’端连接有淬灭基团bhq1。
[0088]
具体的,第二次巢式pcr引物探针混合液为:
[0089][0090]
第二次巢式pcr反应预混液与第一次巢式pcr反应预混液相同:10-100mmtris-hcl或tricine-koh,20-100mmk
+
,1-5mmmg
2+
,2-5%甘油,25-250μmdntps,0.5-2uhotstarttaq酶。
[0091]
优选的,所述第二次巢式pcr反应预混液为:10mmtris-hcl或tricine-koh,70mmk
+
,1-5mmmg
2+
,2-5%甘油,200μmdntps,2uhotstarttaq酶。
[0092]
按照pcr反应预混液与引物探针混合液体积比3~4:1~3的比例混合,进行第二次巢式pcr,扩增程序如下:
[0093][0094]
在本技术的另一个实施例中,将上述引物混合液、引物探针混合液、pcr反应预混液分装加贴标签即可组装用于检测乙型肝炎病毒耐药基因的试剂盒。
[0095]
具体的,所述试剂盒包括第一次巢式pcr引物混合液、第二次巢式pcr引物探针混合液、第一次巢式pcr反应预混液、第二次巢式pcr反应预混液。
[0096]
该试剂盒在使用时,由于该试剂盒不含提取试剂,血液样本可以使用市售的核酸提取试剂盒,如qiagen公司的qiaampminelute virus spin kit(货号:57704)、天根生化科技有限公司病毒基因组dna/rna提取试剂盒(货号:dp315)或takaraminibest viral rna/dna extraction kit ver.5.0(货号:9766),具体提取步骤请参照相应提取试剂盒说明书。
[0097]
将提取到的样本dna加装到含有第一次巢式pcr引物混合液和第一次pcr反应预混液的反应体系中,盖上管盖,离心数秒后移至扩增检测区,将pcr反应管放入荧光pcr扩增仪中进行扩增检测。
[0098]
结果判定方法为:
[0099]
当耐药基因对应特异性探针的荧光基团显示扩增曲线均不成s型,而内标探针的
荧光基团hex显示扩增曲线呈s型且ct值≤35,表示不存在突变的耐药基因;
[0100]
当耐药基因对应特异性探针的荧光基团显示扩增曲线为s型,且ct值≤35,则表示存在该特异性探针的突变耐药基因。
[0101]
在本技术的另一个实施例中,在上述试剂盒的基础上,所述试剂盒还包括封闭隔离材料、裂解液、洗液a、洗液b和可熔性材料。
[0102]
该试剂盒体系可应用于实时荧光pcr即时检测(point-of-care testing,poct)技术检测乙型肝炎病毒耐药基因。实时荧光pcr即时检测(point-of-caretesting,poct)是一种集核酸提取、实时荧光基因检测与微流控卡盒相结合的一体化基因分析新技术,只需要手工加样,而后的核酸提取检测及分析过程均由机器完成,实现了从样本到基因检测结果的全封闭自动输出,具有操作简单、特异性高、成本低、速度快、结果准确等特点。利用基于poct技术的一体化核酸快速检测试剂盒,可以在相对较低成本的情况下,一体化地对乙型肝炎病毒进行核酸提取和pcr扩增,进而可直接进行光学检测所需的数据收集和分析,无需像常规核酸检测技术那样需要二级生物安全资质的核酸检测实验室(包括试剂配制间,核酸提取间和pcr扩增间)和专业技术人员进行手工pcr扩增体系的配制,提取核酸的加样,扩增基因的检测,荧光数据的分析和实验结果的判定。它可以用于真正实现从样本到结果输出的自动化,帮助条件有限地区实现快速的核酸检测。
[0103]
参照公布号为cn114015567a,专利名称为一种基于旋转柱塞的气动一体式pcr检测试剂盒及其检测方法的专利,该专利记载了一体式pcr检测的微流控卡盒,该微流控卡盒上至少设置有一个用于样本清洗和洗脱的混合仓、多个分别用于存储不同试剂的储液仓和多个反应仓;盒体上还设置有柱塞腔,柱塞腔内设置有可沿轴向旋转至不同角度的旋转柱塞,旋转柱塞上设置有多个不同的液体流道,每个液体流道分别在旋转柱塞旋转至不同角度下连通混合仓与储液仓。
[0104]
所述封闭隔离材料为疏水性液态材料,可以对多个功能性腔体进行隔离,使各个腔体间的液体不会外溢,生物样本能够在各个腔体内分别进行裂解、清洗纯化和扩增反应,并可以利用磁珠以附着方式将核酸依次带入各个腔体,其中疏水性液态封闭材料能够对磁珠有个分散作用,它能够允许穿过磁珠和磁珠上的核酸,阻隔其它杂质,当磁珠穿过时,磁珠上附着的如一些非极性大颗粒的杂质会浸润在疏水性液态封闭材料内而被截留,可以降低杂质对检测结果的影响。
[0105]
具体的,所述封闭隔离材料的密度为0.1-1.5g/ml,粘度为1000-200000cstg/ml,该设置可以确保疏水性液态封闭材料能够对液体进行隔离,又能让负载有样本的磁珠穿过,且对磁珠有分散作用,清楚磁珠上的非极性杂质。优选的,所述封闭隔离材料为硅油。
[0106]
所述裂解液包含1-1000mm乙酸-乙酸钠、0.1-10wt%聚乙二醇、0.1-10m异硫氰酸胍、0.1-10wt%tritonx-100、1-5wt%十二烷基硫酸钠。
[0107]
所述洗液a包含1-500m ph8.0的mtris-hcl、10-500mm kcl、0.1-10wt%聚乙二醇。
[0108]
所述洗液b包含1-500mm ph8.0的tris-hcl、10-500mm kcl、0.1-10wt%peg、0.75wt%非蛋白封闭剂。其中,所述非蛋白封闭剂来自于jsr公司的blockmastertmpa1080。
[0109]
所述可熔性材料用于包埋第一次巢式pcr引物混合液和第二次巢式pcr引物探针混合液中的部分反应组分,具体为将镁离子液包埋在可熔性材料内,使反应液体系的反应液和酶促金属离子分离,避免金属离子刺激酶蛋白,延长卡盒的有效期。具体的,所述可熔
性材料为石蜡、十二烷、十四烷、十六烷等烷烃类物质中的任意一种或多种的组合,熔点范围为20℃~95℃,优选为石蜡。使用时熔化为液态的石蜡油可以防止形成气溶胶的pcr产物污染实验室;石蜡油热传导性弱,有效保证pcr的温度条件;石蜡的低温凝固特性在磁珠回拖温度下降后可以固定磁珠位置;石蜡可熔性使包埋物可以使反应液从隔离状态合并。
[0110]
具体的,在本实施例中,申请人还分别设计了针对seq id no.3~seq id no.4所示引物的野生型乙肝病毒的如seq id no.28的探针,针对seq id no.5~seq id no.6所示引物的野生型乙肝病毒的如seq id no.29~34的探针。并在探针如seq id no.28~34的探针的5
′
端标标记有荧光基团fam。具体如下:
[0111]
hbv探针18:5
’‑
fam-atttgtcctggtta-mgb-3’(seq id no:28);
[0112]
hbv探针19:5
’‑
fam-cactcccataggtat-mgb-3’(seq id no:29);
[0113]
hbv探针20:5
’‑
fam-tacctatgggagtgg-mgb-3’(seq id no:30);
[0114]
hbv探针21:5
’‑
fam-ttctcttggctcagt-mgb-3’(seq id no:31);
[0115]
hbv探针22:5
’‑
fam-ctcagtttactagc-mgb-3’(seq id no:32);
[0116]
hbv探针23:5
’‑
fam-ctggctttcagttat-mgb-3’(seq id no:33);
[0117]
hbv探针24:5
’‑
fam-ttcagttatatggat-mgb-3’(seq id no:34)。
[0118]
第二次巢式pcr引物探针混合液为:
[0119]
其中,反应仓1组成:
[0120][0121]
其中,反应仓2组成:
[0122][0123][0124]
其中,反应仓3组成:
[0125][0126]
其中,反应仓4组成:
[0127][0128]
其中,反应仓5组成:
[0129][0130]
其中,反应仓6组成:
[0131][0132]
其中,反应仓7组成:
[0133][0134][0135]
其中,反应仓8组成:
[0136][0137]
上述各反应仓对应基因如下:
[0138]
[0139][0140]
下面以基于poct技术的一体化核酸快速检测试剂盒为例,说明本技术技术方案的效果。
[0141]
实验例
[0142]
为验证本发明试剂盒针对乙型肝炎病毒耐药性检测的准确性,对30位hbv患者进行检测。
[0143]
1)检测准备
[0144]
①
仪器准备:请根据仪器手册的要求操作机器。打开全自动医用pcr分析仪(巢式)电源。仪器自检完毕后待用。
[0145]
②
程序确认:如果第一次使用此试剂盒时,请在仪器操作界面点击【新建实验】[new experiment],界面转换后点击【扫描二维码】[scan qr code],扫描试剂盒外包装侧面的二维码,待程序新建成功后(如果仪器内已存有该程序,执行此步骤不会产生干扰),退出此界面。部分仪器已经内置该程序,就不需要再新建程序,即不需要此步骤。
[0146]
③
试剂准备:取出检测卡盒、磁珠,室温下复温。磁珠在使用前请充分振荡混匀。
[0147]
2)样本检测:
[0148]
①
打开卡盒的盖子,再打开封口膜,加入200μl样本。再加入10μl的磁珠(使用前请振荡使之充分悬浮),用移液器分吹打试剂混匀,后盖紧盖子。
[0149]
②
在主界面选择【快速运行】/rapid run。单击[检测名称]/[detect name]列的扫描图标。将检测卡上的条形码与仪器的扫描仪对齐,扫描条码以加载测试程序。然后单击样
本信息列并输入样本信息。
[0150]
③
软件提示出现后,选择一个通道,将检测卡盒插入待运行的检测通道,按紧。
[0151]
④
点击仪器开始检测,软件显示运行界面。
[0152]
3)数据分析:
[0153]
检测完成后,数据出来后,在屏上选择【分析数据】/analysis,仪器将直接对结果进行分析并自动判断待测样本的定性检测结果。
[0154]
4)结果分析:
[0155]
①
检测程序运行结束后,适用仪器自动报告检测结果。
[0156]
②
结果显示靶标基因(fam/rox/cy5)、内参基因(hex)的检测结果:
[0157]
当hex通道扩增曲线呈s型且ct值≤35,在fam、rox和cy5通道扩增曲线均不成s型,表示不存在突变的耐药基因;
[0158]
当hex通道扩增曲线呈s型且ct值≤35,在fam、rox或cy5通道扩增曲线为s型,且ct值≤35,则表示存在相应通道探针对应的存在耐药基因。检测结果如表1。
[0159]
表1 30位hbv患者血液样本检测结果
[0160]
[0161]
[0162]
[0163][0164]
结论:30例样本检测结果中,30例样本为有效数据,样本有效数据阳性样本符合率100%,除样本15未检测出突变位点,其它样本且均存在基因的突变。
[0165]
为了进一步验证上述检测结果的准确性,同时对pcr扩增产物进行了测序分析。将巢式第二次pcr的产物进行sanger测序,测序完成后,使用序列分析软件sequencher将测序
图谱与hbv参考株序列进行比对,进而确定待分析位点的突变情况确定hbv核苷类似物耐药突变位点。检测结果如表2。
[0166]
表2 30位hbv患者血液样本的耐药基因突变位点
[0167][0168][0169]
结论:由表1和表2结果对比可知,本技术方法未检测出样本15的耐药基因,其它样本与sanger测序结果一致。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1