一种病毒核酸提取试剂盒及利用该试剂盒提取完整病毒颗粒核酸的方法
1.本发明涉及核酸提取技术领域,尤其涉及一种病毒核酸提取试剂盒及利用该试剂盒提取完整病毒颗粒核酸的方法。
背景技术:
2.几乎所有的生物包括动物、植物和细菌、真菌等微生物都可以被相应的病毒感染,我们人类也不能幸免。病毒严重威胁着人类健康,80%的人类传染病都是由病毒引起,如新冠、流感、天花、肝炎、麻疹、脊髓灰质炎、狂犬病、疯牛病以及爱滋病等,有的病毒(乙肝病毒、丙肝病毒、人乳头瘤病毒等)还参与了正常动物细胞转化成癌细胞的过程。
3.病毒(biological virus)是一种个体微小(大多在10~300nm之间),结构简单,只含一种遗传物质(病毒dna或rna),必须在活细胞内寄生并以复制方式增殖的非细胞型生物。病毒是一种非细胞生命形态,它由一个核酸长链和蛋白质外壳构成,病毒没有自己的代谢机构,没有酶系统。因此病毒离开了宿主细胞,就成了没有任何生命活动、也不能独立自我繁殖的化学物质。它的复制、转录、和转译的能力都是在宿主细胞中进行,当它进入宿主细胞后,它就可以利用细胞中的物质和能量完成生命活动,按照它自己的核酸所包含的遗传信息产生和它一样的新一代病毒。
4.病毒是一种没有细胞结构的最低级的生命体。最简单的病毒中心是核酸(病毒dna或rna),外面包被着1层有规律地排列的蛋白亚单位,称为衣壳(capsid)。构成衣壳的形态亚单位称为壳粒(capsomere),由核酸和衣壳蛋白所构成的粒子称为核衣壳(nucleocapsid)。较复杂的病毒外边还有由脂质和糖蛋白构成的包膜(envelope)。核衣壳按壳粒的排列方式不同而分为3种模式:二十面体对称,如脊髓灰质炎病毒;螺旋对称,如烟草花叶病毒;复合对称,如t偶数噬菌体。在脂质的包膜上还有1种或几种糖蛋白,在形态上形成突起,如流感病毒的血凝素和神经氨酸酶。
5.病毒是专性细胞内病原体,它们必须依赖宿主细胞进行繁殖和代谢。病毒的生命周期在病毒的种类和类别之间有很大的不同,但其遵循相同的病毒复制基本阶段。病毒的生命周期可以分为几个主要阶段:吸附、进入、脱壳、复制、成熟和释放。完整病毒与宿主细胞表面受体结合,病毒通过两条主要途径进入真核细胞,然后就开始脱壳和复制的过程。病毒衣壳由一个或几个翻译后的病毒蛋白组装而成,核酸基因组和其他必需蛋白质被包装在衣壳内后,组装成为完整病毒颗粒后分泌到胞外,进而开始新一轮感染宿主细胞。
6.病毒颗粒在组装和分泌时候,会产生大量的不具有感染活性的亚病毒成分。例如新冠病毒n蛋白质可以与基因组rna结合并形成亚病毒颗粒分泌,乙型肝炎病毒的核心蛋白和病毒dna可组装成衣壳颗粒并分泌,人类免疫缺陷病毒(hiv)的衣壳蛋白(ca)和丙型肝炎病毒(hcv)的核心蛋白可以包被病毒rna并将其作为亚病毒颗粒分泌。同时病毒还能够分泌大量的不含有病毒基因组的空壳病毒、游离的抗原等。然而,根据病毒生命周期,完整的病毒颗粒显然是维持感染的唯一元素,而亚病毒颗粒及空壳病毒等无法维持足够一致的病毒
生命周期,从而持续感染宿主。因此如何能够检测具有感染活性的完整病毒颗粒,是目前乃至今后病毒检测领域值得解决的问题。
7.目前的病毒检测方法主要是免疫检测和分子检测两类,以乙肝和新冠病毒为例。乙肝病毒的免疫检测对象主要是对乙肝病毒编码的抗原及其在宿主体内产生的相应抗体,检测方法主要是基于化学发光对乙肝病毒抗原(hbeag、hbsag)和抗体(hbeab和hbsab)等检测。乙肝病毒的分子检测主要是检测乙肝病毒的基因组,主要是基于乙肝病毒的基因组dna以及新近发展起来的病毒rna。新冠病毒检测也是类似,目前的免疫检测主要是基于新冠病毒n蛋白的抗原检测和基于n和(或)s(或者rbd)免疫产生的抗体进行检测,以及基于病毒rna的核酸检测。现有的商品化或者文献报道的病毒免疫检测和分子检测都只是检测病毒抗原或者核酸,都无法检测具有感染活性的病毒颗粒。
8.要实现完整病毒的精准检测,能够快速、便捷提取完整病毒颗粒的核酸是关键。目前核酸提取纯化大多使用煮沸法、碱裂解法、离心吸附柱法、磁珠法等。传统的核酸提取方法用时操作繁琐、费时、难以实现批量提取和自动化操作等,同时还存在安全风险和样品污染,如煮沸裂解法,高温处理样本容易产生气溶胶,存在污染检测环境风险;硅胶膜吸附法需要多次离心,容易出现交叉污染等问题。磁珠法作为可应用自动化的核酸提取方法,主要原理是基于磁珠在高盐溶液中对核酸进行特异性的吸附,然后经过磁性分离和漂洗蛋白质和多糖等杂质后,在低盐溶液中被洗脱下来,从而达到对核酸进行提取纯化的目的。
9.核酸提取仪是配合核酸提取试剂自动或半自动完成样本核酸提取工作的仪器。广泛应用在临床疾病诊断、疾病控制中心、食品安全检测、分子生物学研究等多种领域。核酸提取仪通常采用磁珠法提取,该种方法是以磁珠为载体,利用磁珠在高盐低ph值下吸附核酸,在低盐高ph值下与核酸分离的原理,再通过移动磁珠或转移液体来实现核酸的整个提取纯化过程。目前可以完成细胞、细菌、病毒、组织、血清等样品的核酸提取。国内外有较多的生物技术公司(如圣湘、中元、之江、科华、艾康、奥盛等以及roche、qiagen、biomerieux、thermofisher、abbott、promega、chemagen、ambion等)均有基于磁珠法原理的半自动核酸提取仪或全自动提取纯化系统。但是目前均无法实现完整病毒颗粒提取。
10.基于此,提出本发明。
技术实现要素:
11.本发明的目的在于提供一种病毒核酸提取试剂盒及利用该试剂盒提取完整病毒颗粒核酸的方法。
12.为了实现上述发明目的,本发明提供以下技术方案:
13.本发明提供了一种病毒核酸提取试剂盒,包括病毒颗粒俘获液、病毒颗粒洗液、病毒颗粒裂解液、洗涤液1、洗涤液2、核酸洗脱液和磁珠溶液;
14.所述病毒颗粒俘获液包括偶联抗体或适配体的磁珠以及病毒颗粒洗液;
15.所述偶联抗体或适配体的磁珠与病毒颗粒洗液的体积比为1:20~50;
16.所述病毒颗粒俘获液的ph为4.0~9.5。
17.作为优选,所述病毒颗粒洗液以水为溶剂包括如下浓度的组分:
18.50~200mm的nacl、0.05~0.2g/l的牛血清白蛋白、5~10vt%的聚乙二醇4000;
19.所述病毒颗粒洗液的ph为4.0~9.5。
20.作为优选,所述病毒颗粒裂解液以水为溶剂,包括如下浓度的组分:
21.1~5mm的异硫氰酸胍、2~4m的盐酸胍、10~40vt%的无水乙醇、10~100mm的乙二胺四乙酸、0.1~0.3g/l的蛋白酶k、5~20mm的tris-hcl、0.1~1vt%的tritonx-100、100~300mm的nacl、50~300ug的rna酶;
22.所述病毒颗粒裂解液的ph为5.0~8.0。
23.作为优选,所述病毒颗粒裂解液以水为溶剂,包括如下浓度的组分:
24.1~5mm的异硫氰酸胍、2~4m的盐酸胍、10~40vt%的乙醇、1~4vt%的吐温20、10~100mm的乙二胺四乙酸;
25.所述病毒颗粒裂解液的ph为5.0~7.5。
26.作为优选,所述洗涤液1以水为溶剂,包括如下浓度的组分:
27.10~15mm的tris-hcl、2~4m的盐酸胍、20~50vt%的无水乙醇、10~100mm的乙二胺四乙酸、100~300mm的nacl;
28.所述洗涤液1的ph为6.5~8.0。
29.作为优选,所述洗涤液2以水为溶剂,包括如下浓度的组分:
30.10~15mm的tris-hcl、50~80vt%的无水乙醇、0.1~0.5wt%的pvp和10~100mm乙二胺四乙酸;
31.所述洗涤液2的ph为6.5~8.0。
32.作为优选,所述核酸洗脱液为tris-hcl水溶液;
33.所述tris-hcl水溶液中含有tris-hcl的浓度为10~30mm;
34.所述核酸洗脱液的ph为6.5~8.0;
35.所述磁珠溶液的初始浓度为20~100mg/ml;
36.所述磁珠为硅羟基修饰、羧基修饰或链霉亲和素修饰的磁珠。
37.作为优选,所述病毒包括甲肝病毒(hepatitis avirus,hav)、乙肝病毒(hepatitis b virus,hbv)、丙肝病毒(hepatitis c virus,hcv)、丁肝病毒(hepatitis d virus,hdv)、戊肝病毒(hepatitis e virus,hev)、新冠病毒(sars cov-2)、艾滋病病毒(human immunodeficiency virus,hiv)、流感病毒(influenza virus)、偏肺病毒(partial pulmonary virus)、人乳头状瘤病毒(humanpapillomavirus,hpv)、疱疹病毒(herpes virus)、单纯疱疹病毒(herpesvirus hominis)、寨卡病毒(zikavirus)、埃博拉病毒(ebola virus,ebv)、人类嗜t淋巴细胞病毒(human t-lymphocytic virus)、禽流感病毒(avian influenzavirus)、猪瘟病毒(hog cholera virus,csfv)、脊髓灰质炎病毒(poliovirus)、狂犬病病毒(rabies virus)、腺病毒(adenovirus)或慢病毒(lentivirus)。
38.本发明还提供了利用权利要求所述的核酸提取试剂盒提取完整病毒颗粒的方法,包括如下步骤:
39.(1)将病毒颗粒俘获液与血清样本混合,25~30℃条件下孵育8~20min后,静置1~2min,弃上清,得到中间物1;
40.(2)将所述的中间物1与病毒颗粒洗液混匀,弃上清,重复操作该步骤1~2次,得到中间物2;
41.(3)将所述的中间物2与病毒颗粒裂解液混匀,53~57℃条件下孵育4~6min,得到中间物3;
42.(4)将所述的中间物3与磁珠溶液混合,25~30℃条件下孵育8~12min后,静置1~2min,弃上清,得到中间物4;
43.(5)将所述的中间物4与洗涤液1混匀后,弃上清后,得到中间物5;
44.(6)将所述的中间物5与洗涤液2混匀后,弃上清,重复操作此步骤1~2次,得到中间物6;
45.(7)将所述的中间物6静置4~6min后,加入核酸洗脱液,53~57℃孵育4~6min后,静置1~3min,取上清液得到完整病毒颗粒内病毒核酸。
46.作为优选,所述病毒颗粒俘获液与血清样本混合的体积比为1:4~5;
47.血清样本与病毒颗粒洗液1的体积比为1:9~11;
48.血清样本与病毒颗粒裂解液的体积比为1:9~11;
49.血清样本与蛋白酶k的体积比为5:1.5~2.5;
50.血清样本与磁珠溶液的体积比为5:2.5~3.5;
51.血清样本与核酸洗脱液的体积比为1:0.8~1.2。
52.本发明提供了一种病毒核酸提取试剂盒及利用该试剂盒提取完整病毒颗粒核酸的方法。本发明的病毒核酸提取试剂盒具有如下优点:
53.本发明的病毒核酸提取试剂盒能够提取完整病毒颗粒核酸,也可以与完整病毒颗粒核酸提取仪配套而实现全自动化提取。该试剂盒具有快速、高效且避免污染的优点,可以节省大量时间和试剂,为精准、快捷、高通量地检测具有感染活性的完整病毒颗粒提供重要支撑。
附图说明
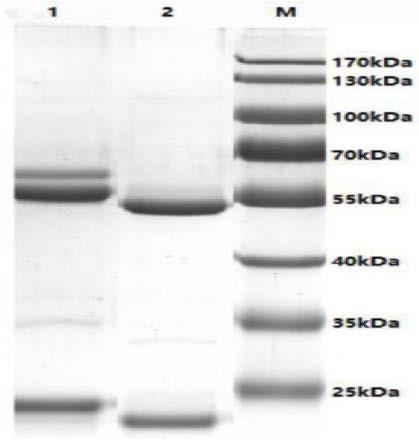
54.图1为单克隆抗体纯化图(其中1表示#17单抗,2表示#33单抗,m表示marker);
55.图2为particle gel检测结果图(1和3表示空白对照,2表示#17抗体,4表示#33抗体);
56.图3为六例chb病人的完整病毒颗粒病毒dna和病毒rna检测;
57.图4为hbv阳性患者血清中提取出的核酸qpcr曲线图;
58.图5为hbv阳性患者血清中提取出的核酸qpcr cq值柱状图;
59.图6为向购买现有hbv pres1单克隆抗体particle gel检测结果图(1、2号为hbv阳性血清;阴性对照为慢病毒)。
具体实施方式
60.本发明提供了一种病毒核酸提取试剂盒,包括病毒颗粒俘获液、病毒颗粒洗液、病毒颗粒裂解液、洗涤液1、洗涤液2、核酸洗脱液和磁珠溶液;
61.所述病毒颗粒俘获液包括偶联抗体或适配体的磁珠以及病毒颗粒洗液;
62.所述偶联抗体或适配体的磁珠与病毒颗粒洗液的体积比为1:20~50,优选为1:35;
63.所述病毒颗粒俘获液的ph为4.0~9.5,优选为6~7.5,进一步优选为6.75。
64.在本发明中,在偶联抗体的磁珠中加入120μl病毒颗粒洗液,将偶联抗体的磁珠悬起,得到病毒颗粒俘获液。该病毒颗粒俘获液在4℃条件下保存备用。
65.在本发明中,所述偶联磁珠的抗体可以为现有技术的抗体或者现制备的抗体。
66.在本发明中,所述病毒颗粒洗液以水为溶剂包括如下浓度的组分:
67.50~200mm的nacl,优选为100~150mm,进一步优选为125mm;0.05~0.2g/l的牛血清白蛋白,优选为0.1~0.15g/l,进一步优选为0.125g/l;5~10vt%的聚乙二醇4000,优选为7.5vt%;所述病毒颗粒洗液的ph为4.0~9.5,优选为6~7.5,进一步优选为6.75。
68.在本发明中,所述病毒颗粒裂解液以水为溶剂,包括如下浓度的组分:
69.1~5mm的异硫氰酸胍,优选为3mm;2~4m的盐酸胍,优选为2m;10~40vt%的乙醇,优选为25vt%;0.05~1vt%的tritonx-100,优选为0.125vt%;10~100mm的乙二胺四乙酸,优选为30mm;0.1~0.3g/l的蛋白酶k,优选为0.15g/l;5~20mm的tris-hcl,优选为10mm;100~300mm的nacl,优选为200mm;0.1~0.4g/l的rna酶,优选为0.3g/l;所述病毒颗粒裂解液的ph为5.0~8.0,优选为6.25。
70.在本发明中,所述病毒颗粒裂解液以水为溶剂,包括如下浓度的组分:
71.1~5mm的异硫氰酸胍,优选为3mm;2~4m的盐酸胍,优选为3m;10~40vt%的乙醇,优选为25vt%;1~4vt%的吐温20,优选为2.5vt%;10~100mm的乙二胺四乙酸(edta),优选为55mm;所述病毒颗粒裂解液的ph为5.0~7.5,优选为6.25。所述病毒颗粒裂解液的ph为5.0~7.5。
72.在本发明中,所述洗涤液1以水为溶剂,包括如下浓度的组分:
73.10~15mm的tris-hcl,优选为12.5mm;2~4m的盐酸胍,优选为3m;20~50vt%的无水乙醇,优选为35vt%;10~100mm的乙二胺四乙酸,优选为55mm;100~300mm的nacl,优选为200mm;所述洗涤液1的ph为6.5~8.0,优选为8.0。
74.在本发明中,所述洗涤液2以水为溶剂,包括如下浓度的组分:
75.10~15mm的tris-hcl,优选为12.5mm;50~80vt%的无水乙醇,优选为65vt%;0.1~0.5wt%的pvp,优选为0.3wt%;10~100mm乙二胺四乙酸,优选为55mm;
76.所述洗涤液2的ph为6.5~8.0,优选为7.25。
77.在本发明中,所述核酸洗脱液为tris-hcl水溶液;所述tris-hcl水溶液中含有tris-hcl的浓度为10~30mm,优选为20mm;所述核酸洗脱液的ph为6.5~8.0,优选为7.25;所述tris-hcl水溶液配置时的水为经过depc处理后的水。
78.所述磁珠溶液的初始浓度为20~100mg/ml,优选为75mg/ml;所述磁珠为硅羟基修饰、羧基修饰或链霉亲和素修饰的磁珠。
79.在本发明中,所述偶联抗体磁珠的制备过程如下:
80.方式一:羧基修饰磁珠偶联抗体的制备方法为:
81.(1)剧烈振荡羧基磁珠(100~300nm),使其分散均匀。取3.3mg磁珠至2ml ep管中,磁力分离,用预冷mes缓冲液洗涤3次;
82.(2)施加磁场,去上清,将100μlnhs与等量edc溶液迅速加入ep管中,剧烈振荡,25℃持续活化磁珠30min;
83.(3)借助磁力架,用预冷的mes缓冲液洗涤磁珠3次,并尽快用于单克隆抗体偶联;
84.(4)将待偶联的单克隆抗体用预冷mes缓冲液稀释至抗体终浓度约为0.6g/l,100μl;
85.(5)活化好的磁珠用100μlmes缓冲液重悬,剧烈摇晃,保证磁珠全部分散;
86.(6)每次取20μl活化磁珠悬液,分5次将活化磁珠悬液缓慢加入稀释好的单克隆抗体悬液中,每次加入磁珠后立即温和混匀,4℃,温和旋转混匀4h;
87.(7)配制5%的bsa溶液(10mlmes溶液+0.5g bsa);
88.(8)施加磁场,将上清移去,迅速向管中加入200μlbsa封闭液,25℃温和旋转30min;
89.(9)借助磁力架,用pbs将磁珠清洗三次,得到偶联抗体的磁珠。
90.在本发明中,在偶联抗体的磁珠中加入120μl病毒颗粒洗液,将偶联抗体的磁珠悬起,得到病毒颗粒俘获液。该病毒颗粒俘获液在4℃条件下保存备用。
91.方式二:链霉亲和素修饰磁珠偶联经生物素化抗体的制备方法
92.(1)使用载玻片分析仪透析盒进行生物素化,首先用反应缓冲液稀释抗体溶液至2mg/ml;
93.(2)向2mg nhs-peg4-生物素中添加170μl超纯水,以制备20mm储备溶液;
94.(3)将36μl的nhs-peg4-生物素溶液添加到1ml上述抗体溶液中;
95.(4)室温避光孵育30min;
96.(5)通过透析去除未反应的nhs-peg4-生物素;
97.(6)生物素化的蛋白4℃存放使用;
98.(7)剧烈振荡链霉亲和素磁珠,使其分散均匀。取适量磁珠(0.3~0.5mg)于2ml干净ep管中,通过磁力架分离弃上清。用上样缓冲液洗涤3~5次。
99.(8)向上述磁珠中加入经生物素化的抗体,25℃振荡反应10~30min。置于磁力架上进行磁分离,弃上清,并用上样缓冲液重复洗3次,得到偶联生物素化抗体的链霉亲和素磁珠。
100.在本发明中,所述病毒包括甲肝病毒(hepatitisavirus,hav)、乙肝病毒(hepatitis b virus,hbv)、丙肝病毒(hepatitis c virus,hcv)、丁肝病毒(hepatitis d virus,hdv)、戊肝病毒(hepatitis e virus,hev)、新冠病毒(sars cov-2)、艾滋病病毒(human immunodeficiency virus,hiv)、流感病毒(influenzavirus)、偏肺病毒(partialpulmonaryvirus)、人乳头状瘤病毒(humanpapillomavirus,hpv)、疱疹病毒(herpes virus)、单纯疱疹病毒(herpesvirus hominis)、寨卡病毒(zikavirus)、埃博拉病毒(ebolavirus,ebv)、人类嗜t淋巴细胞病毒(humant-lymphocytic virus)、禽流感病毒(avian influenzavirus)、猪瘟病毒(hog choleravirus,csfv)、脊髓灰质炎病毒(poliovirus)、狂犬病病毒(rabies virus)、腺病毒(adenovirus)或慢病毒(lentivirus)。
101.在本发明中,所述病毒核酸提取试剂盒提取的为上述所述病毒的完整病毒颗粒的dna或rna。
102.本发明还提供了利用权利要求所述的核酸提取试剂盒提取完整病毒颗粒的方法,包括如下步骤:
103.(1)将病毒颗粒俘获液与血清样本混合,25~30℃条件下孵育8~20min后,静置1~2min,弃上清,得到中间物1;(2)将所述的中间物1与病毒颗粒洗液混匀,弃上清,重复操作该步骤1~2次,得到中间物2;(3)将所述的中间物2与病毒颗粒裂解液混匀,53~57℃条件下孵育4~6min,得到中间物3;(4)将所述的中间物3与磁珠溶液混合,25~30℃条件下孵育8~12min后,静置1~2min,弃上清,得到中间物4;(5)将所述的中间物4与洗涤液1混匀
后,弃上清后,得到中间物5;(6)将所述的中间物5与洗涤液2混匀后,弃上清,重复操作此步骤1~2次,得到中间物6;(7)将所述的中间物6静置4~6min后,加入核酸洗脱液,53~57℃孵育4~6min后,静置1~3min,取上清液得到完整病毒颗粒内病毒核酸。
104.在本发明中,所述病毒颗粒俘获液与血清样本混合的体积比为1:4~5,优选为1:4.5;步骤(1)所述孵育的温度优选为27.5℃;步骤(1)所述孵育的时间优选为10min;步骤(1)所述孵育为旋转共孵育;步骤(1)所述静置的时间优选为1.5min;步骤(1)所述静置借助磁力架进行静置。
105.血清样本与病毒颗粒洗液1的体积比为1:9~11,优选为1:10;步骤(2)所述混匀为颠倒混匀;步骤(2)所述弃上清的步骤为借助磁力架弃上清;步骤(2)所述弃上清的作用为去除非特异性结合物质。
106.血清样本与病毒颗粒裂解液的体积比为1:9~11,优选为1:10;步骤(3)所述混匀为颠倒混匀;步骤(3)所述孵育的温度优选为55℃;步骤(3)所述孵育的时间优选为5min。
107.血清样本与蛋白酶k的体积比为5:1.5~2.5,优选为5:2;步骤(4)所述孵育的温度优选为27.5℃;步骤(4)所述孵育的时间优选为10min;步骤(4)所述静置借助磁力架静置;步骤(4)所述静置的时间优选为1.5min。
108.血清样本与磁珠溶液的体积比为5:2.5~3.5,优选为5:3;步骤(5)所述混匀为颠倒混匀;步骤(5)所述弃上清为借助磁力架弃上清。步骤(6)所述混匀为颠倒混匀;步骤(6)所述弃上清为借助磁力架弃上清。
109.步骤(7)所述静置的时间优选为5min;血清样本与核酸洗脱液的体积比为1:0.8~1.2,优选为1:1.0;步骤(7)所述孵育的温度优选为55℃;步骤(7)所述孵育的时间优选为5min;步骤(7)所述静置为借助磁力架静置;步骤(7)所述静置的时间优选为2min。
110.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
111.实施例1
112.以俘获完整乙肝病毒颗粒(hbv)的单克隆抗体设计制备进行阐释。乙肝病毒是一种具有双链dna基因组的假逆转录病毒。其重要的特征是hbv感染肝细胞后可以分泌多种形式的病毒颗粒,大致可以分为包含基因组及无基因组的病毒粒子。根据基因组的种类又可以分为hbv rna类病毒粒子、hbv dna病毒粒子与无基因组病毒粒子。以有无hbsag为标准,又可以将不同基因组的病毒粒子划分为核衣壳病毒、包膜化病毒与亚病毒粒子。
113.hbv dane颗粒是一种球形颗粒,直径约为42nm,外含包膜蛋白(大、中、小表面蛋白),内由hbc蛋白包裹rcdna形成的核衣壳组成。与hbsag病毒颗粒相比,前者包含丰富的l蛋白,l蛋白是成熟ncs包膜化和完整病毒颗粒分泌不可缺少的成分。迄今为止,hbv dane颗粒被认为是hbv分泌的多种病毒粒子中唯一具有传染性的病毒颗粒。其传染性大致有两个原因,一是包膜蛋白上含有可与肝细胞受体结合的结构域,从而介导hbv的感染;二为hbv dane颗粒可以将其内部携带的完整基因组运送到新的肝细胞,从而造成持续性感染。综上可见,hbv不同形式的病毒粒子在病毒生命周期中各司其职,都有自己独特的作用,其中hbv dane颗粒是hbv存在传染性最重要的成分,而ncs颗粒是保证其正确形成的关键性粒子。
114.鉴于乙肝病毒包膜上大蛋白质的pres1结构位于病毒的最表面,也是与宿主细胞受体(钠离子牛磺胆酸共转运多肽,ntcp)结合的区域。我们构建了gst-pres1融合质粒,利
用原核的大肠杆菌bl21(de3)进行表达,纯化后发现容易降解。于是进行了pres1的抗原表位分析和序列保守性分析,发现其系统pres1结构域肽片段(19-cys-pnplgffpdhqldpafkans-38)偶联载体蛋白质klh(keyholelimpethemocyanin,血蓝蛋白)获得klh-c-pnplgffpdhqldpafkans进行小鼠免疫,偶联bsa(bovineserumalbumin,牛血清白蛋白)获得bsa-c-pnplgffpdhqldpafkans进行检测。所述pres1结构域肽片段的序列如seq id no.1所示。
115.选择4只spf级balb/c雌性小鼠(4~6周)以60μg/只剂量进行初次免疫,然后以30μg/只进行三次加强免疫,利用klh-c-pnplgffpdhqldpafkans包被elisa板测定免疫小鼠效价,乙肝病毒pres1抗体小鼠免疫效价结果如表1所示。
116.表1乙肝病毒pres1抗体小鼠免疫效价检测
[0117][0118][0119]
然后选择#3小鼠进行冲击免疫后进行融合实验,将融合后的细胞转到半固体培养基中培养,将单克隆挑选到96孔培养板中进行培养和后续筛选。对挑选的克隆采用elisa方法,做第二次筛选,得到33株阳性杂交瘤细胞株。将33株阳性的细胞株,再次用klh-c-pnplgffpdhqldpafkans包板,采用elisa方法,做第三次筛选,得到8株阳性杂交瘤细胞株,筛选得到的8株阳性杂交瘤细胞株如表2所示。
[0120]
表2筛选得到的杂交瘤细胞株
[0121][0122][0123]
表2显示,3#、10#、13#、16#、17#、30#、31#和33#的效价比较高。将筛选出来的效价较高的8株阳性杂交瘤细胞株进行亚类鉴定,最后得到8株igg类的阳性杂交瘤细胞株。大量培养及冻存,成功冻存8株细胞株。
[0124]
然后获得的细胞株利用融合表达的gst-pres1进行筛选,发现有两个细胞株17#和33#具有比较高的效价。进而选择将17#和33#细胞株进行培养,注射小鼠腹部后收集腹水,纯化获得17#和33#单克隆抗体。
[0125]
实施例2
[0126]
将纯化获得的17#和33#单克隆抗体sds-page电泳发现其纯化大于90%,电泳结果图如图1所示。之后进行效价检测,发现其亲和力分别为8.192
×
10
11
和1.42
×
109,结果如表3所示。
[0127]
表3单克隆抗体效价检测
[0128][0129][0130]
从表3可以看出,17#和33#单克隆抗体能够满足后续实验的需求。
[0131]
利用particle gel测试完整抗体或者适配体俘获病毒粒子的验证。将含有病毒颗粒的hbv阳性患者血清样本进行水平琼脂糖电泳(琼脂糖浓度0.8%),电泳(100v,70min),剪切nc膜后进行引流法转膜(6h),用50%甲醇固定膜30min后ddh2o洗膜5min三次,于4℃过夜孵育单抗;洗膜4次后加入二抗并室温孵育2h;吸弃二抗后洗膜4次进行曝光检测。结果如图2所示。图2显示,17#和33#单克隆抗体均能够结合hbv病毒颗粒。
[0132]
实施例3
[0133]
以上述33#单克隆抗体为例进行乙肝病毒颗粒俘获液的制备,其他现有的病毒抗体的病毒颗粒俘获液的制备方法与该方法一致。
[0134]
(1)剧烈震荡羧基磁珠150nm,使其分散均匀。取3.3mg磁珠至2ml ep管中,磁力分
离,用预冷mes缓冲液洗涤3次;
[0135]
(2)施加磁场,去上清,将100μlnhs与等量edc溶液迅速加入ep管中,剧烈震荡,25℃持续活化磁珠30min;
[0136]
(3)借助磁力架,用预冷的mes缓冲液洗涤磁珠3次,并尽快用于单克隆抗体偶联;
[0137]
(4)将上述33#单克隆抗体预冷mes缓冲液稀释至抗体终浓度为0.6g/l,100μl;
[0138]
(5)活化好的磁珠用100μlmes溶液重悬,剧烈摇晃,保证磁珠全部分散;
[0139]
(6)每次取20μl活化磁珠悬液,分5次将活化磁珠悬液缓慢加入稀释好的单克隆抗体悬液中,每次加入磁珠后,立即搅拌混匀,4℃,温和旋转混匀4h;
[0140]
(7)配制5%的bsa溶液(10mlmes溶液+0.5g bsa);
[0141]
(8)施加磁场,将上清移去,迅速向管中加入200μlbsa封闭液,25℃温和旋转30min;
[0142]
(9)借助磁力架,用pbs将磁珠清洗三次;
[0143]
(10)最后加入120μl的病毒颗粒洗液,将磁珠悬起,4℃保存。
[0144]
所述病毒颗粒洗液以水为溶剂包括如下浓度的组分:200mm nacl、0.1g/l的牛血清白蛋白、8%的聚乙二醇4000。
[0145]
实施例4
[0146]
选择能够分泌乙肝病毒的hepg2.2.15细胞培养上清为例进行完整病毒颗粒核酸的提取。
[0147]
(1)将10μl实施例3配置得到的病毒颗粒俘获液与hepg2.2.15细胞培养上清液50μl加入1.5ml离心管中,在25℃条件下旋转共孵育10min,借助磁力架,静置1min,弃上清,得到中间物1。
[0148]
(2)将中间物1与病毒颗粒洗液500μl,颠倒混匀,借助磁力架弃上清,去除非特异性结合物质,重复此步骤一次,得到中间物2。
[0149]
(3)在中间物2中加入500μl病毒颗粒裂解液,同时加入20μl蛋白酶k颠倒混匀,55℃孵育5min,得到中间物3。
[0150]
(4)将中间物3与30μl磁珠溶液混合,25℃旋转孵育10min。借助磁力架,静置2min后弃上清,得到中间物4。
[0151]
(5)在中间物4中加入500μl洗涤液1。颠倒混匀至磁珠完全重悬后借助磁力架弃上清,得到中间物5。
[0152]
(6)在中间物5中加入700μl洗涤液2。颠倒混匀至磁珠完全重悬后借助磁力架弃上清。重复此步骤一次,得到中间物6。尽量将离心管中残余液体弃尽。
[0153]
(7)将中间物6借助磁力架,于25℃下开盖静置5min后,加入50μl核酸洗脱液,重悬磁珠。55℃孵育5min,孵育期间轻弹离心管2次以免磁珠团聚。借助磁力架,静置2min,将含洗脱核酸的上清转移入新的离心管中,得到完整病毒颗粒内核酸。-20℃保存以备后续实验。
[0154]
注意:如果离心管壁或管盖上有液体附着,请瞬时离心后再进行磁吸操作。
[0155]
病毒颗粒洗液以水为溶剂包括如下浓度的组分:
[0156]
100mm的nacl、0.1g/l的牛血清白蛋白、10vt%的聚乙二醇4000;所述病毒颗粒俘获液的ph为7.0。
[0157]
所述病毒颗粒裂解液以水为溶剂,包括如下浓度的组分:
[0158]
3mm的异硫氰酸胍、2m的盐酸胍、20vt%的乙醇、0.05vt%的tritonx-100、30mm的乙二胺四乙酸、0.15g/l的蛋白酶k、10mm的tris-hcl、200mm的nacl、0.3g/l的rna酶;所述病毒颗粒裂解液的ph为6.5。
[0159]
所述洗涤液1以水为溶剂,包括如下浓度的组分:
[0160]
10mm的tris-hcl、3m的盐酸胍、50vt%的无水乙醇、40mm的乙二胺四乙酸、200mm的nacl;所述洗涤液1的ph为7.0。
[0161]
所述洗涤液2以水为溶剂,包括如下浓度的组分:
[0162]
10mm的tris-hcl、60vt%的无水乙醇、0.3wt%的pvp和40mm乙二胺四乙酸;所述洗涤液2的ph为7.0。
[0163]
所述核酸洗脱液为tris-hcl水溶液;所述tris-hcl水溶液中含有tris-hcl的浓度为20mm;所述核酸洗脱液的ph为7.0;
[0164]
所述磁珠溶液的初始浓度为80mg/ml;
[0165]
所述磁珠为硅羟基修饰的磁珠。
[0166]
实施例5
[0167]
乙肝病毒为非双链dna病毒,但是最近的研究发现乙肝病毒中也有病毒rna。为此,我们利用临床细胞上清和临床血清进行了完整乙肝病毒核酸的提取,然后进行荧光定量pcr的检测(圣湘生物科技股份有限公司)进行完整病毒颗粒中dna和rna的分别检测。
[0168]
在经过重庆医科大学伦理委员会批准并与志愿者签署知情同意书的前提下,我们选择六例慢性乙肝病人(chb)的血清进行乙肝完整病毒dna和rna的提取。按照实施例4的提取步骤提取这6例乙肝病人血清中的dna和rna后,利用荧光定量pcr的检测(圣湘生物科技股份有限公司)进行完整病毒颗粒中dna和rna的检测,检测结果如图3所示。
[0169]
图3显示,实施例4提取方法可以同时满足完整病毒颗粒dna和rna提取,并能够直接用于后续的临床检测与相关生物学研究。
[0170]
同时对其中一名乙肝阳性患者血清进行核酸提取的验证实验,分别取50μl血清样本三管,在经过重庆医科大学伦理委员会批准并与志愿者签署知情同意书的前提下,按照实施例4的方法进行核酸提取后,进行后续qpcr实验验证。结果如图4~5所示。
[0171]
图4~5显示,实施例4的提取方法可以提取出血清完整病毒颗粒中所含核酸,且结果重复性好。
[0172]
另按样本梯度10μl、30μl、50μl、100μl、150μl、200μl进行核酸提取,结果如表4所示。
[0173]
表4提取核酸的浓度
[0174]
样本量(μl)总核酸(ng/μl)完整病毒颗粒核酸(ng/μl)108.9066.7323010.0897.3895024.32115.83410042.13830.40915065.46342.45620089.55763.465
[0175]
表4显示,不同样本体积与其中能提取出的核酸浓度呈线性关系,在一定范围内,样本体积越大,能提取出的核酸浓度越高。
[0176]
实施例6
[0177]
实施例4的提取方法,适用于临床病毒感染者血清中多种病毒颗粒的检测,包括甲肝病毒(hepatitisavirus,hav)、乙肝病毒(hepatitis b virus,hbv)、丙肝病毒(hepatitis c virus,hcv)、丁肝病毒(hepatitis d virus,hdv)、戊肝病毒(hepatitis e virus,hev)、新冠病毒(sars cov-2)、艾滋病病毒(human immunodeficiency virus,hiv)、流感病毒(influenza virus)、偏肺病毒(partial pulmonary virus)、人乳头状瘤病毒(human papillomavirus,hpv)、疱疹病毒(herpes virus)、单纯疱疹病毒(herpesvirus hominis)、寨卡病毒(zikavirus)、埃博拉病毒(ebolavirus,ebv)、人类嗜t淋巴细胞病毒(human t-lymphocytic virus)、禽流感病毒(avian influenzavirus)、猪瘟病毒(hog choleravirus,csfv)、脊髓灰质炎病毒(poliovirus)、狂犬病病毒(rabies virus)、腺病毒(adenovirus)、慢病毒(lentivirus)等常见病毒的完整病毒颗粒的dna和rna的提取。
[0178]
实施例7
[0179]
向厦门万泰沧海生物技术有限公司(现厦门英博迈生物科技有限公司)购买hbv抗体(hbvpres1单抗)。对该抗体进行验证,按照实施例3的方法进行磁珠抗体偶联剂,按照实施例4的方法提取核酸。利用particle gel测试所购现有技术抗体或者适配体俘获病毒粒子的验证。将含有病毒颗粒的hbv阳性患者血清样本进行水平琼脂糖电泳(琼脂糖浓度0.8%),电泳(100v,70min),剪切nc膜后进行引流法转膜(6h),用50%甲醇固定膜30min后ddh2o洗膜5min三次,于4℃过夜孵育单抗;洗膜4次后加入二抗并室温孵育2h;吸弃二抗后洗膜4次进行曝光检测。结果如图6所示。图6显示,该hbvpres1单克隆抗体能够结合hbv病毒颗粒。
[0180]
之后对实施例5中6例乙肝病人血清样本使用公司购买的现有hbv pres1单克隆抗体进行磁珠抗体偶联后按照上述方法进行核酸提取(第一次提取和第二次提取为相同标本重复试验),结果显示本发明所述方法可以使用现有技术抗体,且结果稳定,如表5所示。
[0181]
表5现有抗体提取乙肝病人血清样本中病毒的提取浓度
[0182][0183][0184]
表5显示,利用本发明的方法,利用现有的抗体,也能将乙肝病人血清中的病毒提取出来。
[0185]
实施例8
[0186]
利用链霉素亲和素偶联实施例7的抗体,按照实施例4的方法提取核酸。之后对实施例5中6例乙肝病人血清样本使用链霉素亲和素偶联实施例7的单克隆抗体进行提取,提取结果也能达到实施例7的效果。
[0187]
由以上实施例可知,本发明提供一种病毒核酸提取试剂盒及利用该试剂盒提取完整病毒颗粒核酸的方法。本发明的病毒核酸提取试剂盒能够提取完整病毒颗粒核酸,也可
以与完整病毒颗粒核酸提取仪配套而实现全自动化提取。该试剂盒具有快速、高效且避免污染的优点,可以节省大量时间和试剂,为精准、快捷、高通量地检测具有感染活性的完整病毒颗粒提供重要支撑。
[0188]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1