以基因工程水稻表达和制备重组人艾杜糖苷酸酶的方法与流程
1.本发明涉及生物技术领域,具体涉及以基因工程水稻为生物反应器,表达和分离纯化重组人艾杜糖苷酸酶的方法。
背景技术:
2.粘多糖是一类蛋白多糖,包括透明质酸(ha)、硫酸软骨素(cs)、硫酸皮肤素(ds)、硫酸乙酰肝素(hs)和硫酸角质素(ks)。粘多糖的体内分解代谢过程为:组织蛋白酶使蛋白多糖复合物的肽链分离并水解,然后经葡萄糖苷酶或半乳糖苷酶等逐步降解,最后释出蛋白多糖。
3.粘多糖贮积症i型(mucopolysaccharidosistypeone,mps-i)是由a-l-艾杜糖苷酸酶(idua)基因突变引起的一种常染色体隐性遗传病。多种突变可导致a-l-艾杜糖苷酸酶的缺陷。a-l-艾杜糖苷酸酶(idua)是hs和ds降解过程中所必需的酶。该酶的功能缺陷导致其天然底物在各组织溶酶体内堆积,最终引起临床症状。粘多糖贮积症i型的临床表现具有广泛的变异性,现分为3种亚型:重型hurler综合征(发病率约1/100,000);中间型hurler/scheie综合征(发病率约1/115,000);轻型scheie综合征(发病率约1/500,000)。
4.酶替代治疗是近年新发展起来的治疗mps的方法。美国fda于2003年批准用于治疗粘多糖贮积症i型(mps-i)的一种罕用药(orphan):α-艾杜糖苷酸酶(α-liduronidase,通用名laronidase,商品名aldurazyme),为cho细胞表达。天然idua有653个氨基酸,其中前26个氨基酸为信号肽。市售药物laronidase的氨基酸为626个,第一个氨基酸e去除,分子量为83kd,等电点为8.99。2020年6月laronidase在中国获批,商品名为艾而赞,是全球首个也是目前唯一批准治疗黏多糖贮积症ⅰ型的酶替代疗法,同时也是中国唯一治疗mps
‑ⅰ
的特异性治疗药物。
5.cho细胞表达的idua具有6个n糖基化位点,分别为n110、n190、n336、n372、n415、n451、n372和n415,为高度mannose修饰;n110和n190为复杂糖基化修饰,n336和n451为m6p修饰,对于靶向idua进入溶酶体具有重要作用。但是,利用cho细胞表达idua的缺点主要是重组细胞培养费用昂贵,成本高,生产效率低,产物浓度普遍偏低。
技术实现要素:
6.基于此,有必要提供以基因工程水稻表达和制备重组人艾杜糖苷酸酶(osrhidua)的方法,具体是从基因工程稻谷种子中提取分离纯化,获得rp-hplc纯度达到99%以上的osrhidua,得率高,安全性高,容易实现规模化。
7.本发明采用如下技术方案:
8.本发明的一个目的是提供一种利用水稻胚乳细胞生物反应器来高效表达重组人艾杜糖苷酸酶(osrhidua),具体提供从转基因工程水稻种子中提取和分离纯化osrhidua的方法。
9.本发明提供以下技术方案:
10.(1)合成经水稻密码子优化的人源idua基因序列,如sed id no.1所示;
11.(2)构建水稻胚乳细胞特异性表达人源idua的表达载体,优选具有如图2所示的谱图结构;
12.(3)将步骤(2)中获得的表达载体转化水稻愈伤组织中,经培养,筛选和诱导获得osrhidua转基因工程水稻植株。
13.本发明的另外一个目的是提供一种从osrhidua基因工程水稻中提取和分离纯化osrhidua的方法,包括如下步骤:
14.s1,从osrhidua基因工程水稻种子中提取含osrhidua的粗提取物;
15.s2,将含有osrhidua的粗提取物经阳离子交换层析,得到含osrhidua的初级产物;
16.s3,利用疏水层析对含osrhidua的初级产物进行中级纯化,获得含osrhidua的中级产物;
17.s4,利用阴离子层析对含osrhidua的中级产物进行末级纯化,获得纯化的osrhidua,;
18.s5,将纯化的osrhidua经过透析置换,得到osrhidua制剂。
19.在其中一些实施例中,优选的工艺参数如下:
20.在步骤s1中,以osrhidua转基因工程水稻为原料,将稻谷晒干脱壳,加工成半精米并研磨成80~100目的米粉,将所述米粉与提取缓冲液以1:5(重量/体积,kg/l)的比例混匀,在24~26℃提取3~4小时,获得含osrhidua的提取物;该含osrhidua提取物中加入2%~5%的珍珠岩压滤,滤液再经滤膜过滤后即为含osrhidua的粗提取物,所述提取缓冲液的成分优选为:15~30mm磷酸缓冲液,0.3m~0.5m氯化钠,ph7.0~8.0。
21.在步骤s2中,采用阳离子交换层析介质进行初级分离纯化,离子交换层析填料包括diamond mmc mustang、unimmc 50s、unigel 50sp、nanosp30l、nanogel 50sp(苏州纳微科技股份有限公司),优选使用unigel 50sp填料进行初级分离纯化。用5~10倍柱体积(cv)的ph6.5的20mm醋酸钠缓冲液,以220~250cm/h的线性流速平衡unigel 50sp层析柱;将上述的osrhidua粗提取物与ph为6.5的20mm醋酸钠缓冲液按照体积比1:1~1:2混匀稀释,滤膜过滤后作为上样液,最佳上样液电导为12~14ms/cm,其中上样液ph6.4~6.6,上样体积不超过65cv;采用ph为6.5的20mm醋酸钠和0.16~0.175m氯化钠缓冲液,以220~250cm/h的流速进行杂质蛋白洗脱,最佳洗杂缓冲液电导为15~19ms/cm;采用ph为6.5的20mm醋酸钠和0.4~0.6m氯化钠缓冲液,以220~250cm/h的流速进行洗脱,最佳洗脱缓冲液电导为37~50ms/cm,收集富含osrhidua的洗脱液,获得含osrhidua的初级产物。
22.在步骤s3中,采用疏水层析介质进行中级分离纯化,疏水层析填料包括unihr phenyl 30l或nanohr phenyl 15l(苏州纳微科技股份有限公司),优选使用unihr phenyl 30l填料的层析柱进行中级分离纯化。用3~5cv的ph为6.5的20mm醋酸钠和1.2m硫酸铵缓冲液,以300~350cm/h的流速平衡unihr phenyl 30l层析柱;用3m硫酸铵调节osrhidua初级产物的电导,最佳上样电导为155~158ms/cm,ph调整为6.5,以300~350cm/h的流速全部上样;采用ph为6.5的20mm醋酸钠和1.1
±
0.1m硫酸铵的缓冲液,以300~350cm/h的流速进行杂质蛋白洗脱,最佳洗杂缓冲液电导为140~148ms/cm;采用ph为6.5的20mm醋酸钠和0.15~0.10m硫酸铵的缓冲液,以300~350cm/h的流速进行洗脱,最佳洗脱缓冲液电导为25~30ms/cm,收集富含osrhidua的洗脱液,获得含osrhidua的中级产物。
23.在步骤s4中,采用阴离子层析填料进行末级分离纯化,阴离子层析填料包括deae hp(博格隆(上海)生物技术有限公司)或者unigel 80deae(苏州纳微科技股份有限公司),优选使用unigel 80deae填料。用5~10cv的ph为6.5的20mm醋酸钠缓冲液,以300~320cm/h的流速平衡纳微unigel80deae层析柱;将中级产物用ph为6.5的20mm醋酸钠缓冲液透析4~5次,电导降至3ms/cm以下后,调整ph为6.5,滤膜过滤后作为上样液,全部上样,收集富含osrhidua的穿透液作为纯化的osrhidua。采用2m nacl缓冲液,以300~320cm/h的流速进行杂质蛋白洗脱。
24.与现有技术相比,本发明的有益效果是:
25.本发明通过优化osrhidua的基因序列筛选获得能够利用水稻胚乳细胞生物反应器来高效表达及纯化的工艺方法,获得rp-hplc纯度达到99%以上的osrhidua,得率高达0.4g/kg米粉。采用水稻源osrhidua的安全性高,容易实现规模化。
附图说明
26.图1为实施例1中pospmp840质粒结构示意图。
27.图2为实施例1中基因工程水稻部分植株目的基因的pcr检测图;其中,m对应dna标准分子量marker;001~030分别对应t0代转基因材料的不同植株。
28.图3为实施例1中基因工程水稻部分植株wb检测结果图;其中,840(idua)对应种子批号,m对应蛋白标准分子量marker;5~44分别对应t0代转基因材料的不同植株。
29.图4为实施例2中不同提取工艺条件下含osrhidua粗提物的sds-page图(a)和wb检测结果图(b);其中,1-15分别对应表1中编号为1~15的提取工艺条件,ph4.0对应编号为16的提取条件,ph7.0对应编号为17的提取条件,ph10.0对应编号为18的提取条件。
30.图5.为实施例3中初级纯化阳离子填料unigel 50sp层析优化筛选试验图;其中,a图中1~8对应不同上样电导编号;b中load表示上样液;ft表示穿透液,16%表示0.16m nacl,tw表示拖尾,17%表示0.17m nacl,18%表示0.18m nacl,25%表示0.25m nacl,28%表示0.28m nacl,40%表示0.4m nacl,100%表示1.0m nacl。
31.图6为实施例4中中级纯化疏水填料unihr phenyl 30l层析条件优化筛选结果统计图;其中,a~d图中1~46表示梯度洗脱收集样品编号,load表示上样液,ft表示穿透液,w表示洗杂液,elu表示洗脱液;e图中10%表示10%b洗脱液,50%表示50%b洗脱液,70%表示70%b洗脱液,100%表示20mm醋酸钠洗脱液,水表示水洗,碱/cip表示0.5m naoh再生,m为标准分子量marker。
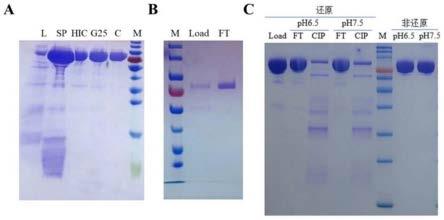
32.图7为实施例5中末级纯化阴离子填料筛选和层析条件优化筛选结果统计图;其中,a图中m为标准分子量marker,l表示上样液,sp表示unigel50sp层析洗脱液,hic表示疏水层析unihr phenyl 30l层析洗脱液,g25表示脱盐样品,c图表示第三步层析unigel 80deae穿透液;b和c图中m为标准分子量marker,load表示上样液,ft表示穿透液,cip表示再生样品。
具体实施方式
33.下面结合具体实施例对本发明作进一步的详细说明,以使本领域的技术人员更加清楚地理解本发明。
34.以下各实施例,仅用于说明本发明,但不止用来限制本发明的范围。基于本发明中的具体实施例,本领域普通技术人员在没有做出创造性劳动的情况下,所获得的其他所有实施例,都属于本发明的保护范围。
35.在本发明实施例中,若无特殊说明,所有原料组分均为本领域技术人员熟知的市售产品;在本发明实施例中,若未具体指明,所用的技术手段均为本领域技术人员所熟知的常规手段。
36.【实施例1】
37.本实施例提供水稻特异性表达osrhidua载体的构建方法和基因工程水稻的获得方法,具体包括如下步骤:
38.1.osrhidua表达载体的构建:
39.如图1所示,本实施例选用水稻特异性启动子gt13a及其信号肽来介导idua基因在水稻胚乳细胞中表达。
40.根据人源艾杜糖苷酸酶基因序列(genbank登记号:aaa81589.1),委托南京金斯瑞生物科技有限公司根据水稻偏好的遗传密码子合成如下核苷酸序列:
41.gaggccccgcacctcgtgcacgtggacgccgcccgcgccctctggccgctccgccgcttctggc
42.gcagcaccggcttctgcccgccgctcccgcacagccaggccgaccagtacgtgctcagctggg
43.accagcagctcaacctcgcctacgtgggcgccgtgccgcaccgcggcatcaagcaggtgcgca
44.cccactggctcctagagctcgtgaccacccgcggcagcaccggccgcggcctcagctacaactt
45.cacccacctcgacggctacctcgacctcctccgcgagaaccagctcctcccgggcttcgagctc
46.atgggcagcgccagcggccacttcaccgacttcgaggacaagcagcaggtgttcgagtggaag
47.gacctcgtgagcagcctcgcccgccgctacatcggccgctacggcctcgcccacgtgagcaagt
48.ggaacttcgagacctggaacgagccggaccaccacgacttcgacaacgtgagcatgaccatgc
49.agggcttcctcaactactacgacgcctgcagcgagggcctccgcgccgccagcccggccctccg
50.cctcggcggcccgggcgacagcttccacaccccgccgcgcagcccgctcagctggggcctcctc
51.cgccactgccacgacggcaccaacttcttcaccggcgaggccggcgtgcgcctcgactacatca
52.gcctccaccgcaagggcgcccgcagcagcatcagcatcctagagcaggagaaggtggtggccc
53.agcagatccgccagctcttcccgaagttcgccgacaccccgatctacaacgacgaggccgaccc
54.gctcgtgggctggagcctcccgcagccgtggcgcgccgacgtgacctacgccgccatggtggtg
55.aaggtgatcgcccagcaccagaacctcctcctcgccaacaccaccagcgccttcccgtacgccc
56.tcctcagcaacgacaacgccttcctcagctaccacccgcacccgttcgcccagcgcaccctcac
57.cgcccgcttccaggtgaacaacacccgcccgccgcacgtgcagctcctccgcaagccggtgctc
58.accgccatgggcctcctcgccctcctcgacgaggagcagctctgggccgaggtgagccaggcc
59.ggcaccgtgctcgacagcaaccacaccgtgggcgtgctcgccagcgcccaccgcccgcagggc
60.ccggccgacgcctggcgcgccgccgtgctcatctacgccagcgacgacacccgcgcccacccga
61.accgcagcgtggccgtgaccctccgcctccgcggcgtgccgccgggcccgggcctcgtgtacgt
62.gacccgctacctcgacaacggcctctgcagcccggacggcgagtggcgccgcctcggccgccc
63.ggtgttcccgaccgccgagcagttccgccgcatgcgcgccgccgaggacccggtggccgccgc
64.cccgcgcccgctcccggccggcggccgcctcaccctccgcccggccctccgcctcccgagcctc
65.ctcctcgtgcacgtgtgcgcccgcccggagaagccgccgggccaggtgacccgcctccgcgcc
66.ctcccgctcacccagggccagctcgtgctcgtgtggagcgacgagcacgtgggcagcaagtgc
67.ctctggacctacgagatccagttcagccaggacggcaaggcctacaccccggtgagccgcaag
68.ccgagcaccttcaacctcttcgtgttcagcccggacaccggcgccgtgagcggcagctaccgcg
69.tgcgcgccctcgactactgggcccgcccgggcccgttcagcgacccggtgccgtacctagaggtgccggtgccgcgcggcccgccgagcccgggcaacccgtga(seq id no.1)。
70.与常规人源艾杜糖苷酸酶基因序列相比,优化后的核苷酸序列改变了15.65%,密码子改变了21.25%,但其对应的氨基酸序列(天然idua,627aa)没有变化,构建的质粒为pospmp838。
71.将合成的优化的人源艾杜糖苷酸酶核苷酸序列(seq id no.1)用mlyi和xhoi酶切后克隆到经naei和xhoi酶切的pospmp003中,经t4连接酶构建一个中间载体质粒pospmp839。
72.将长度为3392bp的含gt13a启动子、信号肽序列及密码子优化的人源艾杜糖苷酸酶基因和nos终止子的整个表达盒插入到经hindiii和ecori酶切双元表达载体pc1300(cambia公司),构建农杆介导菌质粒,命名为pospmp840(图1)。
73.2.基因工程水稻转化及阳性鉴定:
74.将pospmp840质粒转化到根癌农杆菌eha105(美国invitrogen公司),通过根癌农杆菌介导将pospmp840质粒转化到水稻品种lgc的愈伤组织中,经培养、筛选和诱导后形成完整的植株。
75.具有诱导培养的步骤方法为:
76.(1)愈伤组织诱导:70%乙醇浸泡成熟的水稻种子脱壳灭菌1分钟后,20%次氯酸钠再处理30分钟;用无菌水清洗5~7次后,将种子接种到诱导培养基(n6培养基)上,每皿接种6~8粒,在32℃光照处理大约5~7天。
77.(2)农杆菌制备:将含有表达载体pospmp840的农杆菌扩大培养,在卡拉霉素抗性平皿中涂菌,28℃培养箱中培养2~3天;用接种环取农杆菌单菌落接种到悬浮培养基(aam液体培养基)中,在28℃摇菌培养。
78.(3)农杆菌侵染(共培养):将愈伤组织转移到灭菌的三角瓶中,调整农杆菌悬浮液od
600
值于0.05~0.1;将种子悬浮在aam培养基中,侵染1.5分钟,期间持续摇晃;弃菌液,用无菌滤纸吸干多余的菌液,将愈伤组织取出置于无菌滤纸上沥干30~45分钟;将无菌滤纸放在2n6-as培养基上,再将含有as(乙酰丁香酮,250mg/ml)的500μl aam滴在直径9cm的无菌滤纸上,将侵染过的愈伤组织放在滤纸上,25℃黑暗共培养3天。
79.(4)水洗和筛选:将共培养的愈伤组织转移到灭菌的三角瓶中,用无菌水清洗愈伤组织5~7次;用含0.5g/l浓度的头孢霉素灭菌水浸泡感染的愈伤组织约30分钟,然后在28℃,180~200rpm摇20~30分钟;倒掉含有抗生素的灭菌水,将三角瓶倒置于含滤纸的灭菌培养基中大约15分钟晾干后,转移愈伤组织到含有hpt抗生素的筛选培养基上培养20~30天。
80.(5)愈伤组织分化:将经过20~30天选择后具有hpt抗性的愈伤组织转移到分化培养基(n6培养基)上,在26℃光照培养20~30天。
81.(6)生根:从分化培养基中挑选出分化后的小苗,转移到含有1/2的ms培养基上进行生根培养,在28℃光照培养30天后,转移到田间生长。
82.取t0代hpt阳性再生苗的叶片,提取dna后,取水稻基因组dna作为模板,设置阳性(质粒dna)和阴性(无菌水)对照;利用重组人艾杜糖苷酸酶正向引物gt13a-f(sed id no.2:5
’‑
cacatccatcattatccatccacc-3’)和反向引物idua-r(sed idno.3:5
’‑
tgtcgaagtcgtggtggtcc-3’)进行pcr扩增,扩增反应体系为:10
×
buffer,2.5μl;la酶(5u/μl),0.15μl;dntp(2.5mm),4μl;引物各0.5μl;加ddh2o至25μl。扩增条件:94℃预变性5分钟,94℃变性30秒,54℃退火反应30秒,72℃延伸40秒,35个循环,最后72℃延伸10分钟),产物理论大小为750bp;扩增产物经1%琼脂胶,eb染色后150v,200ma电泳15分钟,凝胶成像仪中观察结果。
83.鉴定结果表明,通过根癌农杆菌介导转化获得44株阳性的重组人艾杜糖苷酸酶转基因水稻,部分基因工程水稻目的基因pcr鉴定结果如图2所示。
84.3.高表达osrhidua单株的筛选
85.将获得的重组人艾杜糖苷酸酶阳性苗移栽到室温中生长至成熟,收种能够正常结实的单株。采用wb检测样品相对表达量,利用10%sds-page电泳后转膜,5%脱脂奶粉封闭1h,一抗(mouse anti-iduamab)按照1:1000孵育1h,二抗(ap-马抗小鼠)按照1:5000孵育1h后显色。
86.如图3所示,鉴定结果表明:重组人艾杜糖苷酸酶阳性转基因水稻有10个单株高表达osrhidua,编号分别为840-5、30、31、33、37、38、39、41、42、44。
87.【实施例2】
88.本实施例提供从基因工程水稻中提取osrhidua的方法,具体包括如下步骤:
89.将实施例1获得的高表达osrhidua的基因工程水稻脱壳后加工成半精米,研磨成80~100目的含osrhidua米粉,按照分别下表1所示的提取条件进行粗提取:
90.表1不同提取条件
91.实验编号提取液ph提取液盐浓度(mm)提取温度(℃)1102507.627250273425037410500275402767037772502784500279707.610100271142507.61275007.61310250371475003715725027
92.具体工艺步骤为:准确称取18份1g含osrhidua米粉于10ml离心管中,按照料液比
1:5(质量/体积比)比例向其中15管中依次加入表1的提取液(磷酸缓冲体系,盐为nacl),震荡混匀后,将各离心管固定在旋转混合仪上,按照表1条件放置,旋转提取1h。
93.另外,按照料液质量/体积比1:5,分别向试验编号16、17、18的3管中依次加入ph4.0的醋酸盐缓冲提取液(5ml 20mm naac,150mm nacl,ph4.0)、ph7.0的磷酸盐提取液(20mm pb,150mm nacl,ph 7.0)、ph10.0的tris缓冲提取液(20mm tris,150mm nacl,ph 10.0);震荡混匀后,将各离心管固定在旋转混合仪上,室温(25
±
2℃)放置,旋转提取1h。
94.提取结束后,离心管取出,10000g离心5min,上清备用。
95.另称,取1份1g lgc米粉(对照),加入5ml提取液(20mm pb,500mm nacl,ph7.0),旋转提取1h,其它同上处理。
96.取各样品的上清进行sds-page/wb检测,结果如图4所示。结果显示,对于提取工艺的影响因子中,ph》nacl》温度;提取ph 7.0》4.0》10.0;提取nacl盐浓度:500mm》250mm》0;提取温度:37℃》27℃》7.6℃,但随温度上升,杂蛋白增加,37℃和25℃下的总蛋白提取量相差不大。
97.因此,结合试验和软件分析优化,优选确定提取液组成为:15-30mm磷酸缓冲液,0.3m~0.5m氯化钠,ph6.5~8.5。
98.【实施例3】
99.本实施例采用阳离子交换层析介质初级纯化含osrhidua上清液,具体方法步骤为:
100.1.初级纯化用阳离子交换层析介质的筛选
101.根据实施例2中确定的优选提取条件(提取液:20mm磷酸缓冲液,0.3m~0.5m氯化钠,ph7.0~8.0,料液比1:5,旋转提取1h)制备含osrhidua的粗提物,采用ep管离心捕获法进行阳离子交换层析填料的初筛。
102.试验用的阳离子交换层析填料包括:博格隆(上海)生物技术有限公司的diamond s,diamond cm,diamond sp mustang,diamond mmc mustang,sp bb,sp ff,cm ff和苏州纳微科技股份有限公司的unigel 80sp,unigel80cm,unimmc 50s-n,unimmc-50s,unigel 50sp,nano sp-30l。
103.通过采用不同的磷酸盐缓冲液上样电导,以及nacl盐浓度梯度洗脱。初级纯化用阳离子交换层析介质的试验情况统计见下表2:
104.表2osrhidua初级纯化用阳离子填料筛选试验情况统计表
105.[0106][0107]
结果显示,4#(diamond mmc mustang)和10#(unimmc 50s-n)填料样品直接上样有少量样品流穿,样品2倍和4倍稀释时基本无流穿,洗脱样在1m nacl中。12#(unigel 50sp)和13#(nanosp-30l)具有一定杂带分离度,纳入后期填料摸索。
[0108]
2.初级纯化阳离子交换填料unigel 50sp层析工艺筛选
[0109]
根据实施例2中确定的优选提取条件(提取液:20mm磷酸缓冲液,0.3m~0.5m氯化钠,ph7.0~8.0,料液比1:5,旋转提取1h)制备含osrhidua粗提物。
[0110]
利用20mm醋酸盐缓冲液进行不同倍数(1.25x,1.5x,1.75x,2.0x,2.25x,2.5x,2.75x,3x)稀释,采用ph为6.5的不同的上样电导13-25ms/cm(点值分别为:22.29,20.96,19.35,18.12,16.75(16.8),15.76,14.90,13.83ms/cm)进行ep管离心捕获法检测。
[0111]
如图5中a图,结果显示:unigel 50sp上样电导为14ms/cm以下时,含osrhidua粗提物样品未发生明显穿透,说明上样电导需要控制在14ms/cm以下;进一步通过采用0.16m、0.17m、0.18m、0.25m、0.28m和0.4m nacl进行梯度洗杂和洗脱,检测结果显示,洗杂盐浓度由0.16m增加至0.17m nacl时,洗杂液检测到极少量的osrhidua,当洗杂盐浓度增加至0.18m nacl时,大部分osrhidua被洗脱下来,表明洗杂盐浓度暂定为0.16~0.17m nacl;osrhidua在0.4m nacl基本可以完全洗脱(参见图5中的b)。
[0112]
因此,本实施例优选确定采用阳离子交换填料unigel 50sp层析工艺参数为:上样电导低于14ms/cm,洗杂盐浓度为0.16~0.17m nacl,洗脱盐浓度为0.4~0.6m nacl。
[0113]
【实施例4】
[0114]
本实施例提供osrhidua疏水层析介质中级纯化
[0115]
1.中级纯化疏水层析介质的选择
[0116]
根据实施例2和3确定的提取工艺条件和阳离子层析工艺条件制备含osrhidua初级产物。
[0117]
初级产物中添加nacl,使上样液的nacl浓度分别为0.4m和1.0m,分别进行12种疏水填料筛选,试验情况统计见下表3:
[0118]
表3含osrhidua初级产物纯化用疏水填料的筛选试验统计表
[0119][0120][0121]
结果显示:unihr phenyl-30l(2#)在0.4m nacl流穿较少,在1m nacl下没有流穿;nano hr phenyl-15l(7#)在0.4m nacl和1m nacl均没有流穿,杂蛋白比目的蛋白疏水性更强,unihr phenyl-30l在0.4m nacl下对杂蛋白和目的蛋白有较好的分离作用;nano hr phenyl-15l疏水性强于unihr phenyl-30l,选择unihr phenyl-30l进行后续层析条件优化。
[0122]
2.中级纯化疏水填料unihr phenyl-30l层析条件优化和载量确认
[0123]
根据实施例2和3确定的提取工艺条件和阳离子层析工艺条件制备含osrhidua初级产物。
[0124]
将含osrhidua初级产物中添加硫酸铵形成上样液,使上样液的硫酸铵浓度为0.9m。
[0125]
将上样液持续上样至流穿中出现拐点,结果显示unihr phenyl-30l上样载量为13.37mg/ml(图6a);按照上述上样量,分别采用上样硫酸铵浓度为0.9m、1.2m和1.5m的浓度梯度进行载量确认,利用ph为6.5的20mm醋酸钠缓冲液进行梯度洗脱。
[0126]
结果显示:高载量下,盐浓度为0.9m硫酸铵的上样液中目的蛋白结合能力不强,再平衡时目的蛋白被洗脱下来(图6b),提高上样盐浓度(1.2m和1.5m硫酸铵),1.2m硫酸铵的上样液的层析纯度优于1.5m(图6中的c和d);1.2m硫酸铵的上样液上样后,利用10%b、50%b、70%b和100%b进行洗杂洗脱。其中,a为平衡液,b为ph为6.5的20mm醋酸钠缓冲液。
[0127]
最终确定:洗杂条件为10
±
1%b,洗脱条件为70%~80%b(图6e),洗脱获得含osrhidua中级产物。
[0128]
【实施例5】
[0129]
本实施例提供针对含osrhidua中级产物的阴离子层析介质末级纯化方法,具体包括如下步骤:
[0130]
1.末级阴离子纯化层析介质的筛选
[0131]
根据实施例2、3和4确定的提取、阳离子交换层析和疏水层析优选工条件制备含osrhidua中级产物。
[0132]
将含osrhidua中级产物用g25脱盐柱脱盐后,ph调整为7.5,分别采用bgl deae hp填料和unigel 80deae填料进行层析纯化:
[0133]
柱体积5ml,流速2ml/min,平衡液:20mm pb,ph为7.5,平衡柱子5cv后,上样osrhidua脱盐后样品,收集穿透液,2m nacl再生柱子。
[0134]
采用bgl deae hp填料和unigel 80deae层析的结果分别如图7中的a和b所示,结果表明:unigel 80deae层析结果显示穿透峰和杂质峰基线分离,能够重复bgl deae hp层析结果,电泳纯度为95%以上,因此优选unigel 80deae作为末级纯化填料。
[0135]
2.末级阴离子纯化unigel 80deae层析条件优化
[0136]
将含osrhidua中级产物分别利用ph7.5和ph6.5的20mm醋酸钠缓冲溶液进行透析,然后进行unigel 80deae层析:
[0137]
柱体积5ml,流速2ml/min,平衡液:20mm pb,ph为7.5/6.5(设置2个ph条件进行探究),平衡柱子5cv后,上样osrhidua脱盐后样品,收集穿透液,2m nacl再生柱子。
[0138]
检测结果如图7中的c图所示,结果显示:ph为6.5与ph为7.5的缓冲最终蛋白纯度和活性回收都无明显变化(图7c)。
[0139]
但是透析后osrhidua的蛋白回收率和样品稳定性体现:ph为6.5优于ph为7.5的工艺条件,因此,确定末级纯化unigel 80deae层析的透析优选用缓冲平衡液ph为6.5。
[0140]
在此有必要指出的是,以上实施例仅限于对本发明的技术方案做进一步的阐述和说明,并不是对本发明的技术方案的进一步的限制,本发明的方法仅为较佳的实施方案,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1