双水相体系分离纯化流感病毒样颗粒的方法与流程
1.本发明涉及病毒样颗粒分离纯化技术领域,具体涉及双水相体系分离纯化流感病毒样颗粒的方法。
背景技术:
2.病毒样颗粒(virus-like particles,vlps)是由某种病毒的一个或多个结构蛋白自组装而成,具有高度结构化的空心蛋白颗粒,其大小从几纳米到数百纳米不等,可在多种不同的细胞类型中通过病毒包膜或衣壳蛋白的表达产生。首先vlps很容易在昆虫、哺乳动物或植物细胞中表达,并可通过设计携带多种外源性免疫抗原和佐剂。其次,绝大多数vlps粒径分布于20-100nm之间,这使得其可以自由进入淋巴管和被动运输至淋巴结包膜下区域,并被抗原提呈细胞(antigen-presenting cells,apcs)高效摄取。第三,vlps的形成模仿了病毒的天然装配过程,因而具有与天然病毒粒子相似的结构和结构特征及免疫原性,可激活树突状细胞(dendritic cells,dcs)等apcs,将其提呈给t细胞及b细胞,能有效激发更强的体液免疫、细胞免疫和黏膜免疫反应,是一种非常优秀的疫苗抗原递送系统。在vlps颗粒上分布的重复且高度有序的外源性表位则可以与b细胞受体进行多重结合,进而激发强的b细胞免疫和持久的抗体反应。第四,由于其缺乏调节蛋白和感染性核酸,无复制和感染能力且不依赖于鸡胚培养系统,因而具有很高的安全性。vlps不能在受体中复制,但由于其重复结构,通过识别重复亚基刺激免疫系统,产生较高的细胞和体液免疫应答反应,这为该类疫苗的制造和施用带来很大方便。基于上述特点,vlps是一种非常理想的疫苗开发平台,目前己被广泛用于疫苗的研究中,包括流感vlp疫苗。
3.流感病毒属于正粘科,可分为四种类型(a,b,c和d)。a型流感病毒和b型流感病毒可引起季节性流行病,c型流感病毒通常引起轻度疾病,d型流感病毒为新出现的流感病毒,可感染牛和猪。流感病毒是包含单链,分节段rna基因组的包膜颗粒。流感病毒样颗粒(vlps)是由流感病毒结构蛋白组成的中空结构,其自发组装而产生具有与天然流感病毒相似形态和抗原性的颗粒。vlps是基因组缺陷结构,因此不能感染细胞。可以使用与用于产生完整病毒的类似方法去生成vlps。与流感病毒的裂解或亚单位疫苗不同,vlps具有与天然病毒非常相似的表面抗原呈递的特点。
4.流感病毒的下游处理通常包括离心澄清、超滤浓缩、柱层析和超速离心纯化。此外,还有使用蔗糖、酒石酸钾、和氯化铯进行密度梯度离心或连续流离心从培养液中纯化病毒的方法。
5.现有流感vlp技术存在的问题及缺陷为:
6.(1)超滤浓缩技术虽然抗原回收率很高,在提高病毒或病毒样颗粒含量的同时,宿主蛋白也被成倍提高,对抗原来说浓缩作用大于纯化用,且同时需要专业的设备。故只能用于纯化的初级阶段来减小抗原溶液的体积;
7.(2)柱层析技术在蛋白纯化下游工艺为成熟的技术,但是纯化病毒或者病毒样颗粒需要特定的填料,填料成本太高,且也需要配套的层析设备,价格高昂;(3)密度梯度离心
或连续流离心纯化病毒或病毒样颗粒,不仅操作繁琐,需要相应的超高速离心机或者连续流离心机,设备成本高且不利于大规模纯化。
8.因此,开发出简单实用、价格低廉且易于操作的病毒样颗粒快速纯化方法,是目前亟待解决的技术问题。
技术实现要素:
9.有鉴于此,本发明要解决的技术问题在于提供双水相体系分离纯化流感病毒样颗粒的方法,本发明提供了操作简单、实用、价格低廉且提取纯度高的双水相体系分离纯化流感病毒样颗粒的方法。
10.本发明提供了双水相成相剂组合物,由磷酸缓冲液与peg400溶液组成,其中,所述磷酸缓冲液由水、kh2po4和k2hpo4组成。
11.相比其他双水相成相剂,本发明提供的双水相成相剂组合物,所述磷酸缓冲液的分相时间更短,所述peg400溶液亲水性极强,由于其二者搭配使用时优异的分离纯化效果,进一步简化了操作步骤,且对环境友好,更易于规模化工业生产。
12.优选的,所述磷酸缓冲液由水、kh2po4和k2hpo4组成,其中,所述kh2po4的质量分数为3.92wt%~6.72wt%,所述k2hpo4的质量分数为10.08wt%~17.28wt%;
13.所述peg400溶液由水和peg400组成,所述peg400的质量分数为14wt%~24wt%。
14.在此浓度范围内,所述磷酸缓冲液与所述peg400溶液配合紧密,能够更高效的分离纯化样品病毒,从而获得更高的病毒分离纯化效果。
15.在一些具体的实施例中,所述磷酸缓冲液由水、kh2po4和k2hpo4组成,其中,所述kh2po4的质量分数为5.04wt%,所述k2hpo4的质量分数为12.96wt%;
16.所述peg400溶液由水和peg400组成,其中,所述peg400的质量分数为20wt%。
17.实验表明,在此浓度范围内,所述磷酸缓冲液与所述peg400溶液能够更好的配合,分离纯化的效果最好。
18.本发明提供了所述的双水相成相剂组合物在分离和/或纯化病毒样颗粒中的应用。
19.本发明所述的病毒样颗粒可为人工合成的各种病毒的病毒样颗粒,例如诺如病毒、hpv病毒、禽流感病毒、腹泻病毒、乙肝病毒、猪圆环病毒、猪细小病毒、带状疱疹病毒、新冠病毒、脑炎病毒等,本发明实施例中,以流感病毒样颗粒为例进行纯化效果的验证。更具体的,本发明实施例中采用的是h1n1流感病毒样颗粒。
20.实验表明,所述的双水相成相剂组合物相比较其他组合物,对流感病毒样颗粒的分离纯化效果尤其优异,可获得高纯度的流感病毒样颗粒,流感病毒样颗粒的结构和活性均得到保持。
21.本发明提供了双水相分离纯化病毒样颗粒的方法,将病毒样颗粒的粗提液采用所述的双水相成相剂组合物分离纯化。
22.优选的,所述粗提液的分离纯化方法包括:
23.将所述病毒样颗粒的粗提液中与所述的双水相成相剂组合物混合,静置至形成液-液两相体系,经初次离心后形成液-固-液三相体系,回收中间固相;
24.所述固相采用pbs溶液溶解,经再次离心后获得病毒样颗粒溶液。
25.进一步优选的,所述粗提液的分离纯化温度为18~35℃。
26.在一些具体的实施例中,所述粗提液的分离纯化温度为25℃,所述初次离心采用3000rpm离心5min,所述再次离心采用6000rpm离心15min。
27.优选的,所述粗提液的制备方法包括:
28.构建病毒重组质粒农杆菌,侵染植物组织;
29.取植物侵染组织,用tbe提取液破碎浸提;
30.浸提后离心,获得所述病毒样颗粒粗提液。
31.进一步优选的,所述tbe提取液由水、10mmol/l的edta、0.45mol/l的h3bo3和0.45mol/l的tris盐组成。
32.相比其他提取方法,本发明提供的双水相分离纯化病毒样颗粒的方法只需通过简单的操作即可完成分离和纯化过程,可获得高纯度的流感病毒样颗粒,更适合与推广至工业化生产中。
33.本发明提供的双水相体系分离纯化流感病毒样颗粒的方法,采用磷酸缓冲液作为成相盐与peg400组成双水相萃取体系,对流感病毒样颗粒进行萃取。与现有技术相比,本发明所述流感病毒样颗粒分离纯化制备方法工艺简单,整个过程仅需静置和离心即可形成双水相,上、下相液体均可回收处理后重复使用,成本低,对环境友好,提取的流感病毒样颗粒的纯度好,流感病毒样颗粒的结构和活性均得到保持,同时提取样本可按比例放大,适用于规模化工业生产推广使用。
附图说明
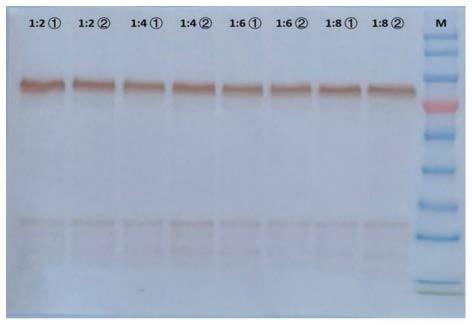
34.图1示实施例1中不同料液比对对流感vlp的提取影响western blotting检测图;
35.图2示双水相萃取流程图;
36.图3示实施例3流感vlp分离后外观图;
37.图4示实施例4流感vlp分离后外观图;
38.图5示实施例4分离样品的sds-page凝胶电泳以及western blotting检测图;
39.图6示实施例5中peg400/磷酸盐双水相制备流感vlp结果示意图,其中,图6a为流感vlp溶液重悬后外观图,图6b为流感vlp溶液sds-page凝胶电泳结果图,图6c为流感vlp溶液western blotting结果图;
40.图7示实施例5中peg400/硫酸铵双水相制备流感vlp结果示意图,其中,图7a为流感vlp溶液sds-page凝胶电泳结果图,图7b为流感vlp溶液western blotting结果图;
41.图8示实施例6中流感vlp溶液重悬后外观图;
42.图9示实施例7中结果示意图,其中图9a为流感vlp溶液重悬后外观图,图9b为流感vlp溶液sds-page凝胶电泳结果图,图9c为流感vlp溶液western blotting结果图;
43.图10示流感vlp的透射电镜图;
44.图11示流感vlp的血凝结果图。
具体实施方式
45.本发明提供了双水相体系分离纯化流感病毒样颗粒的方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领
域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
46.本发明采用的试材皆为普通市售品,皆可于市场购得,植物密码子优化后的hemagglutinin[influenza a virus(a/california/165/2019(h1n1))]序列由擎科生物合成;磷酸二氢钾、磷酸氢二钾(ar)上海麦克林生化科技有限公司、peg6000和peg400(cp)国药集团化学试剂有限公司,一抗为influenza a virus ha antibody,rabbit mab,sino biological inc.,二抗为goat anti-rabbit igg-hrp antibody,华安生物。
[0047]
一种双水相体系快速分离纯化制备流感病毒样颗粒的方法,所述方法包括以下步骤:
[0048]
a、含有流感病毒样颗粒的粗提液的制备:
[0049]
a1、含有流感ha基因质粒的农杆菌eha105,通过农杆菌侵染植物叶片,3天后收获叶片。取待分离纯化流感病毒样颗粒的植物叶片,加入由乙二胺四乙酸(edta)、硼酸(h3bo3)、和tris盐组成的tbe提取液中破碎,进行充分混合浸提,得到浸提液;
[0050]
a2、将a1中浸提液中的不溶物过滤掉,将过滤后得到的滤液在4℃下经离心后得到流感病毒样颗粒粗提液;
[0051]
b、双水相体系分离纯化流感病毒样颗粒
[0052]
b1、将流感病毒样颗粒粗提液加入到双水相体系中,经充分混合后,静止待形成明显的上下相形成液-液两相体系,经离心后液-固-液三相体系,回收中间固相;
[0053]
b2、将步骤b1中的固相用pbs溶液溶解,并进行离心,除去不溶物,得到流感病毒样颗粒溶液;
[0054]
c、流感病毒样颗粒的检测
[0055]
c1、取一定量的制备好的流感病毒样颗粒溶液加入蛋白loading,煮沸10min,12000rpm离心10min后,取上清样品进行sds-page凝胶电泳检测;
[0056]
c2、流感病毒样颗粒进行sds-page凝胶电泳检测后,转膜,对样品进行western blotting检测。
[0057]
d、流感vlp的透射电镜鉴定
[0058]
准备双水相萃取后,经sds-page凝胶电泳鉴定和wb检测后的流感vlp样品,利用磷钨酸负染法进行透射电镜样品制样,具体制备及观察步骤如下:
[0059]
d1、将5μl样品滴于200目带有碳膜的铜网上,室温吸附5min,然后用滤纸小心的将余下的溶液吸掉。
[0060]
d2、室温下,用10μl 2%的磷钨酸对铜网样品染色5min,用滤纸小心的将余下的溶液吸掉,然后将铜网放于滤纸上让自然干燥。
[0061]
d3、在电压120kv下,用透射电镜观察病毒样颗粒的形态。
[0062]
e、流感vlp的血凝实验
[0063]
流感病毒颗粒表面的血凝素(ha)蛋白,具有识别并吸附在鸡红细胞表面受体的结构,并产生红细胞的凝集现象。在96孔血凝板上,加入一排50μl pbs作为阴性对照,再加入50μl流感vlp吸打混匀,向每孔内加入50μl的1%鸡红细胞悬液,轻轻震荡,室温下静置30min-45min,观察结果。
[0064]
下面结合实施例,进一步阐述本发明:
[0065]
实施例1、溶液配制
[0066]
1、tbe提取液的配制:分别称取10mmol edta(乙二胺四乙酸),0.45mol h3bo3,0.45mol tris盐于烧杯中,加入900ml纯水,用浓盐酸调节ph至8.0后定容至1l,配制提取液备用。
[0067]
2、peg400和peg6000溶液配制:称80g peg400或peg6000加ddh2o定量至100g,分别配置成80wt%peg400和peg6000原液,用磷酸或氢氧化钠调ph至7.0。
[0068]
3、磷酸缓冲液配制:称11.2g kh2po4,28.8g k2hpo4,加适量ddh2o溶解,用磷酸或氢氧化钠调ph至7.0,最后加ddh2o定量至100g,配制为40wt%磷酸缓冲液原液。
[0069]
4、硫酸铵溶液配制:称40g(nh4)2so4,加适量ddh2o后加热溶解,用氨水或硫酸调ph至7.0,最后加ddh2o定量至100g,配制为40wt%的硫酸铵溶液。
[0070]
5、pbs溶液的配制:称7.9g nacl,0.2g kcl,1.44g na2hpo4,1.8g k2hpo4,溶于800ml ddh2o中,用盐酸或氢氧化钠调节ph值至7.4,加ddh2o定容至1l备用。
[0071]
实施例2含有流感vlp的粗提液的制备
[0072]
1、流感vlp的植物表达
[0073]
将带有密码子优化的ha基因序列的质粒转入农杆菌eha105,然后使用lb培养基在28℃,220rpm扩培20小时后,收集菌液且用mes溶液重悬菌液至od600=0.8~1.0之间时。将四周大小的烟草苗倒置浸泡在菌液中,然后使用抽真空装置抽真空2min,让农杆菌侵染烟草叶片后,继续培养3天后收取烟草叶片。
[0074]
2、流感vlp的粗提液的制备
[0075]
取8份相同的液氮研磨的烟叶粉末样品,每份5g,分装入50ml离心管中,共8管,按料液比标记为1:2
①
、1:2
②
、1:4
①
、1:4
②
、1:6
①
、1:6
②
、1:8
①
、1:8
②
,四个梯度,每个梯度两个重复;向对应的离心管中分别加入10ml、20ml、30ml和40ml的tbe提取液,充分振荡混匀,置于4℃消化1小时,用纱布滤去滤渣,然后4℃条件下,6000rpm离心15min,收集上清,用tbe溶液调整8管样品至相同体积(45ml)后,分别取50μl通过western blotting检测,结果如图1所示。
[0076]
从图1可以看出,料液比1:2-1:8范围内,tbe溶液对流感vlp的提取效率几乎相同,在兼顾成本和可操作性的基础上选取实际操作料液比为1:3。
[0077]
实施例3peg6000/硫酸铵与peg400/硫酸铵双水相制备流感vlp的对比
[0078]
分别称量一定质量的peg400、peg6000原溶液、硫酸铵溶液原溶液及蒸馏水,配制16wt%的硫酸铵为盐相,分别与6wt%、8wt%、10wt%的peg6000以及peg400组成两个体系各三个梯度的六组双水相体系对流感vlp进行萃取。
[0079]
取2.5g含有流感vlp的粗提液,分别加入到上述的6个不同比例的双水相体系中,组成10g的双水相体系,不够10g的用纯净水补足,上下颠倒混匀或者震荡混匀,室温静置30min分相,然后3000rpm离心5min(流程如图2所示),观察其双水相分离情况,结果如图3所示。
[0080]
由图可知,peg6000/硫酸铵的3组体系都能各自形成双水相,但是6wt%~10wt%的peg400与硫酸铵溶液组成的双水相体系萃取流感vlp,结果无法形成双水相,低浓度的peg400与硫酸铵溶液组成的双水相体系不适用于流感vlp分离。
[0081]
实施例4peg6000/硫酸铵与peg6000/磷酸盐双水相制备流感vlp的对比
[0082]
以16wt%的硫酸铵或磷酸盐(磷酸缓冲液)为盐相,分别与6wt%、8wt%、10wt%的peg6000组成两个体系各三个梯度的六组双水相体系对流感vlp进行萃取。其中,其双水相分离情况如图4所示。离心使双水相彻底分相,然后分别取每个体系的中间相,用500μlpbs重悬混匀,并进行离心,离心条件为6000rpm,15min,除去不溶物,得到流感vlp溶液。
[0083]
经过sds-page凝胶电泳和western blotting的检测病毒。具体步骤包括:收集流感vlp双水相中间相的样品,进行聚丙烯酰胺凝胶电泳分析(sds page),然后将分离的蛋白条带转印至硝酸纤维(nc)膜,用tbst缓冲液漂洗3次nc膜,然后用含5%脱脂奶粉的tbst缓冲液封闭1h;再用tbst缓冲液漂洗3次nc膜,用含5%脱脂奶粉的tbst缓冲液稀释表达抗体一抗至工作浓度(1:500),室温孵育1h;再用tbst缓冲液漂洗3次nc膜,然后加入辣根过氧化物酶标记山羊抗兔的酶标二抗(1:1000)室温孵育1h;同上漂洗3次nc膜后,加入dab辣根过氧化物酶显色液显色充分覆盖nc膜,室温孵育直至目的条带显色,用纯净水冲洗两遍终止显色,室温晾干,结果如图5所示。
[0084]
从图4可知,两组六个体系均能形成双水相体系。但是,从图4b可以明确的看出,peg6000/磷酸盐要比peg6000/硫酸铵成相快。其中图4为在25℃条件下观察的双水相分离结果,在10℃条件下分离结果与图4相似。
[0085]
由图5可知,其中,m为蛋白marker,t代表上相top,i代表中间相interphase,d代表下相down,t/i/d(1-3)分别代表图4中peg6000/硫酸铵体系的3个双水相样品的上/中/下三组样品,t/i/d(4-6)分别代表图4中peg6000/磷酸盐体系的3个双水相样品的上/中/下三组样品。图5a和图5a1代表上相样品(t1-t6)的sds-page凝胶电泳以及western blotting检测,可以看出上相含有的蛋白质很少(图5a),且上相不含有流感vlp(图5a1);图5b和图5b1代表中间相样品(i1-i6)的sds-page凝胶电泳以及western blotting检测,可以看出中间相含有的蛋白质较少(图5b),流感vlp主要存在于中间相,且随着peg6000比例的增加,流感vlp在中间相含量越高(图5b1);图5c和图5c1代表下相样品(d1-d6)的sds-page凝胶电泳以及western blotting检测,可以看出大多数蛋白质主要存在于下相(图5c),六组萃取体系的下相中均存在少量的流感vlp。
[0086]
综上所述,磷酸盐体系的中间相样品i6中流感vlp的含量要高于硫酸铵体系的样品,图3在取样的过程发现上相peg6000上相层样品粘稠度非常高,并不利于小量取样以及大批量的取样,这样并不利于工业应用推广;且磷酸盐体系分相时间快(图4b),更适合在工业应用上的推广。
[0087]
实施例5、peg400/硫酸铵与peg400/磷酸盐双水相制备流感vlp的对比
[0088]
按照磷酸缓冲液的浓度为18wt%,ph7.0,peg400浓度分别为14wt%、16wt%、18wt%、20wt%、22wt%、24wt%组成6个不同的体系分别对含有流感病毒样颗粒的粗提液进行萃取,此处双水相的盐相ph为7.0,定义为双水相体系ph为7.0,而我tbe提取液的ph值为8.0,提取烟叶的总蛋白后提取液的ph约为7.6,总蛋白提取液加入到双水相中后,双水相分相后,上相与下相ph值发生变化,变化范围在7.0~8.0范围内。中间相回收率与流感病毒样颗粒回收纯度结果如表1所示。然后分别取每个体系的中间相,用500μl pbs重悬混匀得到流感vlp溶液,经过sds-page凝胶电泳和western blotting的检测病毒,结果如图6所示。
[0089]
按照硫酸铵的浓度为18wt%,ph7.0,peg400浓度分别为14wt%、16wt%、18wt%、
20wt%、22wt%、24wt%组成6个不同的体系分别对含有流感病毒样颗粒的粗提液进行萃取,中间相回收率与流感病毒样颗粒回收纯度结果如表2所示。经过sds-page凝胶电泳和western blotting的检测病毒,结果如图7所示。
[0090]
表1磷酸缓冲液-peg400双水相对流感vlp制备的条件筛选
[0091]
磷酸缓冲液(wt%)peg(wt%)浓缩倍数中间相回收率(%)流感vlp纯度(%)181465-1816643.6-1818678.783.51820694.388.71822691.283.31824685.879.4
[0092]
表2硫酸铵-peg400双水相对流感vlp制备的条件筛选
[0093]
硫酸铵(wt%)peg(wt%)浓缩倍数中间相回收率(%)流感vlp纯度(%)181462-1816613.4-1818649.623.51820660.838.61822642.545.11824628.364.3
[0094]
最优体系为磷酸缓冲液的浓度为18wt%,ph7.0,peg400浓度为20wt%时,结果显示可看到清晰特异的流感vlp目的条带,流感vlp大约60kd(如图6c所示),且中间相的流感vlp回收率最高为94.3%,纯度为88.7%(表1)。而相同组分的硫酸铵-peg400的双水相体系的纯化结果中间相最高的流感vlp回收率为60.8%,纯度最高的为64.3%(表2),在流感vlp的纯化制备中,磷酸缓冲液-peg400的双水相体系比硫酸铵-peg400的结果要好很多,故选用磷酸缓冲液-peg400的双水相体系来纯化制备流感vlp,磷酸缓冲液的浓度为18wt%,ph7.0,peg400浓度为20wt%作为流感vlp一步双水相方法的最优比例。
[0095]
实施例6双水相体系制备流感vlp的50g体系放大
[0096]
按照双水相条件筛选出来的最优体系比例,将萃取体系放大到50g。取150g含有流感vlp的粗提液,加入到磷酸缓冲液的浓度为18wt%,ph7.0,peg400浓度为20wt%的双水相中,使得整个双水相体系重量为50g,上下颠倒混匀或者震荡混匀,室温静置30min分相,然后3000rpm离心5min,使双水相彻底分相,取中间相,用2.5ml pbs重悬混匀得到流感vlp溶液(图8)。
[0097]
实施例7双水相体系制备流感vlp的1000g体系放大
[0098]
按照双水相条件筛选出来的最优体系比例,将萃取体系放大到1000g。取300g含有流感vlp的粗提液,加入到磷酸缓冲液的浓度为18wt%,ph7.0,peg400浓度为20wt%的双水相中,使得整个双水相体系重量为1000g,上下颠倒混匀或者震荡混匀,室温静置60min分相,然后3000rpm离心5min,使双水相彻底分相(图9a),取中间相,用50ml pbs重悬混匀得到流感vlp溶液。双水相分相时间为本实验必然经历的过程,这个过程的长短仅涉及到对本方法的效率的影响,并不对实验结果产生重大影响。整体趋势是相同双水相体系,温度越高,
分相时间越短;双水相体系越大,分相时间越长。将50g双水相体系和1000g双水相体系经过sds-page凝胶电泳(图9b)和western blotting的检测(图9c),得到的回收率分别为93.4%和94.7%,纯度分别为89.6%和88.3%,由此可见,本发明的双水相体系可以有效的放大规模,且稳定易操作。
[0099]
实施例8流感vlp的透射电镜鉴定
[0100]
准备双水相萃取后,经sds-page凝胶电泳鉴定和wb检测后的流感vlp样品,利用
[0101]
磷钨酸负染法进行透射电镜样品制样,具体制备及观察步骤如下:
[0102]
(1)将5μl样品滴于200目带有碳膜的铜网上,室温吸附5min,然后用滤纸小心的将余下的溶液吸掉。
[0103]
(2)室温下,用10μl 2%的磷钨酸对铜网样品染色5min,用滤纸小心的将余下的溶液吸掉,然后将铜网放于滤纸上让自然干燥。
[0104]
(3)在电压120kv下,用透射电镜观察病毒样颗粒的形态。
[0105]
双水相分离纯化制备的流感vlp经负染,透射电镜观察到了直径大约100nm,是个张曼刺突的椭圆形颗粒,结果如图10所示。说明利用双水相体系分离纯化流感vlp的方法是高效可行的。
[0106]
实施例9流感vlp的血凝实验
[0107]
血凝是一种在某些包膜病毒(如流感病毒)存在的情况下导致红细胞凝集的反应。病毒表面的血凝素抗原与红细胞相互作用,“粘合”在一起,形成晶格结构,使红细胞呈弥散状,这种现象称为血凝反应。当没有病毒或者病毒滴度(浓度)较低的情况下,溶液中的红细胞会沉到孔的底部,看起来像一个红点。流感病毒颗粒表面的血凝素(ha)蛋白,具有识别并吸附在鸡红细胞表面受体的结构,并产生红细胞的凝集现象。本实施例使用鸡血红细胞验证双水相体系分离纯化流感的vlp,具体试验步骤如下:
[0108]
1、在96孔v型微量血凝板1~12孔均加入25μl pbs。
[0109]
2、在第1孔中加入25μl流感裂解病毒(阳性对照)、流感vlp或pbs(阴性对照),充分混匀。
[0110]
3、将阳性对照(第一行)、流感vlp(第三行)、阴性对照(第二、四行)分别在反应板上进行连续稀释(2倍稀释),即从第1孔(原液)中吸取25μl悬液至第2孔(2倍稀释,记1/2),混匀后再吸取25μl悬液至第3孔(4倍稀释,记1/4),依次进行倍比稀释。
[0111]
4、每孔加入25μl pbs。
[0112]
5、每孔加入25μl体积分数为1%的鸡红细胞悬液(将鸡红细胞悬液充分摇匀后加入)。
[0113]
6、将微量反应板在微型振荡器振荡混匀或轻扣反应板混匀反应物,室温(约25℃)静置40min,将反应板倾斜60℃,观察红细胞有无泪珠状流淌。
[0114]
结果如图11所示,以完全凝集,不流淌的最高稀释倍数为抗原或病毒悬液的血凝效价(图11第三行第二孔),且血凝效价与抗原的初始浓度有关。阴性对照里鸡红细胞完全呈点状沉于孔底,而双水相分离纯化制备的流感vlp样品孔里,鸡红细胞先是呈沙样均匀铺于孔底,后又呈点状沉于孔底,说明利用双水相体系分离纯化流感vlp是有血凝活性的,也说明了本发明制备流感vlp的方法是有效可行的。
[0115]
由以上实施例可知,本发明首次建立了一种双水相体系分离纯化流感vlp的方法。
本发明所述流感vlp分离纯化制备的方法具有简单实用、价格低廉且易于操作的、可规模化工业生产、提取率高、纯度高的优点,使用该方法可以获得较高的产品纯度和回收率,适合工业推广应用。
[0116]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1