核苷酸类的纯化方法和核苷酸类的纯化装置以及疏水性试剂和疏水性底物与流程
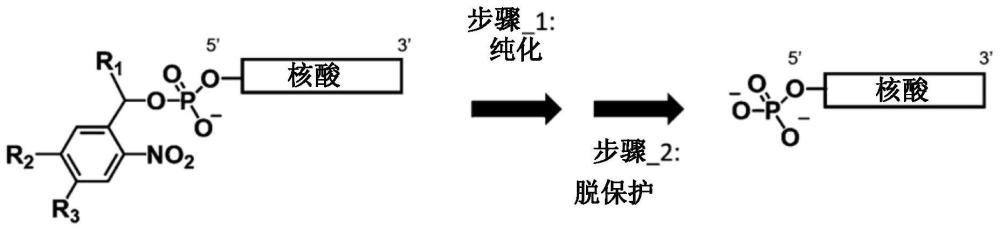
本发明涉及核苷酸类的纯化方法和核苷酸类的纯化装置以及疏水性试剂和疏水性底物。
背景技术:
1、dna,rna等核酸是生命科学中的重要分子,已在医疗领域等中研究多年。近年来,mrna的医药品应用引起了特别的关注。与抑制蛋白质的合成的反义核酸、或引起rna干扰的sirna(小干扰rna,small interfering rna)等不同,mrna医药品是通过在细胞内合成蛋白质来获得治疗效果。因此,不仅能够抑制异常蛋白质,还能够补充正常蛋白质,mrna医药品的实现导致使用核酸药物的治疗策略的扩展。另外,mrna不需要输送到细胞核中,也没有向基因组中的插入突变风险,因此在安全性上也具有优异的一面。此外,近年来,通过核酸递送相关技术的开发进展,已被广泛认为mrna的细胞膜透过性低是可克服的,并且mrna医药品是能够实现的。
2、mrna的分离纯化中使用着高效液相色谱(hplc)或变性聚丙烯酰胺凝胶电泳。目前为止,已知利用疏水性的rna纯化法。例如,有报告根据亚磷酰胺法,在固相上合成的rna末端导入作为疏水性标签的二硝基苯保护基,通过反相hplc纯化rna的方法(例如参照非专利文献1、参照后述的图5的c))。在该方法中,将疏水性修饰rna分离纯化后,通过紫外光照射将光保护基除去,得到天然型的rna。根据该文献,成功地将67mer的rna分离纯化,以95%以上的高收率实现了二硝基苯基的脱保护。
3、另一方面,到目前为止,本发明的发明人开发出了用于核酸扩增的具有分解性保护基的引物(例如参照专利文献1)。该分解性保护基由硝基苄基等构成,导入到构成核酸的核苷酸中的中间位置的核苷酸的3’位磷酸基,而不是导入到构成核酸的核苷酸中的5’末端或3’末端等的末端位置。
4、现有技术文献
5、专利文献
6、专利文献1:国际公开第2021/020562号(权利要求1、权利要求4、权利要求5、第0073~0088段、图9、图10等)
7、非专利文献
8、非专利文献1:pradere,u.et al.,chem.eur.j.2017,23,5210-5213
技术实现思路
1、发明所要解决的技术问题
2、非专利文献1的方法仅在化学合成的rna90残基程度的纯化中使用。非专利文献1的二硝基苯保护基虽然有2个硝基苄基,但位于它们之间的碳是亲电子性的且反应性高。因此,二硝基苯保护基容易受铵等的攻击而被分解,因此保护基导入后缺乏稳定性,目标核苷酸类的收率低。另外,本文献的二硝基苯保护基在分子内具有2个反应性高的硝基苄基,因此具有爆炸性,不容易操作,很危险。进而,在该文献中,并没有记载100个碱基以上的长rna的纯化、以及通过使用聚合酶的转录法的纯化。
3、本发明的目的在于提供导入了保护基的状态的核苷酸类稳定、脱保护后的核苷酸类的收率高、且安全性高的核苷酸类的纯化方法和核苷酸类的纯化装置。另外,本发明的另一个目的在于提供用于在这样的核苷酸类的纯化方法和纯化装置中使用的疏水性试剂和疏水性底物。
4、用于解决技术问题的技术方案
5、本发明的发明人为了解决上述问题反复进行了深入研究。其结果发现,通过将单硝基苯作为保护基,导入了保护基的核苷酸类变得稳定,通过光或还原反应的脱保护带来的核苷酸类的收率也提高,从而完成了本发明。本发明如下所述。
6、〔1〕一种以至少1个核苷酸和/或其衍生物作为结构单元的核苷酸类的纯化方法,其特征在于,包括:
7、将下述式(p1)或(p2)所示的疏水性保护基导入核苷酸类,生成疏水性核苷酸类的保护基导入工序;
8、在疏水性环境下将上述疏水性核苷酸类分离纯化的分离纯化工序;和
9、从上述疏水性核苷酸类将上述疏水性保护基脱保护,生成上述核苷酸类的脱保护工序。
10、
11、(其中,r1表示碳原子数1~30的直链或支链烷基,r4表示氢、碳原子数1~10的直链或支链烷基,r2、r3、r5和r6表示氢、碳原子数1~10的直链或支链烷基或碳原子数1~10的直链或支链烷氧基,r2、r3、r5和r6可以相同或不同。*是与核苷酸类的价键,直接或经由选自-o-c-和-o-c(=o)-的连结基与构成核苷酸类的原子结合。)
12、〔2〕如上述〔1〕所述的核苷酸类的纯化方法,其特征在于:上述疏水性保护基由下述式(p3)表示。
13、
14、(其中,r2和r3如〔1〕中所规定。)
15、〔3〕如上述〔1〕所述的核苷酸类的纯化方法,其特征在于:上述保护基导入工序在位于上述核苷酸类的5’末端的核苷酸导入上述疏水性保护基。
16、〔4〕如上述〔3〕所述的核苷酸类的纯化方法,其特征在于:上述保护基导入工序在构成上述核苷酸的糖的5’磷酸基、2’羟基或碱基上导入上述疏水性保护基。
17、〔5〕如上述〔1〕所述的核苷酸类的纯化方法,其特征在于:上述保护基导入工序将下述式(cr1)所示的亚磷酰胺试剂导入核苷酸,合成保护基导入核苷酸,通过固相合成在上述保护基导入核苷酸的3’末端侧依次连接单核苷酸,合成上述疏水性核苷酸类。
18、
19、(其中,pro表示上述疏水性保护基。)
20、〔6〕如上述〔1〕所述的核苷酸类的纯化方法,其特征在于:上述保护基导入工序通过以具有与上述核苷酸类互补的序列的核酸为模板,以下述式(er1)所示的疏水性底物和核苷三磷酸为底物,利用rna聚合酶转录上述模板,从而合成上述疏水性核苷酸类。
21、
22、(其中,pro表示上述疏水性保护基。)
23、〔7〕如上述〔1〕所述的核苷酸类的纯化方法,其特征在于:上述保护基导入工序使下述式(ca1)所示的腺苷化试剂与包含上述核苷酸类的寡核苷酸的5’末端的磷酸基反应,合成上述疏水性核苷酸类。
24、
25、(其中,pro表示上述疏水性保护基。)
26、〔8〕如上述〔1〕所述的核苷酸类的纯化方法,其特征在于:上述保护基导入工序通过以具有与上述核苷酸类互补的序列的核酸为模板,以下述式(ea1)所示的疏水性底物和核苷三磷酸为底物,利用rna聚合酶转录上述模板,从而合成上述疏水性核苷酸类。
27、
28、(其中,pro表示上述疏水性保护基。)
29、〔9〕如上述〔1〕所述的核苷酸类的纯化方法,其特征在于:上述保护基导入工序使选自下述式(cc1)~(cc4)中的加帽化试剂与包含上述核苷酸类的寡核苷酸的5’末端的磷酸基反应,合成上述疏水性核苷酸类。
30、
31、(其中,pro表示上述疏水性保护基,n表示1或2的整数。)
32、〔10〕如上述〔1〕所述的核苷酸类的纯化方法,其特征在于:上述保护基导入工序通过以具有与上述核苷酸类互补的序列的核酸为模板,以包含下述式(ec0)的结构的疏水性底物和核苷三磷酸为底物,利用rna聚合酶转录上述模板,合成上述疏水性核苷酸类。
33、
34、(其中,pro1~pro4表示上述疏水性保护基或氢,它们中的任意至少1个为疏水性保护基,pro1~pro4彼此可以相同或不同。x选自氧、硫和硒原子。nuc表示天然或非天然型的核苷或者在其3’位的碳上连接有1个或多个天然或非天然型的核苷酸的天然或非天然型的核苷。)
35、〔11〕如上述〔10〕所述的核苷酸类的纯化方法,其特征在于:上述nuc为天然或非天然型的核苷或者在其3’位的碳连接有1个或2个天然或非天然型的核苷酸的天然或非天然型的核苷。
36、〔12〕如上述〔10〕所述的核苷酸类的纯化方法,其特征在于:包含上述式(ec0)的结构的上述疏水性底物选自下述式(ec1)~(ec4)、下述式(ec5)~(ec12)。
37、
38、(其中,pro表示上述疏水性保护基。)
39、
40、(其中,r1表示选自羟基(oh)、甲氧基(och3)、甲氧基乙基(-och2och3)、氟(f)、甲酰胺基(-nhcho)中的取代基,r2表示氢、碳原子数1~10的直链或支链烷基,r3表示氢或氨基(-nh2)。其中,base表示选自腺嘌呤、胞嘧啶、胸腺嘧啶、尿嘧啶、鸟嘌呤中的天然型核酸碱基、或者非天然碱基。其中,x选自氧、硫和硒原子。其中,pro表示上述式(p1)或(p2)所示的疏水性保护基。)
41、〔13〕如上述〔10〕所述的核苷酸类的纯化方法,其特征在于:上述疏水性底物为上述式(ec0)所示的加帽衍生物,在上述脱保护工序之前,使用结合有上述疏水性保护基的状态的上述疏水性核苷酸类进行翻译。
42、〔14〕如上述〔1〕所述的核苷酸类的纯化方法,其特征在于:上述分离纯化工序通过高效液相色谱将上述疏水性核苷酸类分离纯化。
43、〔15〕如上述〔1〕所述的核苷酸类的纯化方法,其特征在于:上述脱保护工序通过光照射对上述疏水性保护基进行脱保护。
44、〔16〕一种以至少1个核苷酸和/或其衍生物作为结构单元的核苷酸类的纯化装置,其特征在于,包括:
45、将下述式(p1)或(p2)所示的疏水性保护基导入核苷酸类,生成疏水性核苷酸类的保护基导入单元;
46、在疏水性环境下将上述疏水性核苷酸类分离纯化的分离纯化单元;和
47、从上述疏水性核苷酸类将上述疏水性保护基脱保护,生成上述核苷酸类的脱保护单元。
48、
49、(其中,r1表示碳原子数1~30的直链或支链烷基,r4表示氢、碳原子数1~10的直链或支链烷基,r2、r3、r5和r6表示氢、碳原子数1~10的直链或支链烷基或碳原子数1~10的直链或支链烷氧基,r2、r3、r5和r6可以相同或不同。*是与核苷酸类的价键,直接或经由选自-o-c-和-o-c(=o)-中的连结基与构成核苷酸类的原子结合。)
50、〔17〕一种用于通过化学合成来合成疏水性核苷酸类的疏水性试剂,其特征在于,其选自下述式(cr1)、式(ca1)和式(cc1)~(cc4)。
51、
52、
53、(其中,pro表示下述式(p1)或(p2)所示的疏水性保护基,n表示1或2的整数。)
54、
55、(其中,r1表示碳原子数1~30的直链或支链烷基,r4表示氢、碳原子数1~10的直链或支链烷基,r2、r3、r5和r6表示氢、碳原子数1~10的直链或支链烷基或碳原子数1~10的直链或支链烷氧基,r2、r3、r5和r6可以相同或不同。*是价键。)
56、〔18〕一种用于利用rna聚合酶生成疏水性核苷酸类的疏水性底物,其特征在于:其选自下述式(er1)、下述式(ea1)和下述式(ec0)。
57、
58、(其中,pro表示下述式(p1)或(p2)所示的疏水性保护基。)
59、
60、(其中,pro表示下述式(p1)或(p2)所示的上述疏水性保护基。)
61、
62、(其中,pro1~pro4表示下述式(p1)或(p2)所示的疏水性保护基或氢,它们的任意至少1个为疏水性保护基,pro1~pro4彼此可以相同或不同。x选自氧、硫和硒原子。nuc表示核苷,在其3’位的碳上可以连接有1或2个天然或非天然型的核苷酸。)
63、
64、(其中,r1表示碳原子数1~30的直链或支链烷基,r4表示氢、碳原子数1~10的直链或支链烷基,r2、r3、r5和r6表示氢、碳原子数1~10的直链或支链烷基或碳原子数1~10的直链或支链烷氧基,r2、r3、r5和r6可以相同或不同。*是价键。)
65、〔19〕如上述〔18〕所述的疏水性底物,其特征在于:上述nuc是天然或非天然型的核苷或者在其3’位的碳上连接有1个或2个天然或非天然型的核苷酸的天然或非天然型的核苷。
66、〔20〕一种mrna医药品,其包含在以至少1个核苷酸和/或其衍生物作为结构单元的核苷酸类上导入有下述式(p1)或(p2)所示的疏水性保护基的疏水性核苷酸类。
67、
68、(其中,r1表示碳原子数1~30的直链或支链烷基,r4表示氢、碳原子数1~10的直链或支链烷基,r2、r3、r5和r6表示氢、碳原子数1~10的直链或支链烷基或碳原子数1~10的直链或支链烷氧基,r2、r3、r5和r6可以相同或不同。*是与核苷酸类的价键,直接或经由选自-o-c-和-o-c(=o)-的连结基与构成核苷酸类的原子结合。)
69、〔21〕如〔20〕所述的mrna医药品,其具有在包含下述式(ec0)的结构的疏水性底物的3’末端侧的核苷酸的3’位的碳上连接有rna的结构。
70、
71、(其中,pro1~pro4表示上述疏水性保护基或氢,它们的任意至少1个为疏水性保护基,pro1~pro4彼此可以相同或不同。x选自氧、硫和硒原子。nuc表示天然或非天然型的核苷或者在其3’位的碳上连接有1个或多个天然或非天然型的核苷酸的天然或非天然型的核苷。)
72、〔23〕如上述〔21〕所述的mrna医药品,其特征在于:包含上述式(ec0)的结构的上述疏水性底物选自下述式(ec1)~(ec12)。
73、
74、(其中,pro表示上述疏水性保护基。)
75、
76、(其中,r1表示选自羟基(oh)、甲氧基(och3)、甲氧基乙基(-och2och3)、氟(f)、甲酰胺基(-nhcho)中的取代基,r2表示氢、碳原子数1~10的直链或支链烷基,r3表示氢或氨基(-nh2)。其中,base表示选自腺嘌呤、胞嘧啶、胸腺嘧啶、尿嘧啶、鸟嘌呤中的天然型核酸碱基、或非天然碱基。其中,x选自氧、硫和硒原子。其中,pro表示上述式(p1)或(p2)所示的疏水性保护基。)
77、〔24〕一种mrna医药品的制造方法,其用于制造上述〔20〕所述的mrna医药品,该制造方法的特征在于,包括:
78、将上述式(p1)或(p2)所示的疏水性保护基导入上述核苷酸类,生成疏水性核苷酸类的保护基导入工序。
79、〔25〕一种mrna医药品的纯化方法,其用于纯化上述〔21〕所述的mrna医药品,该纯化方法的特征在于:
80、上述保护基导入工序通过以具有与上述核苷酸类互补的序列的核酸为模板,以具有上述式(ec0)的结构的疏水性底物和核苷三磷酸为底物,利用rna聚合酶转录上述模板,来合成上述疏水性核苷酸类。
81、〔opt1〕一种mrna医药品,在上述〔21〕中,包含上述式(ec0)的结构的疏水性底物被脱保护,上述pro1~pro4为氢。
82、〔opt2〕如上述〔opt1〕所述的mrna医药品,其特征在于:包含上述式(ec0)的结构的上述疏水性底物选自上述式(ec1)~(ec12),该疏水性保护基被脱保护,上述pro为氢。
83、发明的效果
84、根据本发明,能够提供导入了保护基的状态的核苷酸类稳定、脱保护后的核苷酸类的收率高、且安全性高的核苷酸类的纯化方法和核苷酸类的纯化装置。另外,根据本发明,能够提供用于在这样的稳定、高收率、安全的核苷酸类的纯化方法或纯化装置中使用的疏水性试剂和疏水性底物。
- 还没有人留言评论。精彩留言会获得点赞!