一种与不同湿度下皮肤起保湿和/或修护作用相关的生物标志物群组及其应用的制作方法
本发明涉及组织学检测,具体涉及到一种与不同湿度下皮肤起保湿和/或修护作用相关的生物标志物群组及其应用,尤其涉及一种与不同湿度下皮肤起保湿和/或修护作用相关的生物标志物群组,以及基于该生物标志物群组的检测评估不同湿度下皮肤保湿和/或修护功效中的应用。
背景技术:
1、皮肤是人体与环境的界面,水分控制是皮肤生理和保养的核心要素,在人类的进化过程中,我们的皮肤拥有着对外界环境的高适应性。皮肤的保水能力主要与角质层(sc)有关,它起着阻止水分流失的作用,角质层中的丝聚蛋白(filaggrin,flg)是角质层重要的成分,由角质形成细胞合成,在许多部位都可分布,随着角质形成细胞迁移的过程而逐渐被酶降解,降解成天然保湿因子等角质层需要的小分子物质,可维持皮肤一定水平的水和度。
2、flg的代谢过程,也是皮肤应对不同湿度环境的重要调控机制,角质形成细胞合成的丝聚蛋白原(pro-flg)在颗粒层经去磷酸化和蛋白水解后可形成flg单体,flg在转谷氨酰胺酶5(tgm5)的作用下与角质透明蛋白颗粒、兜甲蛋白(lor)、内披蛋白等形成复杂网络结构,参与角化包膜的形成。角质层内的flg又可在半胱氨酸肽酶14(caspase 14)、博来霉素水解酶、钙蛋白酶(calpain 1)等的作用下被分解成游离的氨基酸形成nmfs,调节皮肤水合功能。因此,pro-flg-flg-nmfs的智能调控网络有助于实现皮肤水分的动态平衡,以适应高、低湿度环境下皮肤的正常状态。
3、现有的皮肤保湿、修护功效测试方法,一般是选择人体临床测试方法,但人体测试方法限制较多,且测试环境要求为20~22℃、相对湿度40~60%,无法同时对比干燥和湿润环境条件下的差异,也无法说明可达到保湿、修护功效的机理。
4、在皮肤模型的保湿、修护功效研究上,flg及其构成的角化包膜起着非常关键的作用,但不同湿度条件对皮肤模型的影响研究较少。cau l在2017年报道了一种评价方法,其利用原代的皮肤细胞,在构建皮肤模型的过程中,引入高湿度、低湿度环境,持续培养10天后,检测发现促进flg脱氨的pad1表达量上升、活性上升。但是,此方法一是使用未成熟的皮肤模型,不利于重复;二是培养时间较长,不利于操作;三是正向的可检测指标较少,不能从多维度充分评价某些产品的效果。
5、此外,由于现有保湿、修护功效的机理很多,评价方法也很多,基于不同机理的评价方法中采用的是不同的生物标志物。因此目前没有一个完整的基于flg通路的各生物标志物进行细胞学评价的方法。
6、基于此,本发明提出了一种针对flg通路中多个生物标志物进行检测并用于评价保湿、修护功效的细胞学方法,该方法不仅可用于评价待测物的保湿、修护功效,还可同时确定其作用机理。
技术实现思路
1、针对现有技术的不足,本发明的目的是提供一种与不同湿度下皮肤起保湿和/或修护作用相关的生物标志物群组及其应用。
2、本发明的目的是通过以下技术方案实现的:
3、第一方面,本发明提供了一种与不同湿度下皮肤起保湿和/或修护作用相关的生物标志物群组,其包括flg、pca、uca、lor、zo-1和tgm5中的至少三种。
4、优选地,所述生物标志物群组选自以下群组中的任一种:
5、flg、pca和uca的群组;
6、flg、lor、zo-1和tgm5的群组;
7、flg、pca、uca、lor、zo-1和tgm5的群组。
8、第二方面,本发明提供了一种生物标志物群组在人体皮肤修护功效的检测评估中的应用,所述生物标志物群组包括flg、lor、zo-1和tgm5。
9、第三方面,本发明提供了本发明提供了一种生物标志物群组在人体皮肤保湿功效的检测评估中的应用,所述生物标志物群组包括flg、pca、uca。
10、第四方面,本发明提供了本发明提供了一种生物标志物群组在人体皮肤保湿和修护功效的检测评估中的应用,所述生物标志物群组包括flg、pca、uca、lor、zo-1和tgm5。
11、第五方面,本发明提供了一种人体皮肤保湿和/或修护功效的检测评估方法,包括以下步骤:
12、s1、将体外人造皮肤模型均匀涂抹待测样品后放入孔板中,加入培养基,分别在90-100%相对湿度和30-50%相对湿度条件下孵育2-48h;
13、s2、孵育结束后,取出体外人造皮肤模型,并检测保湿和/或修护功效相关指标;
14、步骤s1中,所述体外人造皮肤模型选自上海斯安肤诺生物科技有限公司的标准化、大孔径皮肤模型episkin;
15、所述保湿和/或修护功效相关指标包括flg、pca、uca、lor、zo-1和tgm5中的至少三种。
16、优选地,步骤s1中,当孔板为12孔板时,所述培养基的加入量为2.0ml/孔;当孔板为24孔板时,所述培养基的加入量为700μl/孔;
17、所述孔板在使用前,采用保鲜膜包裹孔板表面;采用保鲜膜包裹以防止水分蒸发而影响环境湿度。
18、所述孵育在37℃,5%co2的条件下进行,孵育过程中采用开盖培养,以充分接触环境;
19、所述孵育时间为4h和24h。
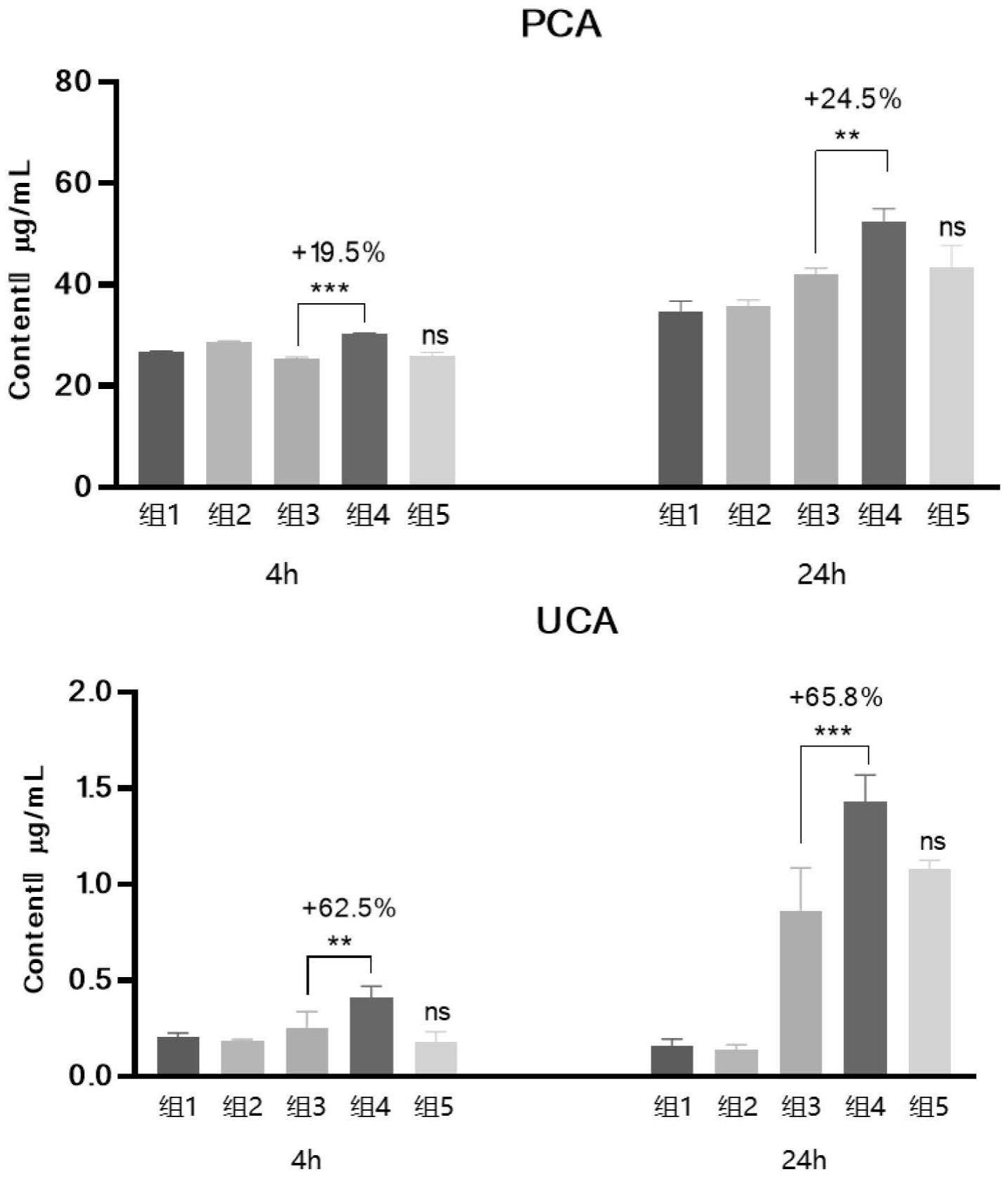
20、优选地,步骤s2中,检测保湿和/或修护功效相关指标时,pca、uca的具体检测步骤如下:
21、a1、将部分体外人造皮肤模型剪成碎片后,加入含1%pmsf的ripa裂解液进行裂解;
22、a2、将步骤a1所得体外人造皮肤模型裂解液进行hplc检测,得pca、uca峰面积,并根据标准曲线计算得到pca、uca含量;
23、a3、将步骤a1所得体外人造皮肤模型裂解液采用蛋白质印迹法进行tgm5检测,得到tgm5的相对定量值。
24、本发明中,采用含1%pmsf的ripa裂解液对体外人造皮肤模型进行裂解,相比其他裂解液如triton x-100,可更充分裂解体外人造皮肤模型,使检测结果更准确。
25、优选地,步骤s2中,检测保湿和/或修护功效相关指标时,flg、lor、zo-1的具体检测步骤如下:
26、将部分体外人造皮肤模型进行冰冻切片,然后通过免疫荧光染色法检测flg、lor、zo-1的荧光强度,即得flg、lor、zo-1的相对表达量。
27、优选地,所述方法还包括对空白对照样品进行步骤s1和s2的处理,并对比待测样品与空白对照样品的各保湿修护功效相关指标的检测结果,以评价待测样品的保湿和/或修护效果;
28、所述保湿功效的评价标准如下:
29、a1.待测样品孵育4h的flg相对表达量相比空白对照样品下调且具有显著性差异,即p<0.05;
30、a2.待测样品孵育24h的flg相对表达量相比空白对照样品上调且具有显著性差异,即p<0.05;
31、a3.待测样品孵育4h或24h的pca含量相比空白对照样品上调且具有显著性差异,即p<0.05;
32、a4.待测样品孵育4h或24h的uca含量相比空白对照样品上调且具有显著性差异,即p<0.05;
33、满足上述a1-a4中的至少两项时,则待测样品具有保湿功效;
34、所述修护功效的评价标准如下:
35、b1.待测样品孵育24h的flg相对表达量相比空白对照样品上调且具有显著性差异,即p<0.05;
36、b2.待测样品孵育24h的lor相对表达量相比空白对照样品上调且具有显著性差异,即p<0.05;
37、b3.待测样品孵育24h的zo-1相对表达量相比空白对照样品上调且具有显著性差异,即p<0.05;
38、b4.待测样品孵育24h的tgm5相对表达量相比空白对照样品上调且具有显著性差异,即p<0.05;
39、满足上述b1-b4中的至少两项时,则待测样品具有修护功效。
40、与现有技术相比,本发明具有如下的有益效果:
41、1)本发明特定采用上海斯安肤诺生物科技有限公司的标准化、大孔径皮肤模型episkin作为体外人造皮肤模型用于保湿和修护功效的检测,具有更好的质量均一性,获得准确的检测结果。且该皮肤模型episkin的表面积较大,约为1.07cm2,一个皮肤模型即可满足各项指标的检测。
42、2)本发明通过在测试过程中严格控制实验的湿度条件,在高湿度条件和低湿度条件下进行保湿和修护功效测试,并以检测丝聚蛋白降解过程中的关键蛋白指标(flg、pca、uca)和屏障功能相关的关键蛋白指标(flg、lor、zo-1、tgm5)作为保湿和/或修护功效相关指标,从而可准确评价各待测样品在不同湿度条件下的保湿和/或修护效果。
43、3)通过本发明的方法可灵敏、准确地检测出flg、pca和uca、lor、zo-1和tgm5这六个指标的相对表达量和含量,可用于更多待测物的检测评估,具有更广泛的应用价值。
- 还没有人留言评论。精彩留言会获得点赞!