一种靶向肝脏拮抗PCSK9并特异性结合LDL-C的工程化外泌体及其构建方法和应用
本发明属于外泌体,具体涉及一种靶向肝脏拮抗pcsk9并特异性结合ldl-c的工程化外泌体及其构建方法和应用。
背景技术:
1、血脂升高是心血管疾病的重要独立危险因素,其主要表现为血浆低密度脂蛋白胆固醇(ldl-c)的水平升高。正常状态下,血浆ldl-c首先与肝细胞表面低密度脂蛋白受体(ldlr)结合形成复合物,随后进入细胞,在内体的酸性环境中复合物解离成ldlr和ldl-c。ldlr通常循环回到细胞表面,而ldl-c在溶酶体中降解,其代谢产物在细胞中被重新利用。因此,肝脏细胞表面表达的ldlr是决定ldl-c水平的首要因素,可结合的ldlr越多,血浆中ldl-c水平越低。研究表明,细胞表面的ldlr是由839个氨基酸组成的单链单次跨膜糖蛋白,由配体结合结构域、表皮生长因子(egf)前体结构域、o-连接糖结构域、跨膜结构域和胞浆结构域等5个功能区组成。配体结合结构域由l1-l7等7个氨基酸残基重复序列连接而成,是ldlr特异性结合ldl-c的主要结构域。
2、与此同时,前蛋白转化酶枯草溶菌素9(pcsk9)现已成为新式降脂药物的作用靶点。研究表明,pcsk9不仅能够与ldl-c竞争性结合ldlr,导致血液中ldl-c水平升高,还能“绑架”ldlr共同进入溶酶体降解,破坏ldlr循环。因此,pcsk9是导致ldlr加速降解,ldl-c水平升高的关键分子,抑制pcsk9对于恢复ldlr循环,增强ldl-c的清除能力,维持血脂稳态有重要作用。inclisiran是一种化学合成的pcsk9小干扰rna(sirna)药物,由galnac和pcsk9 sirna组成,通过靶向抑制pcsk9mrna发挥降低pcsk9的作用。galnac是肝细胞特异性表达的去唾液酸糖蛋白受体(asgpr)的靶向性配体,与肝细胞亲和力高,能够迅速内化,从而保证pcsk9 sirna药物特异性结合膜蛋白后进入胞内。该sirna药物不仅可以降低循环pcsk9水平,还可以有效降低细胞内的pcsk9水平,缓释作用强、脱靶率低,几乎无不良反应,可以持续降低ldl-c水平。
3、外泌体是来源于细胞内膜系统的囊泡样纳米结构,直径在50~130nm,可由各种类型的细胞分泌释放。外泌体可携带多种分子物质,如蛋白质、rna和脂类,参与机体的生理和病理过程。有研究指出,ptgfrn是大量富集于外泌体表面的单次跨膜蛋白,n端在膜外、c端在膜内,特别适合通过基因工程构建外泌体装载的融合蛋白。外泌体作为生物活性物质的天然载体,具有稳定性高、渗透性好、毒性低和无免疫原性等优势,在药物装载和靶向递送方面有良好的应用价值和市场前景。
4、然而目前还没有关于同时具备拮抗pcsk9和促进ldl-c降解双重功效的药物的报道,阻碍了高胆固醇血症或高脂血症的治疗进程。
技术实现思路
1、有鉴于此,本发明的目的在于提供一种靶向肝脏拮抗pcsk9并特异性结合ldl-c的工程化外泌体及其构建方法和应用,具有良好的降血脂作用,为治疗高胆固醇血症或高脂血症提供新手段。
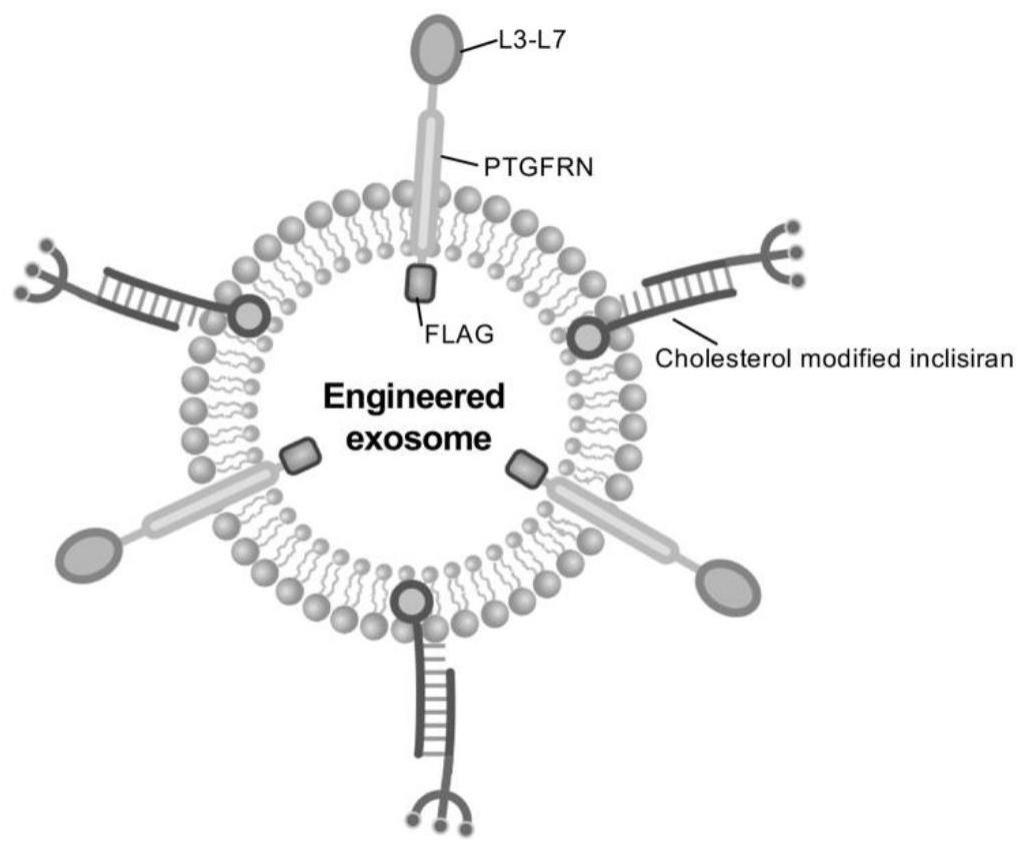
2、本发明提供了一种靶向肝脏拮抗pcsk9并特异性结合ldl-c的工程化外泌体,所述工程化外泌体的膜外表达融合蛋白ldlr l3-l7-ptgfrn,所述工程化外泌体的表面连接有inclisiran;
3、所述融合蛋白ldlr l3-l7-ptgfrn中ldlr l3-l7的氨基酸序列如seq id no:1所示;所述ptgfrn的氨基酸序列如seq id no:2所示。
4、优选的,所述融合蛋白ldlr l3-l7-ptgfrn还包括连接肽;
5、所述连接肽的氨基酸序列如seq id no:3所示。
6、优选的,所述融合蛋白ldlr l3-l7-ptgfrn的氨基酸序列如seq id no:4所示。
7、优选的,所述inclisiran是pcsk9 sirna和n-乙酰半乳糖胺组成;
8、所述inclisiran为胆固醇修饰后的inclisiran。
9、本发明提供了一种所述工程化外泌体的构建方法,包括以下步骤:
10、1)构建表达融合基因ldlr l3-l7-ptgfrn的重组载体;
11、2)将步骤1)中所述重组载体转染哺乳细胞,得到重组细胞;
12、3)将步骤2)中所述重组细胞进行培养,收集外泌体;
13、4)将步骤3)中所述外泌体与inclisiran共孵育,得到工程化外泌体。
14、优选的,步骤1)中所述表达融合基因ldlr l3-l7-ptgfrn的重组载体的方法,包括以下步骤:
15、将两端连接有酶切位点的融合基因ldlr l3-l7-ptgfrn序列进行酶切,得到的酶切片段克隆至同样种类限制性内切酶酶切的质粒,得到重组载体。
16、优选的,所述融合基因ldlr l3-l7-ptgfrn的核苷酸序列如seq id no:5所示;
17、所述限制性内切酶包括nheⅰ/hindⅲ。
18、优选的,所述转染的方法为将所述重组质粒在转染试剂作用下处理hek293t细胞;
19、所述培养包括将转染后的hek293t细胞在不含抗生素的胎牛血清培养基中培养4~6h后,更换为无血清完全培养基,培养48h收集细胞上清,得到含外泌体的溶液。
20、本发明提供了所述工程化外泌体或所述构建方法获得的工程化外泌体在制备降血脂药物中的应用。
21、优选的,所述药物治疗的疾病包括以下一种或几种:原发性高胆固醇血症(杂合子型家族性和非家族性)、顽固性高脂血症、脂肪肝和心肌梗死、中风和不稳定心绞痛等动脉粥样硬化衍生疾病,受益人群包括对他汀类药物不耐受或疗效有限的患者,降低动脉粥样硬化性心血管疾病患者的心血管事件风险。
22、本发明提供了一种靶向肝脏拮抗pcsk9并特异性结合ldl-c的工程化外泌体,所述工程化外泌体的膜外表达融合蛋白ldlr l3-l7-ptgfrn,所述工程化外泌体的表面连接有inclisiran;所述融合蛋白ldlr l3-l7-ptgfrn中ldlr l3-l7的氨基酸序列如seq id no:1所示;所述ptgfrn的氨基酸序列如seq id no:2所示。本发明通过对跨膜蛋白ptgfrn进行改造,具体在膜外融合表达包含ldlr的l3-l7区段ptgfrn序列,进而能够特异结合ldl-c;同时将pcsk9抑制药物inclisiran与外泌体表面连接。所述工程化外泌体同时具备拮抗pcsk9和促进ldl-c降解双重功效,既能高效靶向肝脏并抑制肝细胞表达pcsk9,又能特异性结合ldl-c至肝脏降解,为降低血脂含量提供崭新途径,具有广泛应用价值。同时,本发明提供的工程化外泌体具有制备方法简便,能够实现大规模生产工程化外泌体,为广泛应用提供了基础。
技术特征:
1.一种靶向肝脏拮抗pcsk9并特异性结合ldl-c的工程化外泌体,其特征在于,所述工程化外泌体的膜外表达融合蛋白ldlr l3-l7-ptgfrn,所述工程化外泌体的表面连接有inclisiran;
2.根据权利要求1所述工程化外泌体,其特征在于,所述融合蛋白ldlr l3-l7-ptgfrn还包括连接肽;
3.根据权利要求2所述工程化外泌体,其特征在于,所述融合蛋白ldlr l3-l7-ptgfrn的氨基酸序列如seq id no:4所示。
4.根据权利要求1所述工程化外泌体,其特征在于,所述inclisiran是pcsk9 sirna和n-乙酰半乳糖胺组成;
5.一种权利要求1~4任意一项所述工程化外泌体的构建方法,其特征在于,包括以下步骤:
6.根据权利要求5所述构建方法,其特征在于,步骤1)中所述表达融合基因ldlr l3-l7-ptgfrn的重组载体的方法,包括以下步骤:
7.根据权利要求6所述构建方法,其特征在于,所述融合基因ldlr l3-l7-ptgfrn的核苷酸序列如seq id no:5所示;
8.根据权利要求5所述构建方法,其特征在于,所述转染的方法为将所述重组质粒在转染试剂作用下处理hek293t细胞;
9.根据权利要求1~4任意一项所述工程化外泌体或权利要求5~8任意一项所述构建方法获得的工程化外泌体在制备降血脂药物中的应用。
10.根据权利要求9所述应用,其特征在于,所述药物治疗的疾病包括以下一种或几种:杂合型家族性高胆固醇血症、顽固性高脂血症、脂肪肝和动脉粥样硬化衍生疾病。
技术总结
本发明提供了一种靶向肝脏拮抗PCSK9并特异性结合LDL‑C的工程化外泌体及其构建方法和应用,属于外泌体技术领域。本发明对跨膜蛋白PTGFRN进行改造,在膜外融合表达包含LDLR的L3‑L7区段PTGFRN序列,进而能够特异结合LDL‑C;同时将PCSK9抑制药物Inclisiran与外泌体表面连接。所述工程化外泌体同时具备拮抗PCSK9和促进LDL‑C降解双重功效,既能高效靶向肝脏并抑制肝细胞表达PCSK9,又能特异性结合LDL‑C至肝脏降解,为降低血脂含量提供崭新途径,具有广泛应用价值。同时,本发明提供的工程化外泌体具有制备方法简便,能够实现大规模生产工程化外泌体,为广泛应用提供了基础。
技术研发人员:袁丽君,王辰,杨国栋,韦梦影,李者龙,张亮,孙汶齐
受保护的技术使用者:中国人民解放军空军军医大学
技术研发日:
技术公布日:2024/1/14
- 还没有人留言评论。精彩留言会获得点赞!